不同评分模型对肝硬化患者经颈静脉肝内门体分流术后生存的预测价值
2023-04-29刘钰懿慕之勇胡辂王军熊伟胡鸿刘爱民安选许愈强余灏东王金能文良志陈东风
刘钰懿 慕之勇 胡辂 王军 熊伟 胡鸿 刘爱民 安选 许愈强 余灏东 王金能 文良志 陈东风
摘要:目的 探討Child-Pugh评分、终末期肝病模型(MELD)评分、联合血清钠离子的终末期肝病模型(MELD-Na)评分、慢性肝衰竭联盟-急性失代偿(CLIF-C AD)评分和经颈静脉肝内门体分流术(TIPS)术后生存Freiburg指数(FIPS)评分对肝硬化患者生存的预测价值。方法 回顾性分析2014年1月—2021年2月我国西南地区多家医院行TIPS治疗的447例肝硬化患者的临床资料,其中生存组306例,死亡组62例。计算五种评分模型分值,并基于五种评分模型分别对患者进行生存分析。正态分布的计量资料组间比较采用独立样本的t检验;不符合正态分布的计量资料组间比较采用非参数Mann-Whitney U检验;计数资料组间比较采用Pearson χ2检验;采用Cox回归分析各评分模型对TIPS患者预后的影响;Kaplan-Meier法分析不同评分水平的患者死亡风险的差异,并采用Log-rank检验。各模型预测能力采用受试者工作特征曲线下面积(AUC)、不同时间点C指数及决策曲线进行评估。结果 生存组患者年龄(Z=2.884)低于死亡组,Alb(t=3.577)、Na+(Z=-3.756)均高于死亡组,而酒精性肝硬化患者比例(χ2=22.674)、AST(Z=2.141)、PT(Z=2.486)、INR(Z=2.429)、TBil(Z=3.754)、腹水严重程度(χ2=14.186)及五种模型评分均低于死亡组(P值均<0.05)。生存分析显示,各评分模型均能有效对TIPS患者预后进行风险分层。对各评分模型不同时间点C指数比较发现,Child-Pugh评分对术后生存预测能力较高,其次为MELD-Na评分、MELD评分和CLIF-C AD评分,而FIPS评分预测能力相对较差,此外,随时间延长,各评分预测效能均减弱。Child-Pugh评分术后1年生存率的预测效能最大(AUC=0.832),MELD-Na评分术后3年生存率的预测效能最大(AUC=0.726),而FIPS评分术后在1年和3年生存预测能力比较中均较差。结论 五种评分模型均可作为肝硬化TIPS术后患者生存的预测方法,且都可为肝硬化TIPS患者提供有效的预后风险分层。在短期预测上Child-Pugh评分生存预测能力更好,长期预测上MELD-Na评分生存预测能力更好,而FIPS评分预测能力均相对较差。
关键词:肝硬化; 门静脉高压; 门体分流术, 经颈静脉肝内
基金项目:国家自然科学基金(82170594)
Value of different scoring models in predicting the survival of patients with liver cirrhosis after transjugular intrahepatic portosystemic shunt
LIU Yuyi1, MU Zhiyong1, HU Lu1, WANG Jun1, XIONG Wei2, HU Hong3, LIU Aimin4, AN Xuan5, XU Yuqiang6, YU Haodong7, WANG Jinneng8, WEN Liangzhi1, CHEN Dongfeng1. (1. Department of Gastroenterology, Chongqing Key Laboratory of Digestive Malignancies, Army Specialized Medical Center of Army Medical University & Daping Hospital, Chongqing 400042, China; 2. Department of Gastroenterology, The Third Affiliated Hospital of Chongqing Medical University, Chongqing 400042, China; 3. Department of Interventional Radiology, Nanchong Central Hospital, North Sichuan Medical College, Nanchong, Sichuan 637000, China; 4. Department of Gastroenterology, Chongqing University Fuling Hospital, Chongqing 408000, China; 5. Department of Hepatology, Chongqing University Three Gorges Hospital, Chongqing 404100, China; 6. Department of Gastroenterology, The Peoples Hospital of Leshan, Leshan, Sichuan 614000, China; 7. Department of Gastroenterology, Chongqing University Qianjiang Hospital, Chongqing 409000, China; 8. Department of Gastroenterology, The Ninth Peoples Hospital of Chongqing, Chongqing 400042, China)
Corresponding author:
CHEN Dongfeng, chendf1981@126.com (ORCID:0000-0001-5514-7358)
Abstract:
Objective To compare the value of Child-Pugh score, Model for End-Stage Liver Disease (MELD) score, MELD combined with serum sodium concentration (MELD-Na) score, CLIF Consortium Acute Decompensation (CLIF-C AD) score, and Freiburg index of post-transjugular intrahepatic portosystemic shunt (TIPS) survival (FIPS) score in predicting the survival of patients undergoing TIPS. Methods A retrospective analysis was performed for the clinical data of 447 patients with liver cirrhosis who underwent TIPS in several hospitals in southwest China, among whom there were 306 patients in the survival group and 62 in the death group. The scores of the above five models were calculated, and a survival analysis was performed based on these models. The independent samples t-test was used for comparison of normally distributed continuous data between groups, and the non-parametric Mann-Whitney U test was used for comparison of non-normally distributed continuous data between groups; the Pearson chi-square test was used for comparison of categorical data between groups; a multivariate Cox regression analysis was used for correction analysis of known influencing factors with statistical significance which were not included in the scoring models; the Kaplan-Meier method was used to evaluate the discriminatory ability of each model in identifying risks in the surgical population, and the log-rank test was used for analysis. The area under the receiver operating characteristic curve (AUC), C-index at different time points, and calibration curve were used to evaluate the predictive ability of each scoring model. Results Compared with the death group, the survival group had significantly lower age (Z=2.884, P<0.05), higher albumin (t=3.577, P<0.05), and Na+ (Z=-3.756, P<0.05) and significantly lower proportion of patients with alcoholic cirrhosis (χ2=22.674, P<0.05), aspartate aminotransferase (Z=2.141, P<0.05), prothrombin time (Z=2.486, P<0.05), international normalized ratio (Z=2.429, P<0.05), total bilirubin (Z=3.754, P<0.05), severity of ascites (χ2=14.186, P<0.05), and scores of the five models (all P<0.05). Survival analysis showed that all scoring models effectively stratified the prognostic risk of the patients undergoing TIPS. Comparison of the C-index of each scoring model at different time points showed that Child-Pugh score had the strongest ability in predicting postoperative survival, followed by MELD-Na score, MELD score, and CLIF-C AD score, and FIPS score had a relatively poor predictive ability; in addition, the prediction efficiency of each score gradually decreased over time. Child-Pugh score had the largest AUC of 0.832 in predicting 1-year survival rate after surgery, and MELD-Na score had the largest AUC of 0.726 in predicting 3-year survival rate after surgery, but FIPS score had a poor ability in predicting 1- and 3-year survival rates. Conclusion All five scoring models can predict the survival of patients with liver cirrhosis after TIPS and can provide effective stratification of prognostic risk for such patients. Child-Pugh score has a better ability in predicting short-term survival, while MELD-Na score has a better ability in predicting long-term survival, but FIPS score has a relatively poor predictive ability in predicting both short-term and long-term survival.
Key words:
Liver Cirrhosis; Portal Hypertension; Portasystemic Shunt, Transjugular Intrahepatic
Research funding:
National Natural Science Foundation of China (82170594)
经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)是治疗肝硬化门静脉高压相关并发症的重要手段之一,目前已被多部指南[1-2]推荐用于肝硬化食管胃底静脉破裂急性出血的控制、再出血的预防以及顽固性胸腹水的治疗。相较于外科分流术或断流术,TIPS具有创伤性小、安全性高、适用性广、疗效确切等优点。然而临床上仍有部分患者术后因肝衰竭、顽固性肝性脑病、再出血等各种原因死亡[3],因此准确的评估预测TIPS术后患者的生存结局对临床患者术前筛选及术后随访管理具有重要意义。
目前临床上已有多种肝脏功能评分模型用于肝硬化患者预后评估,其中包括1973年由Child、Turcotte创建,并被Pugh 进一步改良后形成的Child-Pugh 评分[4];2001年Malinchoc等[5]提出的终末期肝病(MELD)评分;2006年Biggins等[6]在MELD评分基础上联合血清钠提出了MELD-Na评分;2015年,欧洲肝病学会-慢性肝衰竭联盟(EASL-CLIF)[7]发布了慢性肝衰竭联盟-急性失代偿评分(chronic liver failureconsortium acute decompensation score, CLIF-C AD),该评分旨在预测失代偿性肝硬化患者的3个月病死率;2021年Bettinger等[8]基于胆红素、肌酐、年龄及Alb构建新型评分模型(Freiburg index of post-TIPS survival, FIPS)预测TIPS患者半年内生存结局。尽管目前对Child-Pugh 评分、MELD评分、MELD-Na评分以及CLIF-C AD评分之间预测TIPS患者临床结局价值进行比较的研究已有报道,但由于手术技术的革新及指南意见的更新[9],TIPS治疗适应证相比以往有所拓展,治疗人群基线特征出现了新变化,加上近两年FIPS评分的提出,目前尚无相关研究采用上述几种评分模型对TIPS术后患者生存预测进行比较。此外,既往研究主要评估多种评分模型对术后短期生存的预测价值,而对术后中长期生存预测价值的评估尚未见报道。
为此,本研究通过分析我国西南地区多家医院近年来接受TIPS治疗的肝硬化患者临床及随访资料,比较Child-Pugh评分、MELD评分、MELD-Na评分、CLIF-C AD评分及FIPS评分对TIPS术后患者的中长期生存预测价值,以期为临床提供有益参考。
1 资料与方法
1.1 研究对象 回顾性分析2014年1月—2021年2月于陆军军医大学陆军特色医学中心(大坪医院)、重庆医科大学第三附属医院、川北医学院附属南充市中心医院、重庆大学附属涪陵医院、重庆大学附属三峡医院、四川省乐山市人民医院、重庆大学附属黔江医院、重庆市第九人民医院行TIPS 治疗的447例患者的病历资料。纳入标准:(1)肝硬化行TIPS治疗患者;(2)年龄18歲~80岁,性别不限;排除标准:(1)合并肝癌及其他恶性肿瘤;(2)非首次TIPS或手术失败;(3)非肝硬化或严重肝衰竭;(4)术后1年内肝移植或失访;(5)合并严重心肺等大器官疾病;(6)精神疾病;(7)研究者认为不适合纳入的其他情况。
1.2 数据收集 收集临床基线资料与随访资料,其中临床基线资料包括患者性别、年龄、BMI、肝硬化病因、肝硬化并发症(腹水、肝性脑病),以及实验室检查,包括血常规(WBC、PLT、Hb),肝肾功能及生化指标(ALT、AST、Alb、TBil、Scr、血Na+)和凝血功能(PT、INR)。随访资料通过电话和门诊进行随访,随访终点是死亡或肝移植,随访截止日期为2022年3月10日。生存时间从TIPS手术之日起计算。
1.3 各评分模型分值计算 Child-Pugh评分[4]由血清TBil、Alb、PT、腹水、肝性脑病分期求和,再进一步分级(A级4~6分,B级7~9分,C级10~15);MELD评分[5]=3.8×ln[TBil (μmol/L)÷17.1] + 11.2 × ln(INR)+9.6×ln[Scr (μmol/L)÷88.4]+6.4,并把任何小于1的实验室检查值均设定为1,以消除负值;MELD-Na评分[6]=MELD+1.59×(137-Na+),其中血Na+浓度小于125 mmol/L与大于137 mmol/L的血清钠浓度分别设定为125 mmol/L与137 mmol/L。CLIF-C AD评分[7]=10×{[0.03×年龄(岁)]+0.66×ln[Scr(μmol/L)÷88.4]+[1.71×ln(INR)]+[0.88×ln WBC(×109/L)]-[0.05×Na(mmol/L)]+8};FIPS评分[8]=1.43×lg[TBil(μmol/L)]-88.4×1.71÷Scr(μmol/L)+0.02×年龄(岁)-0.02×Alb(g/L);其中CLIF-C AD根据是否大于35,FIPS根据是否大于-0.45,MELD根据是否大于9,MELD-Na根据是否大于15分为高危组与低危组,以进一步评估各模型对不同风险人群预后的区分度。
1.4 统计学方法 应用SPSS 26.0和R 4.1.2软件进行统计分析。符合正态分布的计量资料以x±s表示,组间比较采用独立样本的t检验;不符合正态分布的计量资料用M(P25~P75)表示,组间比较采用非参数Mann-Whitney U检验;计数资料组间比较采用Pearson χ2检验;Cox回归分析各评分模型对TIPS患者预后的影响;Kaplan-Meier法分析不同评分水平的患者死亡风险的差异,并采用Log-rank进行检验。各模型预测能力采用受试者工作特征曲线(ROC曲线)下面积(AUC)、不同时间点C-index指数及决策曲线进行评估。P<0.05为差异有统计学意义。
2 结果
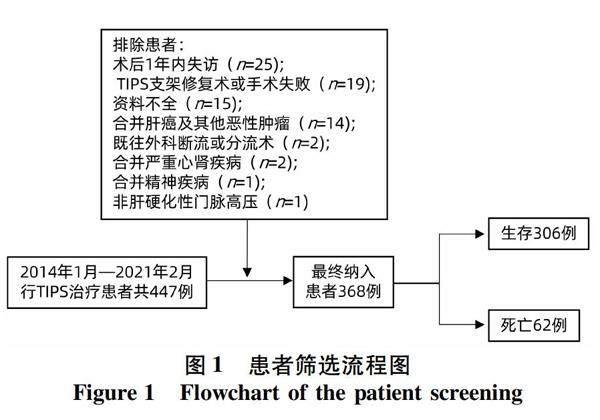
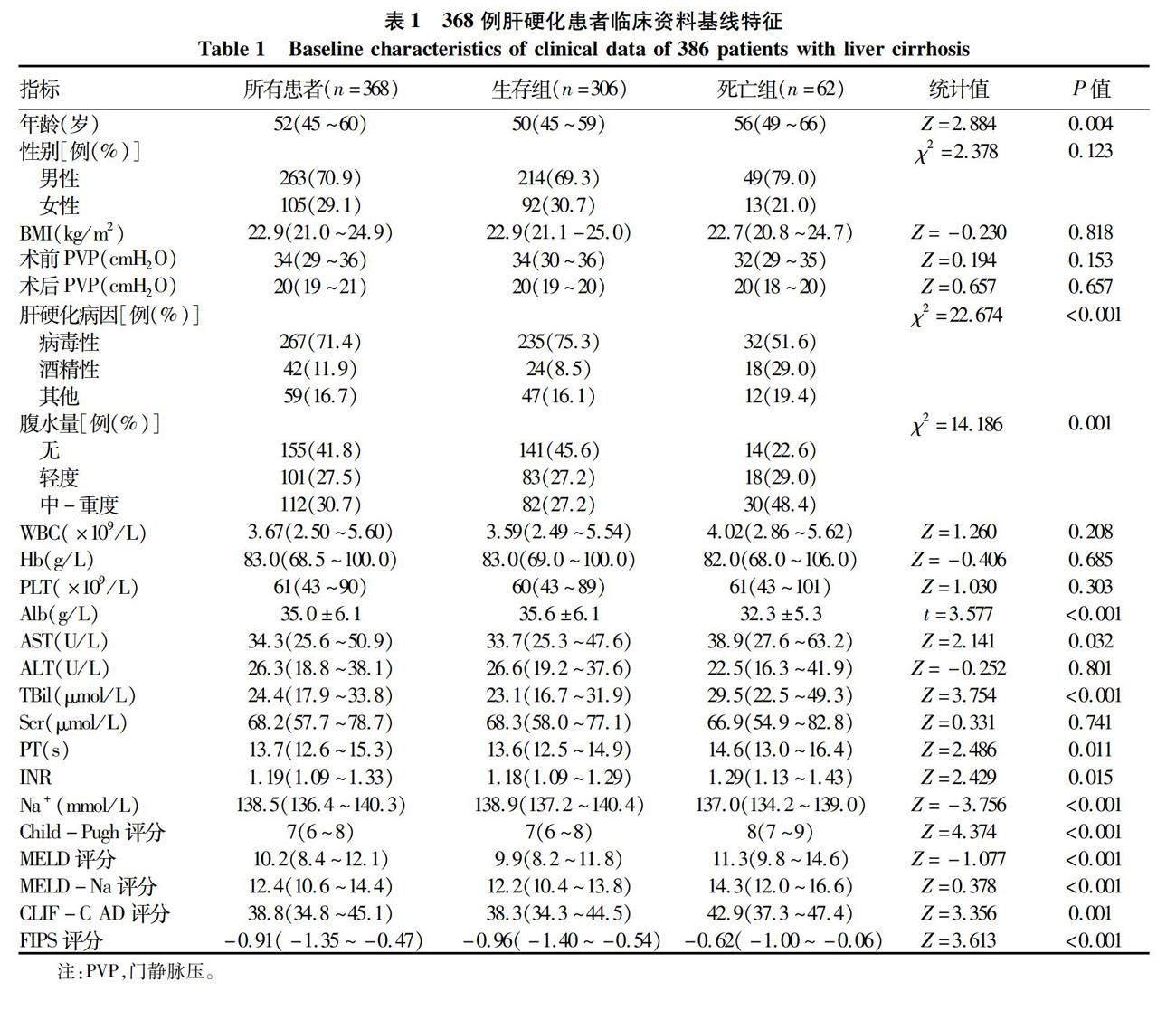
2.1 一般资料 447例肝硬化患者在研究期间接受了TIPS手术治疗,79例被剔除,其中术后1年内失访25例,TIPS支架修复术或手术失败19例,合并肝癌及其他恶性肿瘤14例,其他21例,最终纳入368例患者(图1)。至随访终止,62例患者因肝脏疾病去世,其中上消化道出血20例,肝性脑病14例,原发性肝癌11例,严重感染9例,肝衰竭6例,下消化道大出血2例。生存组与死亡组患者之间年龄、肝硬化病因、腹水严重程度、Alb、AST、PT、INR、TBil、Na+、Child-Pugh评分、MELD评分、MELD-Na评分、CLIF-C AD评分及FIPS评分差异均有统计学意义(P值均<0.05)(表1)。
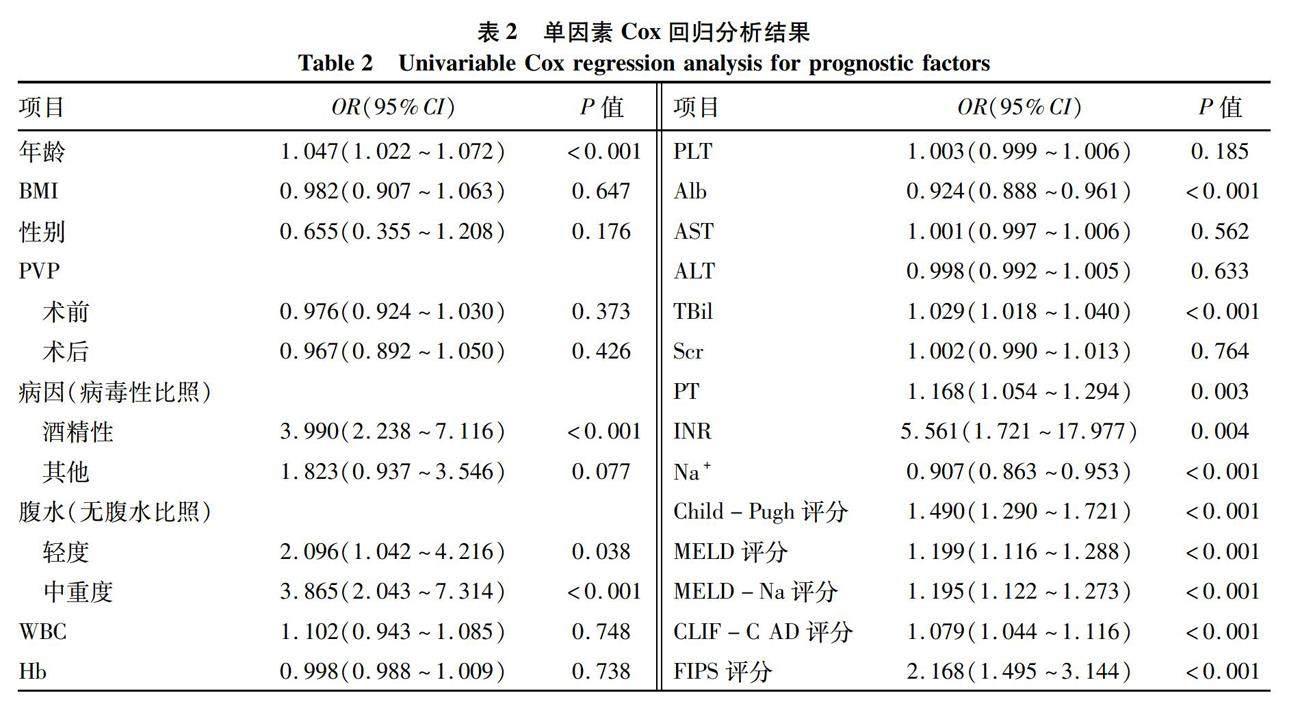
2.2 各评分模型对TIPS患者预后的影响评价 单因素Cox回归分析结果显示,年龄、肝硬化病因、腹水严重程度、Alb、PT、INR、TBil、Na+、Child-Pugh评分、MELD评分、MELD-Na评分、CLIF-C AD评分及FIPS评分差异均有统计学意义(P<0.05)(表2)。鉴于各评分模型所纳入临床指标存在交集,为避免多重共线性,分别将生存组与死亡组间存在统计学差异且未被纳入评分模型的临床指标分别纳入各评分模型行多因素Cox回归分析,进一步验证各评分模型是否为TIPS患者生存的独立危险因素。结果发现,校正年龄、肝硬化病因和Na+后,Child-Pugh评分是TIPS患者预后的独立影响因素(HR=1.51, 95%CI:1.29~1.77, P<0.05);校正年龄、腹水、Alb和Na+后,MELD评分是TIPS患者预后的独立影响因素(HR=1.14, 95%CI:1.05~1.24, P<0.05);校正年龄、腹水和Alb后,MELD-Na评分是TIPS患者预后的独立影响因素(HR=1.14, 95%CI:1.06~1.20, P<0.05);校正肝硬化病因、腹水、Alb和血清TBil后,CLIF-C AD评分是TIPS患者预后的独立影响因素(HR=1.04, 95%CI:1.01~1.10, P<0.05);校正肝硬化病因、腹水、和Na+后,FIPS评分是TIPS患者预后的独立影响因素(HR=1.79, 95%CI:1.24~2.56, P<0.05)(图2)。
2.3 各评分模型对TIPS患者死亡风险的区分能力生存分析显示,Child-Pugh A与B、C级,MELD低危组(≤9)与高危组(>9),MELD-Na低危组(≤15)与高危组(>15),CLIF-C AD低危组(≤35)与高危组(>35)以及FIPS低危组(≤-0.45)与高危组(>-0.45),各组之间患者生存率存在统计学差异(P值均<0.01),提示五种评分模型均能有效对TIPS患者预后进行风险分层(图3)。
2.4 五种评分模型生存预测能力比较 五种模型均有较好的区分能力,C指数均大于0.6。Child-Pugh评分对术后生存预测能力较高,而FIPS评分预测能力最差,此外,随时间延长,各评分预测能力均减弱(图4a)。决策曲线显示,Child-Pugh评分及MELD-Na评分表现良好(图4b)。为进一步检验各评分模型预测能力,选取术后1年、3年作为观察点,结果显示,Child-Pugh(AUC=0.832)能更好的预测术后1年生存率,然后依次分别为MELD-Na(AUC= 0.807),CLIF-C AD(AUC=0.747),MELD(AUC=0.746)和FIPS(AUC=0.745)。而在預测3年生存率方面,MELD-Na(AUC=0.726)具有更好的预测能力,其次是Child-Pugh(AUC=0.710),MELD(AUC=0.705)和CLIF-C AD(AUC=0.705),然后是FIPS(AUC=0.658)(图4c、d)。
3 讨论
TIPS自1982年开始应用于临床[10],历经数十年的发展,现已成为治疗肝硬化门静脉高压症的重要手段。患者肝脏功能与TIPS术预后密切相关。为了能够准确预测TIPS术后患者生存结局,目前已应用了一系列肝脏评分模型,如传统的CTP评分及肌酐矫正后CTP(CrCTP-Ⅰ, CrCTP-Ⅱ)、各种改良后MELD评分(MELD-Na、MESO、iMELD等)、APACHEⅡ评分以及近年来新开发的ALBI评分、FIPS评分等[6,11-13]。既往一些研究已对CTP、MELD、FIPS及APACHEⅡ评分模型的预测能力分别进行对比研究。然而,目前尚未见用传统肝功能Child-Pugh评分、MELD评分、MELD-Na与近年来新开发的CLIF-C AD评分、FIPS评分对TIPS患者生存预测价值相对比的研究。
本研究结果显示,TIPS术后生存组患者年龄低于死亡组,Alb、Na+均高于死亡组,而酒精性肝硬化患者比例、AST、PT、INR、TBil、腹水严重程度及五种模型评分均低于死亡组,差异均有统计学意义(P值均<0.05)。这与之前相关研究[14-18]报道年龄、酒精性肝硬化、肝功能评分是TIPS术后危险因素研究结果一致。分别校正生存组与死亡组患者间存在统计学差异且未被纳入各评分模型的混杂变量后发现,五种评分模型均是TIPS患者预后的独立影响因素。针对人群风险分层,通过Kaplan-Meier方法绘制生存曲线,并采用Log-rank检验进行比较,与既往研究结果相同[19],本研究同样显示,五种评分模型均具有较好的人群风险区分能力。比较每个时间点不同评分模型C指数发现,Child-Pugh评分对术后生存预测能力较高,其次为MELD-Na评分、MELD评分和CLIF-C AD评分,而FIPS评分预测能力相对较差;但随患者生存时间延长,Child-Pugh评分与FIPS评分预测能力均降低,而MELD评分和CLIF-C AD评分预测能力相对稳健。通过决策曲线也发现Child-Pugh评分和MELD-Na评分均表现良好。在1年、3年生存率预测的对比研究发现,Child-Pugh评分预测1年生存率优于另外四种评分;但在3年生存率预测方面,Child-Pugh评分预测能力下降,而MELD评分和CLIF-C AD评分预测能力相对稳健。在两个横断面时间点上,FIPS评分预测能力均不令人满意。
本研究显示,MELD评分在生存组与死亡组之间有统计学差异(P<0.05)。虽然Parvinian等[14]曾报道MELD评分不是TIPS患者预后危险因素,但本研究与既往大多研究[20-21]结果一致。另外,在模型预测能力评估中,本研究发现MELD评分与CLIF-C AD评分预测能力相当,但与Bettinger等[8]研究结果不同,本研究未发现FIPS评分对TIPS术后1年生存率预测能力优于Child-Pugh评分,究其原因可能为:一是纳入人群不同,本研究纳入患者主要是以乙型肝炎肝硬化为主体,而以上五种评分模型主要基于西方酒精性肝硬化人群建立,不同病因的肝硬化患者肝脏损伤特点及发生发展规律不尽一致,这可以导致研究结论不完全相同;二是本研究中患者肾功能基本正常,血肌酐水平在生存组与死亡组中未见明显统计学差异,且基本处于正常参考范围,因此,与Yang等[22]近期发表的回顾性研究结果不同,正常的血肌酐值可能降低了血肌酐作为评分因子(如MELD、FIPS、CLIF-C AD等)的整体预测效能。因此,针对我国肝硬化人群,肌酐是否可作为肝功能评分模型的纳入指标,需要进一步验证。此外,在评价各个评分模型在不同时间点预测肝硬化TIPS术后生存的能力方面,Child-Pugh评分在术后短期的生存率预测效能良好,这与Lv等[23]的研究一致。但本研究发现,Child-Pugh评分的生存预测能力受时间因素影响较大,术后3年生存率的预测能力明显低于其对TIPS术后1年生存率的预测,这可能是由于Child-Pugh评分主要用于预测急性出血情况下门体分流术后的早期存活率,因此,对TIPS术后长期预测价值可能存在局限性。
尽管本研究纳入人群数量相对较多,但仍存在一些局限性。第一,本研究是回顾性的研究,失访患者较多,可能导致统计分析上实际死亡人数降低。第二,由于本研究中患者总死亡人数较少,且部分患者随访时间未满3年,可能导致统计数据产生偏倚。第三,随着TIPS技术的发展及修订后手术适应证的相对宽松,在本研究中未对支架类型、手术适应证等潜在影响因素进行矫正分析,此外,部分患者缺乏术中门静脉压力值,以上均是研究结果出现偏倚的潜在因素。
本研究表明,Child-Pugh、MELD、MELD-Na、CLIF-C AD及FIPS对肝硬化TIPS术后患者生存均有一定的预测价值,且Child-Pugh分级、MELD评分>9、MELD-Na評分>15,CLIF-C AD评分>35及FIPS评分>-0.45均可为TIPS治疗的肝硬化患者提供有效的预后风险分层。在短期预测上Child-Pugh评分生存预测能力更好,长期预测上MELD-Na评分生存预测能力更好。而FIPS评分预测能力均相对较差。
伦理学声明:本研究2022年4月19日已取得中国人民解放军陆军特色医学中心伦理委员会批准,批号:医研伦审(2022)第74号。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:刘钰懿、慕之勇、胡辂、王军负责调研整理文献,设计论文框架,撰写论文;王军、熊伟、胡鸿、刘爱民、安选、许愈强、余灏东,王金能、文良志负责研究方案设计,TIPS手术及结果分析解读;陈东风负责终审论文。
参考文献:
[1]BOIKE JR, THORNBURG BG, ASRANI SK, et al. North American practice-based recommendations for transjugular intrahepatic portosystemic shunts in portal hypertension[J]. Clin Gastroenterol Hepatol, 2022, 20(8): 1636-1662.e36. DOI: 10.1016/j.cgh.2021.07.018.
[2]Chinese College of Interventionalists. CCI clinical practice guidelines: management of TIPS for portal hypertension (2019 edition)[J]. J Clin Hepatol, 2019, 35(12): 2694-2699. DOI: 10.3969/j.issn.1001-5256.2019.12.010.
中国医师协会介入医师分会. 中国门静脉高压经颈静脉肝内门体分流术临床实践指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2694-2699. DOI: 10.3969/j.issn.1001-5256.2019.12.010.
[3]LIU F, ZHAO JB, WANG JY, et al. Transjugular intrahepatic portosystemic shunt via jugular vein by using specialized covered stent: 2-year follow-up observation[J]. J Interv Radiol, 2021, 30: 888-892. DOI: 10.3969/j.issn.1008-794X.2021.09.007.
[4]PUGH RN, MURRAY-LYON IM, DAWSON JL, et al. Transection of the oesophagus for bleeding oesophageal varices[J]. Br J Surg, 1973, 60: 646-649. DOI: 10.1002/bjs.1800600817.
[5]MALINCHOC M, KAMATH PS, GORDON FD, et al. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts[J]. Hepatology, 2000, 31(4): 864-871. DOI: 10.1053/he.2000.5852.
[6]BIGGINS SW, KIM WR, TERRAULT NA, et al. Evidence-based incorporation of serum sodium concentration into MELD[J]. Gastroenterology, 2006, 130(6): 1652-1660. DOI: 10.1053/j.gastro.2006.02.010.
[7]JALAN R, PAVESI M, SALIBA F, et al. The CLIF Consortium Acute Decompensation score (CLIF-C ADs) for prognosis of hospitalised cirrhotic patients without acute-on-chronic liver failure[J]. J Hepatol, 2015, 62(4): 831-840. DOI: 10.1016/j.jhep.2014.11.012.
[8]BETTINGER D, STURM L, PFAFF L, et al. Refining prediction of survival after TIPS with the novel Freiburg index of post-TIPS survival[J]. J Hepatol, 2021, 74(6): 1362-1372. DOI: 10.1016/j.jhep.2021.01.023.
[9]de FRANCHIS R, BOSCH J, GARCIA-TSAO G, et al. Baveno VII - Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76(4): 959-974. DOI: 10.1016/j.jhep.2021.12.022.
[10]COLAPINTO RF, STRONELL RD, BIRCH SJ, et al. Creation of an intrahepatic portosystemic shunt with a Grüntzig balloon catheter[J]. Can Med Assoc J, 1982, 126(3): 267-268.
[11]GIANNINI E, BOTTA F, FUMAGALLI A, et al. Can inclusion of serum creatinine values improve the Child-Turcotte-Pugh score and challenge the prognostic yield of the model for end-stage liver disease score in the short-term prognostic assessment of cirrhotic patients?[J]. Liver Int, 2004, 24(5): 465-470. DOI: 10.1111/j.1478-3231.2004.0949.x.
[12]HUO TI, WANG YW, YANG YY, et al. Model for end-stage liver disease score to serum sodium ratio index as a prognostic predictor and its correlation with portal pressure in patients with liver cirrhosis[J]. Liver Int, 2007, 27(4): 498-506. DOI: 10.1111/j.1478-3231.2007.01445.x.
[13]RUBIN RA, HASKAL ZJ, O'BRIEN CB, et al. Transjugular intrahepatic portosystemic shunting: decreased survival for patients with high APACHE II scores[J]. Am J Gastroenterol, 1995, 90(4): 556-563.
[14]PARVINIAN A, SHAH KD, COUTURE PM, et al. Older patient age may predict early mortality after transjugular intrahepatic portosystemic shunt creation in individuals at intermediate risk[J]. J Vasc Interv Radiol, 2013, 24(7): 941-946. DOI: 10.1016/j.jvir.2013.03.018.
[15]FENG IC, TZENG WS, WANG SJ, et al. The role of transjugular intrahepatic portosystemic shunt in acute variceal bleeding: differential survival owing to different cirrhosis etiology[J]. J Gastroenterol, 2010, 27: 166-174. DOI: 10.6557/GJT.201006_27(2)0.0001
[16]SAAD N, RUDE MK, DARCY M, et al. Older age is associated with increased early mortality after transjugular intrahepatic portosystemic shunt[J]. Ann Hepatol, 2016, 15(2): 215-221. DOI: 10.5604/16652681.1193716.
[17]LI J, TANG S, ZHAO J, et al. Long-term survival prediction for transjugular intrahepatic portosystemic shunt in severe cirrhotic ascites: assessment of ten prognostic models[J]. Eur J Gastroenterol Hepatol, 2021, 33(12): 1547-1555. DOI: 10.1097/MEG.0000000000001890.
[18]ASCHA M, ABUQAYYAS S, HANOUNEH I, et al. Predictors of mortality after transjugular portosystemic shunt[J]. World J Hepatol, 2016, 8(11): 520-529. DOI: 10.4254/wjh.v8.i11.520.
[19]WEN L, HE S, ZHANG H, LUO X. Comparison study of five scoring systems for evaluating prognosis of patients undergoing transjugular intrahepatic portosystemic shunt procedures [J]. Chin J Hepatol, 2014, 22: 514-518. DOI: 10.3760/cma.j.issn.1007-3418.2014.07.008.
文龙跃, 何松, 张浩, 等. 五种评分系统对经颈静脉肝内门体静脉分流术患者预后的评价比较[J]. 中华肝脏病杂志, 2014, 22: 514-518. DOI: 10.3760/cma.j.issn.1007-3418.2014.07.008.
[20]SCHEPKE M, ROTH F, FIMMERS R, et al. Comparison of MELD, Child-Pugh, and Emory model for the prediction of survival in patients undergoing transjugular intrahepatic portosystemic shunting[J]. Am J Gastroenterol, 2003, 98(5): 1167-1174. DOI: 10.1111/j.1572-0241.2003.07515.x.
[21]ANGERMAYR B, CEJNA M, KARNEL F, et al. Child-Pugh versus MELD score in predicting survival in patients undergoing transjugular intrahepatic portosystemic shunt[J]. Gut, 2003, 52(6): 879-885. DOI: 10.1136/gut.52.6.879.
[22]YANG C, CHEN Q, ZHOU C, et al. FIPS score for prediction of survival after TIPS placement: External validation and comparison with traditional risk scores in a cohort of chinese patients with cirrhosis[J]. AJR Am J Roentgenol, 2022, 219(2): 255-267. DOI: 10.2214/AJR.21.27301.
[23]LV Y, WANG Z, LI K, et al. Risk stratification based on chronic liver failure consortium acute decompensation score in patients with child-pugh B cirrhosis and acute variceal bleeding[J]. Hepatology, 2021, 73(4): 1478-1493. DOI: 10.1002/hep.31478.
收稿日期:
2022-11-10;錄用日期:2022-12-29
本文编辑:林姣
