核因子E2相关因子2/血红素加氧酶-1(Nrf2/HO-1)信号通路在酒精性肝病中的作用
2023-04-29马成杨慧
马成 杨慧
摘要:
酒精性肝病(ALD)在我国的发病率逐年上升,国民的疾病负担日益增加。肝细胞的氧化应激反应是ALD的重要致病机制。核因子E2相关因子2/血红素加氧酶-1(Nrf2/HO-1)信号通路是人体重要的内源性抗氧化应激通路,在氧化应激作用下,Nrf2被激活并发挥其转录活性诱导HO-1高表达。HO-1是体内重要的氧化应激反应蛋白,与其血红素酶解产物(胆红素、CO、铁)共同发挥着抗炎、抗氧化及调控细胞凋亡的作用。本文将对近年来Nrf2/HO-1信号通路在ALD中的研究进展进行综述,力求为ALD的发生发展寻找理论依据及治疗切入点。
关键词:
肝疾病, 酒精性; NF-E2相关因子2; 血红素加氧酶-1; 信号传导
基金项目:
山西省省筹资金资助留学人员科研项目(2020-168)
Role of the nuclear factor erythroid 2-related factor 2/heme oxygenase-1 signaling pathway in alcoholic liver disease
MA Cheng1, YANG Hui2. (1. Graduate School of Shanxi Medical University, Taiyuan 030001, China; 2. Department of Infectious Diseases, The First Hospital of Shanxi Medical University, Taiyuan 030001, China)
Corresponding author:
YANG Hui,576371816@qq.com (ORCID:0000-0002-9162-6951)
Abstract:
The incidence rate of alcoholic liver disease (ALD) is increasing year by year China, and there is a gradual increase in disease burden among Chinese people. Oxidative stress response in hepatocytes is an important pathogenic mechanism of ALD. The nuclear factor erythroid 2-related factor 2 (Nrf2)/heme oxygenase-1 (HO-1) signaling pathway is an important endogenous anti-oxidative stress pathway in the body, and Nrf2 is activated in response to oxidative stress and exerts its transcriptional activity to induce high HO-1 expression. HO-1 is an important oxidative stress response protein and plays a role in anti-inflammation, anti-oxidation, and cell apoptosis regulation together with heme hydrolysis products (bilirubin, carbon monoxide, and iron). This article reviews the research advances in the role of the Nrf2/HO-1 signaling pathway in ALD in recent years, so as to find a theoretical basis for the development and progression of ALD and an entry point for treatment.
Key words:
Liver Diseases, Alcoholic; NF-E2-Related Factor 2; Heme Oxygenase-1; Signal Transduction
Research funding:
Scientific Research Project of Shanxi Province Raises Funds to Support Overseas Students (2020-168)
酒精性肝病(alcoholic liver disease,ALD)是由于長期大量饮酒导致的肝脏疾病。初期通常表现为脂肪肝,进而发展为酒精性肝炎、肝纤维化、肝硬化甚至肝癌[1]。随着人们生活水平的提高,ALD的发生率呈明显的上升趋势,已成为我国除病毒性肝炎之外的第二大肝病。ALD的发生发展由多种因素共同参与,乙醇代谢产物的直接损伤及其诱导的氧化应激是疾病进展的关键。核因子E2相关因子2(nuclear factor erythroid-2-related actor 2,Nrf2)系统是细胞和生物体响应氧化应激的关键防御机制,在活性氧(reactive oxygen species,ROS)的作用下Nrf2激活并发挥其转录活性诱导下游多种抗氧化酶的表达。血红素加氧酶-1(heme oxygenase-1,HO-1)是重要的氧化应激反应蛋白,与其血红素酶解产物(胆红素、CO、铁)共同发挥抗炎、抗氧化、调控细胞凋亡的作用。本文对Nrf2/HO-1信号通路在ALD发生发展中的作用进行综述,进而充分了解二者的相关性。
1 Nrf2/HO-1信号通路概述
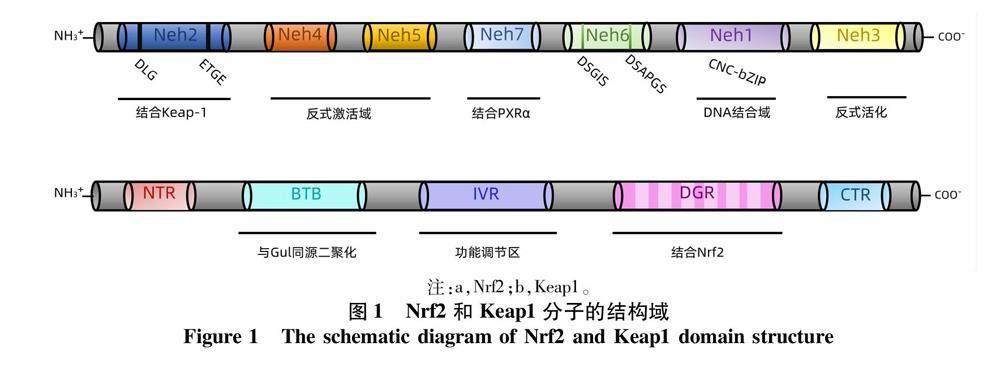
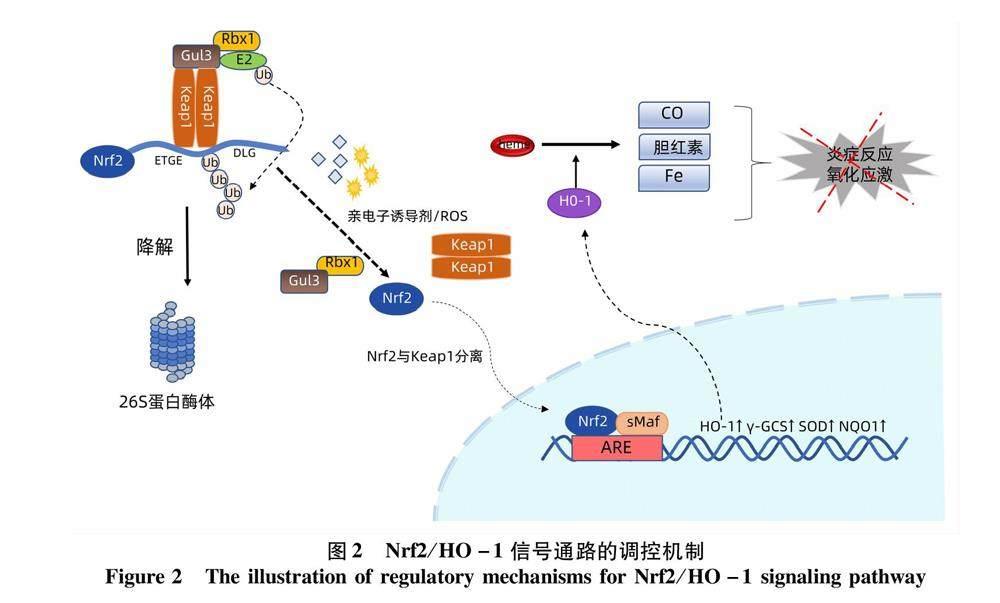
Nrf2系抗氧化剂的主要调节因子,并与一系列氧化应激相关的毒性和慢性疾病有关。Nrf2是具有碱性亮氨酸拉链(basic leucine zipper,bZIP)结构的cap‘ncollar转录因子家族成员,具有Neh1~Neh7高度保守的结构域(图1)。在基础条件下的细胞质中,Nrf2的Neh2结构通过其ETGE和DLG基序以1∶2的比例与Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH-associated protein-1,keap-1)中DGR结构域相互作用且由于其亲和力的差异结合成铰链-闩锁模型,并通过E3泛素连接酶的多泛素化使Nrf2被蛋白酶体迅速降解,导致细胞中的Nrf2蛋白水平较低[2]。在ROS或亲电子物质等诱导剂的修饰下,Nrf2-Keap1相互作用被破坏导致Nrf2降解减少和Nrf2在胞质中的积累,Keap1结合位点饱和使游离的Nrf2易位进入细胞核后与具有bZIP结构域的sMaf蛋白二聚化形成Nrf2-sMaf 異源二聚体,结合DNA占据并激活抗氧化反应元件(antioxidant response element,ARE),从而诱导多种抗氧化酶和信号蛋白的表达(图2),参与体内药物代谢的调节且发挥抗氧化防御保护作用[3]。
HO-1又称热休克蛋白32,广泛存在于人和哺乳动物中,是血红素分解代谢和限速步骤的关键酶,催化血红素的氧化裂解产生等摩尔量的亚铁、CO和胆红素。HO-1及其酶解产物具有抗炎、抗氧化、调控细胞凋亡和改善组织微循环等作用,在机体多种组织细胞的抗氧化应激反应和维系氧化与抗氧化系统稳态中发挥着重要作用[4]。Nrf2/HO-1信号通路是一种多器官保护通路,在多种实验性动物模型中均已证实该通路对各种炎症性疾病的调节起着核心作用,包括心血管疾病、肺部疾病、肾脏疾病以及相关代谢性疾病,HO-1 的过表达具有有益的治疗效果并且可能成为多种肝脏疾病有希望的治疗靶点[5]。
2 Nrf2/HO-1信号通路在ALD中的作用
肝脏是人体内最大的消化腺,接受来自肝动脉和门静脉的双重血供,具有分泌胆汁、分解和储存糖原、药物和毒物代谢、解毒及防御等重要功能[6]。由于肝脏是乙醇代谢的主要场所,肝脏会因过度饮酒而遭受最早和最大程度的组织损伤。而乙醇所致的酒精性肝损伤发病机制至今尚未阐明,其中氧化应激及炎性介质学说广泛参与了乙醇诱导的肝脂肪变性、炎症、肝纤维化、肝硬化及肝癌的形成和发展。Nrf2/HO-1信号通路在抗氧化和抑制炎症等方面起着关键作用,Sheriff等[7]研究发现,Nrf2基因敲除的小鼠对乙醇诱导的肝损伤更为敏感,表现为肝脏氧化应激、炎症反应、脂肪变性和坏死增加,确立了Nrf2在防止乙醇诱导的肝损伤中的核心作用。也有研究[8-9]表明,通过药理学方法或基因治疗增强肝脏Nrf2/HO-1途径表达可能是干预ALD氧化应激病理生理学的有效策略。
2.1 Nrf2/HO-1信号通路与酒精性脂肪肝 酒精性脂肪肝是长期饮酒导致肝脂肪的慢性过度积聚,数据[10]显示超过90%的酗酒者出现肝脂肪变性,约30%出现严重肝脂肪变性的患者有进展为肝硬化的风险。乙醇在乙醇脱氢酶和乙醛脱氢酶介导下代谢产生的还原型烟酰胺腺嘌呤二核苷酸改变了正常肝细胞内的氧化还原电位,使过氧化物酶体增殖物激活受体α失活的同时增加固醇调节元件结合蛋白基因表达,从而降低脂肪酸β氧化导致肝脂质沉积[11-12];乙醇诱导细胞色素P4502E1(CYP2E1)的活性产生过量的氧自由基导致氧化应激、脂质过氧化及酶活性的改变,促使肝细胞脂肪变性并进展为更严重的肝损伤[13]。
Nrf2作为经典的抗氧化调节蛋白,在调节肝脂质稳态中有着重要作用。Wu等[14]发现Nrf2的激活可通过增加抗氧化防御相关基因的同时减少参与脂质生成的基因,从而阻止乙醇诱导的氧化应激和肝脏中游离脂肪酸的积累。Palipoch等[15]在施用HO-1诱导剂血红素的雄性Wistar大鼠肝脏中发现HO-1基因表达的上调,氧化应激标志物丙二醛以及甘油三酯、ALT和AST水平显著降低,给予HO-1抑制剂锌原卟啉IX(ZnPPIX)则得到截然相反的结果,充分表明HO-1可以通过抑制氧化应激反应来缓解酒精诱导的肝脂肪变性。此外,Buko等[16]通过建立乙醇灌胃大鼠模型,分别检测乙醇处理组和绿原酸干预组大鼠的肝组织形态学改变和血清学指标及Nrf2和HO-1基因表达,发现用绿原酸治疗乙醇喂养的大鼠后,肝细胞中脂滴大小和数量明显减少,转氨酶及血清和肝脏甘油三酯含量显著降低,同时增强了Nrf2、HO-1的表达,揭示了绿原酸主要通过上调Nrf2/HO-1的表达来改善乙醇诱导氧化应激所致的肝损伤。然而,Nrf2/HO-1在酒精性脂肪肝中的作用仍需研究探讨并可为该疾病提供新的防治策略。
2.2 Nrf2/HO-1信号通路与酒精性肝炎 酒精性肝炎是由于持续过度饮酒导致肝脏发生炎症性改变,其临床表现从无症状的肝生物化学紊乱到暴发性肝功能衰竭或死亡,是一种更为严重的肝脏损害。反复高剂量饮酒会诱导CYP2E1上调、Kupffer细胞和中性粒细胞浸润以及谷胱甘肽等抗氧化剂的耗竭,加速肝细胞产生较高水平的ROS,导致氧化应激的发生和肝细胞损伤[17]。酒精会破坏消化道上皮屏障的紧密连接导致“肠道渗漏”,使微生物成分从肠道转移到门静脉循环和肝脏,引起肝脏炎症和肝细胞破坏[18]。
Nrf2能够通过调节炎症细胞的募集并诱导细胞的内源性抗氧化反应来抵消促炎过程,在肝脏炎症的发生和再生中扮演着重要的角色[19]。研究[20]已阐明Nrf2的激活部分通过减少肝脏炎性细胞因子的释放来减轻乙醇诱导的肝损伤,其保护作用伴随着参与抗氧化防御基因的诱导。Hong等[21]研究发现,在人和小鼠酒精性肝炎中内质网伴侣蛋白ERdj5 mRNA表达均升高,乙醇诱导的ERdj5在通过Nrf2介导的抗氧化反应保护小鼠免受酒精诱导的氧化应激方面发挥着关键作用。HO-1及其血红素降解产物与酒精性肝炎中肝细胞保护有关,HO-1可诱导肝损伤的改善和促炎细胞因子水平的下调,CO可以抑制炎症反应并促进巨噬细胞抗炎反应,而胆红素和胆绿素的保护作用主要基于它们的抗氧化作用[22]。槲皮素是一类具有自由基清除能力和抗炎活性的多酚类化合物,其生物活性在于通过诱导HO-1表达以降低ROS水平并抑制NLRP3炎症体的激活减少肝损伤。Liu等[23]通过灌胃给予雄性SPF Wistar大鼠槲皮素后进行急性乙醇暴露模拟急性酒精性肝损伤模型,研究表明,槲皮素可提高大鼠Nrf2/HO-1的表达,进而改善乙醇诱导的急性肝损伤,而给予抑制剂ZnPPIX 时,槲皮素的这种保护作用可能会减弱。
2.3 Nrf2/HO-1信号通路与酒精性肝硬化 酒精性肝硬化是酒精性肝病的终末期,是酒精滥用者死亡的主要原因之一。在慢性炎症反应激活Kuppffer细胞分泌多种细胞因子、趋化因子、神经内分泌因子、血管生成因子和先天免疫系统成分的影响下,肝星状细胞(HSC)活化并产生大量胶原蛋白和细胞外基质成分,是早期酒精性肝病向肝硬化发展的关键环节[24-25]。
酒精性肝硬化患者中Nrf2的表达和HO-1 mRNA的水平均明显升高,在维持氧化还原状态和肝脏功能中至关重要[26]。同样,Nunes等[27]研究结果显示了Nrf2启动子区域的单核苷酸变异有助于酒精性肝硬化的发病机理。Ni等[28]建立了乙醇诱导的酒精性肝纤维化的体外模型,进一步证明了IL-22延缓酒精性肝纤维化疾病进展的机制,可能与其促进Nrf2核易位和增强抗氧化轴Nrf2-keap1-ARE活性进而有效地抑制了HSC的活化和增殖密切相关。Liu等[29]研究也得出相似的结论,非活性菱形蛋白2最有可能通过激活Nrf2/HO-1信号通路来调节由酒精暴露引起的肝纤维化的进展。本课题组实验数据表明,HO-1诱导可以通过上调过氧化物酶体增殖物激活受体γ表达的同时直接或间接下调核因子-κB的活化来抑制HSC增殖和活化,对肝脏具有保护作用。Yang等[30]以HSC-T6作为研究肝纤维化机制的简便模型,Hemin和ZnPP-IX作为HO-1的特异性激动剂和抑制剂,研究表明Hemin诱导的HO-1表达降低了HSC中α平滑肌肌动蛋白的表达及血清透明质酸和Ⅲ型前胶原的产生,而这些影响可以被ZnPP-IX逆转,再次证明HO-1具有作为肝纤维化治疗靶点的潜力。
2.4 Nrf2/HO-1信号通路与酒精相关性肝癌 近年来随着全球范围内酒精滥用的增加,饮酒成为肝癌发生的重要危险因素,酒精相关性肝癌的发生率及死亡率呈逐年升高趋势,其风险与酒精消耗量呈指数关系[31]。氧化应激是酒精相关性肝癌发生的关键机制,继发于酒精代謝、炎症和铁储存增加的ROS所致。ROS的积累会导致DNA的结构和功能改变,从而导致细胞周期停滞或细胞凋亡,严重影响复制和转录等基因功能,在癌症的发生和促进中起主要作用[32]。
大量研究表明Nrf2信号通路在癌症预防和促进中起矛盾作用,HO-1在肝癌中的分子机制尚未阐明。黄芪甲苷在预防和治疗癌症相关疾病方面具有潜在的药理作用,Zhang等[33]实验数据显示,黄芪甲苷通过促进Nrf2的磷酸化和调节HO-1来减少氧化应激,持续抑制了肝纤维化的发展和延缓肝细胞癌(HCC)的发生,指出了Nrf2/HO-1 信号通路的激活是治疗HCC的潜在途径。同样,Zou等[34]研究表明HO-1可以通过其代谢产物下调miR-30d/miR-107水平来抑制HCC在体内的增殖和迁移,从而显著延缓HCC进展,此为HO-1在抗癌作用中新的分子机制。但Nrf2/HO-1通路在酒精相关性肝癌中的作用仍存在较大争议,部分学者[35]认为失调的 Nrf2 可能促进细胞增殖、触发血管形成、增强侵袭性并赋予药物抗性,是 HCC 的主要参与者。Wu等[36]揭示了HO-1 基因中的短(GT)n变体与肝癌风险有关,其可能赋予机体对肝癌的易感性而非保护作用。因此,Nrf2/HO-1抗氧化通路在肝脏肿瘤中发挥作用的分子生物学机制及其利弊评判仍需进一步研究探讨。
3 小结与展望
氧化应激是ALD发生发展的关键因素,Nrf2/HO-1信号通路是体内重要的抗氧化应激途径。以上研究均表明Nrf2/HO-1信号通路在ALD的各个阶段有着重要的保护作用,Nrf2和HO-1可能开发成为乙醇诱导的氧化应激和肝损伤较为敏感的预测标志物,而以上调Nrf2/HO-1信号通路为作用机制的抗氧化疗法很可能成为预防、延缓或治愈ALD的安全有效的治疗方法,因此,需要更多的临床实验证明上调Nrf2/HO-1信号通路在治疗ALD中的益处。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:马成负责收集文献,撰写论文;杨慧负责拟定写作思路,指导撰写文章,最后定稿及经费支持。
参考文献:
[1]
Fatty Liver Expert Committee, Chinese Medical Doctor Association, National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology,Chinese Medical Association. Guidelines of prevention and treatment for alcoholic liver disease: a 2018 update[J]. J Clin Hepatol, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.
中国医师协会脂肪性肝病专家委员会, 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 酒精性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34(5): 939-946. DOI: 10.3969/j.issn.1001-5256.2018.05.006.
[2]SILVA-ISLAS CA, MALDONADO PD. Canonical and non-canonical mechanisms of Nrf2 activation[J]. Pharmacol Res, 2018, 134: 92-99. DOI: 10.1016/j.phrs.2018.06.013.
[3]SHAW P, CHATTOPADHYAY A. Nrf2-ARE signaling in cellular protection: Mechanism of action and the regulatory mechanisms[J]. J Cell Physiol, 2020, 235(4): 3119-3130. DOI: 10.1002/jcp.29219.
[4]ZHANG A, SUZUKI T, ADACHI S, et al. Distinct regulations of HO-1 gene expression for stress response and substrate induction[J]. Mol Cell Biol, 2021, 41(11): e0023621. DOI: 10.1128/MCB.00236-21.
[5]RYTER SW. Heme oxygenase-1: An anti-inflammatory effector in cardiovascular, lung, and related metabolic disorders[J]. Antioxidants (Basel), 2022, 11(3): 555. DOI: 10.3390/antiox11030555.
[6]ZHOU J, ZHENG Q, CHEN Z. The Nrf2 pathway in liver diseases[J]. Front Cell Dev Biol, 2022, 10: 826204. DOI: 10.3389/fcell.2022.826204.
[7]SHERIFF L, KHAN RS, SABORANO R, et al. Alcoholic hepatitis and metabolic disturbance in female mice: a more tractable model than Nrf2-/- animals[J]. Dis Model Mech, 2020, 13(12): dmm046383. DOI: 10.1242/dmm.046383.
[8]WANG G, FU Y, LI J, et al. Aqueous extract of Polygonatum sibiricum ameliorates ethanol-induced mice liver injury via regulation of the Nrf2/ARE pathway[J]. J Food Biochem, 2021, 45(1): e13537. DOI: 10.1111/jfbc.13537.
[9]WANG X, CHANG X, ZHAN H, et al. Curcumin and Baicalin ameliorate ethanol-induced liver oxidative damage via the Nrf2/HO-1 pathway[J]. J Food Biochem, 2020. DOI: 10.1111/jfbc.13425. [Online ahead of print]
[10]FERDOUSE A, CLUGSTON RD. Pathogenesis of alcohol-associated fatty liver: lessons from transgenic mice[J]. Front Physiol, 2022, 13: 940974. DOI: 10.3389/fphys.2022.940974.
[11]OSNA NA, DONOHUE TM Jr, KHARBANDA KK. Alcoholic liver disease: pathogenesis and current management[J]. Alcohol Res, 2017, 38(2): 147-161.
[12]SEEN S. Chronic liver disease and oxidative stress - a narrative review[J]. Expert Rev Gastroenterol Hepatol, 2021, 15(9): 1021-1035. DOI: 10.1080/17474124.2021.1949289.
[13]CHEN WY, SHU FM, WANG H, et al. Role of the cytochrome P450 family in metabolic-associated liver diseases[J]. J Chin Hepatol, 2022, 38(9): 2182-2187. DOI: 10.3969/j.issn.1001-5256.2022.09.045.
陳玮钰, 舒发明, 王涵, 等. 细胞色素P450家族在肝脏代谢相关疾病中的作用[J]. 临床肝胆病杂志, 2022, 38(9): 2182-2187. DOI: 10.3969/j.issn.1001-5256.2022.09.045.
[14]WU KC, LIU J, KLAASSEN CD. Role of Nrf2 in preventing ethanol-induced oxidative stress and lipid accumulation[J]. Toxicol Appl Pharmacol, 2012, 262(3): 321-329. DOI: 10.1016/j.taap.2012.05.010.
[15]PALIPOCH S, KOOMHIN P, PUNSAWAD C, et al. Heme oxygenase-1 alleviates alcoholic liver steatosis: histopathological study[J]. J Toxicol Pathol, 2016, 29(1): 7-15. DOI: 10.1293/tox.2015-0035.
[16]BUKO V, ZAVODNIK I, BUDRYN G, et al. Chlorogenic acid protects against advanced alcoholic steatohepatitis in rats via modulation of redox homeostasis, inflammation, and lipogenesis[J]. Nutrients, 2021, 13(11). DOI: 10.3390/nu13114155.
[17]TOROK NJ. Update on alcoholic hepatitis[J]. Biomolecules, 2015, 5(4): 2978-2986. DOI: 10.3390/biom5042978.
[18]HOSSEINI N, SHOR J, SZABO G. Alcoholic hepatitis: a review[J]. Alcohol Alcohol, 2019, 54(4): 408-416. DOI: 10.1093/alcalc/agz036.
[19]RAMOS-TOVAR E, MURIEL P. Free radicals, antioxidants, nuclear factor-E2-related factor-2 and liver damage[J]. J Appl Toxicol, 2020, 40(1): 151-168. DOI: 10.1002/jat.3880.
[20]GALICIA-MORENO M, LUCANO-LANDEROS S, MONROY-RAMIREZ HC, et al. Roles of Nrf2 in liver diseases: molecular, pharmacological, and epigenetic aspects[J]. Antioxidants (Basel), 2020, 9(10):980. DOI: 10.3390/antiox9100980.
[21]HONG DG, SONG GY, EOM CB, et al. Loss of ERdj5 exacerbates oxidative stress in mice with alcoholic liver disease via suppressing Nrf2[J]. Free Radic Biol Med, 2022, 184: 42-52. DOI: 10.1016/j.freeradbiomed.2022.03.027.
[22]RYTER SW. Heme oxgenase-1, a cardinal modulator of regulated cell death and inflammation[J]. Cells, 2021, 10(3): 515. DOI: 10.3390/cells10030515.
[23]LIU S, TIAN L, CHAI G, et al. Targeting heme oxygenase-1 by quercetin ameliorates alcohol-induced acute liver injury via inhibiting NLRP3 inflammasome activation[J]. Food Funct, 2018, 9(8): 4184-4193. DOI: 10.1039/c8fo00650d.
[24]ZHANG Y, WU Y, SHEN W, et al. Crosstalk between NK cells and hepatic stellate cells in liver fibrosis (Review)[J]. Mol Med Rep, 2022, 25(6): 208. DOI: 10.3892/mmr.2022.12724.
[25]LI T, LIU HB, HU WY, et al. Role of inflammation in hepatic fibrosis[J]. J Clin Hepatol, 2022, 38(10): 2368-2372. DOI:10.3969/j.issn.1001-5256.2022.10.032.
李婷, 劉华宝, 胡文艳, 等. 炎症在肝纤维化中的作用[J]. 临床肝胆病杂志, 2022, 38(10): 2368-2372. DOI:10.3969/j.issn.1001-5256.2022.10.032.
[26]CHENG ML, LU YF, CHEN H, et al. Liver expression of Nrf2-related genes in different liver diseases[J]. Hepatobiliary Pancreat Dis Int, 2015, 14(5): 485-491. DOI: 10.1016/s1499-3872(15)60425-8.
[27]NUNES DOS SANTOS K, FLORENTINO RM, FRANA A, et al. Polymorphism in the promoter region of NFE2L2 gene is a genetic marker of susceptibility to cirrhosis associated with alcohol abuse[J]. Int J Mol Sci, 2019, 20(14): 3589. DOI: 10.3390/ijms20143589.
[28]NI YH, HUO LJ, LI TT. Antioxidant axis Nrf2-keap1-ARE in inhibition of alcoholic liver fibrosis by IL-22[J]. World J Gastroenterol, 2017, 23(11): 2002-2011. DOI: 10.3748/wjg.v23.i11.2002.
[29]LIU Y, KUANG Q, DAI X, et al. Deficiency in inactive rhomboid protein2 (iRhom2) alleviates alcoholic liver fibrosis by suppressing inflammation and oxidative stress[J]. Int J Mol Sci, 2022, 23(14): 7701. DOI: 10.3390/ijms23147701.
[30]YANG H, ZHANG L, CHEN J, et al. Heme oxygenase-1 inhibits the proliferation of hepatic stellate cells by activating PPARγ and suppressing NF-κB[J]. Comput Math Methods Med, 2022, 2022: 8920861. DOI: 10.1155/2022/8920861.
[31]BUCHANAN R, SINCLAIR J. Alcohol use disorder and the liver[J]. Addiction, 2021, 116(5): 1270-1278. DOI: 10.1111/add.15204.
[32]GANNE-CARRI N, NAHON P. Hepatocellular carcinoma in the setting of alcohol-related liver disease[J]. J Hepatol, 2019, 70(2): 284-293. DOI: 10.1016/j.jhep.2018.10.008.
[33]ZHANG C, LI L, HOU S, et al. Astragaloside IV inhibits hepatocellular carcinoma by continually suppressing the development of fibrosis and regulating pSmad3C/3L and Nrf2/HO-1 pathways[J]. J Ethnopharmacol, 2021, 279: 114350. DOI: 10.1016/j.jep.2021.114350.
[34]ZOU C, ZOU C, CHENG W, et al. Heme oxygenase-1 retards hepatocellular carcinoma progression through the microRNA pathway[J]. Oncol Rep, 2016, 36(5): 2715-2722. DOI: 10.3892/or.2016.5056.
[35]RAGHUNATH A, SUNDARRAJ K, ARFUSO F, et al. Dysregulation of Nrf2 in hepatocellular carcinoma: role in cancer progression and chemoresistance[J]. Cancers (Basel), 2018, 10(12): 481. DOI: 10.3390/cancers10120481.
[36]WU MM, HSIEH FI, HSU LI, et al. GT-repeat polymorphism in the HO-1 gene promoter Is associated with risk of liver cancer: a follow-up study from arseniasis-endemic areas in Taiwan[J]. J Clin Med, 2021, 10(7): 1489. DOI: 10.3390/jcm10071489.
收稿日期:
2022-09-20;錄用日期:2022-11-21
本文编辑:朱晶
引证本文:
MA C, YANG H. Role of the nuclear factor erythroid 2-related factor 2/heme oxygenase-1 signaling pathway in alcoholic liver disease
[J]. J Clin Hepatol, 2023, 39(7): 1708-1713.
马成, 杨慧. 核因子E2相关因子2/血红素加氧酶-1(Nrf2/HO-1)信号通路在酒精性肝病中的作用
[J]. 临床肝胆病杂志, 2023, 39(7): 1708-1713.