肝动脉灌注化疗及其综合治疗方案对中晚期肝细胞癌患者的临床疗效及预后因素分析
2023-04-29戴文聪臧梦雅袁国盛李祺李榕李文利董书语陈锦章
戴文聪 臧梦雅 袁国盛 李祺 李榕 李文利 董书语 陈锦章
摘要:
目的 本研究旨在觀察FOLFOX方案持续肝动脉灌注化疗(HAIC)及其综合治疗方案对中晚期肝细胞癌患者的临床疗效并分析影响预后的因素。方法 回顾性收集南方医科大学南方医院2018年9月—2021年11月行FOLFOX方案持续HAIC的66例中晚期肝细胞癌患者临床资料。观察治疗后患者的客观缓解率、疾病控制率、中位无疾病进展生存时间(mPFS)和中位生存时间(mOS)并记录治疗相关不良反应。针对伴有门静脉癌栓的患者,评价治疗对门静脉癌栓的疗效。采用Kaplan-Meier法进行生存分析。采用Cox回归分析影响预后的因素。结果 按照RECIST1.1标准,FOLFOX-HAIC及其综合治疗方案治疗66例中晚期肝细胞癌患者的客观缓解率和疾病控制率分别为33.3%(22/66)、86.4%(57/66),mPFS和mOS分别为8.2个月和22.1个月。其中39例合并门静脉癌栓的肝癌患者中完全缓解2例,部分缓解8例,稳定24例,进展5例。客观缓解率为25.6%(10/39),疾病控制率为87.2%(34/39)。不良反应主要为消化道反应16.7%(11/66)、发热12.1%(8/66)、肝区疼痛10.6%(7/66)、骨髓抑制3.0%(2/66)和造影剂过敏3.0%(2/66)。无Ⅳ级以上的毒副反应。无并发症导致的死亡。Cox分析显示肝外转移(HR=2.668,95%CI:1.357~5.245)和凝血酶原时间(HR=1.282,95%CI:1.080~1.630)是影响患者PFS的独立危险因素(P值均<0.05), AST水平(HR=1.008,95%CI:1.002~1.013)和凝血酶原时间(HR=1.303,95%CI:1.046~1.630)是影响患者OS的独立危险因素(P值均<0.05)。结论 FOLFOX-HAIC及其综合治疗方案治疗中晚期肝细胞癌有一定的疗效,不良反应可控。
关键词:癌, 肝细胞; 分子靶向治疗; 预后
基金项目:
广东省自然科学基金(2022A1515010526); 南方医科大学南方医院院长基金(2018C006)
Efficacy of hepatic arterial infusion chemotherapy and its multimodality therapeutic regimens in treatment of patients with advanced hepatocellular carcinoma and related prognostic factors
DAI Wencong1, ZANG Mengya1, YUAN Guosheng1, LI Qi1, LI Rong1, LI Wenli1, DONG Shuyu2, CHEN Jinzhang1. (1. Department of Infectious Diseases and Hepatology Unit, Nanfang Hospital, Southern Medical University, State Key Laboratory of Organ Failure Research, Guangdong Provincial Key Laboratory of Viral Hepatitis Research, Guangdong Provincial Institute of Liver Diseases, Guangzhou 510515, China; 2. The First Clinical Medical College, Southern Medical University, Guangzhou 510515, China)
Corresponding author:
CHEN Jinzhang, chenjinzhang@smu.edu.cn (ORCID:0000-0003-4964-2218)
Abstract:
Objective To investigate the efficacy of continuous hepatic arterial infusion chemotherapy (HAIC) with the FOLFOX regimen and its multimodality therapeutic regimen in the treatment of patients with advanced hepatocellular carcinoma, as well as the influencing factors for prognosis. Methods A retrospective analysis was performed for the clinical data of 66 patients with advanced hepatocellular carcinoma who received continuous HAIC with FOLFOX regimen in Nanfang Hospital, Southern Medical University, from September 2018 to November 2021. The patients were observed in terms of objective response rate (ORR), disease control rate (DCR), median progression-free survival (mPFS), and median overall survival (mOS) after treatment, and treatment-related adverse reactions were recorded. For the patients with portal vein tumor thrombus, the effect of the treatment on portal vein tumor thrombus was assessed. The Kaplan-Meier method was used for survival analysis, and the Cox regression analysis was used to investigate the influencing factors for prognosis. Results According to the RECIST1.1 criteria, FOLFOX-HAIC and its multimodality therapeutic regimen achieved an ORR of 33.3% (22/66) and a DCR of 86.4% (57/66) in the treatment of 66 patients with advanced hepatocellular carcinoma, with an mPFS time of 8.2 months and an mOS time of 22.1 months. Among the 39 patients with portal vein tumor thrombus, 2 achieved complete remission, 8 achieved partial remission, 24 achieved stable disease, and 5 had disease progression, with an ORR of 25.6% (10/39) and a DCR of 87.2% (34/39). The main adverse reactions included gastrointestinal reactions (16.7%, 11/66), pyrexia (12.1%, 8/66), liver area pain (10.6%, 7/66), bone marrow suppression (3.0%, 2/66), and contrast agent allergy (3.0%, 2/66), and there were no grade >Ⅳ toxic or side effects or deaths caused by such complications. The Cox regression analysis showed that extrahepatic metastasis (hazard ratio [HR]=2.668, 95% confidence interval [CI]: 1.357-5.245, P<0.05) and prothrombin time (PT) (HR=1.282, 95%CI: 1.080-1.630, P<0.05) were independent risk factors for PFS, and aspartate aminotransferase level (HR=1.008, 95%CI: 1.002-1.013, P<0.05) and PT (HR=1.303, 95%CI: 1.046-1.630, P<0.05) were independent risk factors for OS. Conclusion FOLFOX-HAIC and its multimodality therapeutic regimen has a certain clinical effect with controllable adverse reactions in the treatment of advanced hepatocellular carcinoma.
Key words:
Carcinoma, Hepatocellular; Molecular Targeted Therapy; Prognosis
Research funding:
Natural Science Foundation of Guangdong Province (2022A1515010526); President Foundation of Nanfang Hospital, Southern Medical University (2018C006)
原发性肝癌是全球第六大最常见的恶性肿瘤,病死率位列第四位,给家庭和社会带来沉重负担[1-2]。我国的肝癌发病率及病死率约占全球一半以上[3]。其中肝细胞癌(HCC)约占原发性肝癌的90%,患者确诊时往往已达中晚期,常规治疗手段中位生存时间不足10个月。因此,不断探索并寻求中晚期肝癌的综合治疗方案是改善患者总体生存率的关键[4-5]。
目前国内外指南中一致推荐索拉非尼和仑伐替尼作为晚期HCC的一线靶向治疗药物[6-7]。此外,在不可行手术切除、局部消融、经肝动脉栓塞化疗(transcatheter arterial chemoembolization, TACE),或已经出现血管侵犯等的晚期HCC患者中,肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)也是重要的治疗方法之一[8-9]。在亚洲的大部分国家和地区,HAIC已作为晚期HCC的标准治疗方案之一纳入了临床诊疗指南中[10]。然而HAIC的化疗方案众多,目前尚未明确推荐最优的化疗方案。在日韩地区,常使用的是以顺铂为基础的化疗方案[11-12]。在我国,以往常采用TACE联合HAIC作为晚期HCC的辅助治疗方式,不同地区不同中心的化疗方案不尽相同,常用的化疗药物有:顺铂、洛铂、奥沙利铂、雷替曲塞、阿霉素、表阿霉素、丝裂霉素等[13]。
近年来,中国学者创新性地以奥沙利铂为基础的FOLFOX化疗方案应用于肝癌的HAIC中,已有的数据提示FOLFOX-HAIC可以显著提高肿瘤的反应率和患者生存率,得到了国内越来越多临床医生的关注[14-16]。以FOLFOX-HAIC为核心的综合治疗方案,如FOLFOX-HAIC联合靶向治疗或免疫治疗或三联治疗也成为目前热点的研究方向。然而,FOLFOX-HAIC在国内的普及应用时间尚短,以FOLFOX-HAIC为核心的联合治疗方案还有待进一步探索及优化。本研究旨在分析FOLFOX-HAIC及其综合治疗方案治疗中晚期HCC患者的临床效果并进一步分析影响患者预后的因素,为优化其临床应用提供可靠的数据。
1 资料与方法
1.1 研究对象 回顾性分析2018年9月—2021年11月南方医科大学南方医院行FOLFOX方案HAIC及其综合治疗方案治疗的中晚期肝癌患者临床资料。原发性肝癌临床诊断标准参照国家卫生健康委发布的《原发性肝癌诊疗指南(2022版)》[17]。
纳入标准:(1)有完整的临床及实验室检查资料、影像资料以及随访资料;(2)美国东部肿瘤协作组(ECOG)体力状况(PS)评分≤2分;(3)Child-Pugh A级或B级;(4)无化疗禁忌证。
排除标准:(1)首次治疗伴有其他系统恶性肿瘤史者;(2)资料不全者;(3)只行1次HAIC治疗者;(4)严重且不可纠正的凝血功能障碍;(5)肝功能严重失代偿,合并难治性腹水、肝性脑病、消化道出血等;(6)恶病质或多器官功能衰竭;(7)HAIC治疗间隔时间超过4周。
1.2 治疗方法 HAIC治療采用Seldinger技术穿刺股动脉。根据肿瘤的动脉供血情况,超选择性地将导管置入到肿瘤的主要供血动脉。导管放置完毕后,外露部分用无菌纱布覆盖。患者卧床接受持续的化疗药物动脉灌注,严格按照化疗方案的剂量和时间注入化疗药物,全部输注完毕后再拔出导管。FOLFOX-HAIC化疗方案具体为:奥沙利铂 85 mg/m2 动脉滴注2~3 h,亚叶酸钙 400 mg/m2动脉滴注1~2 h,5-氟尿嘧啶 400 mg/m2 动脉团注后再以2 400 mg/m2持续动脉灌注46 h。HAIC术后给予护胃、止吐、保肝、补液等治疗,必要时给予止痛治疗,观察并记录术后不良反应。术后3 d复查肝肾功能及血常规。靶向治疗药物包括:索拉非尼、仑伐替尼、阿帕替尼、瑞戈非尼;免疫治疗药物包括:信迪利单抗、卡瑞利珠单抗、特瑞普利单抗、替雷利珠单抗和帕博利珠单抗。
1.3 疗效评价 每2个周期HAIC后复查上腹部增强CT或增强MRI评价病灶情况,采用RECIST1.1标准进行实体瘤疗效评价。完全缓解(CR):肿瘤完全消失;部分缓解(PR):肿瘤最大径之和缩小≥30%,并至少维持4周;稳定(SD):肿瘤最大径之和缩小未达到PR,或增大未达PD;进展(PD):最大径增大≥20%或出现新病灶。客观缓解率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD。长期生存时间(overall survival, OS):开始对肿瘤进行HAIC治疗至死亡或末次随访时间差值。无疾病进展生存时间(progression-free survival, PFS):开始对肿瘤进行HAIC治疗到肿瘤进展的时间。不良反应参照世界卫生组织抗肿瘤药物剂急性或亚急性毒性反应分度评价标准。
1.4 统计学方法 采用SPSS 20.0软件进行统计学分析。符合正态分布的计量资料采用x±s表示,不符合正态分布的采用M(P25~P75)表示。计数资料患者比例采用例(%)形式表示;Kaplan-Meier曲线分析生存率。单因素和多因素回归分析采用Cox回归分析,单因素分析P<0.1的指标纳入多因素分析。
P<0.05为差异有统计学意义。
2 结果
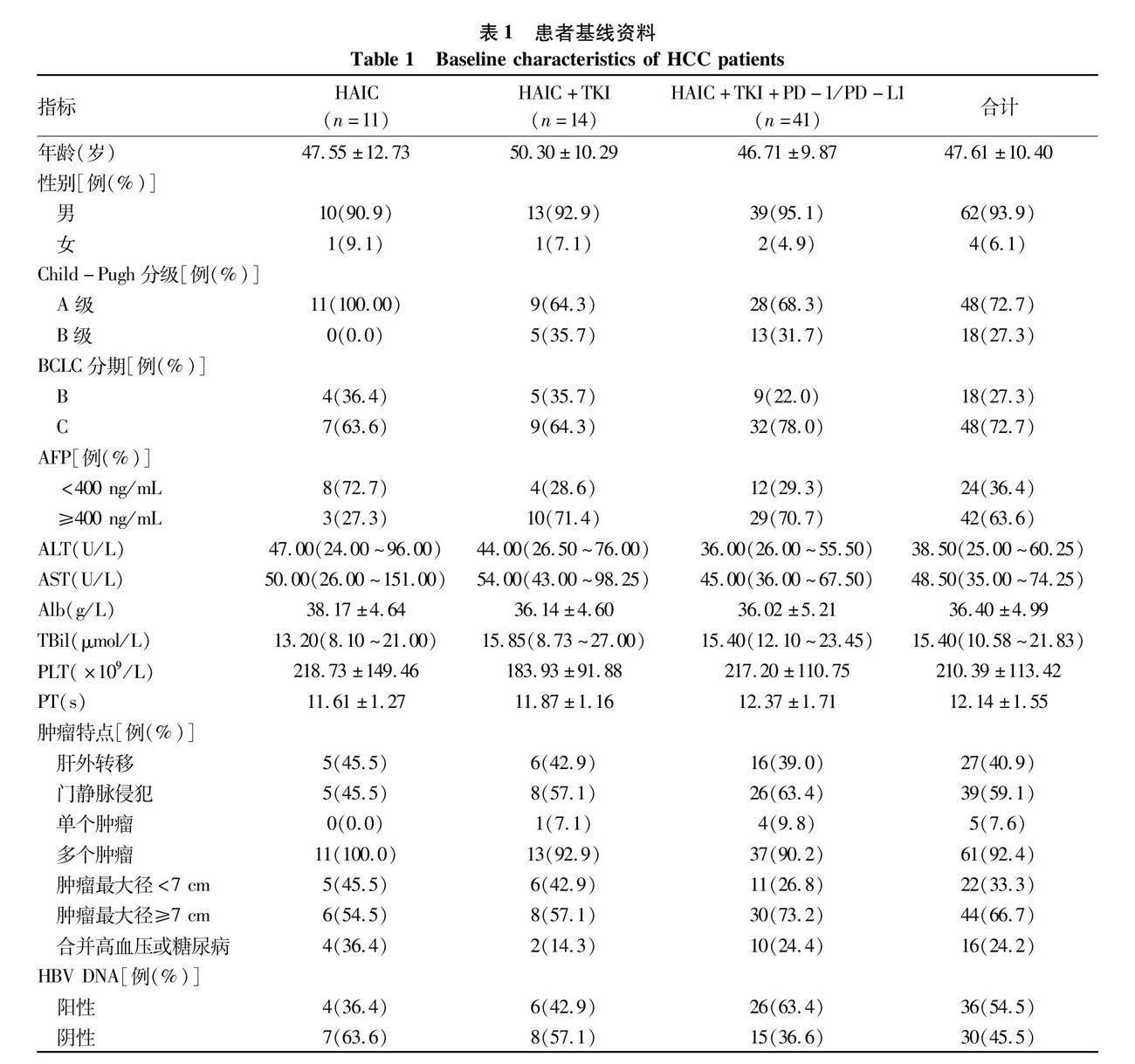
2.1 患者基线资料 共纳入66例中晚期HCC患者,其中单独行HAIC治疗11例,HAIC联合靶向治疗(HAIC+TKI)14例,HAIC联合靶向同时联合免疫治疗[HAIC+酪氨酸激酶抑制剂(TKI)+程序性死亡受体1及其配体(PD-1/PD-L1)]41例。平均年龄(47.61±10.40)岁,其中男62例(93.9%),BCLC分期C期48例(72.7%),肝功能Child-Pugh分级A级48例(72.7%),AFP≥400 ng/mL的42例(63.6%),HBV DNA阳性36例(54.5%)。肿瘤最大径≥7 cm的44例(66.7%),合并门静脉侵犯39例(59.1%),合并肝外转移27例(40.9%),多发肿瘤61例(92.4%)(表1)。
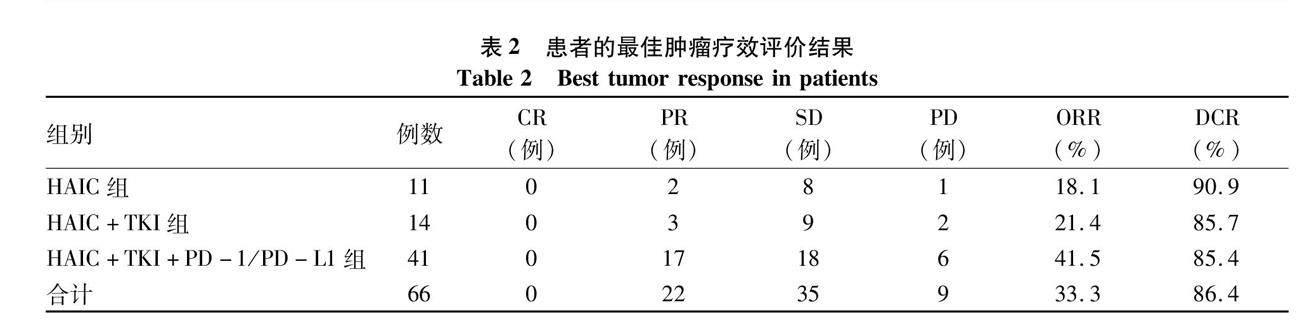
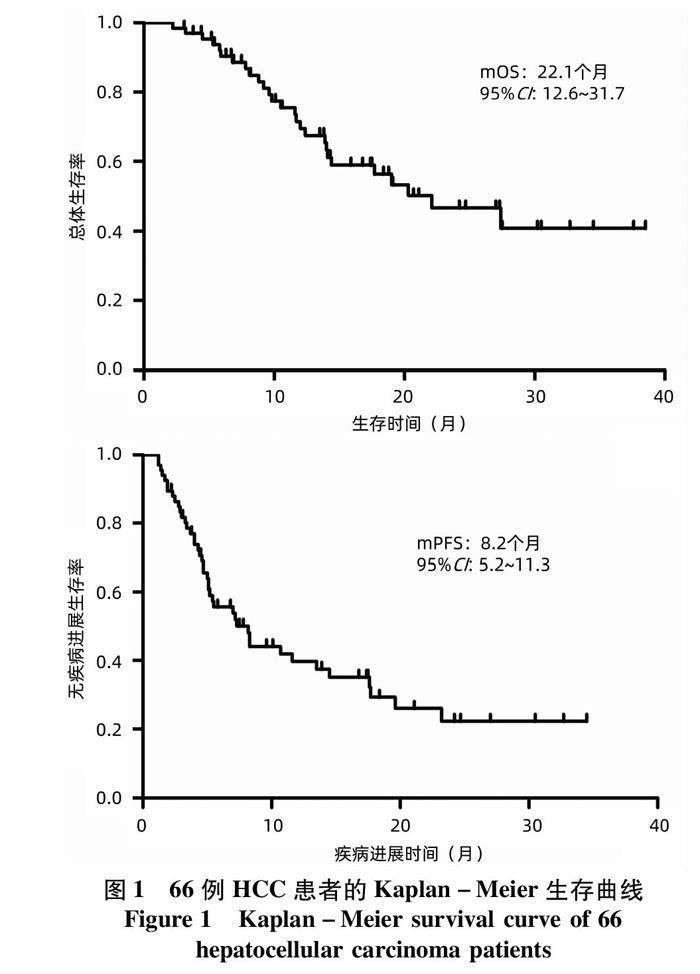
2.2 疗效评价 纳入的66例中晚期HCC患者的HAIC次数为2~6次,中位HAIC次数为3.7次。按照RECIST1.1标准,从HAIC治疗开始到HAIC治疗结束后1个月内肿瘤疗效评价的最佳结果进行分析,显示66例患者的ORR和DCR分别为33.3%(22/66)、86.4%(57/66)。其中单独HAIC组ORR和DCR分别为18.1%(2/11)和90.9%(10/11),HAIC+TKI组ORR和DCR分别为21.4%(3/14)和85.7%(12/14),HAIC+TKI+PD-1/PD-L1组ORR和DCR分别为41.5%(17/41)和85.4%(35/41)(表2)。66例中晚期HCC患者的中位无疾病进展生存时间(mPFS)和中位生存时间(mOS)分别为8.2个月和22.1个月(图1)。此外,针对合并门静脉癌栓的这部分患者进一步分析了治疗对门静脉癌栓的影响,按照RECIST1.1标准,结果显示39例合并门静脉癌栓的肝癌患者中CR 2例,PR 8例,SD 24例,PD 5例。ORR为25.6%(10/39),DCR为87.2%(34/39)(图2)。
2.3 不良反应 在所有患者中,主要不良反应为消化道反应16.7%(11/66)、发热12.1%(8/66)、肝区疼痛10.6%(7/66)、骨髓抑制3%(2/66)和造影剂过敏3%(2/66)。无Ⅳ级以上的毒副反应。无并发症导致的死亡。
2.4 影响患者PFS的可能因素 单因素分析结果显示,肝外转移(HR=2.907,95%CI:1.536~5.500,P=0.001)、HBV DNA阳性(HR=2.151,95%CI:1.126~4.110,P=0.020)和凝血酶原时间(PT)(HR=1.254,95%CI:1.024~1.535,P=0.028)与患者的PFS有关。将上述危险因素引入Cox比例风险回归模型,分析结果显示肝外转移和PT是影响患者PFS的独立危险因素(P值均<0.05)(表3)。
2.5 影响患者OS的可能因素 单因素分析结果显示,年龄(HR=0.964,95%CI:0.931~0.999,P=0.042)、AST水平(HR=1.007,95%CI:1.002~1.013,P=0.007)和PT(HR=1.276,95%CI:1.036~1.572,P=0.022)可能是患者OS的影响因素。将上述危险因素引入Cox比例风险回归模型,分析结果显示AST水平和PT是影响患者OS的独立危险因素(P值均<0.05)(表4)。
3 讨论
HCC是我国最常见的恶性肿瘤之一[18],其发病率高且预后较差。肝移植、外科手术切除及局部消融治疗是根治早期肝癌的重要手段[19],然而在我国大多数患者确诊时已是中晚期,失去了根治性治疗的最佳时机,无干预情况下mOS仅为半年。目前,国内外指南大多数推荐使用索拉非尼及仑伐替尼作为晚期HCC的一线标准治疗方案[17,20]。此外,日本指南[10]推荐将顺铂为主的HAIC作为晚期HCC的标准治疗方案之一。2021年,中國抗癌协会肝癌专业委员会也发布了HAIC治疗HCC的中国专家共识[21]。共识中指出以FOLFOX方案为核心的HAIC是一种安全且有效的晚期HCC治疗方法,其对机体的创伤较小、伤口愈合快、不良反应率低且住院时间短,与TACE相比,HAIC发生栓塞后综合征的概率显著降低[22]。
HAIC是利用肿瘤血供95%来源于肝动脉的特点,通过皮下置入动脉泵或者直接经导管给药的方法,将化疗药物经肝动脉送达肿瘤区域,使得肿瘤内部的药物浓度提高,从而降低了化疗药物的全身毒副作用,可以显著地提高肿瘤反应率和患者生存率。2019年,中山大学附属肿瘤防治中心团队研究[23]发现FOLFOX-HAIC联合索拉非尼治疗晚期肝癌相较于单纯的索拉非尼靶向治疗,在mOS(13.37个月vs 7.13个月)、mPFS(7.03个月vs 2.60个月)、ORR(40.8% vs 2.5%)等方面都有显著优势。此外有报道[11-12]指出,晚期HCC患者接受HAIC治疗可获得7.6~17.6个月的mOS。Mei等[24]研究发现在HAIC基础上联合免疫治疗可以进一步提升HAIC效果,mOS从14.6个月提高到18个月,mPFS从5.6个月提升到10个月,DCR从66%提高至83%。此外,HAIC联合靶向及免疫治疗的三联方案也展现出良好的疗效和安全性。有研究[25]结果显示,HAIC联合仑伐替尼及免疫治疗的三联方案较单用仑伐替尼获得了更长的mPFS(11.1个月vs 5.1个月)和mOS(未到达vs 11.1个月),更高的ORR(59.2% vs 9.3%)和DCR(90.1% vs 72.1%)。在本研究中,纳入的66例中晚期HCC患者接受了FOFLOX-HAIC及以其为基础的综合治疗方案,mPFS和mOS为8.2个月和22.1个月,这与既往的研究结果较为接近。此外,尽管有样本例数的限制,仍然观察到了HAIC联合靶向及免疫治疗三联方案较HAIC联合靶向治疗、单纯HAIC治疗有着更高的ORR(41.5% vs 21.4% vs 18.1%),这与既往的研究结论也是比较一致的[24-25]。但是在DCR方面,本研究未观察到HAIC联合靶向及免疫治疗三联方案较其他两组有着更高的DCR(85.4% vs 85.7% vs 90.9%)。
值得一提的是,在本研究中,伴有门静脉癌栓的患者比例达到59.1%。本研究进一步观察了治疗对门静脉癌栓的影响,结果显示,39例合并门静脉癌栓的肝癌患者中CR 2例,PR 8例,SD 24例,PD 5例。ORR为25.6%(10/39),DCR为87.2%(34/39)。既往有研究也提示HAIC对原发性肝癌患者的门静脉癌栓有一定疗效。在50例确诊原发性肝癌合并门静脉癌栓并接受FOLFOX-HAIC治疗的患者中,70%的患者门静脉癌栓较治疗前有所改善[26]。柯映平等[27]通过临床观察发现TACE联合FOFLOX-HAIC治疗对比TACE治疗,在门静脉癌栓DCR方面显示出更好的疗效(80% vs 54%)。此外,在分析影响患者预后因素方面,本研究发现肝外转移是影响患者PFS的独立危险因素之一。这在某种程度上提示,HAIC作为一种局部灌注的治疗方法可以较好地控制肝内病变,但其对于合并肝外转移患者的控制时间相对有限。此外,本研究发现AST水平而非ALT水平是影响患者OS的独立危险因素之一,这与Mei等[24]的研究结果一致。但是具体的机制还有待进一步探讨。
本研究是回顾性单中心研究,且样本例数有限。再者,由于回顾性研究的局限性,后续治疗不受控制,治疗方案在某种程度上对生存率有影响。尽管尚存在不足,但FOFLOX-HAIC及其综合治疗方案疗效是肯定的且不良反应可控,对于合并门静脉癌栓的患者也有良好的效果。期待未来有更多前瞻性多中心研究不断优化治疗策略及探索治疗优势人群。
伦理学声明:本研究方案于2020年7月9日经由南方医科大学南方医院伦理委员会审批,批号:NFEC-2020-130。所有患者均知情并签署知情同意书。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:戴文聪、臧梦雅负责分析数据,撰写论文;袁国盛、李祺、李榕、李文利、董书语负责查阅资料,修改稿件;陈锦章负责选题,指导撰稿及修改并最后定稿。
参考文献:
[1]
Global Burden of Disease Liver Cancer Collaboration, AKINYEMIJU T, ABERA S, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: Results from the global burden of disease study 2015[J]. JAMA Oncol, 2017, 3(12): 1683-1691. DOI: 10.1001/jamaoncol.2017.3055.
[2]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[3]ZHENG R, ZENG H, ZHANG S, et al. Estimates of cancer incidence and mortality in China, 2013[J]. Chin J Cancer, 2017, 36(1): 66. DOI: 10.1186/s40880-017-0234-3.
[4]WU T, CHEN L. New advances in the precision diagnosis and treatment of liver cancer[J]. J Clin Hepatol, 2022, 38(3): 497-498. DOI: 10.3969/j.issn.1001-5256.2022.03.001.
吴彤, 陈磊. 肝癌精准诊疗新进展[J]. 临床肝胆病杂志, 2022, 38(3): 497-498. DOI: 10.3969/j.issn.1001-5256.2022.03.001.
[5]LI Z, ZHU JY. Interpretation of Standard for diagnosis and treatment of primary liver cancer (2022 edition) [J]. J Clin Hepatol, 2022, 38(5): 1027-1029. DOI: 10.3969/j.issn.1001-5256.2022.05.010.
李照, 朱繼业. 《原发性肝癌诊疗指南(2022年版)》解读[J]. 临床肝胆病杂志, 2022, 38(5): 1027-1029. DOI: 10.3969/j.issn.1001-5256.2022.05.010.
[6]CHENG AL, KANG YK, CHEN Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. DOI: 10.1016/S1470-2045(08)70285-7.
[7]KUDO M, FINN RS, QIN S, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial[J]. Lancet, 2018, 391(10126): 1163-1173. DOI: 10.1016/S0140-6736(18)30207-1.
[8]LYU N, KONG Y, PAN T, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin in hepatocellular cancer with extrahepatic spread[J]. J Vasc Interv Radiol, 2019, 30(3): 349-357.e2. DOI: 10.1016/j.jvir.2018.09.004.
[9]HE MK, LIANG RB, ZHAO Y, et al. Lenvatinib, toripalimab, plus hepatic arterial infusion chemotherapy versus lenvatinib alone for advanced hepatocellular carcinoma[J]. Ther Adv Med Oncol, 2021, 13: 17588359211002720. DOI: 10.1177/17588359211002720.
[10]KOKUDO N, HASEGAWA K, AKAHANE M, et al. Evidence-based clinical practice guidelines for hepatocellular carcinoma: The Japan Society of Hepatology 2013 update (3rd JSH-HCC Guidelines)[J]. Hepatol Res, 2015, 45(2). DOI: 10.1111/hepr.12464.
[11]IKEDA M, OKUSAKA T, FURUSE J, et al. A multi-institutional phase II trial of hepatic arterial infusion chemotherapy with cisplatin for advanced hepatocellular carcinoma with portal vein tumor thrombosis[J]. Cancer Chemother Pharmacol, 2013, 72(2): 463-470. DOI: 10.1007/s00280-013-2222-x.
[12]NOUSO K, MIYAHARA K, UCHIDA D, et al. Effect of hepatic arterial infusion chemotherapy of 5-fluorouracil and cisplatin for advanced hepatocellular carcinoma in the Nationwide Survey of Primary Liver Cancer in Japan[J]. Br J Cancer, 2013, 109(7): 1904-1907. DOI: 10.1038/bjc.2013.542.
[13]Tumor Interventional Expert Committee of Chinese Anti-Cancer Association. Chinese tumor intervention expert consensus on the application principles of transcatheter arterial infusion chemotherapy[J]. J Intervent Radiol, 2017, 26(11): 963-970. DOI: 10.3969/j.issn.1008-794X.2017.11.001.
中国抗癌协会肿瘤介入专家委员会. 经导管动脉灌注化疗药物应用原则——中国肿瘤介入专家共识[J]. 介入放射学杂志, 2017, 26(11): 963-970. DOI: 10.3969/j.issn.1008-794X.2017.11.001.
[14]ZHAO M. Hepatic arterial infusion Chemotherapy in the Era of Precise[J]. J Sun Yat-Sen Univ(Medical Sciences), 2019, 40(5): 648-656. DOI: 1672-3554(2019)05-0648-09.
趙明. 精准医疗时代背景下的肝动脉灌注化疗[J]. 中山大学学报(医学科学版), 2019, 40(5): 648-656. DOI: 1672-3554(2019)05-0648-09.
[15]LI QJ, HE MK, CHEN HW, et al. Hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin versus transarterial chemoembolization for large hepatocellular carcinoma: A Randomized Phase III Trial[J]. J Clin Oncol, 2022, 40(2): 150-160. DOI: 10.1200/JCO.21.00608.
[16]SIDAWAY P. FOLFOX-HAIC active in large HCC[J]. Nat Rev Clin Oncol, 2022, 19(1): 5. DOI: 10.1038/s41571-021-00577-y.
[17]General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer (2022 edition)[J]. J Clin Hepatol, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
[18]Chinese College of Transplant Doctors, Liver Transplantation Group, Chinese Society of Organ Transplantation, Chinese Medical Association. Chinese clinical practice guidelines on liver transplantation for hepatocellular carcinoma (2021edition)[J]. Chin J Dig Surg, 2022, 21(4): 433-443. DOI: 10.3760/cma.j.cn115610-20220316-00135.
中国医师协会器官移植医师分会, 中华医学会器官移植学分会肝移植学组. 中国肝癌肝移植临床实践指南(2021版)[J]. 中华消化外科杂志, 2022, 21(4): 433-443. DOI: 10.3760/cma.j.cn115610-20220316-00135.
[19]LIU YY. New progress of hepatocellular carcinoma treatment[J]. Chin J Dig Surg, 2022, 21(1): 15-18. DOI: 10.3760/cma.j.cn115610-20220107-00020.
刘允怡. 肝细胞癌治疗的新发展[J]. 中华消化外科杂志, 2022, 21(1): 15-18. DOI: 10.3760/cma.j.cn115610-20220107-00020.
[20]European Association for the Study of the Liver. EASL clinical practice guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182-236. DOI: 10.1016/j.jhep.2018.03.019.
[21]Liver Cancer Professional Committee of Chinese Anti-Cancer Association. Chinese expert consensus on hepatic arterial infusion chemotherapy for hepatocellular carcinoma (2021 edition) [J]. J Chin J Dig Surg, 2021, 20(7): 754-759. DOI: 10.3760/cma.j.cn115610-20210618-00288.
中國抗癌协会肝癌专业委员会. 肝动脉灌注化疗治疗肝细胞癌中国专家共识(2021版)[J]. 中华消化外科杂志, 2021, 20(7): 754-759. DOI: 10.3760/cma.j.cn115610-20210618-00288.
[22]HE MK, LE Y, LI QJ, et al. Hepatic artery infusion chemotherapy using mFOLFOX versus transarterial chemoembolization for massive unresectable hepatocellular carcinoma: a prospective non-randomized study[J]. Chin J Cancer, 2017, 36(1): 83. DOI: 10.1186/s40880-017-0251-2.
[23]HE M, LI Q, ZOU R, et al. Sorafenib plus hepatic arterial infusion of oxaliplatin, fluorouracil, and leucovorin vs sorafenib alone for hepatocellular carcinoma with portal vein invasion: A randomized clinical trial[J]. JAMA Oncol, 2019, 5(7): 953-960. DOI: 10.1001/jamaoncol.2019.0250.
[24]MEI J, LI SH, LI QJ, et al. Anti-PD-1 immunotherapy improves the efficacy of hepatic artery infusion chemotherapy in advanced hepatocellular carcinoma[J]. J Hepatocell Carcinoma, 2021, 8: 167-176. DOI: 10.2147/JHC.S298538.
[25]MEI J, TANG YH, WEI W, et al. Hepatic arterial infusion chemotherapy combined With PD-1 inhibitors plus lenvatinib versus PD-1 inhibitors plus lenvatinib for advanced hepatocellular carcinoma[J]. Front Oncol, 2021, 11: 618206. DOI: 10.3389/fonc.2021.618206.
[26]WU YB, WU ZQ, HUANG JL, et al. Hepatic arterial infusion chemotherapy for primary liver cancer effect of portal vein tumor thrombus[J]. China Health Standard Management, 2022, 13(12): 109-112. DOI: 10.3969/j.issn.1674-9316.2022.12.027.
吴义波, 吴卓琼, 黄洁丽, 等. 肝动脉灌注化疗对原发性肝癌合并门静脉癌栓的效果[J]. 中国卫生标准管理, 2022, 13(12): 109-112. DOI: 10.3969/j.issn.1674-9316.2022.12.027.
[27]KE YP, YE SG, LU SB. Short-term efficacy of transcatheter arterial embolization combined with FOLFOX4 regimen of continuous arterial infusion chemotherapy on hepatocellular carcinoma patients with portal vein tumor thrombus[J]. China Med Pharm, 2022, 12(16): 156-159. DOI: 10.3969/j.issn.2095-0616.2022.16.040.
柯映平, 葉绍光, 卢舜彬. 肝动脉栓塞术联合FOLFOX4方案持续动脉灌注化疗对肝细胞癌门静脉癌栓患者的近期疗效[J]. 中国医药科学, 2022, 12(16): 156-159. DOI: 10.3969/j.issn.2095-0616.2022.16.040.
收稿日期:
2022-11-30;录用日期:2023-01-06
本文编辑:王亚南
引证本文:
DAI WC, ZANG MY, YUAN GS, et al.
Efficacy of hepatic arterial infusion chemotherapy and its multimodality therapeutic regimens in treatment of patients with advanced hepatocellular carcinoma and related prognostic factors
[J]. J Clin Hepatol, 2023, 39(7): 1592-1599.
戴文聪, 臧梦雅, 袁国盛, 等.
肝动脉灌注化疗及其综合治疗方案对中晚期肝细胞癌患者的临床疗效及预后因素分析
[J]. 临床肝胆病杂志, 2023, 39(7): 1592-1599.