12周索磷布韦联合可洛派韦治疗慢性丙型肝炎的效果和安全性分析
2023-04-29张伟翟嵩杜虹景富春王丽梅张野亢必勃王九萍党双锁连建奇姜泓
张伟 翟嵩 杜虹 景富春 王丽梅 张野 亢必勃 王九萍 党双锁 连建奇 姜泓
摘要:目的 分析索磷布韋联合盐酸可洛派韦12周方案治疗中国西北地区慢性丙型肝炎的效果和安全性。方法 本研究纳入2021年7月1日—2021年12月31日空军军医大学第一附属医院、空军军医大学第二附属医院、西安交通大学第二附属医院、陕西省宝鸡市中心医院4家医院的慢性丙型肝炎(CHC)接受索磷布韦(400 mg) 联合盐酸可洛派韦(60 mg)治疗12周的101例患者,其中肝硬化13例,无肝硬化88例。无论是否有肝硬化、任何基因分型均未加用利巴韦林等其他抗病毒药物。提取患者基线、治疗12周及停药后12周的HCV RNA定量、肝生化指标等临床资料。主要评估治疗结束后12周持续病毒学应答(SVR12)和治疗12周时的安全性。其次评估治疗12周对肝生化指标的影响。 不满足正态分布的计量资料采用M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。结果 共101 例患者纳入分析,其中男性55例(54.5%),中位年龄53岁,12.8%有肝硬化,1.0%合并肝癌,3.0%为经治患者,3.0%合并有2型糖尿病。基因型分布:1型8%,2型60%,3型19%,6型6%,未检测基因型7%。101例患者经12周治疗HCV RNA均低于检测下限,SVR12达100%,与基线相比治疗12周血清ALT水平明显降低(P<0.05)。有阿托伐他汀钙、阿司匹林、二甲双胍、硝苯地平、双环醇、复方甘草酸苷等合并用药的患者为22.7%。任何不良事件发生率为16.8%,疲乏(12.9%)最常见。结论 12周索磷布韦联合盐酸可洛派韦治疗西北地区 CHC患者可获得较高的SVR12,抗病毒治疗安全性良好,治疗12周时患者血清ALT异常明显改善。
关键词:丙型肝炎, 慢性; 盐酸可洛派韦; 索磷布韦; 治疗结果
基金项目:国家自然科学基金面上项目(81671555)
Efficacy and safety of the 12-week sofosbuvir-coblopasvir regimen in treatment of chronic hepatitis C
ZHANG Wei1, ZHAI Song2, DU Hong3, JING Fuchun4, WANG Limei5, ZHANG Ye3, KANG Bibo3, WANG Jiuping1, DANG Shuangsuo2, LIAN Jianqi3, JIANG Hong3. (1. Department of Infectious Diseases, The First Affiliated Hospital of Air Force Medical University, Xian 710032, China; 2. Department of Infectious Diseases, The Second Affiliated Hospital of Xian Jiaotong University, Xian 710004, China; 3. Department of Infectious Diseases, Baoji Peoples Hospital, Baoji, Shaanxi 721006, China; 4. Department of Infectious Diseases, The Second Affiliated Hospital of Air Force Medical University, Xian 710038, China; 5. Department of Microbiology and Pathogenic Biology, School of Basic Medical Sciences, Air Force Medical University, Xian 710032, China)
Corresponding author:
JIANG Hong, jiangh518@126.com (ORCID:0000-0003-2075-3272)
Abstract:
Objective To investigate the efficacy and safety of the 12-week regimen with sofosbuvir and coblopasvir hydrochloride in the treatment of chronic hepatitis C (CHC) in northwest China. Methods This study enrolled 101 patients with CHC of any genotype who received sofosbuvir (400 mg) combined with coblopasvir hydrochloride (60 mg) for 12 weeks in The First Affiliated Hospital of Air Force Medical University, The Second Affiliated Hospital of Air Force Medical University, The Second Affiliated Hospital of Xian Jiaotong University, and Baoji Central Hospital from July 1 to December 31, 2021, among whom 13 had liver cirrhosis and 88 did not have live cirrhosis. Other antiviral drugs such as ribavirin were not added regardless of the presence or absence of liver cirrhosis or the genotype of CHC. Related clinical data ere extracted, including HCV RNA quantification and liver biochemical parameters at baseline, at week 12 of treatment, and at 12 weeks after drug withdrawal. The primary endpoints were sustained virologic response at 12 weeks after the end of treatment (SVR12) and safety at week 12 of treatment, and the secondary endpoint was the effect of the 12-week treatment on liver biochemical parameters. The non-normally distributed continuous data were expressed as M(P25-P75), and the Mann-Whitney U test was used for comparison between groups. Results A total of 101 patients were included in the analysis, among whom there were 55 male patients (54.5%) and 46 female patients, and the median age was 53 years. Among these patients, 12.8% had liver cirrhosis, 1.0% had liver cancer, 3.0% were treatment-experienced patients, and 3.0% had type 2 diabetes. As for genotype distribution, 8% had CHC genotype 1, 60% had CHC genotype 2, 19% had CHC genotype 3, and 6% had CHC genotype 6, and genotype was not tested for 7% of the patients. After 12 weeks of treatment, all 101 patients had a HCV RNA level of below the lower limit of detection and an SVR12 rate of 100%, with a significant reduction in the serum level of alanine aminotransferase (ALT) from baseline to week 12 of treatment (P<0.05). Among these patients, 22.7% had concomitant medications such as atorvastatin calcium, aspirin, metformin, nifedipine, bicyclol, and compound glycyrrhizin. The incidence rate of adverse events was 16.8%, and fatigue (12.9%) was the most common adverse event. Conclusion The 12-week treatment with sofosbuvir and coblopasvir hydrochloride can obtain high SVR12 in CHC patients in northwest China and has good antiviral safety, with a significant improvement in abnormal serum ALT at week 12 of treatment.
Key words:
Hepatitis C, Chronic; Coblopasvir; Sofosbuvir; Treatment Outcome
Research funding:National Natural Science Foundation of China (81671555)
慢性丙型肝炎(CHC)是引起肝硬化、肝细胞癌(HCC)的重要原因,相关的肝病导致全球每年约39.9万例患者死亡[1-2]。直接抗病毒药物(DAA)主要作用于非结构蛋白NS3/4A蛋白酶、NS5A和NS5B聚合酶[3]。2013年以来,多种DAA进入临床,在CHC治疗领域全面取代干扰素联合利巴韦林(PR),成为治愈CHC最重要的药物[4-5]。NS5B RNA依赖的RNA聚合酶在HCV复制过程中发挥了重要作用,是DAA作用的重要靶点,多种DAA联合治疗方案包含有NS5B抑制剂。
中国CHC患者約980万[2,6]。目前我国应用的DAA多数为进口药物,有研究[7-9]对比发现,中国和美国患者SVR并没有明显差异。盐酸可洛派韦是我国自主研发的DAA,为NS5A抑制剂,盐酸可洛派韦联合索磷布韦12周方案在Ⅲ期临床试验中显示出较好的疗效和安全性,但治疗CHC真实世界研究尚较少,本文对一组病例进行回顾分析,报告如下。1 资料与方法
1.1 研究对象 回顾性分析2021年7月1日—2021年12月31日空军军医大学第一附属医院、空军军医大学第二附属医院、西安交通大学第二附属医院、陕西省宝鸡市中心医院4家医院的101例CHC接受索磷布韦(400 mg)联合盐酸可洛派韦(60 mg)治疗12周的患者。纳入标准:(1)抗HCV阳性,HCV RNA阳性,无论是否合并肝硬化、HCC,无论既往是否接受过PR治疗或DAA治疗;(2)年龄≥18岁;(3)病史及检验资料齐全。排除标准:(1)合并HIV感染者;(2)实体器官移植者;(3)开始治疗前3个月内接受免疫抑制剂治疗,预期寿命低于12个月的终末期疾病患者。
1.2 研究方法 所有患者接受索磷布韦(400 mg),口服,1次/d,联合盐酸可洛派韦(60 mg),口服,1次/d,疗程12周,包括肝硬化患者或基因3型患者皆采用此方案,均未加用利巴韦林。患者基线检查项目包括血常规、肝生化指标、肾功能、甲胎蛋白、HCV抗体、HCV RNA定量、腹部B超。患者开始治疗前1个月内的检查结果作为基线资料;基线、治疗结束、治疗后12周行血常规、AFP、HCV RNA定量、腹部B超,肝纤维化扫描。
肝硬化诊断需达到以下标准至少1条:(1)肝活检纤维化分期4期;(2)肝脏硬度值>12.5 kPa;(3)临床、内镜、影像和实验室检查提示肝硬化伴或不伴有门静脉高压症[10]。
检测方法:HCV RNA定量试剂盒购自罗式诊断产品(上海)有限公司或湖南圣湘生物科技有限公司,检测下限为HCV RNA 15 IU/mL或100 IU/mL,依患者当时所在医院的检测条件,低于检测下限视为阴性。HCV基因分型采用HCV RNA基因分型PCR,试剂盒购自湖南圣湘生物科技有限公司或中山大学达安基因分司。
疗效指标:主要疗效指标包括12周持续病毒学应答(SVR12)(定义为治疗结束12周HCV RNA低于检测下限)。安全性方面主要观察治疗过程中估算的肾小球滤过率(eGFR)。次要疗效指标包括治疗前、治疗12周的血清总胆结素、ALT、AST。
1.3 统计学方法 使用SPSS 23.0统计软件进行数据分析,使用GraphPAD 9.2和EXCEL2016绘图。计量资料采用M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结果
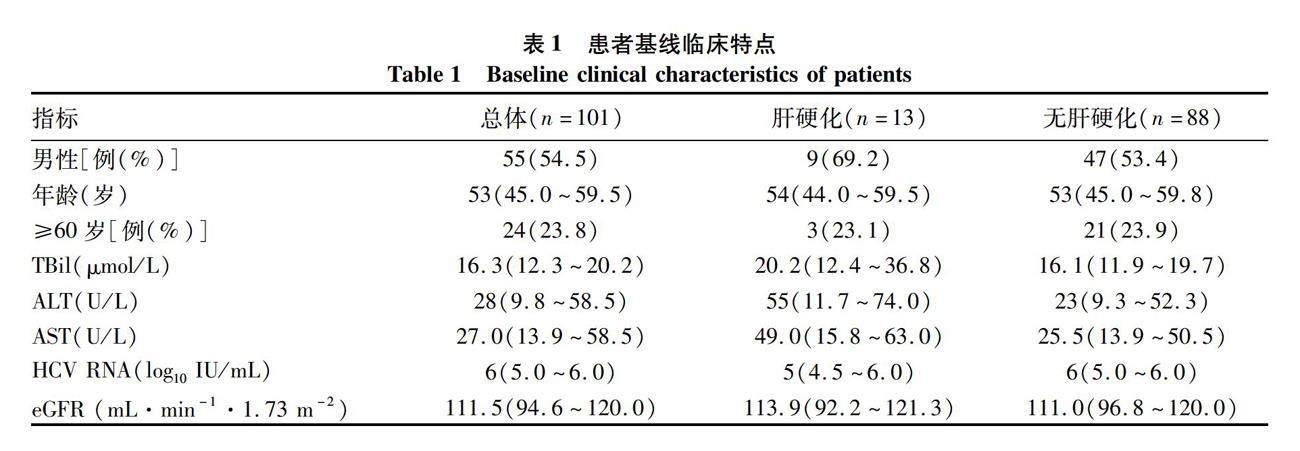
2.1 一般资料 共101例患者纳入研究,患者平均年龄51.4(20~84)岁,男性占54.4%,女性占45.6%,13例(12.8%)患者基线存在肝硬化,无失代偿期肝硬化患者。3例为经治患者,其中1例为索磷布韦维帕他韦治疗后,1例为其他仿制DAA治疗后,1例为干扰素治疗后复发。合并用药的患者占22.8%(23/101):4例患者使用阿托伐他汀钙片,3例患者使用双环醇片,3例患者使用甘草酸二铵肠溶胶囊,2例使用扶正化瘀胶囊,2例使用肝爽颗粒,2例使用二甲双胍,2例使用胰岛素,1例使用阿斯匹林, 1例患者使用谷胱甘肽片,1例患者使用安络化纤丸,1例使用消炎利胆片,1例使用硝苯地平缓释片。伴发疾病:糖尿病3例,高血压2例,酒精性肝病2例,冠心病1例,肝癌1例,肾恶性肿瘤1例,脂肪瘤1例。HCV RNA载量最小值1.97×102 IU/mL,最大值1.97×108 IU/mL,平均值log10值为6。
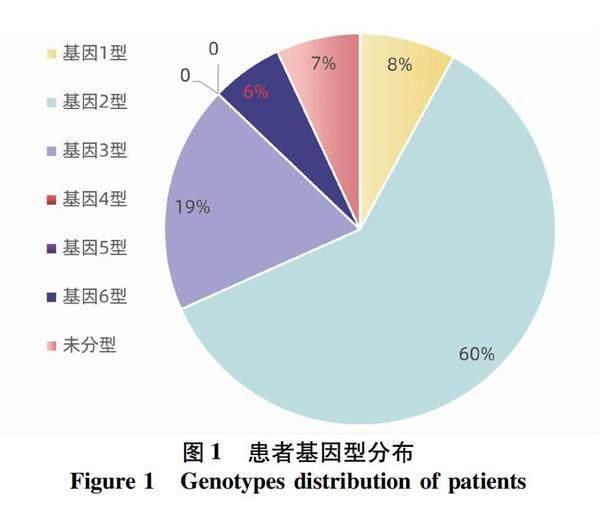
2.2 患者的基因型分布 患者基因型分布见图1,1型8%,2 型60%,3型19%,无4型、5型,6型6%,未检测基因型7%。基因3型患者共19例(3a型12例,3b型7例),其中男性15例,女性4例,平均年龄49.3岁,5例合并肝硬化, HCV RNA载量log10平均值为6。
2.3 病毒学应答情况 101例患者治疗12周时HCV RNA均阴转,SVR12率为100%,其中13例肝硬化、19例基因3型、3例复治患者均获得SVR12。
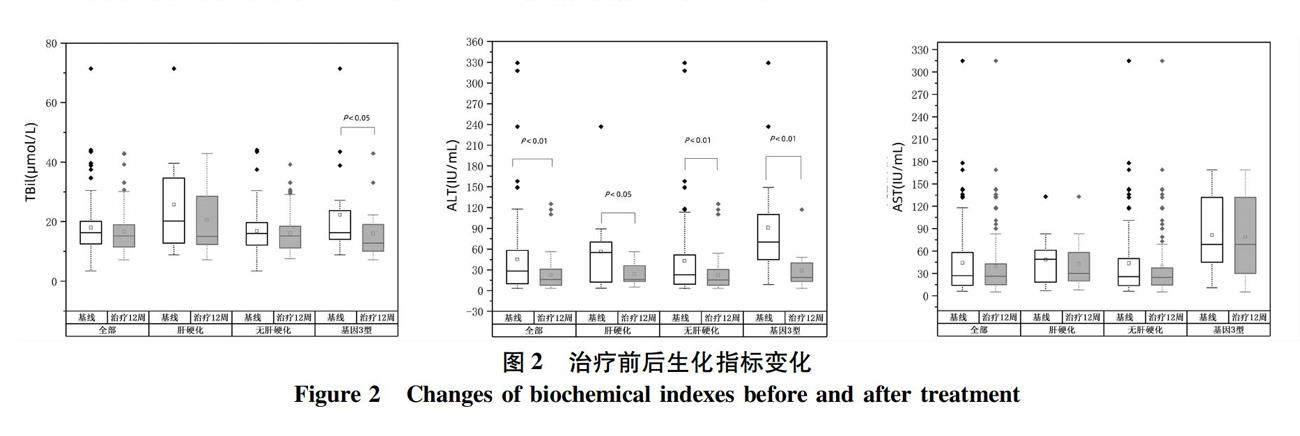
2.4 抗病毒治疗对患者生化指标的影响 治疗后基因3型患者TBil较治疗前有明显降低(P<0.05)。治疗后全部患者、肝硬化患者、无肝硬化患者、基因3型ALT均明显降低(P值均<0.05)。但AST在治疗前后变化没有显著变化。治疗前后患者生化指标变化情况见图2、表2。
2.5 抗病毒治疗安全性 治疗12周eGFR未见明显变化(表3,图3)。本组患者未见发生死亡,在12周治疗中有17例(16.8%)出现至少一种不良事件,任何不良事件发生率为16.8%,乏力(12.9%)最为常见(表4)。
3 讨论
本研究结果显示索磷布韦联合盐酸可洛派韦12周方案治疗CHC效果好,SVR12率不受基线因素,包括性别、年龄、既往治疗经历、基因型、病毒载量、肝功能的影响,在治疗12周肝生化指标明显改善,特别是ALT显著下降。
HCV有多个基因型和亚型,1b、2a、3a、3b和6a是我国的主要基因型,其中1b型在全国都有分布,占56%以上,其他基因型分别呈现出一定的地域差异[11]。本组病例中,基因1b型患者仅有8%,基因2a型达60%,与全国基因型分布总体比例不一致,其主要原因1b型患者选择基因特异型药物更容易得到医保支付,多数选择了基因特异性药物如艾尔巴韦格拉瑞韦、来迪派韦索磷布韦等。因此,基因2型患者成为本组病例的主要患者群。
HCV复发后的再治疗仍然是一个重要挑战,DAA初始治疗失败后重新治疗治愈率约为85%[12]。本组3例复治患者均取得了较好疗效,治疗后12周未见复发。基因3型特别是3b亚型,常可导致肝病的快速发展,在我国西南地区高流行,達26.7%~43.6%,在西北地区也较为常见[13-15]。基因3b型者对NS5A抑制剂有天然抗性,以索磷布韦为骨架的DAA方案在基因3型患者的SVR12低于其他基因型[16]。盐酸可洛派韦胶囊说明书中提到其Ⅱ期临床研究纳入110例受试者,其中7例3型受试者全部获得SVR12,提示盐酸可洛派韦可能在3型患者中有一定的优势。在Ⅲ期临床试验中盐酸可洛派韦联合索磷布韦联合治疗入组371例受试者,其中50例基因3型患者中有45例患者获SVR12,SVR12率达90%。本组研究纳入19例基因3型患者都取得了较好的疗效,与其临床试验结果一致,但病例数仍然较少,尚需大样本观察。
DAA治疗可以减少HCV相关早期肝癌根治术后的复发[17]。一组经过DAA治疗的28例HCV相关HCC患者,其术后3年无病生存率为69%,而未经DAA治疗的对照组3年无病生存率为35%,说明通过DAA治疗获得SVR可以减少HCV相关HCC的复发[18]。另外一项研究,对比经DAA药物治疗、干扰素治疗及未进行抗病毒治疗的HCV相关HCC,发现在根治后的HCV相关HCC患者中,DAA诱导的SVR患者的1年复发率高于接受干扰素抗病毒治疗的患者,但与未治疗的患者相比,DAA似乎没有增加HCC的复发率,通过多变量分析,与未治疗组相比,DAA是HCC复发的一个改善因素[19]。但也有研究[17]认为,在DAA治疗获得SVR的肝硬化患者中,肝组织中干扰素诱导基因表达也随之下降,从肝脏免疫微环境角度而言,并不利于阻止肝癌复发。本组纳入1例肝癌患者,表现出良好的安全性,未观察到与肝癌复发相关指标。有研究[20]表明,在DAA治疗获得SVR的患者中,肝纤维化进展的一些因素仍持续存在。因此获得SVR后仍需定期复查,观察病情变化。
DAA药物的总体安全性良好,即使在老年人群中亦表现出良好的安全性[21]。本研究中纳入24例老年患者,最大年龄84岁,均未出现严重不良事件,与上述结果一致。索磷布韦主要经过肾脏代谢,但是在一些轻中型慢性肾脏病患者也可以使用[22]。本研究中常用的降压药、降酶药、抗肝纤维化药物、糖尿病用药未发现明显影响。
本研究存在一些局限性:一是为本组病例为回顾性分析,主要观察的肝生化指标和病毒学指标以及eGFR、AFP、血常规、Alb等指标未进行比较,在指标设置方面不全面。二是肝硬化患者仅有13例,在统计结果中可能存在较大偏倚。三是观察时间较短,未对治疗前后肝纤维化的指标进行对比分析,未进一步观察SVR24,特别是复治患者,可能需要更长时间的观察。
综上所述,通过本组病例回顾分析初步显示盐酸可洛派韦联合索磷布韦治疗CHC患者耐受性良好,疗效佳,可以作为CHC治疗的推荐药物。有关盐酸可洛派韦联合索磷布韦在肝硬化患者、基因3型患者、经治患者、以及肾功能不全患者中的疗效和安全性,还需要大样本、多中心、前瞻性研究进一步观察。
伦理学声明:本研究于2021年3月8日经空军军医大学第二附属
医院伦理委员会批准,批号:202103-038。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张伟、翟嵩、杜虹、景富春负责实施研究,采集数据,分析/解释数据,起草文稿;王丽梅、张野、亢必勃负责采集数据,分析/解释数据,文稿修改;王九萍、党双锁、连建奇负责技术支持;姜泓负责设计研究,分析/解释数据,修改文章。张伟、翟嵩、杜虹、景富春对本文贡献等同,同为第一作者。
参考文献:
[1]EL-SERAG HB. Epidemiology of viral hepatitis and hepatocellular carcinoma[J]. Gastroenterology, 2012, 142(6): 1264-1273. e1. DOI: 10.1053/j.gastro.2011.12.061.
[2]Polaris Observatory HCV Collaborators. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study[J]. Lancet Gastroenterol Hepatol, 2017, 2(3): 161-176. DOI: 10.1016/S2468-1253(16)30181-9.
[3]KHAN H, PAESHUYSE J, MURAD S, et al. Assessment of the activity of directly acting antivirals and other products against different genotypes of hepatitis C virus prevalent in resource-poor countries[J]. Antiviral Res, 2016, 125: 43-45. DOI: 10.1016/j.antiviral.2015.10.008.
[4]GAO LH, NIE QH, ZHAO XT. Drug-drug interactions of newly approved direct-acting antiviral agents in patients with hepatitis C[J]. Int J Gen Med, 2021, 14: 289-301. DOI: 10.2147/IJGM.S283910.
[5]FU Z, DONG C, GE Z, et al. High SVR12 with 8-week course of direct-acting antivirals in adolescents and children with chronic hepatitis C: A comprehensive analysis[J]. Front Med (Lausanne), 2021, 8: 608760. DOI: 10.3389/fmed.2021.608760.
[6]Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of hepatitis C(2019 version)[J]. J Clin Hepatol, 2019, 35(12): 2670-2686. DOI: 10.3969/j.issn.1001-5256.2019.12.008.
中華医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2670-2686. DOI: 10.3969/j.issn.1001-5256.2019.12.008.
[7]
RAO H, LIU H, WU E, et al. Comparison of clinical outcomes and impact of SVR in American and Chinese patients with chronic hepatitis C[J]. JHEP Rep, 2020, 2(4): 100136. DOI: 10.1016/j.jhepr.2020.100136.
[8]LI C, LI X, ZHU X, et al. Pharmacokinetics, safety, and tolerability of ledipasvir/sofosbuvir and sofosbuvir/velpatasvir in healthy chinese subjects[J]. Clin Ther, 2020, 42(3): 448-457. DOI: 10.1016/j.clinthera.2020.01.013.
[9]LI J, LI G, WANG J, et al. Efficacy and safety of elbasvir/grazoprevir treatment for Chinese patients with hepatitis C virus genotype 1b: a retrospective study[J]. Am J Transl Res, 2022, 14(6): 3995-4005.
[10]HUANG CF, IIO E, JUN DW, et al. Direct-acting antivirals in East Asian hepatitis C patients: real-world experience from the REAL-C Consortium[J]. Hepatol Int, 2019, 13(5): 587-598. DOI: 10.1007/s12072-019-09974-z.
[11]HUANG K, CHEN J, XU R, et al. Molecular evolution of hepatitis C virus in China: A nationwide study[J]. Virology, 2018, 516: 210-218. DOI: 10.1016/j.virol.2018.01.015.
[12]PIECHA F, GNLER JM, OZGA AK, et al. Treatment and re-treatment results of HCV patients in the DAA era[J]. PLoS One, 2020, 15(5): e0232773. DOI: 10.1371/journal.pone.0232773.
[13]RAO H, WEI L, LOPEZ-TALAVERA JC, et al. Distribution and clinical correlates of viral and host genotypes in Chinese patients with chronic hepatitis C virus infection[J]. J Gastroenterol Hepatol, 2014, 29(3): 545-553. DOI: 10.1111/jgh.12398.
[14]CHEN Y, YU C, YIN X, et al. Hepatitis C virus genotypes and subtypes circulating in Mainland China[J]. Emerg Microbes Infect, 2017, 6(11): e95. DOI: 10.1038/emi.2017.77.
[15]WU N, RAO HY, YANG WB, et al. Impact of hepatitis C virus genotype 3 on liver disease progression in a Chinese national cohort[J]. Chin Med J (Engl), 2020, 133(3): 253-261. DOI: 10.1097/CM9.0000000000000629.
[16]LU J, FENG Y, CHEN L, et al. Subtype-specific prevalence of hepatitis C virus NS5A resistance associated substitutions in Mainland China[J]. Front Microbiol, 2019. DOI: 10.3389/fmicb.2019.00535.
[17]CHEN YS, HUANG KH, WANG PM, et al. The impact of direct-acting antiviral therapy on the risk of recurrence after curative resection in patients with hepatitis-C-virus-related early stage hepatocellular carcinoma[J]. Medicina (Kaunas), 2022, 58(2): 259. DOI: 10.3390/medicina58020259.
[18]TANAKA S, SHINKAWA H, TAMORI A, et al. Surgical outcomes for hepatocellular carcinoma detected after hepatitis C virus eradiation by direct-acting antivirals[J]. J Surg Oncol, 2020, 122(8): 1543-1552. DOI: 10.1002/jso.26184.
[19]KUO YH, WANG JH, CHANG KC, et al. The influence of direct-acting antivirals in hepatitis C virus related hepatocellular carcinoma after curative treatment[J]. Invest New Drugs, 2020, 38(1): 202-210. DOI: 10.1007/s10637-019-00870-9.
[20]MONTALDO C, TERRI M, RICCIONI V, et al. Fibrogenic signals persist in DAA-treated HCV patients after sustained virological response[J]. J Hepatol, 2021, 75(6): 1301-1311. DOI: 10.1016/j.jhep.2021.07.003.
[21]XIA H, ZHANG Y, ZAONGO SD, et al Direct-acting antiviral treatments display excellent outcomes even in older HCV-infected patients at increased risk of fibrosis[J]. Ann Transl Med, 2021, 9(10): 847. DOI: 10.21037/atm-21-1297.
[22]KANDA T, LAU GKK, WEI L, et al. APASL clinical practice recommendation: how to treat HCV-infected patients with renal impairment?[J]. Hepatol Int, 2019, 13(2): 103-109. DOI: 10.1007/s12072-018-9915-5.
收稿日期:
2022-08-27;錄用日期:2022-10-08
本文编辑:林姣
