氮杂环卡宾-铜配合物在有机催化反应中的应用研究进展
2023-04-29杨秀芳张晨阳张金王沁欢王一涵李泽剑马思悦
杨秀芳 张晨阳 张金 王沁欢 王一涵 李泽剑 马思悦
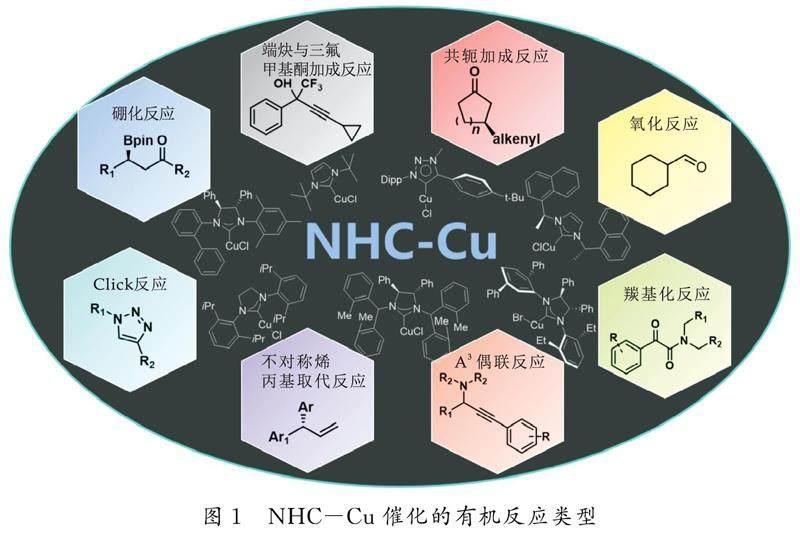
摘要:有机金属催化剂能让化学反应实现高选择性、高产率,并且反应条件温和、操作简单方便.其中,氮杂环卡宾(N-heterocyclic carbenes,NHCs)是一类稳定性强、价格低廉、毒性较低、易制备的配体.因为氮杂环卡宾与过渡金属具有强配位能力,使得其作为过渡金属配合物的新型配体而得到了迅速发展.相比其他金属来说,金属Cu以其价廉和储量丰富等优势而在众多金属中脱颖而出.基于此,本文以氮杂环卡宾-铜配合物(NHC-Cu)为例,总结和归纳了近十年来NHC-Cu作为催化剂在有机反应中的研究进展,主要包含Click反应(叠氮与炔环加成反应)、末端炔烃与三氟甲基酮的加成反应、共轭加成反应、羰基化反应、不对称烯丙基取代反应、A3偶联反应、硼化反应和氧化反应等.
关键词:氮杂环卡宾; 氮杂环卡宾-铜配合物; 有机催化
中图分类号:O626文献标志码: A
Research progress on application of N-heterocyclic carbene-copper
complexes in organocatalytic reactions
YANG Xiu-fang ZHANG Chen-yang ZHANG Jin WANG Qin-huan
WANG Yi-han LI Ze-jian MA Si-yue(1.College of Chemistry and Chemical Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.Xi′an Keyuan Municipal Engineering Consulting Co., Ltd., Xi′an 710000, China; 3.College of Emergency and Trauma, Key Laboratory of Emergency and Trauma, Ministry of Education, Hainan Medical University, Haikou 571199, China)
Abstract:Organometallic catalyst can make chemical reaction achieve high selectivity,high yield,mild reaction conditions,simple and convenient operation.Among them,N-heterocyclic carbenes (NHCs) is a kind of ligand with strong stability,low price,low toxicity and easy preparation.The strong coordination ability of nitroheterocyclic carbens with transition metals has led to its rapid development as a new ligand of transition metal complexes.Compared with other metals,metal Cu stands out among many metals due to its advantages of low price and abundant reserves.Taking nitrogen heterocyclic carben-copper complex (NHC-Cu) as an example,this paper summarized and summarized the research progress of NHC-Cu as catalyst in organic reaction in recent ten years.It mainly includes Click reaction (azide and alkyne cycloaddition reaction),addition of terminal alkynes to trifluoromethyl ketone,conjugate addition reaction,carbonylation,asymmetric allyl substitution,A3 coupling reaction,boriding and oxidation reaction,etc.
Key words:N-heterocyclic carbenes; N-heterocyclic carbene-copper complexes; organic catalysis
0引言
催化剂具有降低反应活化能、加快反应速率的特性,通过在化学反应中高效促进不同类型键的活化[1-5](如C-N键、C-H键、C-C键、C-O键),从而拓宽了有机反应底物类型,因此,其在有机反应中起着至关重要的作用.目前,常用于有机反应的催化剂主要有:金属催化剂[6]和有机小分子催化剂[7].除此之外,还有一些新型催化体系,如光催化[8]、电催化[9]等.
近二十年来,金属有机化学作为一门交叉融合学科受到了有机化学家们的广泛关注.有机金属催化剂具有让化学反应实现高选择性(化学选择性、区域选择性、立体选择性和对映选择性)、产率高、反应条件温和、操作简便等优点,使其在催化反应中的应用成为化学工业发展的重要环节之一.然而,传统催化剂(如膦配体催化剂)存在诸多弊端,例如在空氣中稳定性差易分解、不能进行反应选择性的精准调控[10,11]等.因此,寻找高效稳定、催化活性高以及对环境友好的催化剂已成为有机化学家们研究的热点之一[12-16].
1991年,Arduengo等[17]首次分离出稳定的氮杂环卡宾,随后Herrmann等[18]将氮杂环卡宾化合物应用于均相催化反应中.在此之后,更多的稳定卡宾被相继发现[19-21].氮杂环卡宾是一类稳定性强、价格低廉、毒性较低、易制备的配体,能与元素周期表中的绝大部分金属元素进行配位[22-24],可作为重要的有机配体之一.更重要的是,相比于传统的膦配体,氮杂环卡宾的σ给电子能力强,π电子接受能力弱[25-27],与金属配位后键能高,使其更加稳定不易在空气中分解.此外,氮杂环卡宾配体的空间结构和电子效应可通过改变N原子上的取代基进行调控[28-31].因此,它可作为有机膦配体良好的替代品在有机反应中占有一席之地[32-36],同时在医药[37,38]和材料[39,40]方面有着广泛的应用.
目前,氮杂环卡宾过渡金属催化剂已广泛应用于各类偶联反应中,其参与的反应具有底物范围广、产物结构多样和反应位点多样[41-44]等特点.相比于其他的金属(Au、Pd、Rh等),金属Cu储量丰富,价格便宜,具有不同的氧化态,能够与不同的官能团通过π-共轭或者路易斯酸碱配位而交联在一起.因此,开发氮杂环卡宾铜(NHC-Cu)化合物催化有机化学反应的应用就显得意义非凡[45-48].
在此背景下,本文分类归纳了近十几年来氮杂环卡宾铜催化剂在有机偶联反应中的应用研究进展及反应类型(如图1所示),主要包含Click反应(叠氮与炔环加成反应)、末端炔烃与三氟苯乙酮的加成反应、共轭加成反应、羰基化反应、不对称烯丙基取代反应、A3偶联反应、硼化反应和氧化反应等.
1NHC-Cu在有机催化反应中的应用
1.1Click反应(叠氮与炔环加成反应)
1893年,叠氮化合物与炔烃的1,3-偶极环加成反应(Huisgen反应)[49]首次被发现,标志着点击化学的出现.点击化学在化学合成领域尤其在药物开发和生物医用材料等方面有着很大贡献.随着对氮杂环卡宾与金属配合物研究的深入,化学们开始将NHC-Cu配合物(咪唑型配体或不规则氮杂环卡宾配体)用于催化叠氮化物环加成反应从而生成末端炔烃(其机理如图2所示).因此,本节内容将对氮杂环卡宾铜催化的叠氮与炔烃的环加成反应进行综述.
2008年,Diez Gonzalez等[50]在Huisgen 1,3-偶极环加成反应的基础上,利用NHC-Cu催化剂(SIPrCuCl)对叠氮化合物与炔烃进行[3+2]环加成反应(如图3所示).在该反应中,SIPrCuCl可作为整个过程的高效和特定区域催化剂.此外,该催化剂在用于空间位阻较大的底物时具有更好的反应活性.
该研究发现的催化剂(SIPrCuCl)在当时实现了巨大突破,促使反应条件变得中性温和且提高了效率.因此,该反应在生物学和材料科学中都有着广泛的应用.
2014年,Xia等[51]报道了使用NHC-Cu配合物催化一系列叠氮乙酰胺的[3+2]环加成反应(如图4所示),从而生成手性炔丙基胺衍生物.该反应可分别通过微波辐射的方法和NHC-Cu催化方法两种方法实现.其中,微波辐射法可以催化带有手性氨基甲基侧链的1,4,5-三取代三唑化合物的分子内环加成反应,分离产率达75%~97%,而使用NHC-Cu催化剂在室温下可以生成一般不易获得并且不含TMS基团的1,4-二取代三唑化合物,分离产率达到65%~81%.
该研究比较了使用微波辐射的方法和NHC-Cu催化方法下的叠氮乙酰胺的分子內环加成反应.结果证明,两个反应通过条件的控制解决了不对称的内部炔烃反应性低和区域选择性的问题,使得反应具有明确的区域选择性.可控的反应途径为从现成的手性炔丙基胺中建立分子多样性提供了良好的机会,并且拓展了其在有机合成中的应用.
2015年,Bidal等[52]合成了一种新型的非经典NHC-Cu配合物,并利用该配合物催化炔烃和叠氮化合物的[3+2]环加成反应(如图5所示).该研究证明了其所合成的NHC-Cu配合物(2和4)对于该反应的催化 速度明显快于其它NHC-Cu催化剂(1,3和5),并且其具有可催化的反应底物范围广且产率高的特点(95%以上).
该研究合成的这种新型NHC-Cu催化剂可避免在空气中使用不稳定的游离卡宾.原料廉价易得,合成途径绿色和对环境更友好,符合绿色化学的要求.
2018年,Bruyat等[53]报道了一种有效合成主链中含有1,2,3-三唑环的肽模拟物的方法,即在微波辐射条件下,将在空气中稳定的NHC-Cu配合物作为催化剂进行叠氮炔环加成反应(CuAAC),可得到产率高(93%~100%)且纯度高(高于94%)的三唑化合物(如图6所示).传统方法中肽三唑的合成路线通常需要铜(I)催化剂(CuI或CuSO4)以防止侧链氧化,且一般通常需要较长的反应时间(几小时到几天不等).长时间的反应条件可能对构型不稳定的肽不利,而本研究中所使用的NHC-Cu催化剂一方面避免了常见侧链(例如甲硫氨酸)的氧化,另一方面在反应时间缩短同时该催化剂还具有比较强的稳定性.
2018年,Lazreg等[54]发现了在反应中使用氮杂环卡宾配体和膦配体混合的铜配合物时所存在的协同催化效应,并且首次将该催化剂用于叠氮-炔环加成反应中合成1,4-二取代的1,2,3-磺酰三唑衍生物(如图7所示).该反应体系对反应表现出了优异的底物适应性,同时,将该催化剂用于催化空间位阻较大的底物时也能得到很高的产物收率(92%~98%).
该研究使用的卡宾配体在该体系中起到内置碱的作用,达到从炔底物中捕获并释放质子的目的.与上述方法相比,该研究的独特之处在于抑制了反应物开环形成副产物的趋势,在没有碱或添加剂的情况下能够成功制备1,4-二取代的1,2,3-磺酰三唑衍生物,实现了高选择性.
1.2末端炔烃与三氟甲基酮的加成反应
随着稀有过渡金属价格的上涨,用于催化碳-碳键形成的过渡金属配合物的研究引起高度关注.其中,利用金属催化的末端炔烃加成反应已被广泛研究.在过去几十年中,含氟化合物由于其独特的物理和生物性质而在医药和农药领域备受关注.其中,α-三氟甲基甲醇存在于许多药物中,例如依法韦伦,作为一种用于联合治疗的关键抗艾滋病毒药物,尽管近年来价格有所下降,但对于数百万潜在患者来说,用药成本仍然过高.利用三氟甲基酮合成依法韦伦的方法仍不完善,因此,本节内容将对近年来部分氮杂环卡宾铜催化的三氟苯乙酮的炔化反应进行总结.
2013年,Correia等[55]报道了一种NHC-Cu(IPrCuCl)催化的末端炔烃与三氟甲基酮的加成反应(如图8所示).该反应利用叔丁醇钾做添加剂,可以使得催化剂在较低负载量的情况下将脂肪族和芳香族炔加成到三氟甲基酮中.在拓展的底物类型中,底物为芳基三氟甲基酮时效果最好(一般为72%~99%),这种底物范围非常适合生产活性药物成分依法韦伦,并对其全合成奠定了基础.
该研究基于氮杂环卡宾的强给电子能力以及铜(I)盐的优异性质制备了在低负荷和温和条件下表现良好并能耐受较高温度的催化剂.该方法为实现Cu-NHC促进的不对称炔化打开了大门.
2016年,Czerwinski等[56]首次报道了一种使用水做溶剂的高效的NHC-Cu(IPrCuCl)配合物催化末端炔烃与1,1,1-三氟甲基酮的加成反应(如图9所示).此反应条件可以兼容多种官能团,包括烯烃、酯、醛、酮、腈、缩醛、胺和膦酰基,并且具有较好的底物范围和较高的产率(一般在60%~98%).
该研究首次将水作为溶剂参与反应,与普通有机溶剂相比,水具有安全无害、环境友好且便宜的优点,使得反应条件更符合绿色化学要求.
1.3共轭加成反应
氮杂环卡宾铜配合物在催化α,β-不饱和化合物的共轭加成反应中有着广泛的应用,本节内容将对不对称共轭加成反应进行综述.
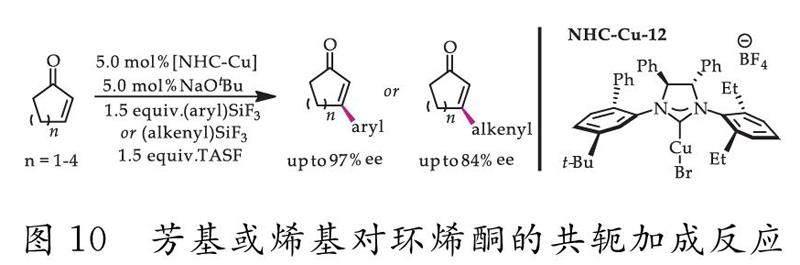
2009年,Lee和Hoveyda[57]报道了使用一种单齿不对称NHC-Cu催化剂用于芳基和烯基对环烯酮的对映选择性共轭加成反应(如图10所示).该反应方法使用的是较容易获取的芳基或烯基硅烷试剂用作亲核试剂,因而能避免使用对空气和水分敏感的有机金属来参与反应.
该研究主要设计了20多种不对称手性咪唑型催化剂,并对新型NHC-Cu催化剂的活性进行了评估.结果发现,这些配合物对活化C-C键的形成过程起着关键作用,在用于芳基和烯基对环烯酮的对映选择性共轭加成反应时产率高且副产物少.
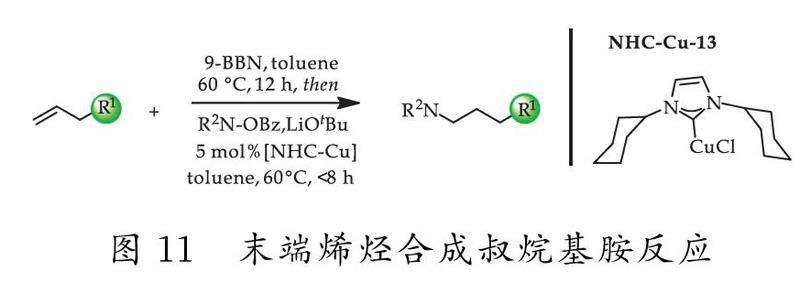
2012年,Rucker等[58]报道了一类在NHC-Cu(ICyCuCl)配合物的催化下,末端烯烃高选择性发生反马尔科夫尼科夫氢胺化反应并直接生成叔烷基胺(如图11所示).该方法适用于多种底物,能用一锅法将末端烯烃成功地转化为叔烷基胺(其机理如图12所示),同时具有优异的区域选择性和较高的产率(80%~97%).
该研究能使烯烃发生反马尔科夫尼科夫规则的加成反应,并且突破性地使反应具有良好的区域选择性.因此,此方法可用于制备一系列环胺和无环胺.
1.4羰基化反应
过渡金属催化的羰基化反应可直接将含氧官能团引入有机化合物中,是一种实现原子经济性的方法.其中,一氧化碳(CO)和二氧化碳(CO2)都是廉价无毒且易于获得的碳源.但由于其具有高热力学稳定性和低反应性,通常需要金属参与才能使用其作为碳源用于参与C-C键的形成.然而,大多数金属价格较为昂贵(如钯、铑和铱),而铜作为廉价金属可广泛参与羰基化反应.因此,本节内容将对优良的氮杂环卡宾铜催化的羰基化反应进行综述.
2007年,Zheng等[59]成功地开发了一种高效和简单的氮杂环卡宾铜催化剂系统(NHC-IPrCuI),并将其首次运用于在无任何添加剂的情况下催化氨基化合物和伯胺的氧化羰基化反应(如图13所示).该反应选择性地制备2-恶唑烷酮、二取代脲和氨基甲酸酯,并获得了良好的选择性和产率(86%~96%).
该研究改良了2-恶唑烷酮、二取代脲和氨基甲酸酯这三种含氮羰基化合物的经典合成路线(通过有毒光气或其衍生物的光气化来进行),并使用对环境无害的试剂进行替代.其中,使用Cu这一廉价易得的金属来作为催化剂是首次将铜络合物用于氨基醇和胺的羰基化反应的举措,这对羰基化催化领域做出了开创性贡献.
2009年,Liu等[60]报道了一种将NHC(IPrCuI)催化体系用于催化芳基碘和伯胺的双羰基化反应(如图14所示),此催化体系可以作为对环境無害的催化方法从而代替膦配体和贵价金属钯催化剂.此外,该反应还对溴、硝基等基团的底物具有较好的适应性和较高的产率(68%~93%).
该研究开发了一种高效的NHC-Cu-X催化剂系统以用于芳基碘和仲胺的双羰基化反应,从而解决了使用贵金属钯和膦配体的问题.使用非稀有金属使得该反应有更大的普遍适用性,同时,这种方法是有价值的和对环境无害的,可以更好的替代膦配体催化剂.
2017年,Cheng等[61]报道了NHC-Cu催化卤代烷的多组分羰基化反应(如图15所示).其中,将NHC-Cu和Mn作为双金属催化剂用于芳基硼酸酯等各种亲核试剂与卤代烷的羰基化偶联反应,从而生成芳基烷基酮或其衍生物(包括酮类、烯丙醇、硼烯酮类、酰胺类、醇类、酰基硅烷类和酰基硼酸盐),得到了较高的产率.
该研究开发了一个用于羰基化偶联反应的双金属平台,并成功运用此催化体系催化多种偶联反应,均得到了较高的产率(高达99%).但该方法的局限性在于需要使用高压反应器,因此需要在通CO的条件下进行或通过使用CO替代物进行反应.
2008年,Ohishi等[62]报道了一种将优良的NHC-Cu(IPr)催化体系用于芳基和烯基硼酸酯与二氧化碳的羧化反应(如图16所示).这种NHC-Cu催化体系不仅表现出很高的官能团耐受性,而且还以高收率得到了相应的羧化产物(73%~99%).
该研究通过实验验证了NHC-Cu(IPr)可作为芳基和烯基硼酸酯与CO2的羧基化的优良催化剂系统.其中,铜催化剂系统不仅表现出更高的官能团耐受性,还具有更高的活性(其机理如图17所示).对于拓展的底物,二氧化碳与其他底物的反应还在进一步的研究中.
1.5不对称烯丙基取代反应
在过渡金属催化的烯丙基取代反应中,使用带有亲核试剂的手性铜催化剂可以有效的形成不对称C-C键.然而,在C-C键形成过程中,底物、手性催化剂的结构和试剂对区域选择性和对映选择性产生很大程度的影响.而氮杂环卡宾为强给电子和弱受电子配体,其金属铜配合物通常比膦配合物表现出更好的空气稳定性和热稳定性.因此,人们对手性NHC配体进行了电子和空间调控,以提高不对称烯丙基芳基化反应中在NHC-Cu催化下脂肪族烯丙基溴化物和几种芳基格氏试剂的区域选择性.研究发现,当格氏试剂的芳基或卡宾配体的N-取代基上的芳基缺电子,或当卡宾配体或烯丙基溴体积较大时,可实现反应的高选择性.因此,本节内容对氮杂环卡宾铜催化的高选择性不对称烯丙基取代反应进行综述.
2008年,Seo等[63]报道了基于双异喹啉的手性二氨基卡宾配体,利用环几基取代的双异喹啉合成NHC-Cu配合物来参与的对映选择性SN2烯丙基烷基化反应(如图18所示).结果表明,反应底物适应性较好和可得到较高的产物收率(60%~99%).
该研究合成了手性双异喹啉基卡宾配体(BIQ)的结构,并证明其是有效催化剂:在一系列反应中,该催化剂显示出了较好的区域选择性和对映选择性,并且在优化条件下底物范围较广,可以使用其他烷基格氏试剂而不会显著降低反应产率和区域选择性或对映体选择性.
2011年,Selim等[64]报道了一种低温下可在空气中稳定存在的单齿手性NHC-Cu配合物,它在催化辛氨溴化物与芳基溴化镁的烯丙基芳基化反应中表现出了优异的对映选择性(如图19所示),并且得到了较高的产率(99%)和选择性(97%),其ee值为98%.
该研究对该配合物进行了电子调控和空间调整,使其能够选择性的催化脂肪族烯丙基溴化物的不对称烯丙基芳基化反应.该方法的主要优点是其具有与几种芳基格氏试剂的较好兼容性.
2010年,Whittaker等[65]报道了利用芳基硼酸酯为亲核试剂的NHC-Cu催化烯丙基氯化物的SN2选择性芳基化反应(如图20所示).该反应具有广泛的底物范围,并且可以在多种官能团的存在下进行,包括甲酰基、羧基、氮基、叠氮基、氯基、溴基和硝基.反应结果表明,芳基化反应产物收率高(高達99%)且底物适用性好.
该研究首次开发和使用了NHC-Cu催化剂的SN2选择性芳基化反应.在多种官能团存在下,多种烯丙基氯化物和芳基硼酸酯能反应产生高收率芳基化产物,该反应且具有较广的底物范围,为铜催化的SN2选择性芳基化反应奠定了基础(其机理如图21所示).
1.6A3-偶联反应
从A3-偶联反应中得到的炔丙基胺是制备许多含氮生物活性化合物的常见骨架和天然产物的多功能关键中间体.因此,在过去的十年中,A3偶联(胺-炔-醛)引起了有机化学家的极大关注(其机理如图22所示).许多研究小组利用铜盐或银盐等金属体系探索了炔丙基胺的化学特性.本节内容将对氮杂环卡宾铜催化的A3偶联反应进行综述.
2008年,Wang等[66]开发了一种新型SiO2-NHC-Cu复合物,并以该复合物为催化剂在室温下通过醛、胺和炔烃的三组分偶联(A3偶联反应)合成炔丙基胺(如图23所示).该反应适用于芳香族和脂肪族醛、炔烃和胺,并以良好产率生成相应的炔丙基胺(一般在71%~96%).反应中该催化剂的活性受溶剂的影响较为明显:极性溶剂(如丙酮或二氯甲烷)能够增强反应性;而使用甲苯、乙腈和四氢呋喃作为溶剂则会使产率较低,目前尚不清楚溶剂对反应的作用机理.
该研究开发的方法可使反应在室温下且在催化剂负载量较低情况下生成产率较高的的炔丙基胺.其中使用的的催化剂在可回收性方面表现良好,不但易回收,而且重复使用十个循环也不会显著降低催化活性.室温下反应和无溶剂对环境友好,以及催化剂可重复使用的特点使其更符合绿色化学要求.
2013年,Chen等[67,68]报道了NHC-Ag催化A3偶联反应生成炔丙基胺,随后又报道了使用NHC-Cu(SIPr)配合物催化A3偶联反应生成炔丙基胺的案例(如图24所示).在最优条件下和使用脂肪族醛为原料时,即使在室温下也能短时间内生成多种炔丙基胺,并且得到较高的产率(79%~99%).
该研究通过报道两例NHC-Cu催化A3偶联反应生成炔丙基胺的案例优化了反应条件.与其他文献中大多数铜催化的A3偶联反应系统截然不同的是,当醛为芳香族醛时,反应活性显著降低,因此芳香醛的偶联需要更高的催化剂负载量、更高的反应温度和更长的反应时间才能获得所需的产物.
1.7硼化反应
有机硼烷是一类重要的中间体,可以用来合成多种类型的有机化合物,而氮杂环卡宾铜配合物可以有效的催化不饱和键的硼化反应.因此,本节内容将对氮杂环卡宾铜配合物催化的烯烃、酯、饱和酰胺的硼化反应进行综述.
2008年,Lillo等[69]首次使用单齿手性NHC-Cu配合物对活化烯烃进行对映选择性β-硼化反应(如图25所示).在温和的反应条件下使用筛选出的最优NHC-Cu配合物催化不饱和酯进行硼化反应,表现出良好的对映选择性(ee值为74% )和转化率(高达99%).其中拥有较大空间位阻的NHC配体相比传统配体来说转化率更高.
研究发现手性NHC-Cu配合物的使用在最终产物的对映体选择性方面起着一定作用.其中使用的不同NHC配体和底物的性质为开发用于此类转化的更具对映选择性的催化剂奠定了基础.
在此基础上,Park等[70]在2010年发现了新的手性六元环铜氮杂环卡宾化合物(NHC-Cu),并以甲醇为添加剂,用此配合物作为催化剂成功催化双联频哪硼酸酯对α,β-不饱和羰基化合物的立体选择性β-硼化反应(如图26所示).在底物方面,该催化体系对于芳基取代的α,β-不饱和酯或脂肪链取代的α,β-不饱和酯均具有较好的催化活性,并表现出优异的反应性(88%~95%产率)和对映选择性(ee值为82%~96%).
该研究基于五元环的咪唑型氮杂环卡宾配合物设计出新的六元环氮杂环卡宾配合物作为催化剂.相较于五元环来说,该配合物催化硼酰化反应产率高以及对映选择性更好,在0.01 mol%催化剂负载下,不仅可显示出较高的催化活性和稳定性,而且不会显著降低对映选择性.
2009年,Lee和Hoveyda[71]报道了NHC-Cu(IMesCuCl)催化烯烃的硼氢化反应(如图27所示).该反应使用芳基取代的环状或非环状烯烃与双联频哪硼酸酯反应,能够以高达97%的产率得到硼化产物.此外,该催化体系能够在较短的时间(10 min)内催化烯烃的硼氢化反应,得到的产物具有高对映选择性,其对映体比ee值高达99∶1.然而,对于苯环上含有吸电子基团的底物来说,该反应整体时间相对较长.
相比于前文中提及的硼氢化反应,该研究使用五元环咪唑型氮杂环卡宾铜配合物作为催化剂,可便于位点选择,从而在最优条件下提高了反应的对映选择性(99∶1).
2011年,Park等[72]报道了一项利用NHC-Cu配合物催化烯丙基芳醚的不对称烯丙基取代反应(如图28所示) 从而合成手性烯丙基硼酸酯的研究.在底物的选择上,芳基醚底物提供了更高的产率和更可变的对映选择性,其中使用的含六元环的NHC-Cu配合物在催化反应中显示出高ee值(62%~91%)和产率(高达95%).
研究表明,在催化剂的选择上,含五元环与六元环的NHC配合物相比,含六元环NHC-Cu配合物能够表现出更独特的化学选择.
2011年,Jang等[73]研究并报道了NHC-Cu(IMesCuCl)催化末端炔烃的硼氢化反应(如图29所示).此反应将末端炔烃转化为各种α-乙烯基硼酸酯,具有较高的选择性(高达98∶2)和95%以上的产物收率.其中,炔丙醇和胺以及衍生的苄基、叔丁基或硅醚以及各种酰胺都是适用性较好的底物.该反应也适用于各种芳基取代的末端炔烃,其带有吸电子取代基的底物可实现更高的α-选择性.
该研究提出了铜催化末端炔烃的位置选择性硼氢化方法,该反应主要生成内部或α-乙烯基硼酸酯(高达98%),为由NHC-Cu催化合成内部或α-乙烯基硼酸酯奠定了基础.
1.8氧化反应
醇氧化成羰基化合物是有机化学中最常见的一类氧化反应.传统的醇的氧化方法常用的氧化剂有氧化铬、氧化锰、氧化钌、高价碘和活化DMSO等,但這类反应往往伴随着大量的金属污染物的生成,反应后处理步骤繁琐且对环境十分不利.此外,有些强氧化剂无法将醇选择性的氧化成醛,而是发生过氧化反应产生羧酸.因此,研发条件温和、环境友好和高效的氧化方法去实现醇类化合物的选择性氧化具有很好的社会效益.同时,以廉价的铜作为催化剂和以清洁的空气和氧气作为氧化剂的新型反应可解决现行醇氧化合成醛酮化合物中催化剂成本高昂的问题,从而实现经济效益最大化.NHC-Cu催化剂在共轭加成、环加成以及硼化反应中研究较为成熟,而对于氧化反应的研究较少.因此,本节内容将对氮杂环卡宾铜催化醇的氧化反应进行综述(如图30所示).
2013年,Liu等[74]将TEMPO(2,2,6,6-四甲基哌啶氧化物)基团接在卡宾配体上,在原位上生成含有TEMPO基团的NHC-Cu催化剂.如此一来,在有氧条件下,不需要添加碱或其他助剂就可氧化含有芳香基团的伯醇以及脂肪伯醇(如图31所示).实验证明NHC-TEMPO络合物是伯醇好氧氧化制醛的高效催化剂,各种伯醇均以较高的产率选择性地转化为醛,即使在温和的空气条件下也能以优异的产率显示出对醛的高选择性.该催化体系适用于各种伯醇底物,其醛的选择性高,产物收率高(一般为71%~99%).
该研究将TEMPO与NHC-Cu结合到一起,从而达到不需要加碱就可将各种伯醇氧化为醛的目的.这种改良使得反应条件更加温和,符合绿色化学要求,同时,催化剂还可以优异的产率显示出对醛的优异选择性.
2015年,Zhan等[75]报道了可将NHC-Cu(IPrCuCl)配合物作为催化剂在温和条件下以优异的产率将醇氧化为醛,并将亚胺还原为胺(如图32所示)的研究案例.此反应副产物少,可在氧气参与下以优异的产率(高达99%)选择性的氧化为醛和酮.这种稳定且有效的NHC-Cu催化剂对芳香底物也是通用的.
该研究使用的一锅法可在氧气参与下选择性地将醇氧化为醛和酮,从而实现用苄基醇和伯胺合成亚胺.此方法不仅适用于脂肪族醇,而且适用于芳香族醇,具有普遍的底物适用性.
2019年,Mncube等[76]合成了新的含三唑亚基配体的NHC-Cu配合物,以过氧化氢为氧化剂催化醇的氧化反应(如图33所示).在该反应中,NHC-Cu配合物能够引发氧化反应.在优化的反应条件下,烷烃氧化的主要产物为酮或醛,但这些配合物不稳定,一般在24 h内分解.
该研究合成的含三唑亚基配体的NHC-Cu配合物稳定性不强.因此,在反应中可通过使用大体积的和给电子的取代基以提高其稳定性.
此外,NHC-Cu还可参与其他各类有机催化反应,比如催化内炔得到 α-羟基联烯[77];催化C(sp3)-C(sp3)键断裂的烯丙基与醛或者亚胺,得到新高烯丙醇或者高烯丙胺[78];催化两分子2-萘酚之间的氧化偶联反应[79];催化亚胺的不对称共轭加成[80,81]等.
2总结和展望
氮杂环卡宾-铜配合物(NHC-Cu)作为一类高效催化剂已经被广泛地运用到诸多有机合成反应中.其在催化反应时能够表现出高效的催化活性和空气稳定性,因此在近几十年在中取得了较大的进展.NHC-Cu配合物可在有机反应中高效促进C-C键、C-H键、C-N键和C-O键活化,拓宽有机底物的类型,并且在医药和材料等领域有广泛的应用.过渡金属铜的引入为新催化策略的发展奠定了基础,从而开辟全新的研究思路.
尽管NHC-Cu配合物在有机反应中已经取得较大进展,但在某些领域还存在着尚未解决的问题,如催化反应使用的溶剂(如四氢呋喃、吡啶、丙酮等)对环境不友好且对人体有害;有些反应所需温度较高等,这些问题局限了可在活细胞或生物体内进行反应的研究及其相关应用.期待在众多化學工作者的不懈努力之下,NHC-Cu配合物催化的有机反应能够得到进一步发展.在未来,研究者们可通过对氮杂环卡宾骨架的修饰来调控NHC-Cu配合物的催化性能,不断优化NHC-Cu催化的反应条件,从而寻求更合适的催化体系,拓宽其在生物医药合成和新型功能材料制备等领域的应用.
参考文献
[1] Louie J,Hartwig J F.Palladium-catalyzed synthesis of arylamines from aryl halides:Mechanistic studies lead to coupling in the absence of tin reagents[J].Tetrahedron Letters,1995,36(21):3 609-3 612.
[2] Guram A S,Rennels R A,Buchwald S L.A simple catalytic method for the conversion of aryl bromides to arylamines[J].Angewandte Chemie (International Edition),1995,34(12):1 348-1 350.
[3] Zhang W Z,Li W J,Zhang X,et al.Cu(I)-catalyzed carboxylative coupling of terminal alkynes,allyliccChlorides,and CO2[J].Organic Letters,2010,12(21):4 748-4 751.
[4] Herrmann W A,Kher C.N-heterocyclic carbenes[J].Angewandte Chemie (International Edition),1997,36(20):2 162-2 187.
[5] DiRocco D A,Rovis T.Catalytica asymmetric α-acylation of tertiary amines mediated by a dual catalysis mode:N-heterocyclic carbene and photoredox catalysis[J].Journal of the American Chemical Society,2012,134(19):8 094-8 097.
[6] Diez Gonzalez S,Marion N,Nolan S P.N-heterocyclic carbenes in late transition metal catalysis[J].Chemical Reviews,2009,109(8):3 612-3 676.
[7] Enders D,Niemeier O,Henseler A.Organocatalysis by N-heterocyclic carbenes[J].Chemical Reviews,2007,107(12):5 606-5 655.
[8] Gong L,Li Y,Ye Z,et al.Visible-light-promoted asymmetric catalysis by chiral complexes of first-row transition metals[J].Synthesis,2020,53(9):1 570-1 583.
[9] Lu L,Fu N,Lin S.Three-component chlorophosphinoylation of alkenes via anodically coupled electrolysis[J].Synlett,2019,30(10):1 199-1 203.
[10] Ikawa T,Barder T E,Biscoe M R,et al.Pd-catalyzed amidation of aryl chlorides using monodentate biaryl phosphine ligands:A kinetic,computational,and synthetic investigation[J].Journal of the American Chemical Society,2007,129(43):13 001-13 007.
[11] Zhang C,Lu X.Phosphine-catalyzed cycloaddition of 2,3-butadienoates or 2-butynoates with electron-deficient olefins:A novel [3+2] annulation approach to cyclopentenes[J].The Journal of Organic Chemistry,1995,60(9):2 906-2 908.
[12] Du Z,Shao Z.Combining transition metal catalysis and organocatalysis an update[J].Chemical Society Reviews,2013,42(3):1 337-1 378.
[13] Afewerki S,Córdova A.Combinations of aminocatalysts and metal catalysts:A powerful cooperative approach in selective organic synthesis[J].Chemical Reviews,2016,116(22):13 512-13 570.
[14] Kim D S,Park W J,Jun C H.Metal-organic cooperative catalysis in C-H and C-C bond activation[J].Chemical Reviews,2017,117(13):8 977-9 015.
[15] Chen D F,Han Z Y,Zhou X L,et al.Asymmetric organocatalysis combined with metal catalysis:Concept,proof of concept,and beyond[J].Accounts of Chemical Research,2014,47(8):2 365-2 377.
[16] Wang M H,Scheidt K A.Cooperative catalysis and activation with N-heterocyclic carbenes[J].Angewandte Chemie (International Edition),2016,55(48):14 912-14 922.
[17] Arduengo A J,Harlow R L,Kline M.A stable crystalline carbene[J].Journal of the American Chemical Society,1991,113(1):361-363.
[18] Herrmann W A,Reisinger C P,Spiegler M J J O O C.Chelating N-heterocyclic carbene ligands in palladium-catalyzed heck-type reactions[J].ACS Catalysis,1998,557(1):93-96.
[19] 韓英锋,甘明明,李楚玉.氮杂环卡宾化合物的研究进展[J].西北大学学报,2019,49(6):825-847.
[20] 郭芳杰,郭亚楠,夏立娜,等.咪唑类氮杂环卡宾金属配合物的合成与应用研究进展[J].化学通报,2017,80(4):329-333.
[21] 王翱,肖永龙,周宇.氮杂环卡宾催化有机反应的研究进展[J].有机化学,2017,37(10):2 590-2 608.
[22] Lei P,Meng G,Ling Y,et al.General method for the suzuki-miyaura cross-coupling of primary amide-derived electrophiles enabled by [Pd(NHC)(cin)Cl] at room temperature[J].Organic Letters,2017,19(24):6 510-6 513.
[23] Huang J,Grasa G,Nolan S P.General and efficient catalytic amination of aryl chlorides using a palladium/bulky nucleophilic carbene system[J].Organic Letters,1999,1(8):1 307-1 309.
[24] Zhao Q,Meng G,Li G,et al.IPr#-highly hindered,broadly applicable N-heterocyclic carbenes[J].Chemical Science,2021,12(31):10 583-10 589.
[25] Díez González S,Nolan S P.Stereoelectronic parameters associated with N-heterocyclic carbene (NHC) ligands:A quest for understanding[J].Coordination Chemistry Reviews,2007,251(5-6):874-883.
[26] Nelson D J,Nolan S P.Quantifying and understanding the electronic properties of N-heterocyclic carbenes[J].Chemical Society Reviews,2013,42(16):6 723-6 753.
[27] Jacobsen H,Correa A,Poater A,et al.Understanding the M(NHC) (NHC=N-heterocyclic carbene) bond[J].Coordination Chemistry Reviews,2009,253(5-6):687-703.
[28] Fortman G C,Nolan S P.N-heterocyclic carbene (NHC) ligands and palladium in homogeneous cross-coupling catalysis:A perfect union[J].Chemical Society Reviews,2011,40(10):5 151-5 169.
[29] Peris E.Smart N-heterocyclic carbene ligands in catalysis[J].Chemical Reviews,2018,118(19):9 988-10 031.
[30] Droge T,Glorius F.The measure of all rings-N-heterocyclic carbenes[J].Angewandte Chemie (International Edition),2010,49(39):6 940-6 952.
[31] Arduengo A J,Dias H V R,Harlow R L,et al.Electronic stabilization of nucleophilic carbenes[J].Journal of the American Chemical Society,1992,114(14):5 530-5 534.
[32] Janssen Muller D,Schlepphorst C,Glorius F.Privileged chiral N-heterocyclic carbene ligands for asymmetric transition-metal catalysis[J].Chemical Society Reviews,2017,46(16):4 845-4 854.
[33] Levin E,Ivry E,Diesendruck C E,et al.Water in N-heterocyclic carbene-assisted catalysis[J].Chemical Reviews,2015,115(11):4 607-4 692.
[34] Samojlowicz C,Bieniek M,Grela K.Ruthenium-based olefin metathesis catalysts bearing N-heterocyclic carbene ligands[J].Chemical Reviews,2009,109(8):3 708-3 742.
[35] Flanigan D M,Romanov Michailidis F,White N A,et al.Organocatalytic reactions enabled by N-heterocyclic carbenes[J].Chemical Reviews,2015,115(17):9 307-9 387.
[36] Marion N,Diez Gonzalez S,Nolan S P.N-heterocyclic carbenes as organocatalysts[J].Angewandte Chemie (International Edition),2007,46(17):2 988-3 000.
[37] Raubenheimer H G,Cronje S.Carbene complexes of gold:Preparation,medical application and bonding[J].Chemical Society Reviews,2008,37(9):1 998-2 011.
[38] Oehninger L,Rubbiani R,Ott I.N-heterocyclic carbenes metal complexes in medicinal chemistry[J].Dalton Transactions,2013,42(10):3 269-3 284.
[39] Liu Y,Persson P,Sundstrom V,et al.Fe N-heterocyclic carbenes complexes as promising photosensitizers[J].Accounts of Chemical Research,2016,49(8):1 477-1 485.
[40] Visbal R,Gimeno M C.N-heterocyclic carbenes metal complexes:Photoluminescence and applications[J].Chemical Society Reviews,2014,43(10):3 551-3 574.
[41] Cheng J,Wang L,Wang P,et al.High-oxidation-state 3d metal (Ti-Cu) complexes with N-heterocyclic carbene ligation[J].Chemical Reviews,2018,118(19):9 930-9 987.
[42] Zhang C,Hooper J F,Lupton D W.N-heterocyclic carbene catalysis via the α,β-unsaturated acyl azolium[J].ACS Catalysis,2017,7(4):2 583-2 596.
[43] Ohmiya H.N-heterocyclic carbene-based catalysis enabling cross-coupling reactions[J].ACS Catalysis,2020,10(12):6 862-6 869.
[44] Grossmann A,Enders D.N-heterocyclic carbene catalyzed domino reactions[J].Angewandte Chemie (International Edition),2012,51(2):314-325.
[45] Zamora M T,Ferguson M J,McDonald R,et al.Unsymmetrical dicarbenes based on N-heterocyclic/mesoionic carbene frameworks:A stepwise metalation strategy for the generation of a dicarbene-bridged mixed-metal Pd/Rh complex[J].Organometallics,2012,31(15):5 463-5 477.
[46] Herrmann W A,Baskakov D,Herdtweck E,et al.Chiral N-heterocyclic carbene ligands derived from 2,2′-bipiperidine and partially reduced biisoquinoline:Rhodium and iridium complexes in asymmetric catalysis[J].Organometallics,2006,25(10):2 449-2 456.
[47] Chen S,Shi Y H,Wang M.Recent progress in (dynamic) kinetic resolution catalyzed by N-heterocyclic carbenes[J].Chemistry (an Asian Journal),2018,13(17):2 184-2 194.
[48] Murauski K J R,Jaworski A A,Scheidt K A.A continuing challenge:N-heterocyclic carbene-catalyzed syntheses of gamma-butyrolactones[J].Chemical Society Reviews,2018,47(5):1 773-1 782.
[49] Huisgen R.Kinetics and mechanism of 1,3-dipolar cycloadditions[J].Angewandte Chemie (International Edition),1963,2(11):633-696.
[50] Diez Gonzalez S,Stevens E D,Nolan S P.A [(NHC)CuCl] complex as a latent click catalyst[J].Chemical Communications,2008(39):4 747-4 749.
[51] Xia Y,Chen L Y,Lv S,et al.Microwave-assisted or Cu-NHC-catalyzed cycloaddition of azido-disubstituted alkynes:Bifurcation of reaction pathways[J].Journal of Organic Chemistry,2014,79(20):9 818-9 825.
[52] Bidal Y D,Lesieur M,Melaimi M,et al.Copper(I) complexes bearing carbenes beyond classical N-heterocyclic carbenes:Synthesis and catalyticaActivity in ″Click Chemistry″[J].Advanced Synthesis & Catalysis,2015,357(14-15):3 155-3 161.
[53] Bruyat P,Gautier A,Jean L,et al.Use of an air-stable Cu(I)-NHC catalyst for the synthesis of peptidotriazoles[J].Journal of Organic Chemistry,2018,83(21):13 515-13 522.
[54] Lazreg F,Cazin C S J.Copper(I)-N-heterocyclic carbene complexes as efficient catalysts for the synthesis of 1,4-disubstituted 1,2,3-sulfonyltriazoles in air[J].Organometallics,2017,37(5):679-683.
[55] Correia C A,Mc Quade D T,Seeberger P H.Copper(I)/N-heterocyclic carbene (NHC)-catalyzed addition of terminal alkynes to trifluoromethyl ketones for use in continuous reactors[J].Advanced Synthesis & Catalysis,2013,355(18):3 517-3 521.
[56] Czerwinski P,Molga E,Cavallo L,et al.NHC-copper(I) halide-catalyzed direct alkynylation of trifluoromethyl ketones on water[J].Chemistry,2016,22(24):8 089-8 094.
[57] Lee K S,Hoveyda A H.Monodentate non-C(2)-symmetric chiral N-heterocyclic carbene complexes for enantioselective synthesis:Cu-catalyzed conjugate additions of aryl- and alkenylsilylfluorides to cyclic enones[J].Journal of Organic Chemistry,2009,74(12):4 455-4 462.
[58] Rucker R P,Whittaker A M,Dang H,et al.Synthesis of tertiary alkyl amines from terminal alkenes:Copper-catalyzed amination of alkyl boranes[J].Journal of the American Chemical Society,2012,134(15):6 571-6 574.
[59] Zheng S,Li F,Liu J,et al.A novel and efficient (NHC)CuI (NHC=N-heterocyclic carbene) catalyst for the oxidative carbonylation of amino compounds[J].Tetrahedron Letters,2007,48(33):5 883-5 886.
[60] Liu J,Zhang R,Wang S,et al.A general and efficient copper catalyst for the double carbonylation reaction[J].Organic Letters,2009,11(6):1 321-1 324.
[61] Cheng L J,Mankad N P.Copper-catalyzed carbonylative coupling of alkyl Halides[J].Accounts of Chemical Research,2021,54(9):2 261-2 274.
[62] Ohishi T,Nishiura M,Hou Z.Carboxylation of organoboronic esters catalyzed by N-heterocyclic carbene copper(I) complexes[J].Angewandte Chemie (International Edition),2008,47(31):5 792-5 795.
[63] Seo H,Hirsch Weil D,Abboud K A,et al.Development of biisoquinoline-based chiral diaminocarbene ligands:Enantioselective SN′2 allylic alkylation catalyzed by copper-carbene complexes[J].Journal of Organic Chemistry,2008,73(5):1 983-1 986.
[64] Selim K B,Nakanishi H,Matsumoto Y,et al.Chiral N-heterocyclic carbene-copper(I)-catalyzed asymmetric allylic arylation of aliphatic allylic bromides:Steric and electronic effects on gamma-selectivity[J].Journal of Organic Chemistry,2011,76(5):1 398-1 408.
[65] Whittaker A M,Rucker R P,Lalic G.Catalytic SN′2-selective substitution of allylic chlorides with arylboronic esters[J].Organic Letters,2010,12(14):3 216-3 218.
[66] Wang M,Li P,Wang L.Silica-immobilized NHC-CuI complex:An efficient and reusable catalyst for A3-coupling (aldehyde-alkyne-amine) under solventless reaction conditions[J].European Journal of Organic Chemistry,2008(13):2 255-2 261.
[67] Navarro O,Chen M T.N-heterocyclic carbene (NHC)-copper(I) complexes as catalysts for A3 reactions[J].Synlett,2013,24(10):1 190-1 192.
[68] Chen M T,Landers B,Navarro O.Well-defined (N-heterocyclic carbene)-Ag(I) complexes as catalysts for A3 reactions[J].Organic & Biomolecular Chemistry,2012,10(11):2 206-2 208.
[69] Lillo V,Prieto A,Bonet A,et al.Asymmetric β-boration of α,β-unsaturated esters with chiral (NHC)Cu catalysts[J].Organometallics,2008,28(2):659-662.
[70] Park J K,Lackey H H,Rexford M D,et al.A chiral 6-membered N-heterocyclic carbene copper(I) complex that induces high stereoselectivity[J].Organic Letters,2010,12(21):5 008-5 011.
[71] Lee Y,Hoveyda A H.Efficient boron-copper additions to aryl-substituted alkenes promoted by NHC-based catalysts:Enantioselective Cu-catalyzed hydroboration reactions[J].Journal of the American Chemical Society,2009,131(9):3 160-3 161.
[72] Park J K,Lackey H H,Ondrusek B A,et al.Stereoconvergent synthesis of chiral allylboronates from an E/Z mixture of allylic aryl ethers using a 6-NHC-Cu(I) catalyst[J].Journal of the American Chemical Society,2011,133(8):2 410-2 413.
[73] Jang H,Zhugralin A R,Lee Y,et al.Highly selective methods for synthesis of internal (alpha-) vinylboronates through efficient NHC-Cu-catalyzed hydroboration of terminal alkynes:Utility in chemical synthesis and mechanistic basis for selectivity[J].Journal of the American Chemical Society,2011,133(20):7 859-7 871.
[74] Liu X,Xia Q,Zhang Y,et al.Cu-NHC-TEMPO catalyzed aerobic oxidation of primary alcohols to aldehydes[J].Journal of Organic Chemistry,2013,78(17):8 531-8 536.
[75] Zhan L W,Han L,Xing P,et al.Copper N-heterocyclic carbene:A catalyst for aerobic oxidation or Reduction Reactions[J].Organic Letters,2015,17(24):5 990-5 993.
[76] Mncube S G,Bala M D.Homogeneous oxidation reactions catalysed by in situ-generated triazolylidene copper(I) complexes[J].Transition Metal Chemistry,2018,44(2):145-151.
[77] Uehling M R,Marionni S T,Lalic G.Asymmetric synthesis of trisubstituted allenes:Copper-catalyzed alkylation and arylation of propargylic phosphates[J].Organic Letters,2012,14(1):362-365.
[78] Sai M,Yorimitsu H,Oshima K.Allyl-,allenyl-,and propargyl-transfer reactions through cleavage of C-C bonds catalyzed by an N-heterocyclic carbene/copper complex:Synthesis of multisubstituted pyrroles[J].Angewandte Chemie (International Edition),2011,50(14):3 294-3 298.
[79] Grandbois A,Mayer M E,Bedard M,et al.Synthesis of C(1)-symmetric BINOLs employing N-heterocyclic carbene-copper complexes[J].Chemistry,2009,15(38):9 655-9 659.
[80] Vieira E M,Snapper M L,Hoveyda A H.Enantioselective synthesis of homoallylic amines through reactions of pinacolato)allylborons with aryl-,heteroaryl-,alkyl-,or alkene-substituted aldimines catalyzed by chiral C1-symmetric NHC-Cu complexes[J].Journal of the American Chemical Society,2011,133(10):3 332-3 335.
[81] Vieira E M,Haeffner F,Snapper M L,et al.A robust,efficient,and highly enantioselective method for synthesis of homopropargyl amines[J].Angewandte Chemie (International Edition),2012,51(27):6 618-6 621.
【責任编辑:蒋亚儒】
