碳酸盐体系中砷酸复盐选择性沉砷研究
2023-03-27田佳王宇峰彭竣张荥斐孙伟刘勇韩海生胡文吉豪沈吉峰李光梅
田佳,王宇峰,彭竣,张荥斐,孙伟,刘勇,韩海生,胡文吉豪,沈吉峰,李光梅
(1.中南大学 资源加工与生物工程学院,湖南 长沙,410083;2.冷水江锑都环保有限责任公司,湖南 冷水江,417500;3.湖南黄金集团有限责任公司,湖南 长沙,410083)
有色冶炼含砷固废碱法处置是实现有价金属组分与砷组分选择性分离的重要方法之一[1-4]。由于原料本身含有碳酸盐,同时碱浸过程中也会加入碳酸钠,碱浸液中会同时含有大量砷酸钠和碳酸钠,形成一种特殊的高碱盐含砷废水[5-6]。以锑冶炼含砷固废砷碱渣的处置为例,砷碱渣浸出后产生的高碱盐含砷废水中砷质量浓度可达20 g/L,而碳酸钠质量浓度则高达150 g/L[7-8]。不同于一般的含砷废水,一方面,由于含有大量碱性碳酸盐,这种高碱盐含砷废水脱砷后可以返回碱浸工序,具有一定的循环利用价值,另一方面,由于大量碳酸盐共沉淀,常规的砷酸金属盐沉淀法无法有效处置这种含砷废水。可以说,这种高碱盐含砷废水的处置是限制含砷固废碱法处置工业化应用的瓶颈问题之一[9-11]。
针对碳酸盐体系下含砷废水的处置问题,张楠等[12]先用H2SO4将强碱液pH降到1.5左右,然后通过在酸性条件下加入铁盐形成臭葱石沉淀的方法除砷。该方法虽然可以使废水中砷含量降到排放标准,但是会消耗大量酸,产生大量气体,最关键的是处置后的废水中不仅含有大量无法直接排放的硫酸盐,而且呈强酸性,无法继续循环利用。李志强等[13]基于砷酸钠和碳酸钠溶解度的差异,采用分步结晶的方法,通过蒸发结晶依次回收碳酸钠和砷酸钠结晶产品,理论上实现了对砷组分和碱组分的资源化利用。但是该方法在实际应用过程中受碱液中杂质影响较大,且蒸发结晶过程中砷和碱分离不彻底,碱产品和砷产品之间相互夹杂,无法大规模工业化应用。LEI等[14]发现在有碳酸根存在的情况下,最终的滤渣中绝大部分为碳酸钙,无法达到除砷的目的[14]。这些研究表明,若不能实现在碱性条件下碳酸钠与砷酸钠的高效选择性分离,则无法解决高碱盐含砷废水的处置问题。
鉴于碳酸盐体系下常规的砷酸金属盐沉淀效果较差,本文基于砷地球成矿化学原理,提出通过砷酸复盐(MgNH4AsO4·6H2O)沉淀实现高碱盐含砷废水中碳酸盐和砷酸盐的高效选择性分离的方案;重点解决砷酸复盐选择性沉砷过程中涉及到的热力学问题,结合相应的验证实验,建立砷酸复盐矿化沉淀法处置高碱盐含砷废水的理论体系。
1 实验
1.1 实验原料与试剂
实验中所用药剂碳酸钠(Na2CO3)、氧化镁(MgO)、碳酸氢铵(NH4HCO3)和砷酸钠(Na3AsO4)均为分析纯。由不同镁盐和铵盐组合形成的砷酸复盐除砷效果不尽相同,为了不引入杂质,本文选择MgO和NH4HCO3的组合。实验中所用高碱盐含砷溶液的配置方法如下:将亚砷酸钠、碳酸钠、去离子水按照一定的比例混合,充分溶解后形成含0.1 mol/L 砷,碳酸钠质量浓度分别为50,100,150 和200 g/L 的高碱盐含砷溶液,供后续验证实验使用。
1.2 实验流程
本文砷酸复盐沉淀除砷验证实验流程如下:首先,取100 mL 预先配置的高碱盐含砷溶液于锥形瓶中,按照实验设计药剂用量依次加入NH4HCO3和MgO药剂,然后,将锥形瓶置于恒温震荡厢中以200 r/min 的速度在常温下充分震荡60 min,最后,将反应完成后的溶液用真空抽滤机过滤,分别取滤液和滤渣用于化验分析。值得说明的是,砷酸复盐沉淀在高温烘干时会分解,所以,滤渣烘干温度不超过60 ℃。
1.3 化验分析
实验中滤液和滤渣中砷和镁的含量通过ICPOES(Thermo Scientific,Waltham,MA,USA)测定;滤渣中铵氮含量通过化学滴定确定;滤渣的粒度分析由激光粒度仪(Mastersizer 3000,Malvern,England)确定;滤渣的物相由XRD(SIMENS D500,Bruker,Switzerland)测量;滤渣的形貌采用场发射电子扫描显微镜SEM(FESEM,USA)确定。
2 砷酸复盐矿化沉淀热力学分析及计算
热力学分析能够反映沉淀过程中各种成分浓度和组成的变化情况,从而为实际砷酸复盐沉淀除砷过程提供理论指导。表1所示为除砷体系中可能存在的反应以及反应的平衡常数[15-17]。
由于该体系成分较为复杂,且缺乏相关物质的活度系数,计算中以物质的质量浓度代替相关活度[18]。由表1中的平衡关系可知,在砷酸复盐沉淀过程中,溶液中可能存在的游离组分为H+,可能存在的固相组分有MgHAsO4,MgNH4AsO4,Mg3(AsO4)2和MgCO3。体系中各离子平衡浓度应满足表2所示关系式。
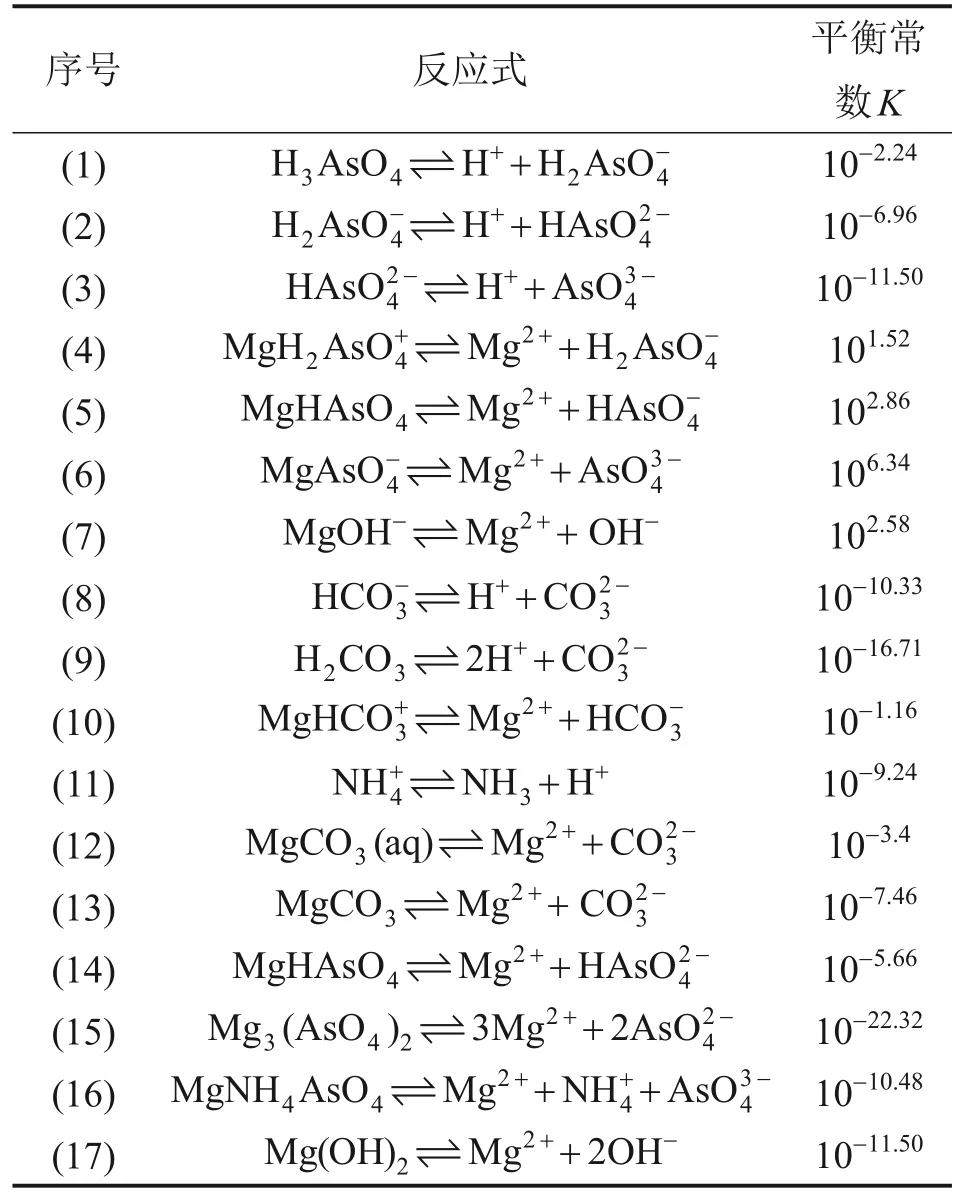
表1 除砷时的化学反应及其在25 ℃下的平衡常数[15-17]Table 1 Chemical reactions and equilibrium in process of arsenic removal at 25 ℃[15-17]
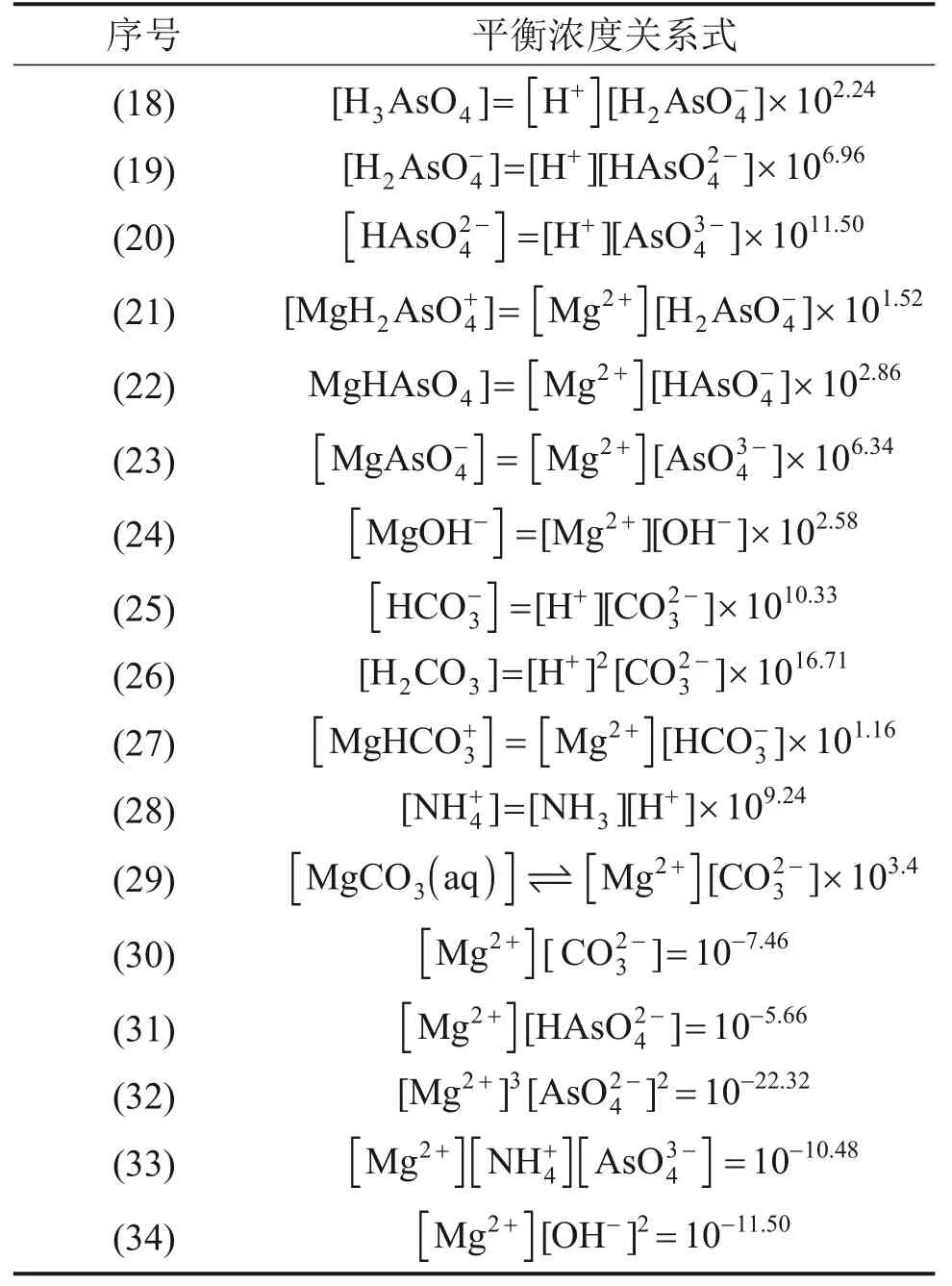
表2 体系中各离子平衡浓度关系式Table 2 Equilibrium concentration equations of ions in the system
假设体系达到沉淀平衡时,溶液中游离的总砷、总镁、总氮和总碳浓度分别为[As]T,[Mg]T,[N]T和[C]T,根据物料守恒,沉淀平衡时这4 种组分的浓度应该满足表3所示关系式。假设体系无沉淀生成时,总砷、总镁、总氮和总碳初始浓度分别为[As]T0,[Mg]T0,[N]T0和[C]T0,随着溶液pH的变化,体系中会出现不同的固相组成,根据质量平衡原理,可计算出各固相成分稳定存在时的pH区间以及溶液中各离子的平衡浓度[19-20]。

表3 体系中各组分物料质量守恒关系Table 3 Mass conservation of components in the system
3 结果与讨论
图1(b)所示为该体系中[As]T,[Mg]T和[C]T随pH 的变化关系。在MgNH4AsO4和MgCO3的共沉淀区间内,随着pH 的升高,[As]T先下降后升高,[C]T先升高后下降,而[Mg]T则不断降低。由于砷碱分离的主要目的是在降低溶液中残余砷酸盐浓度的同时,减少碳酸盐的损失,即保证[As]T和[C]T的最大差值,所以,在本文实验条件下,最佳砷碱分离pH为8.0。此时[As]T最小,为0.016 mol/L;[C]T最大,为0.963 mol/L,对应的除砷效率为83.45%。
图1(c)和图1(d)所示分别为溶液中各含砷组分的摩尔分数和沉淀中各组分的摩尔分数。由图1(c)可知、随着pH的增加,溶液中主要的含砷组分依次为其中在MgNH4AsO4和MgCO3的共沉淀(pH)区间内,溶液主要的含砷组分为说明是形成砷酸复盐沉淀的主要组分之一。同时,由于Mg2+的存在,溶液中还存在少量的MgHAsO4和由图1(d)可知,在不同pH条件下,沉淀中各组分摩尔分数不断变化。当MgCO3和MgNH4AsO4共存时,随着pH 的升高,沉淀中MgNH4AsO4摩尔分数先升高后下降,而MgCO3摩尔分数则先降低后上升,这也与图1(b)中[As]T和[C]T变化趋势相对应。在pH 为8.0 时,沉淀中MgNH4AsO4摩尔分数达到最大值69.48%,而继续增加pH,沉淀中主要物相逐渐变为MgCO3。
3.2 药剂初始浓度对体系平衡的影响

图2 不同[C]T0条件下体系lgc-pH图

图3 不同[Mg]T0条件下体系lgc-pH图Fig.3 Curves of lgc-pH in thesystem with different [Mg]T0
实际上,[Mg]T0不仅会影响体系的除砷效率,也会影响沉淀的组成。图4所示为不同[Mg]T0条件下,沉淀中各组分摩尔分数情况。在MgNH4AsO4和MgCO3共沉淀区域内,当Mg2+和As(Ⅴ)物质的量比为1.0 时,MgNH4AsO4组分摩尔分数在pH 为8.0 时取得最大值83.08%;当Mg2+和As(Ⅴ)物质的量比为1.8时,MgNH4AsO4组分最大摩尔分数降为47.43%;而当Mg2+和As(Ⅴ)物质的量比为2.4 时,MgNH4AsO4组分最大摩尔分数仅为35.53%。由此可见,增加镁盐用量会显著降低沉淀中有效组分MgNH4AsO4的摩尔分数,即过量的镁盐会与碳酸根反应形成MgCO3沉淀,所以,在保证沉砷效率的前提下,应该尽量控制镁盐用量,提高砷渣品位,降低砷渣产量。
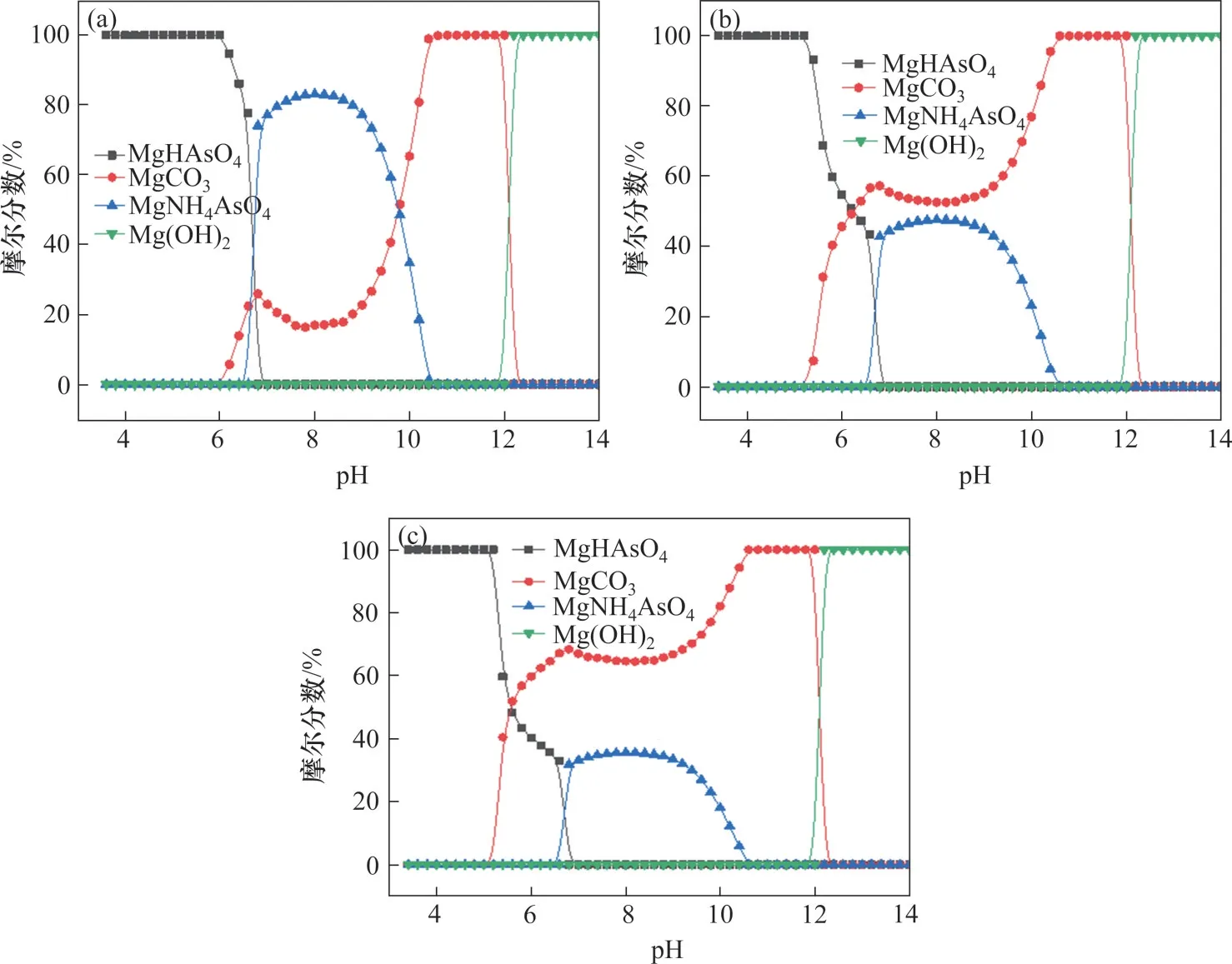
图4 不同[Mg]T0条件下体系沉淀中各组分的摩尔分数Fig.4 Molar fracions of solid species of precipitated components insystem with differnt [Mg]T0
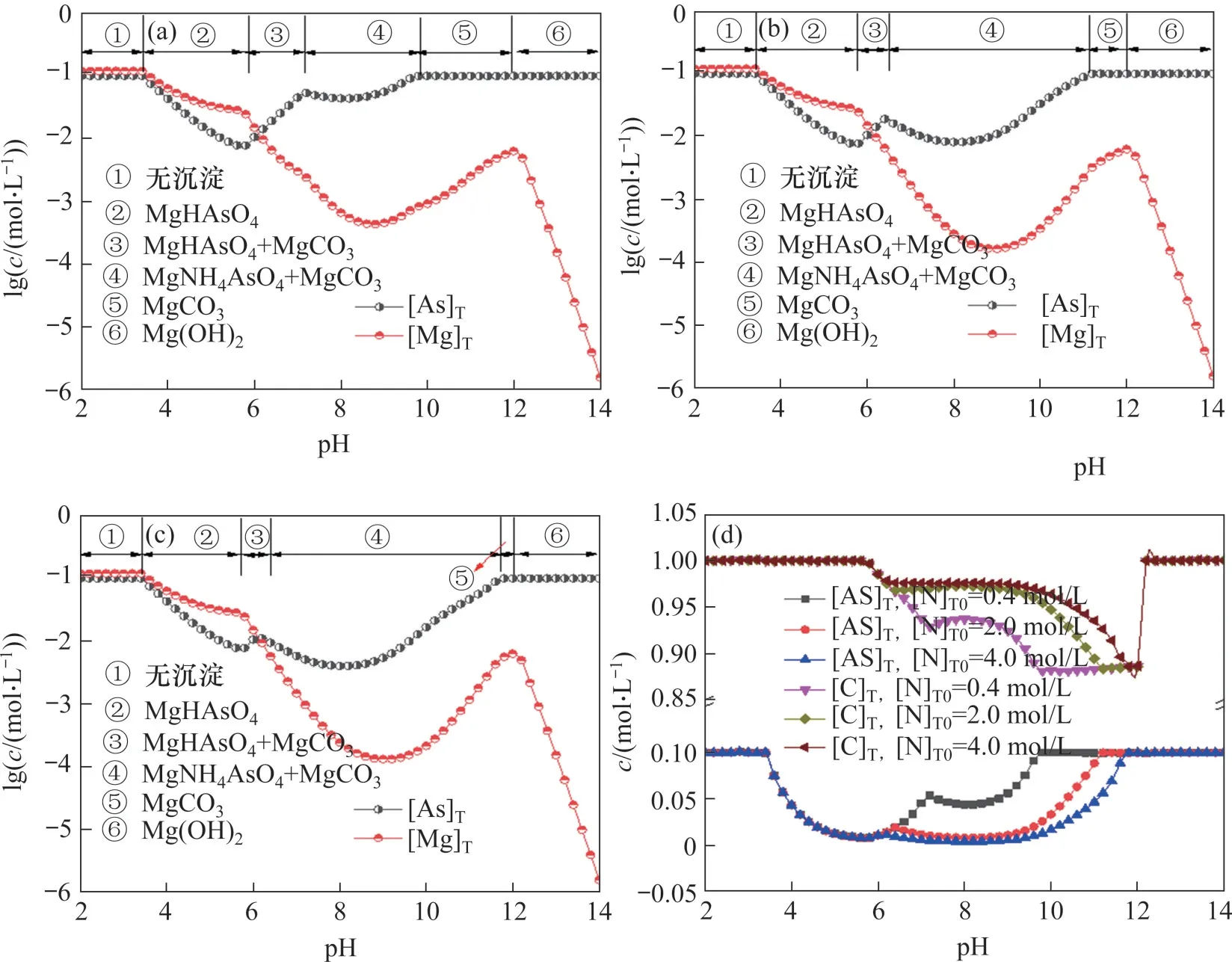
图5 不同[N]T0条件下体系lgc-pH图Fig.5 Curves of lgc-pH in thesystem with different [N]T0
图6所示为不同[N]T0条件下沉淀中各组分摩尔分数变化情况。由图6 可见:在MgNH4AsO4和MgCO3共沉淀区域内,当和As(Ⅴ)物质的量比为4.0 时,MgNH4AsO4组分最大摩尔分数为47.09%;当和As(Ⅴ)物质的量比为20.0 时,MgNH4AsO4组分最大摩尔分数为76.69%;而当和As(Ⅴ)物质的量比为40.0时,MgNH4AsO4组分最大摩尔分数达到80.15%。可知,增加铵盐用量会显著增加沉淀中有效组分MgNH4AsO4的摩尔分数,从而增加砷渣品位,减少砷渣产量。

图6 不同[N]T0条件下体系沉淀各组分的摩尔分数Fig.6 Molar fractions of solid species in the precipitationinthesystem with different initial[N]T0
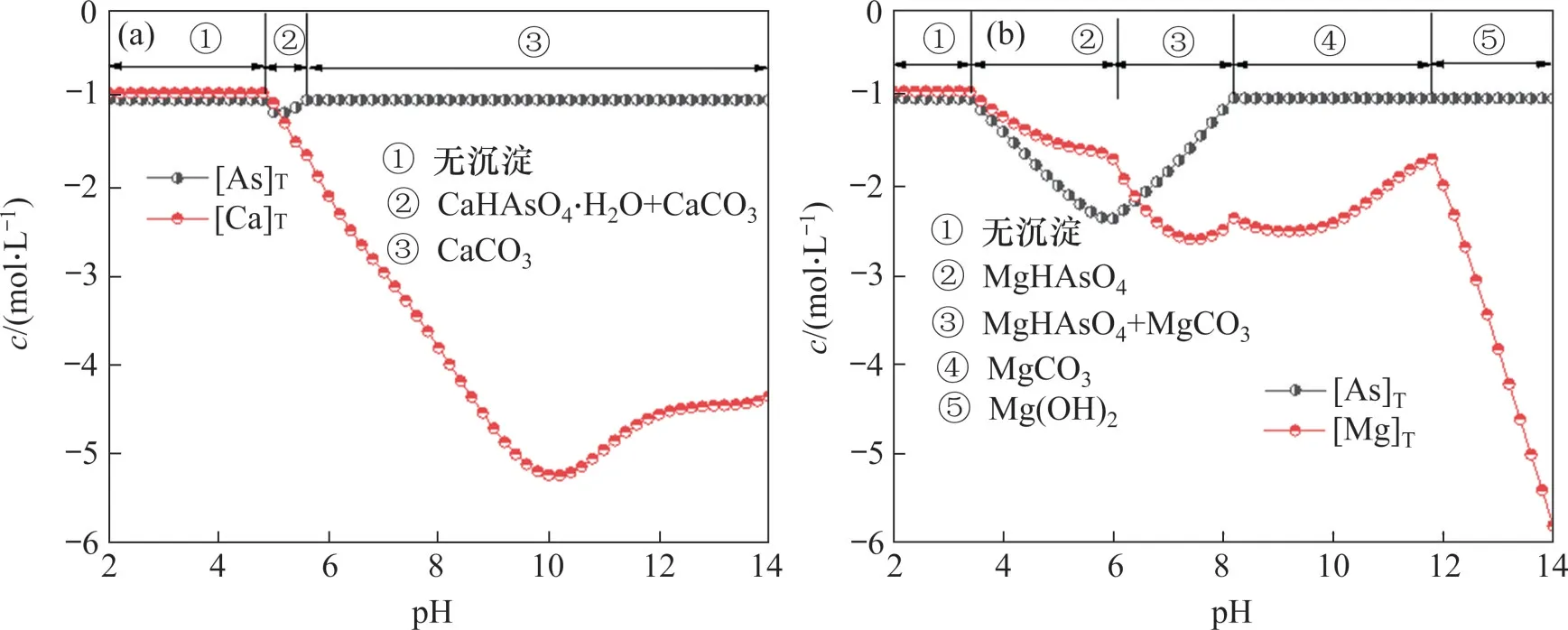
图7 体系和体系lgc-pH图Fig.7 Curves of lgc-pH in thesystem andsystem
3.3 碳酸盐体系除砷实验研究
图8所示为不同Na2CO3质量浓度下单独用钙盐和镁盐的除砷率和砷渣品位。由图8(a)可知,在Na2CO3体系下,当Ca2+和As(Ⅴ)物质的量比为2.0时,随着Na2CO3质量浓度的增加,钙盐沉砷率不断降低。当Na2CO3质量浓度达到200 g/L,钙盐沉砷率为12.33%,此时砷渣品位仅为0.19%。由图8(b)可知:在Na2CO3体系中,当Mg2+和As(Ⅴ)物质的量比为2.0,Na2CO3质量浓度为50 g/L 时,镁盐除砷的最大除砷率仅为38.32%,此时,砷渣中砷质量分数为8.33%,而当Na2CO3质量浓度继续增加时,镁盐除砷率和砷渣中砷的质量分数还会继续下降。钙盐和镁盐除砷实验验证了热力学计算结果,即在有存在的情况下,单独使用钙盐或镁盐无法除砷。

图8 碳酸钠质量浓度对钙盐和镁盐沉砷率和砷渣品位的影响([As]T0=0.1 mol/L)Fig.8 Effect of Na2CO3 mass concentration on arsenic removal rate and arsenic grade in arsenic slag([As]T0=0.1 mol/L)
图9所示为Na2CO3质量浓度、镁盐和铵盐用量对砷酸复盐除砷率和砷渣品位的影响。由图9(a)可知:在Mg2+和As(Ⅴ)物质的量比为1.2,和As(Ⅴ)物质的量比为2.0的条件下,当Na2CO3质量浓度为50 g/L 时,砷酸复盐沉淀最大除砷率为93.21%,砷渣品位为24.12%,而且随着Na2CO3质量浓度的增加,砷酸复盐沉淀除砷率逐渐下降,这与热力学计算结果一致。由图9(b)可知:在Na2CO3质量浓度为150 g/L,和As(Ⅴ)物质的量比为2.0的条件下,随着镁盐用量的增加,除砷效率逐渐升高,但是砷渣品位则先升高后下降。其中最大砷渣品位(27.14%)和最高除砷率(93.41%)分别在Mg2+与As(Ⅴ)物质的量比为1.8 以及Mg2+与As(Ⅴ)物质的量比为2.4 时取得。结合热力学分析可知,增加镁盐用量可以提高除砷率,但是也会增加沉淀中MgCO3的摩尔分数,因而导致砷渣品位下降。由图9(c)可知:在Na2CO3浓度为150 g/L,Mg2+和As(Ⅴ)物质的量比为1.2 的条件下,随着铵盐用量的增加,除砷效率和砷渣品位均不断升高;当和 As(Ⅴ)物质的量比为4.0 时,最大除砷率和最大砷渣品位分别为90.83%和29.75%。
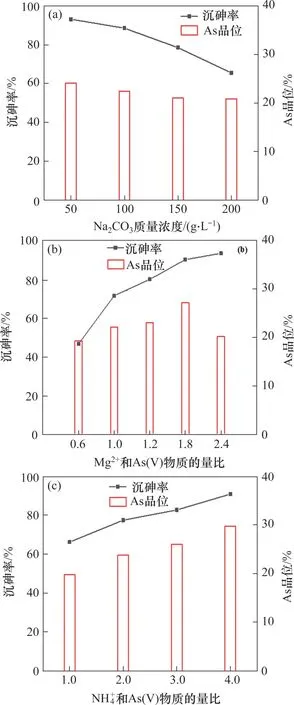
图9 碳酸钠质量浓度和药剂用量对沉砷率和砷渣品位的影响([As]T0=0.1 mol/L)Fig.9 Effect of Na2CO3 mass concentration and reagent dosage on arsenic removal rate and arsenic grade in arsenic slag([As]T0=0.1 mol/L)
图10所示为当Mg2+与As(Ⅴ)物质的量比为1.2、与As(Ⅴ)物质的量比为2.0,不同Na2CO3质量浓度下,砷渣的XRD 分析结果。从图10 可以看出:当Na2CO3质量浓度低于200 g/L时,沉淀中可以检测到明显的MgNH4AsO4·6H2O 的衍射峰,证实了MgNH4AsO4·6H2O 的存在,但是无法检测到MgCO3的衍射峰,这可能是因为沉淀中MgCO3摩尔分数较小或以无定型状态存在。当Na2CO3质量浓度达到200 g/L 时,沉淀中无法检测到明显的衍射峰,说明此时沉淀里主要物质可能呈无定型状态存在。
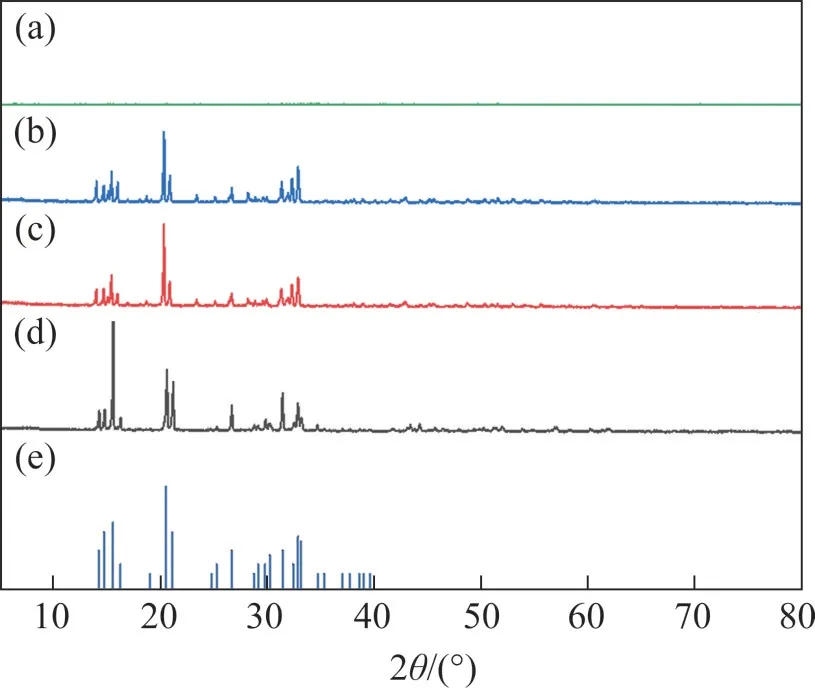
图10 不同碳酸钠质量浓度下砷渣XRDFig.10 XRD of arsenic slag in the different Na2CO3 mass concentrations
图11所示为在Na2CO3质量浓度为150 g/L、Mg2+与As(Ⅴ)物质的量比为1.2、与As(Ⅴ)物质的量比为4.0条件下,沉淀的形貌和粒度分布。沉淀元素组成见表4。从图11(a)可知,该条件下形成的砷渣主要呈梯状,结合图11(b)可知,该沉淀具有较大的粒径,平均粒径为38.05 μm 左右,因而可以较好地实现固液分离;由表4 可知:沉淀中N,Mg 和As 质量分数分别为4.42%,7.57%和29.75%,其中As与N原子分数的比值约为1:1,与MgNH4AsO4·6H2O 物质中2 种元素占比接近,而Mg与As原子分数的比值约为11:9,说明在该沉淀中除了MgNH4AsO4·6H2O 物相外,还含有其他含有镁的物相,这与热力学分析中沉淀相为MgNH4AsO4和MgCO3共存相的结论一致。
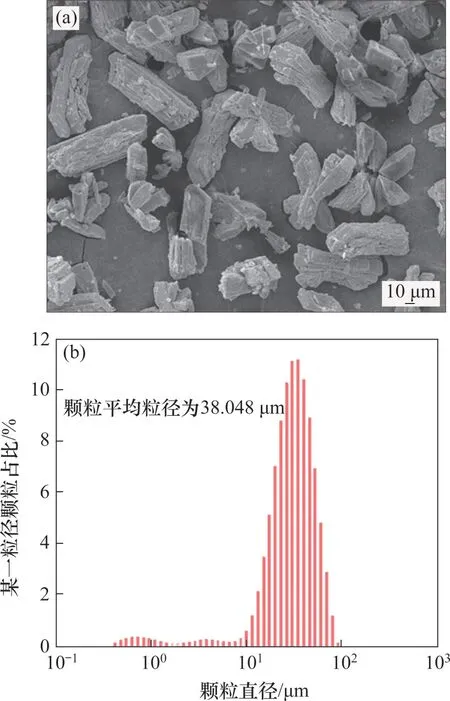
图11 沉淀的SEM图及粒度分布Fig.11 SEM results and particle size distribution of the preci patation

表4 沉淀成分分析Table 4 Components analysis of the precipatation
综上可知,砷酸复盐矿化沉淀可以实现高碱盐含砷溶液中砷酸钠和碳酸钠的高效选择性分离。基于砷碱选择性分离,脱砷后的碳酸钠溶液可以通过蒸发结晶或碳化结晶制备碳酸钠产品,也可以直接返回碱浸工序,实现工业用水循环;沉淀反应形成的砷渣中砷含量高、杂质少,可以直接用于刚性填埋,或者还原焙烧制备砷产品,实现砷组分的无害化处置。基于该技术,冷水江锡矿山地区已经建成年处理量2 万t 的砷碱渣处理线,并实现了工业化应用。
4 结论
3)在Na2CO3为150 g/L 的条件下,控制Mg2+和As(Ⅴ)物质的量比为1.2,和As(Ⅴ)物质的量比为4.0,除砷率和砷渣品位分别为90.83%和29.75%, 沉淀的主要成分为MgNH4AsO4和MgCO3。
