基于网络药理学研究“当归-鸡血藤”药对治疗肾性贫血的作用机制
2023-03-20丁越越孙华洁刘妍妍刘芯吟陈智渊叶黎青马红珍
丁越越 孙华洁 刘妍妍 刘芯吟 陈智渊 叶黎青 马红珍
肾性贫血(renal anemia,RA)是慢性肾脏病(chronic kidney disease,CKD)临床常见并发症,严重的RA会使CKD患者发生心血管事件的概率增加、引起认知功能障碍,是肾病患者进入至终末期肾病的独立危险因素之一[1]。有研究显示CKD 3期贫血发生率为51.1%,CKD 5期可高达90.2%[2]。RA的主要治疗方式为补充铁剂、使用红细胞生成刺激剂(erythropoietin stimulating agents,ESA)和输血等,近年来,口服的新药罗沙司他通过可逆地结合和抑制缺氧诱导因子-脯氨酸羟化(HIF-prolyl hydroxylase,HIF-PH)酶抑制剂,减少HIF分解,改善RA。但RA仍面临治疗率不高、达标率低、ESA低反应性等难题。中医认为血液化生与肾脏息息相关,有“肾藏精,精者,血之所成也”“肾为水脏,主藏精而化血”之说。RA在中医学中归属于“肾劳”“虚劳”等病,其根本病机是肾衰竭时期,湿浊毒瘀邪留滞于机体,耗损正气,导致肾脏元阴元阳俱损,精血化生不足[3]。当归性温,味甘、辛,补血活血、调经止痛。相关研究表明,当归的主要成分当归多糖(angelica sinensis polysaccharide,ASP)可以抑制CKD贫血大鼠肝脏铁调素的表达,增加HIF-2α蛋白的积累,恢复促红细胞生成素(erythropoietin,EPO)的合成,激活JAK2/STAT5和PI3K/Akt信号传导,发挥改善贫血的作用[4-5]。鸡血藤性温,味苦、甘,活血补血,活络止痛,鸡血藤可通过调控hepcidinncoding基因来抑制机体铁调素的过表达,改善铁代谢,纠正贫血[6]。本研究采用网络药理学的方法,全面整理“当归-鸡血藤”药对治疗RA潜在的作用机制,并利用分子对接对预测结果进行佐证,探究其对RA的作用机制,为临床提供新的用药思路。
1 对象和方法
1.1 化合物与靶点获取 以“当归”“鸡血藤”为关键词,在中药系统药理学分析平台(TCMSP)数据库中检索其活性成分。以口服利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18作为标准进行筛选,获取符合条件的活性成分靶点导入Uniport数据库标准化基因名。
1.2 RA靶点的获取 将“Renal Anemia”设置为关键词,分别在Drugbank、Genecards、OMIM数据库中检索RA相关靶标,合并、去重,与中药药物靶点取交集,得到中药治疗RA的潜在作用靶点,并绘制Venn图。
1.3 蛋白质互作(protein-protein interaction,PPI)网络构建 将潜在作用靶点上传至String数据库(https://string-db.org)获取靶点蛋白的交互作用信息,导入Cytoscape软件,获取PPI网络。
1.4 药物-活性成分-疾病-靶点互作网络构建 运用Cytoscape 3.6.0软件,将“当归-鸡血藤”药对的潜在作用靶点与疾病之间的关联通过网络图进行可视化处理。
1.5 潜在作用靶点的基因本体(gene ontolog,GO)富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路注释分析 运用DAVID数据库对“当归-鸡血藤”药对治疗RA的潜在作用靶点进行GO富集分析和KEGG通路注释分析,绘制气泡图。
1.6 分子对接 通过PDB数据库(http://www.rcsb.org)下载蛋白结构,PubChem数据库下载(https://pubchem.ncbi.nlm.nih.gov)活性成分三维结构。利用Autodock Vina(v1.1.2)以及Pymol软件对结果进行分析和可视化。
2 结果
2.1 药物筛选结果 获得2个当归活性成分,24个鸡血藤活性成分,按照筛选条件进行筛选、整合,去重后共获得24个活性成分(有2个活性成分重复)。通过Uniport数据库筛选获得“当归-鸡血藤”靶基因140个。
2.2 RA靶点的收集 通过检索GeneCards、OMIM、Drugbank数据库筛选获得疾病靶点992个,将药物与疾病靶点取交集,获得交集靶点共44个,绘制Venn图,见图1。

图1 药物和疾病靶点Venn图
2.3 PPI网络的构建 将44个交集靶点上传至STRING数据库进行PPI网络构建,应用Cytoscape3.6.0软件构建PPI网络,通过Network Analyzer进行分析。共同靶点出现频次越高,度值越高。其中度值排名靠前的分别是MAPK1、TP53、TNF、CASP3、AKT1、STAT3,见表1。
2.4 药物-活性成分-靶点互作网络构建 应用Cytoscape 3.6.0软件构建中药-成分-疾病靶点互作网络,共获得165个节点与446条边,见图2(插页)。其中节点分别代表中药、成分、疾病靶点,边代表中药-成分-靶点之间的相互联系。箭头代表药物,正方形方格代表活性成分,菱形方格代表作用靶点。度值排名靠前的关键化合物为木犀草素(luteolin,LUT)、β-谷甾醇(beta-sitosterol,BS)、刺芒柄花素(formononetin,FNN)、甘草查尔酮 A(licochalcone A,Lico A)等。

图2 当归-鸡血藤的“药物-活性成分-靶点”网络
2.5 GO富集分析和KEGG通路注释分析 根据P值选择前20条生物过程、分子功能和细胞组分以及KEGG通路分别绘制气泡图,结果见图3、4(插页)。其中GO富集分析共得到GO生物过程361个条目,分子功能49个条目,细胞组分30个条目。

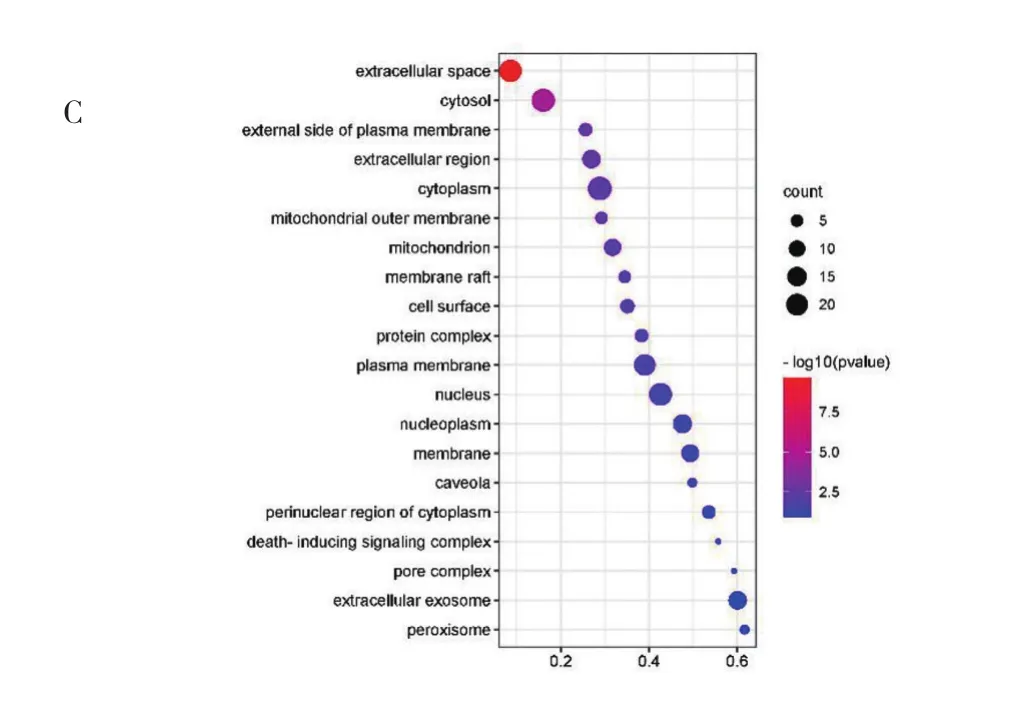
图3 GO生物功能富集分析(A:GO生物过程分析;B:GO细胞组分分析;C:GO分子功能分析)
KEGG通路注释分析到99条信号通路,关键靶点参与的通路主要涉及HIF-1信号通路、PI3K/Akt信号通路、TNF信号通路等,见图4(插页)。
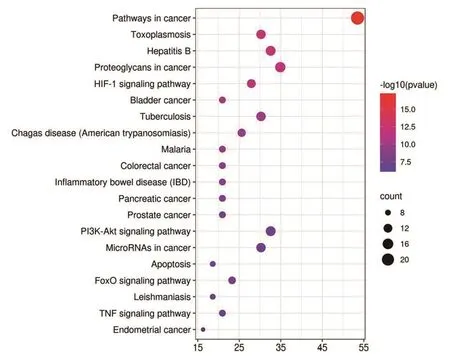
图4 KEGG通路富集分析
2.6 分子对接验证 将“活性成分-靶点”网络中根据度值大小排名前几位化合物和与其相关的作用靶点进行分子对接,得到分子对接热图见图5(插页),图中颜色越深代表结合能越低。结果显示,LUT和STAT3的最低结合能达-8.1,靶点与成分的结合具有强烈的稳定性。以结合较好的两组成分,LUT和STAT3以及LUT和TP53为例,进行受体-配体相互作用分析,结果表明受体蛋白与小分子配体之间以氢键起结合作用,见图6(插页)。

图5 分子对接热图

图6 分子对接模式图(A:TP53和LUT;B:STAT3和LUT)
3 讨论
RA发生机制可能与巨噬细胞内铁释放障碍、铁吸收异常、EPO表达异常等有关。RA会影响肾病患者生存质量,加速终末期肾脏病的进程并增加CKD患者心血管意外发生率等。对RA合理治疗可以改善患者的生存质量[7]。
本研究通过网络药理学的研究方法,获得“当归-鸡血藤”药对的有效化合物成分24种,与疾病靶点关系密切的关键化合物LUT、BS、FNN、Lico A等。LUT抗炎活性强,同时可抗氧化、介导细胞凋亡,可通过激活Nrf2通路,增加细胞抗氧化防御能力;调节HIF-1α通路,促使血管生成和上皮修复,发挥肾脏保护作用[8]。BS具有抗炎、抗氧化、抗肿瘤等生物活性,可下调TNF-α和IL-6的水平改善肾组织氧化应激[9]。FNN和Lico A均可改善机体氧化应激,其中Lico A还涉及调控HIF-1α蛋白表达[10-11]。
药物潜在作用靶点共44个,通过PPI网络得到与RA关系密切的核心蛋白,主要包括MAPK1、TP53、TNF、CASP3、AKT1、STAT3等靶点。MAPK1是丝分裂原活化蛋白激酶的一种,在细胞的增殖、分化、转化及凋亡过程中都具有调节作用,其可通过改善氧化应激缓解缺氧引起的肾纤维化[12]。TNF-α作为造血抑制因子,可激活炎症应答、诱导细胞凋亡等,而炎症则会抑制EPO,影响CKD患者的红细胞生成和增殖和铁的利用[13]。TP53作为TGF-β1诱导的信号通路中的辅助因子,是可以和TGF-β1促纤维化反应基因的转录共调节因子,上调TP53可缓解肾纤维化,调节细胞生长分化[14]。线粒体中AKT1的抑制会加重肾小管损伤、肾纤维化、肾小球硬化,反之可防止AKI和随后CKD的发展[15]。STAT3是JAK/STAT信号级联的核心成员,抑制STAT3具有减少蛋白尿,改善间质纤维化的作用[16]。
GO富集分析结果表明,“当归-鸡血藤”药对主要通过细胞外隙、细胞溶质、细胞质膜外等细胞组分介导对细胞凋亡的负调控、对基因表达的正调控、对RNA聚合酶Ⅱ启动子转录的正调控等生物过程,发挥相同蛋白结合、细胞因子活性、酶结合、蛋白磷酸酶结合、转录因子结合等分子功能,从而治疗RA。KEGG注释分析获得可能涉及的信号通路共99条,其中HIF-1信号通路直接参与造血,HIF是一种对机体氧水平至关重要的转录因子,其通过Hb调节全身氧的输送。调节HIF的亚基——HIF-1α可促进肾脏内源性EPO生成,同时HIF可增加铁吸收、铁储存的可及性和铁转运,降低铁调素的表达可改善炎症反应、提高机体的铁利用,改善RA[17]。PI3K/Akt信号通路主要涉及细胞增殖、分化、凋亡等生物过程,激活该通路可上调GSK-3β/Nrf2通路并抑制ASK1/JNK信号通路,具有改善肾脏氧化应激和炎症的作用[18]。TNF-α信号通路参与炎症反应,活化TNF-α信号转导可诱导激活肾组织的炎性浸润,成纤维细胞增生分化,调控TNF-α信号通路有助于减轻机体炎症状态,改善RA,同时也可能诱导应激性红细胞生成以维持红细胞稳态[19]。总之,“当归-鸡血藤”药对治疗RA主要通过多个成分和多靶点激活多条途径促进红细胞生成,调控机体炎症状态,改善铁利用发挥作用,从而改善RA,尤其对处于微炎症状态、ESA低反应性的CKD贫血患者的疗效有待进一步研究。
分子对接结果显示,STAT3和LUT的配体-受体复合物最低结合能可达-8.1,靶点与成分的结合具有强烈的稳定性。一般认为结合能越低,结合构象越稳定,相互作用的可能性越大[20]。
综上所述,本研究采用网络药理学的研究方法,对“当归-鸡血藤”药对治疗RA的具体机制进行探讨,分子对接结果在理论层面上初步验证了预测的核心成分和关键靶点具有较好的结合活性,为后续研究“当归-鸡血藤”药对治疗RA的相关机制及临床应用提供了理论支持和科学依据。
