hsa_circ_0000073对骨肉瘤脂质代谢的影响
2023-03-20任智晶田晓滨
任智晶,杨 震,杨 丹,田晓滨
(1.贵州省人民医院临床检验科,贵阳 550002;2.贵州省人民医院骨科,贵阳 550002;3.贵州医科大学附属医院骨科,贵阳 550000)
骨肉瘤是一种来源于间充质干细胞的恶性肿瘤,年发病率为1/100万~4/100万,5年生存率为37.5%~77.6%[1-5],了解骨肉瘤致病过程中的分子机制将有助于促进和发展更有效的治疗策略。最近的研究发现,能量代谢的重编程被认为是恶性转化的标志[6]。其中,脂质代谢失调在癌症进展中具有至关重要的作用,靶向脂质代谢已被视为一种新的肿瘤治疗策略[7-10]。环状RNA(circRNA)是一类非编码RNA,与肿瘤细胞的增殖、侵袭和迁移能力、细胞周期、凋亡及自噬等密切相关[11-13]。同时,circRNA也被证实可以参与调控肿瘤的脂质代谢[14-15]。本课题组前期研究证实了hsa_circ_0000073在骨肉瘤细胞系中高表达,并可促进骨肉瘤细胞的增殖、迁移和侵袭[16]。然而hsa_circ_0000073是否可以影响骨肉瘤细胞代谢,国内外尚无研究报道。因此,本研究旨在探索hsa_circ_0000073在骨肉瘤组织中的表达及其对骨肉瘤细胞及裸鼠异种移植瘤体中脂质代谢的影响,以期为骨肉瘤的诊断和治疗提供潜在的靶点,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1骨肉瘤组织标本
收集2020年1月至2022年1月贵州省人民医院就诊且经病理证实的10例骨肉瘤患者的肿瘤组织和癌旁组织。10例患者中男6例,女4例;年龄>18岁2例,<18岁8例;均无高血压、糖尿病等其他基础疾病。本研究经过贵州省人民医院伦理委员会批准[伦预审(2019)030],所有研究对象签署知情同意书。
1.1.2动物与细胞
12只BALB/C-nu小鼠购自西普尔-比凯实验动物科技公司,4周龄,平均体重约15 g,分为两组,每组6只。骨肉瘤细胞系MG-63和Saos-2购自中国科学院细胞库。
1.1.3试剂与仪器
引物、shRNA(安徽通用生物有限公司),MEM培养基、胎牛血清(美国Gibco公司),McCoy’s 5a培养基(美国Invitrogen公司),LipofectamineTM3000(美国Thermo公司),TRIzol试剂(美国Invitrogen公司),油红O染色试剂盒(北京索莱宝科技有限公司),尼罗红荧光染色溶液(上海源叶生物科技有限公司),Gene Chip miRNA Array 4.0(美国Affymetrix公司),荧光定量PCR(qRT-PCR)仪(杭州博日科技股份有限公司),倒置荧光显微镜(德国莱卡公司),自动酶标仪(中安生物科技有限公司)。
1.2 方法
1.2.1分组
根据细胞转染hsa_circ_0000073或随机序列的shRNA,分为circ_0000073干扰组及对照组。
1.2.2qRT-PCR
使用Trizol作为总RNA的抽提试剂。采用酸性酚-氯仿混合液纯化RNA,异丙醇沉淀浓缩,乙醇洗涤沉淀。PrimeScript RTase逆转录试剂盒和SYBR Green PCR试剂盒用于qRT-PCR检测,根据试剂说明书操作。使用GAPDH的表达水平进行标准化,并按公式2-ΔΔCt计算目的基因相对表达水平。引物序列见表1。
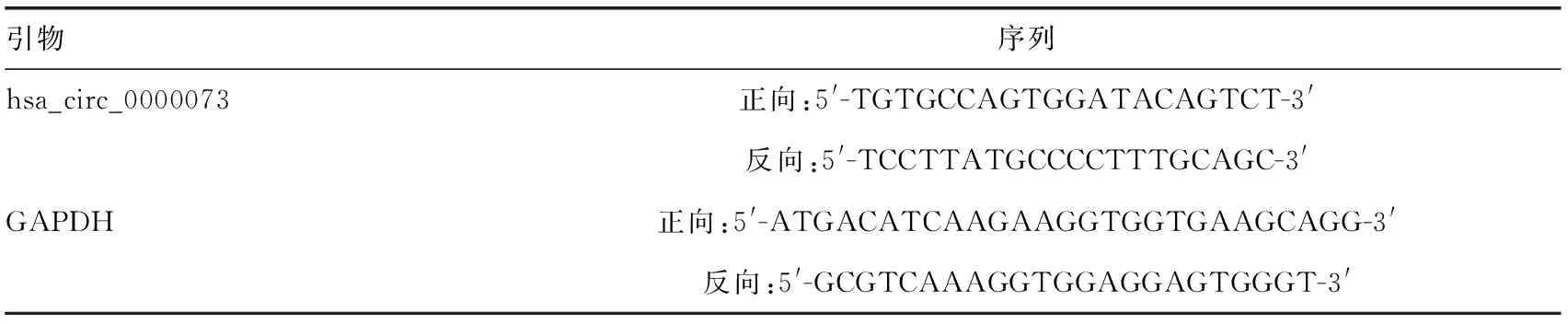
表1 qRT-PCR所使用引物序列
1.2.3细胞培养和稳转细胞株构建
MG-63和Saos-2骨肉瘤细胞在含5% CO2的37 ℃培养箱中培养。培养基中添加10%胎牛血清。使用LipofectamineTM3000将sh-NC(随机序列的sh-RNA,对照)及sh-hsa_circ_0000073转染细胞,shRNAs序列见表2。48 h后加入500~800 μg/mL G418进行筛选。4周后,加入200~300 μg/mL G418维持培养。由于载体中带有绿色荧光蛋白,成功转染目的基因的细胞在荧光显微镜中会呈现绿色荧光。取对数生长期的各组细胞荧光显微镜下观察,待大部分细胞在荧光显微镜下呈现绿色荧光后,通过qRT-PCR检测确认转染效率。
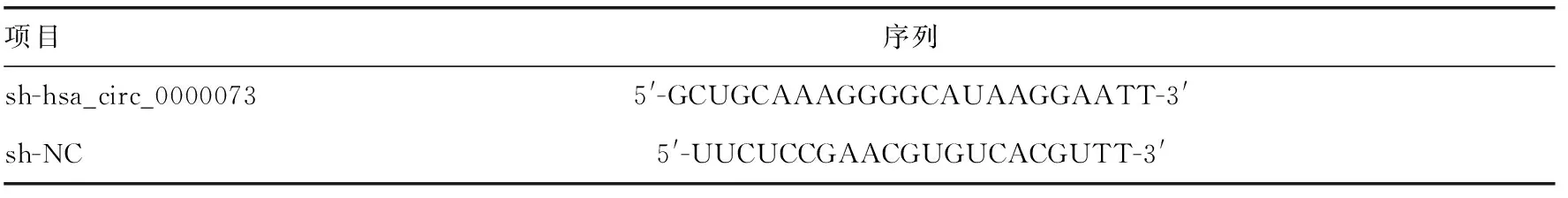
表2 shRNA序列
1.2.4基因表达谱分析和生物信息学分析
为了揭示hsa_circ_0000073在骨肉瘤中的作用及其机制,本研究使用了表达谱芯片对干扰hsa_circ_0000073后的差异基因进行筛选,并将筛选结果通过生物信息学方法进行富集分析。具体方法如下:细胞转染sh-NC或sh-hsa_circ_0000073,使用Trizol试剂提取细胞总RNA。使用GeneChip WT Pico Reagent Kit检测基因表达谱,以FC>1.5为条件筛选差异表达基因。使用GO分析对差异基因进行富集分析,设置条件为:p.adj<0.05和q value<0.2。R语言(3.6.3版本)的“clusterProfiler”包用于数据分析,“ggplot2”包用于数据可视化。
1.2.5油红染色
为了探索hsa_circ_0000073对骨肉瘤细胞脂质代谢的影响,本研究进行了油红实验检测细胞内脂质情况。细胞计数后加入12孔板,适宜条件下生长48 h,各组细胞用4%多聚甲醛固定1 h,磷酸盐缓冲液(PBS)清洗3次后,加入3 mg/mL油红染液于室温下染色30 min,倒置显微镜下观察结果并拍照,异丙醇提取细胞内脂质,酶标仪检测吸光度值。
1.2.6尼罗红荧光染色
由于不同实验方法的灵敏度及特异度不同,为了进一步验证hsa_circ_0000073对骨肉瘤细胞脂质代谢的影响,本研究还使用了尼罗红荧光染色实验对油红染色的实验结果进行验证。各组细胞计数后适宜条件下培养,脂肪固定液固定24 h,1 mg/mL尼罗红染色用PBS 1∶500稀释成工作液,滴加到细胞爬片上,37 ℃下染色30 min,PBS洗涤后,荧光显微镜下观察结果,并测定荧光强度。
1.2.7裸鼠异种移植实验
为了验证hsa_circ_0000073对在体生长的骨肉瘤细胞脂质代谢的影响,本研究使用了BALB/C-nu小鼠侧腋注射2×107个稳定转染的MG-63细胞。适宜条件下饲养5周后,处死小鼠,将瘤体冰冻切片后进行油红和尼罗红染色。
1.3 统计学处理
2 结 果
2.1 hsa_circ_0000073在骨肉瘤组织和癌旁组织的表达情况
hsa_circ_0000073在骨肉瘤组织中的表达水平高于癌旁组织,差异有统计学意义(P<0.05),见图1。
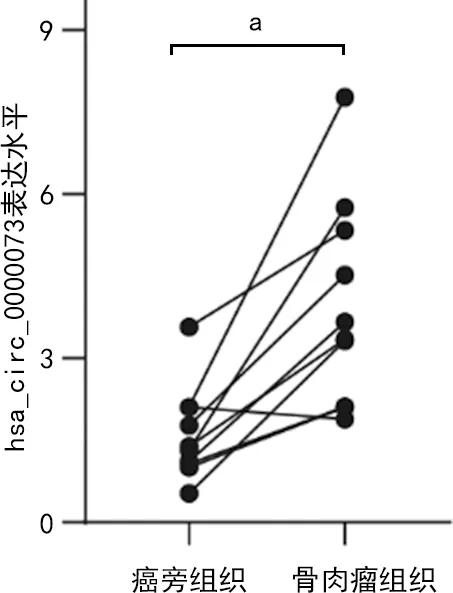
aP<0.05。图1 hsa_circ_0000073在骨肉瘤组织和癌旁组织的表达情况
2.2 细胞培养和稳转细胞株构建情况
通过G418筛选后,对数生长期的大部分细胞在荧光显微镜下呈现绿色荧光。与对照组比较,circ_0000073干扰组hsa_circ_0000073表达水平降低(P<0.05),提示sh-NC和sh-hsa_circ_0000073的稳转细胞株建立成功,可以用于后续实验,见图2~3。
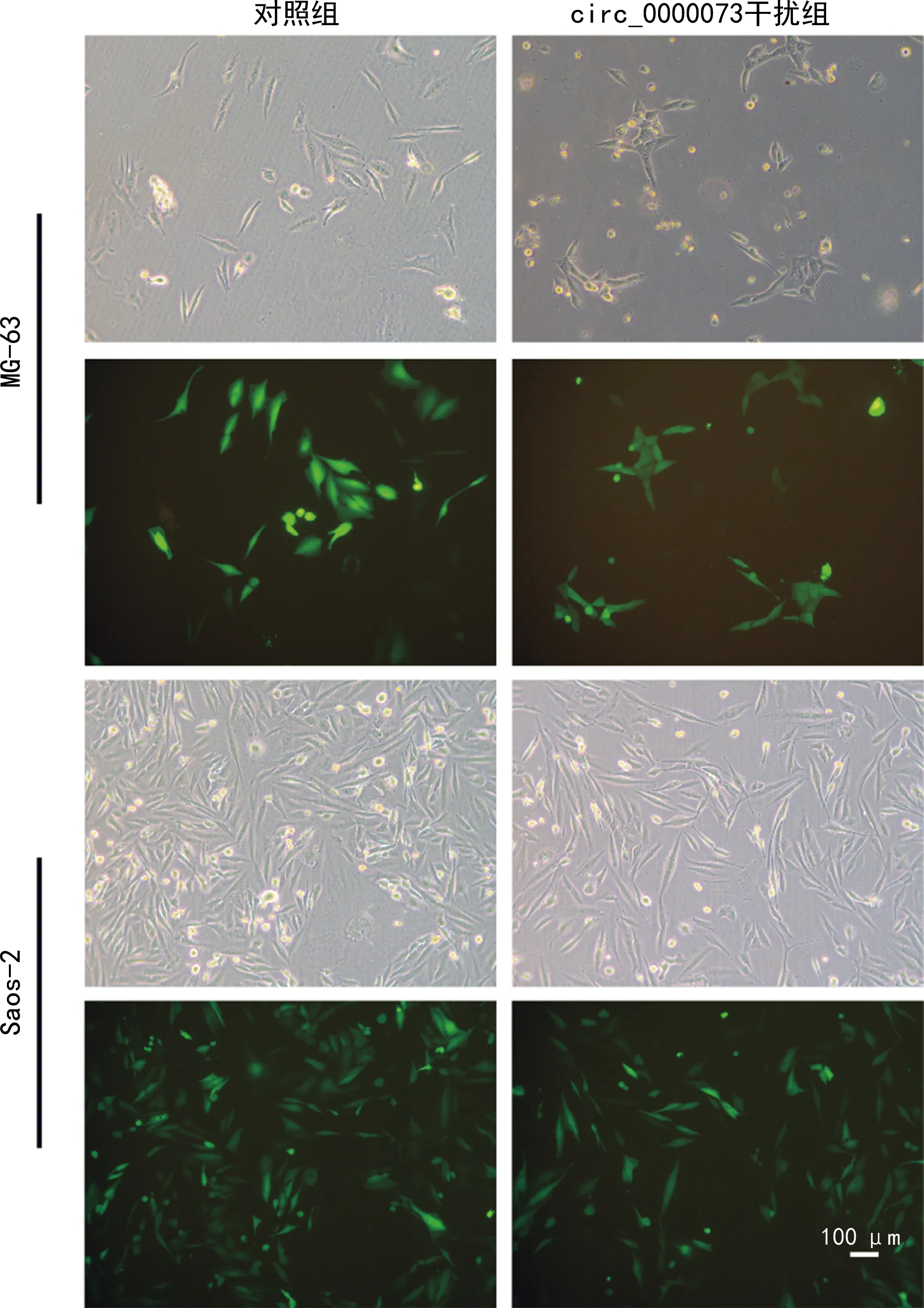
图2 荧光显微镜观察结果
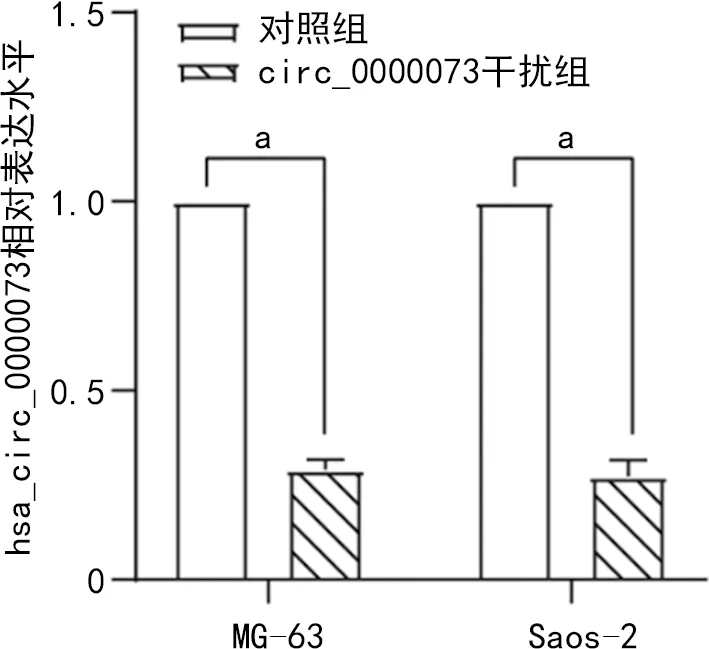
aP<0.05。图3 sh-hsa_circ_0000073相对表达水平
2.3 干扰hsa_circ_0000073后的基因表达谱分析
干扰hsa_circ_0000073后,MG-63细胞和Saos-2细胞中分别有1 838和1 255个下调基因。通过韦恩分析,共筛选出398个共同下调的差异基因。GO分析结果显示这398个差异基因主要富集于有丝分裂核分裂、纺锤体、染色体、着丝粒区。KEGG通路分析发现“代谢通路”是两种细胞干扰hsa_circ_0000073后富集到的主要通路,见图4~5。
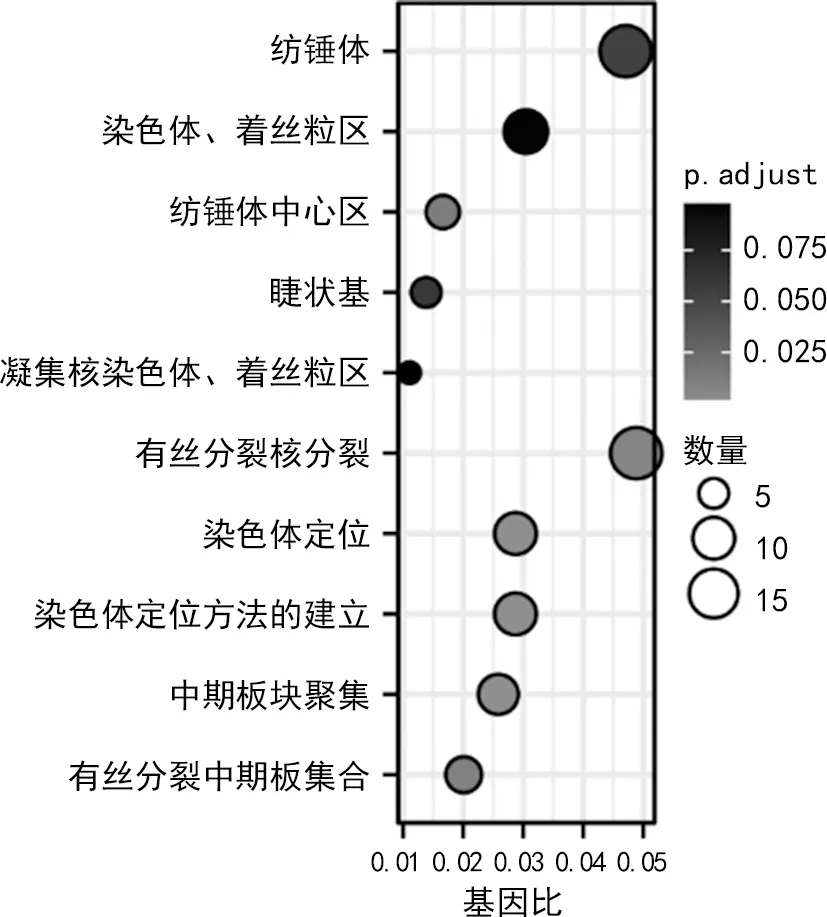
图4 差异基因的 GO富集分析
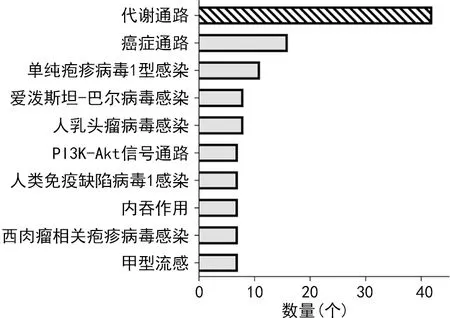
图5 KEGG通路分析
2.4 hsa_circ_0000073可影响骨肉瘤细胞脂质代谢
与对照组比较,circ_0000073干扰组骨肉瘤细胞内脂质减少,吸光度降低,差异有统计学意义(P<0.05),见图6~7。与对照组比较,circ_0000073干扰组骨肉瘤细胞内尼罗红荧光强度减弱,差异有统计学意义(P<0.05),见图8~9。
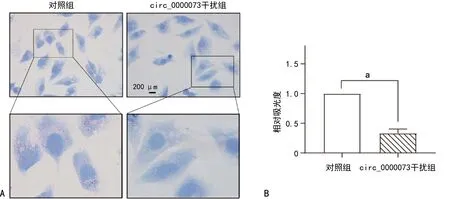
A:两组油红染色图片;B:两组脂质相对水平比较;a:P<0.05。图6 MG-63骨肉瘤细胞油红实验结果

A:两组油红染色图片;B:两组脂质相对水平比较;a:P<0.05。图7 Saos-2骨肉瘤细胞油红实验结果
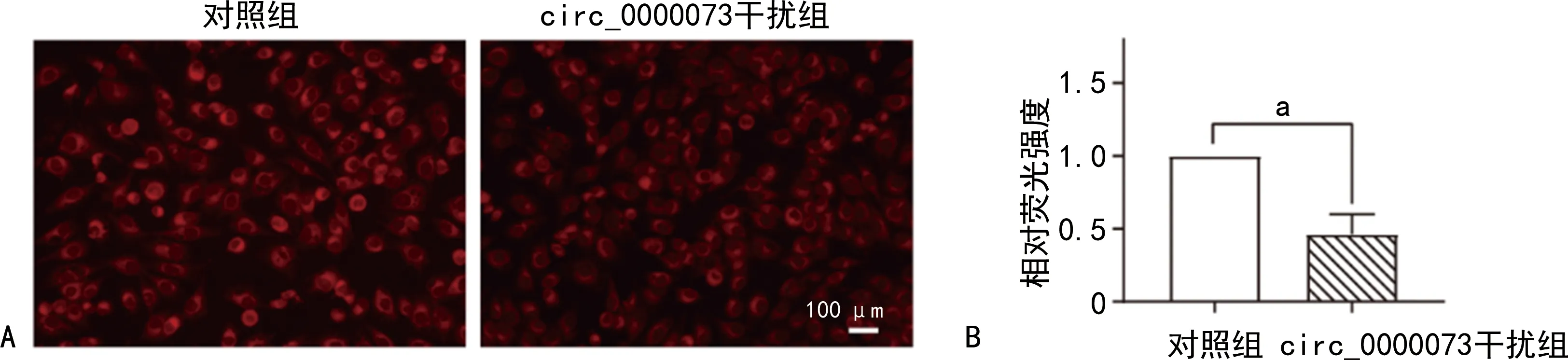
A:两组尼罗红染色图片;B:两组尼罗红荧光相对强度比较;a:P<0.05。图8 MG-63骨肉瘤细胞尼罗红实验结果
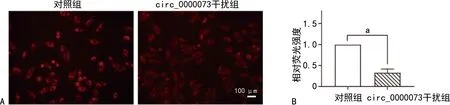
A:两组尼罗红染色图片;B:两组尼罗红荧光相对强度比较;a:P<0.05。图9 Saos-2骨肉瘤细胞尼罗红实验结果
2.5 hsa_circ_0000073可影响裸鼠异种移植瘤中骨肉瘤细胞脂质代谢
裸鼠移植瘤体组织的油红和尼罗红染色结果显示,与对照组比较,circ_0000073干扰组脂质减少,荧光强度减弱,提示干扰hsa_circ_0000073可以降低在体骨肉瘤细胞的脂质代谢,见图10~11。
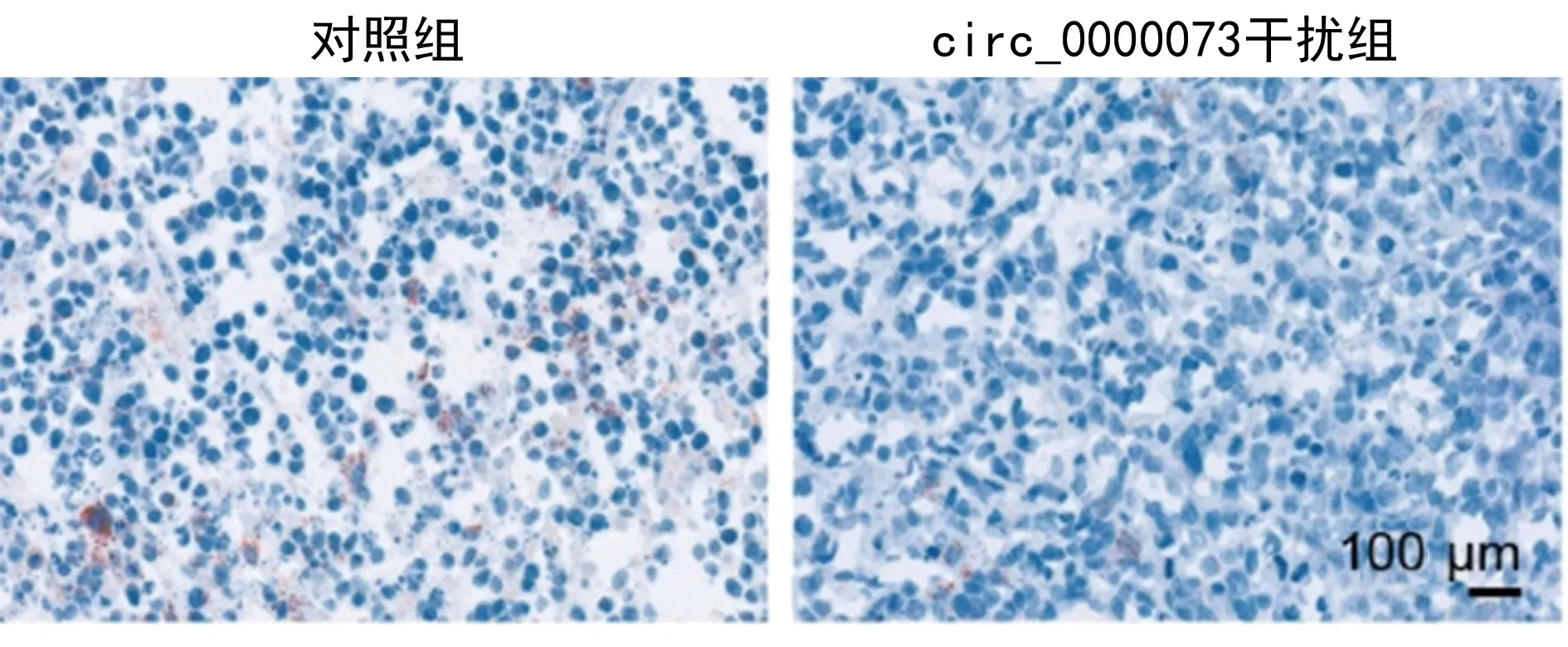
图10 裸鼠异种移植油红实验结果
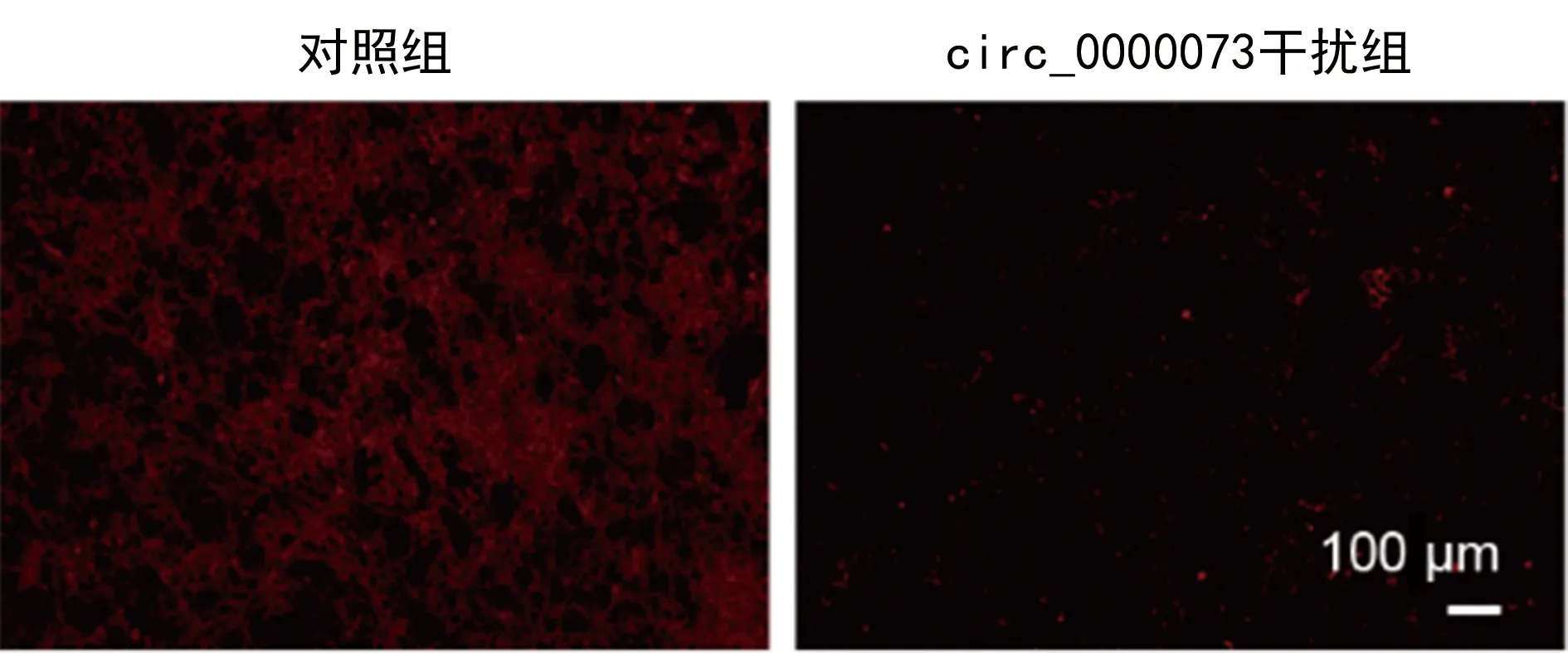
图11 裸鼠异种移植尼罗红实验结果
3 讨 论
最近的研究发现,能量代谢重编程是由基因组不稳定性引起的肿瘤标志[6]。脂质作为重要的信号分子、维持结构完整性和储存能量的细胞成分,经常在癌症状态下重新编程[17]。例如,肿瘤细胞中脂质代谢酶的表达及活性改变,内源性脂肪酸合成激活,脂肪动员异常等,均可导致脂质代谢失调,帮助肿瘤细胞以脂质为原料维持其快速增殖和转移行为,或促进异常的癌细胞-基质细胞通信,触发致癌信号以促进生长,从而导致疾病进展[7-9]。在骨肉瘤中,有研究者以高通量的方式研究了转移性(143B)和非转移性(HOS)骨肉瘤细胞与正常胎儿成骨细胞(FOB)的总体脂质代谢差异,发现许多脂质种类在骨肉瘤的转移中存在较大差异[17]。而另一项研究报道,抑制脂肪酸合酶(FASN)可通过下调HER2/PI3K/AKT信号通路活性影响骨肉瘤细胞转移[18]。因此,靶向脂质代谢等代谢途径可能将有助于发展现有的骨肉瘤治疗策略。
circRNA是一种共价闭合环状结构的非编码RNA。由于缺乏3′端多聚腺苷酸化尾及5′端帽结构,circRNA可以避免外切核酸酶降解,半衰期较长,具有临床应用的潜能[19]。越来越多的circRNA被发现参与肿瘤的脂质代谢。例如,在HepG2细胞培养物和肝组织中,circRNA_0046367表达被发现与甘油三酯水平呈负相关[20]。另一则研究报道发现,circRNA_0057558的表达与前列腺癌患者的甘油三酯水平呈正相关,可能通过调节脂质水平以促进前列腺癌进展[21]。在机制上,circGFRA1被证实可通过ceRNA机制促进GFRA1的表达,从而诱导三阴性乳腺癌细胞中脂质改变[22]。而肺腺癌中高表达的circFARSA也被发现可能通过miR-330-5p和miR-326与FASN相互作用影响肿瘤进展[14]。
本课题组前期研究分析了来自基因表达汇编(GEO)数据库GSE96964 circRNA芯片数据,从中筛选出了hsa_circ_0000073作为目标分子,并证实了其在骨肉瘤细胞系中高表达[16]。该芯片数据是2017年LIU等[23]为了将人骨肉瘤细胞系与人成骨细胞hFOB1.19(对照)中的circRNA表达进行比较分析所获得的circRNA表达谱。自从该数据上传GEO数据库以来,已被多名研究者下载使用,并从中筛选出了多个对骨肉瘤进程具有重要作用的circRNA,为骨肉瘤的诊断和治疗研究提供了帮助[24-25]。
本文在前期研究的基础上收集了10例骨肉瘤患者及其癌旁组织标本,通过qRT-PCR分析,发现hsa_circ_0000073在肿瘤组织中的表达高于癌旁组织,该结果与LI等[26]报道一致。为进一步研究hsa_circ_0000073在骨肉瘤中的作用,本研究使用了Affymetrix基因芯片分析干扰hsa_circ_0000073后的基因表达谱改变。考虑到生物信息学方法对于处理和分析大量信息至关重要,本研究首先将基因芯片获得的差异基因进行了GO分析,结果发现两种细胞的差异基因主要富集于有丝分裂核分裂、纺锤体、染色体、着丝粒区。KEGG通路分析发现“代谢通路”是两种细胞干扰hsa_circ_0000073后富集到的主要通路。提示hsa_circ_0000073的功能可能与细胞的生长和分化有关,尤其与细胞代谢关系密切。随后,通过骨肉瘤细胞和裸鼠异种移植瘤双重模型,证实了hsa_circ_0000073对骨肉瘤细胞脂质代谢的影响,提示hsa_circ_0000073可能通过影响骨肉瘤细胞脂质代谢促进骨肉瘤进展。
综上所述,hsa_circ_0000073在肿瘤组织中的表达高于癌旁组织。通过基因芯片、生物信息学分析,表明hsa_circ_0000073的功能可能与细胞的生长和分化有关,尤其与细胞代谢关系密切。随后的体内外实验进一步证实了干扰hsa_circ_0000073可以影响骨肉瘤细胞的脂质代谢,该发现为骨肉瘤的诊断和治疗提供了新的思路,丰富了骨肉瘤发病机制的理论依据。然而,尽管有初步的证据表明hsa_circ_0000073在调节骨肉瘤脂质代谢中具有重要作用,但未来仍需纳入更多的临床相关性研究,同时还需要深入探讨hsa_circ_0000073影响骨肉瘤脂质代谢的分子机制,以期为相应分子的转化应用奠定理论基础。
