高山湖泊生态系统气候响应研究进展
2023-03-19昝婵娟
韩 飞, 刘 铁, 黄 粤, 昝婵娟
(1.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,新疆 乌鲁木齐 830011;2.新疆维吾尔自治区遥感与地理信息系统应用重点实验室,新疆 乌鲁木齐 830011;3.中国科学院大学,北京 100049)
由人类活动和地球自然的内部过程引起的地表环境及大气组成变化,直接和间接地影响地球各个圈层[1-2]。高山湖泊作为连接山区大气圈、冰冻圈、水圈以及生物圈的关键枢纽,生态环境相对原始,对外界干扰的缓冲能力和自净能力较差,是记录和评估气候变化的理想生态系统[3]。随着古湖沼学手段以及原位监测、遥感等技术的不断完善与革新,淡水生态系统气候响应研究逐渐向高山湖泊延伸并取得重要突破。气候变化通过改变湖面条件(如水面温度、辐射通量和冰层覆盖),湖泊外源物质负荷(如营养盐和持久性有机污染物)以及极端气候水文事件(如干旱、洪水),在一定程度上影响了高山湖泊水文生态过程和生物地球化学循环规律,由此引起的生态效应可以是物理性的(如气候变暖导致湖泊增温)[4]、化学性的(如降水增加导致湖泊营养盐及污染物负荷增加)[5]或生物性的(如气候变暖导致变温水生生物体型朝小型化演变)[6]。一旦外界条件逐渐过渡或跃迁至生态环境阈值,将触发高山湖泊生态响应的级联效应,增加其结构与功能丧失或崩溃的风险,因此阐明高山湖泊生态系统的气候和环境变化响应过程及机制有利于了解区域尺度或全球尺度的历史气候演变,模拟和评估不同气候和环境因子下淡水生态系统归趋。为集中研究目标,本文将围绕气候变暖、太阳辐射及大气沉降3 个方面,对近年来高山湖泊生态系统变化特征及原因进行综述,以期为高山湖沼学和水文学等相关学科的发展提供参考。
1 气候变化与高山湖泊生态系统基本概况
政府间气候变化委员(IPCC)第六次评估报告[7]基于多圈层变量的综合评估明确指出,由人类活动产生的CO2等温室气体导致大气、海洋和陆地变暖是毋庸置疑的(高信度),2010—2019 年全球平均温度比1850—1990 年平均温度提高了0.99 ℃。在气候变暖的背景下,全球年平均降水量及天气系统内水汽含量增加(高信度),极端湿润和极端干旱事件频率以及强度呈上升趋势(高信度)。基于CMIP6大气环流模式,预计2081—2100年全球年平均降水量相对于1995—2014 年将增加0.9%~12.9%(高排放情景SSP5-8)[8]。在气候系统的长期演化过程中,太阳辐射为地气系统提供最基本的能量来源并主导了天气气候过程和结果。地面辐射观测资料显示20 世纪末全球大部分区域太阳辐射量呈上升趋势,即进入全球“变亮”阶段[9]。快速且广泛的气候变化正迫使全球生态系统发生改变,作为淡水生态系统的载体,与气候变化相关的信号在湖泊生态系统中高度可见且易于测量和留存,是记录和评估气候变化的重要一环。
山地是陆地表层复杂的生态系统,储量巨大的山地冰冻圈孕育出世界上众多河流与湖泊,是下游和中、低纬度整个流域水资源“控制塔”。在气候信息传递到众多山地子生态系统中,高山湖泊生态系统趋于单一、脆弱,环境承载力低,对区域或全球尺度气候与环境变化极为敏感,被看作研究气候变化、区域生态和湖泊现代过程的理想生态系统[3]。受山地寒冷气候影响,高山湖泊一般表现为冷水湖泊,水温大部分时间在4 ℃以下,全年湖泊结冰期长达5~9个月,水力停留时间长,湖水外泄主要受蒸发和渗流影响,水量补给则主要依赖邻近集水区山地冰川和积雪融水,以及降水径流。由于高山湖泊集水区土壤发育度和植被覆盖度较差,导致外源有色溶解有机质输入较少,水体漫衰减系数较低,进而具备较高的辐射透明性[10]。同时高山湖泊营养物质含量普遍较低,而长时间的冰雪覆盖又缩短了间冰生长期,导致湖泊生产力和生物多样性发展受限。另一方面,高山湖泊通常地处偏远,人口相对稀少,淡化了局地人类活动干扰,且与其他淡水生态系统相比,高山湖泊的沉积物作为气候变化的代用记录具有连续、分辨率高、保真性强的优势,进而能够更加准确和直观监测和评估湖泊生态系统演变以及气候响应过程[11]。
2 全球气候变暖
2.1 对湖泊温度的影响
气候变暖在高海拔山区存在明显的放大效应,在冰雪反照率反馈、云辐射反馈、水汽反馈以及气溶胶作用下,高海拔山区已经成为除两极外变暖最显著的生态系统[12]。自1990s 中期以来,科罗拉多落基山脉气温以0.5~1.0 ℃·(10a)-1的速率增加,成为北美近30 a增温最剧烈的区域之一[13]。1959—2008年阿尔卑斯山脉夏季升温速率为0.46 ℃·(10a)-1,冬季增温速率为0.40 ℃·(10a)-1,平均年增温速率高于同期全球陆地增温平均值[14]。在海拔依赖型增暖作用下,山区气候变暖势必起高山湖泊快速升温。首先山区增温效应扩大了下垫面与湖泊之间的热力差异,近地面气温升高,上层空气通过湖气界面进行热交换,短波辐射及感热交换直接作用于上层水柱,加速湖泊表层升温。其次气候变暖使湖泊完全解冻期提前,导致湖泊增温期提前并延长。表层湖水升温后密度增加,水团下沉与下层湖水产生对流和紊动混合,该过程不断循环最终使湖泊整体升温。就湖泊增温速率而言,在气温升高、云层覆盖减少以及夏季长波辐射增强的共同作用下,季节性结冰型湖泊的升温速率最快,甚至超过大气增暖速率[15]。尽管大尺度范围内的气候变化已经强迫高山湖泊热量收支发生改变,但湖泊温度往往还受局域因素的调节,如在大气比湿较低的高海拔区域,向下长波辐射对年代际尺度的山区大气增湿变化更为敏感,在水汽反馈作用下使高山湖泊增温趋快趋强[16]。此外,高山湖泊特有的高透光度及低反射率加大了太阳辐射的水体穿透深度并从中吸收更多的热量,加快了湖泊的升温速率[17]。
2.2 对热力特征的影响
湖泊水体热力特征是影响湖泊生态系统的结构与功能的重要因素,受气候变暖的影响,高山湖泊春季热力分层开始日期提前,秋季热力分层结束期延后,进而延长湖泊热力分层时长[18]。过去30 a内奥地利山湖Mondsee 湖春季热力分层开始时间随年份推移明显提前,热力分层周期平均延长26 d[19]。值得注意的是,气候变暖会使部分不曾出现热力分层的浅水湖泊出现季节性分层,增加热力分层发生频率,但热力分层起止时间并未发生显著变化[20]。热力分层结构对气候变暖的响应主要表现为温跃层深度下降。基于美国Tahoe 湖水温垂直剖面观测显示,湖泊1970—2002年间温跃层平均深度下降超过10 m,相关性分析表明年均温持续升高及向下长波辐射增加是导致该湖温跃层的下降的主要因素[21]。
气候变暖已经在大范围内引起湖泊升温和热力分层增强,进而影响湖泊溶解氧溶解度及垂直分布。在0~40 ℃范围内,水温和溶解氧呈负相关,水温每升高1 ℃,水体氧溶解度将减少0.1~0.4 mg·L-1,高山湖泊初始水温偏低,升温引起的氧溶解度下降更为剧烈[18]。其次,热力分层的加强扩大了湖泊变温层与均温层之间的温差,限制了上下层湖水交换,使表层水体溶解氧很难向湖泊底层渗透,而湖泊底层沉积物中的大量有机质进一步加快溶解氧消耗,导致湖泊底层出现缺氧和厌氧环境[22-23]。而相比长期缓慢的气温上升,极端高温事件对溶解氧造成的影响更加显著,长时间的极端高温天气使得湖泊氧跃层深度显著降低,进一步加重湖泊底部缺氧现象。2003 年欧洲极端高温事件导致瑞士冰蚀湖Zurich 湖表层与底层温差骤升,相比1956—2002年平均水温高出2.2 ℃,这种极端的温度垂直梯度使Zurich 湖底层溶解氧亏损加剧,甚至低于该湖营养化水平最高时的溶解氧浓度[23]。
2.3 对水生生物的影响
高山湖泊生态环境与气温密切相关,由气候变暖引起高山湖泊理化特征的变化将直接或间接影响生态系统初级生产、物种组成以及群落结构。一般来说,由气候变暖直接引起的水温升高、封冻期缩短以及热力分层周期延长均有利于提前水生植物春季物候并延长生长季节[24]。同时气候变暖引起的表层沉积物脱氧会促进沉积物中营养盐的释放效率,尤其是磷盐的释放,有利于提高水体的营养盐浓度[25]。一旦增暖幅度超过湖泊生态系统的阈值,将放松或解除低温对浮游植物间冰生长周期和营养盐摄取的限制,从而使水生植物群落朝着藻类占优的方向发展,加速藻类湖泊的形成[26]。基于Saanajärvi 湖泊沉积物的多代用记录表明,自小冰河期以来气候变暖增强了湖泊热力分层,为较轻的浮游藻类提供了有利的光照和营养盐环境,由此促进了沉积物中有机质浓度和藻类色素浓度的增加,并使湖泊整体初级生产从底栖生物向浮游生物转变[27]。
伴随着初级生产者生物量和生产力的变化,高营养级物种组成及结构在各营养级间的相互作用下发生改变。水温升高使消费者的新陈代谢需求以及食物链的传递效率增强,响应程度通常取决于食物链的长度。在只有浮游动物和浮游植物参与营养传递的湖泊中,水温升高使浮游动物发展更具优势,浮游动物与浮游植物比值升高;当食物链中包含浮游植物、浮游动物和鱼类时,水温升高会增加浮游动物被鱼类捕食的压力,进而降低浮游动物与浮游植物比值[28]。然而对于已经适应高山湖泊边际水质和寒冷气候的生物群,气候变暖可能会缩小其分布范围,不利于物种生存以及生物多样性发展,而一些体型较小,适应能力较强水生生物(如浮游动物)的竞争优势将更加明显[29]。这种由水温升高而引起的水生生物个体小型化是暨“物种朝高海拔和纬度迁移”和“生命周期的季节性周转”之后,湖泊对全球变暖的第3个普遍存在的生态响应。
3 太阳辐射增强
太阳辐射作为地球表层生命活动的“源动力”,在气候变化过程中,辐射强迫因子通过反射、吸收以及散射作用引起太阳辐射变化,进而对湖泊的表面温度、水文循环、初级生产和生物过程产生多方面的影响[30]。近年来人类活动排放的大量臭氧消耗物质导致大气平流层臭氧明显减少,太阳辐射强度不断增加,尤其紫外波段(280~400 nm)增加显著[31]。研究表明,大气臭氧浓度每减少1%,紫外辐射(Ultraviolet radiation,UVR)强度将增加1.5%~2.0%[32]。此外,UVR 强度还与海拔高度密切相关,在阿尔卑斯山,海拔每升高1000 m,照射到地表的紫外线A(UVA)、紫外线B(UV-B)强度分别增加11%和19%[10],因此高山湖泊中的生物群落更易暴露在高强度UVR环境中。尽管紫外波段辐射能仅占太阳总辐射3%~5%,但UVR作为湖泊生态系统所能接收到光化学活性最强的太阳光波,能够有效地被生物分子(如核酸、蛋白质、脂类)吸收,产生活性氧,致使基因受损,极大地干扰了有机体的正常生长和繁殖[33]。由于高山湖泊集水区植被稀疏,土壤发育不良,导致湖泊有色可溶性有机物、悬浮颗粒浓度偏低,无法有效抑制UVR 在水中的穿透,因此相较于低海拔平原湖泊,高山湖泊生物群落及生态系统更易受UVR辐照的影响。
3.1 对浮游植物的影响
浮游植物是湖泊生态系统初级生产力的主要贡献者,是食物网的基础,且对UVR 相当敏感。研究表明,UVR 增强对水生植物的伤害是多方面的,主要表现为损伤DNA、破坏色素细胞、降低光合效率、抑制生长,最终导致细胞凋亡[33]。Williamson等[34]对美国山湖Beartooth 湖藻类生长监测实验表明,UV-B增强会对藻类光合色素产生强烈的漂白作用,降低二磷酸核酮糖羧化酶活性,破坏藻类光反应中的PS-II 系统,进而抑制浮游藻类对CO2的吸收。为最大程度降低UVR 损伤,浮游植物会选择避开上层UVR 而迁移到深水弱光区,例如在高山湖泊中常见的深层最大值叶绿素分布现象(DCM),除下潜获取营养盐外,浮游植物躲避UVR 而进行的垂直迁移也是主导因素之一[35-36]。此外,浮游植物体内光保护化合物类菌胞素氨基酸(Mycosporine-like amino acids,MAAs)和伪枝藻素能够有效地吸收UVR,阻断能量传递给敏感的生物分子,进而干扰细胞内活性氧的合成[36]。这类光保护化合物浓度往往会随湖泊透光度和湖泊海拔高度的增加而升高[37-38],从而为暴露在高UVR 环境中浮游植物提供有效的UVR屏障。
UVR 对浮游植物的影响程度要考虑与其他环境因子之间的抵消或叠加作用,在内达华山脉La Caldera 湖控制实验表明,添加适量磷盐能够使藻类更快修复UVR 损伤,有助于提高其生长速率[39]。而与之相反,有研究表明磷盐富集下反而会加剧UVR对浮游植物的伤害,导致浮游植物丰度下降[40]。对此,Korbee 等[41]认为营养盐对藻类UVR 响应的调节主要与藻类种类以及营养盐补给时长和浓度有关,长期且浓度适宜的营养盐补给有利于修复UVR损伤。同时,浮游植物的UVR 敏感度还与水温密切相关,基于原位藻类生长培养实验表明,低温会抑制细胞内MAAs合成,降低浮游植物摄取营养盐的效率,限制生物对光保护机制的能量和资源分配,进而对浮游植物生长会产生抑制作用[42]。
3.2 对水生动物的影响
UVR 增强对高山湖泊水生动物的影响是多方面。在分子及细胞水平上,DNA 在UV-B 诱导作用下会生成嘧啶二聚体、嘧啶酮光产物等光反应产物,扭曲DNA 双螺旋结构,进而干扰DNA 转录、翻译等过程[43-44]。在个体水平上,由于胚胎和幼体发育阶段基因表达活跃,UVR 对DNA 的损伤趋多趋强,由此UVR 导致突变、致畸、致癌效应增强,极大地降低了有机体的存活率[45]。Tucker等[46]在美国山湖Tahoe 湖进行的原位孵化实验表明,持续4 d 暴露在高UV-B 剂量(22.65 kJ·m-2)下,蓝腮翻车鱼幼鱼死亡率高达90%。随着UVR 对水生动物个体的影响加深,将间接导致种群结构发生改变。如当UVR强度达到一定阈值时,桡足类Tigriopus californicus性别比例将发生改变,导致种群的净生殖率和内禀增长率降低,进而使种群结构和特征参数发生变化[30]。
高山湖泊水生动物为避免UVR 对有机体的损伤已建立较为完善的紫外线防御机制。当环境UVR 增强时,水生动物可以向深水、黑暗处移动以躲避上层UVR,尤其在缺乏光保护的湖泊,垂直迁移深度会随辐射剂量的升高而增加[47]。当迁移能力较弱或紫外辐射空间范围较大而使迁移策略不能奏效时,动物体内的光保护化合物如浮游动物和水生脊椎动物皮肤中常见黑色素开始发挥作用,黑色素可以有效吸收紫外波段所有波长的光,进而起到屏蔽UVR 的作用[48]。此外,水生动物可通过共生或摄食水生植物积累MAAs,如桡足类体内MMAs含量与摄食藻类体内MAAs 含量密切相关,这些物质转移至浮游动物体内用于减轻UVR 对机体的损伤[49]。当UVR 突破光保护物质防线进入细胞后,将激活有机体的抗氧化防御体系用于淬灭活性氧,如高山湖泊浮游动物体内常见的类胡萝卜素作为抗氧化剂可以有效清除活性氧,防止细胞膜和脂质过氧化和氧化损伤[50]。
3.3 水下辐照度对气候变化的响应
气候变化对于高山湖泊水下辐照度的影响是多方面的,一方面起到增强作用,全球变暖导致湖泊冰雪覆盖层快速融化,在典型排放浓度路径RCP6.0 下,预计最迟到2100 年全球约1/4 的季节性冰雪覆盖湖泊冰封期永久消失[51]。作为湖泊重要的UVR 屏蔽层,湖泊冰雪覆盖的减少和消失将大幅降低湖泊对UVR 的吸收和散射,使水下UVR 暴露水平显著增强。实验证明,仅去除2 cm 厚度的冰雪覆盖层可使水下UVR 透过率提高2 倍左右,且波长越短,效果越明显[52]。另一方面是抑制作用,气候变暖将推动山区树线向更高海拔移动,有利于提高集水区土壤发育度和植被覆盖度,进而增加湖泊外源有色可溶性有机物(Colored dissolved organic matter,CDOM)输入。作为高山湖泊最重要的光保护化合物,CDOM 可以有效地吸收UVR,其浓度和吸收系数在很大程度上决定UVR 尤其是UV-B 光学透明性[53]。由气候变化引起的水温升高、湖冰覆盖时长减少、CDOM 负荷增加直接和间接的影响高山湖泊生态系统对UVR 的响应,但由于多环境因子的净效应难以评估,其净效应的大小和方向应考虑每种环境因子强度阈值、物种特定的耐受性以及不同种群的权衡机制。
4 大气沉降通量增加
大气沉降是指大气气溶胶及其所携带的物质向陆面和水体沉降的过程,通常分为湿沉降和干沉降两种类型。在山区中,湿润气流受山脉高耸地形阻挡被迫抬升使大量水汽凝结而降水,因此在达最大降水高度前,降水量和降水强度与海拔成正相关[54]。同时,全球陆地平均降水增加加速了大气物质的跨生态系统转移,尽管高山湖泊远离人类活动的直接干扰,但受全球和区域性降水增加及大气污染加剧的影响,大气沉降已成为高山湖泊外源物质补给重要途径之一(图1)。部分湖泊经由水气界面受纳的大气沉降物质总量几乎相当于由河流输送入湖量,而由其引起的生态效应逐渐成为高山湖泊不断增强的环境压力[55-56]。一方面,高山湖泊集水区相对贫瘠的土壤和稀疏的植被、较低的湖水温度和营养盐浓度以及简单的生态系统结构限制了高山湖泊处理过量养分及污染物输入的能力,面对大气沉降引起物质迁移难以保持生态系统稳定性[57]。另一方面,相比低地平原湖泊,高山湖泊淡化了点源污染所产生的生态效应的干扰,且沉积物能够完整准确地保存大气沉降信息,有助于缕清全球各大区大气沉降过程,预测未来大气物质排放及迁移不断增强情境下湖泊生态系统的可能变化趋势。
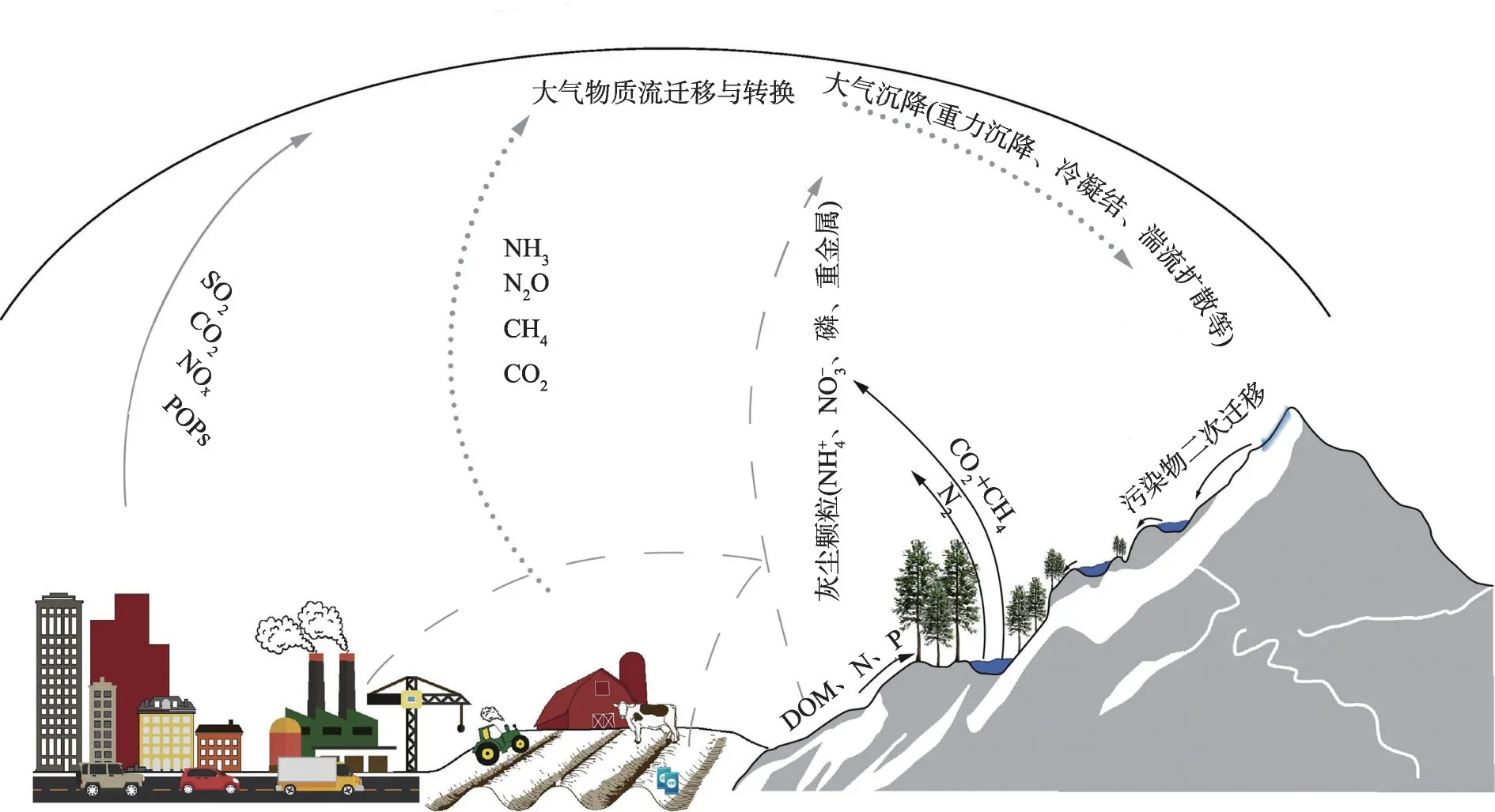
图1 高山湖泊大气沉降过程(在参考文献[3]基础上改进)Fig.1 Atmospheric deposition process of alpine lakes(modified from references[3])
4.1 对营养盐污染的影响
受人类活动影响,全球大气组份和关键生源要素的全球流动性已经发生显著改变,大量氮磷化合物及颗粒物经大气传输进入高山湖泊,成为维持湖泊初级生产力场的重要营养元素[58]。沉降物中的NH+4、NO-3和PO-4等无机盐能够优先被浮游植物和大型水生植物利用,转化为自身生物量。沉积物中的有机氮和有机磷在一定条件下也可以支持初级生产力的增长。研究表明降水中氨基酸、尿素等可溶性有机氮可被甲藻和硅藻直接利用[59];沉降有机磷中磷酸酯(含有C-O-P 键)和磷酸酯(含有C-P 键)则需要通过特定酶水解或微生物分解后,转化为无机磷供浮游植物利用[60]。随着降水以及沙尘天气发生频率的增加,大气沉降对高山湖泊氮、磷污染贡献激增。自小冰河期以来,大气氮养分补给使我国西南地区高山湖泊生态系统生产力大幅提高且沉降速率已经接近湖泊生态系统临界载荷值[61]。近40 a 内美国风河山脉沙尘天气频发,导致沉降在湖泊中的磷盐含量增加了2~3 倍,并引发湖泊浮游藻类的大量繁殖[62]。同时由于大气污染程度及沉降形式的影响,各高山湖泊营养盐浓度和沉降比例不尽相同,而由此可能引发的营养盐限制模式改变将进一步驱动浮游植物群落结构定向改变。Sickman 等[63]对内达华山脉Emerald 湖磷盐溯源结果表明,大气沉降是造成该湖磷盐负荷增加的主要因素,大量磷盐蓄积使湖泊浮游植物丰度从磷限制逐渐向氮限制转变。基于美国洛基山脉Beartooth 湖沉积硅藻记录表明,20 世纪大型降水发生率增加直接提高了大气氮沉降速率,使湖中巴豆叶脆杆藻和广源小环藻比例快速上升,促使嗜氮藻种成为该湖优势物种[64]。
综上所述,由大气沉降输入的营养盐总量已不容忽视,由于缺乏营养缓冲能力,即使少量的营养物质输入即可对高山湖泊浮游植物的生长产生强烈的“施肥效应”,解除生态系统中的养分限制,促进以浮游植物丰度为代表的初级生产力的增长。尤其对一些水容量较小,水力停留时间较长的高山湖泊而言,持续的大气沉降将导致营养盐富集,在气候增暖协同作用下,会促进更适应较高温度环境的蓝藻细菌等有害藻类繁殖,进而加快藻型湖泊形成。
4.2 对有机污染的影响
持久性有机污染物(Persistent organic pollutants,POPs)是一类具有长期残留性、生物蓄积性、高毒性和半挥发性特点的污染物。在“全球分馏效应”以及“冷凝结效应”下,POPs 能够优先在两极和高海拔山区富集。高海拔山区寒冷,湿润和多风的气候有利POPs向山区迁移并凝结,且高海拔山区距离污染源相对较近,能够捕获中短程范围内的污染物,并通过大气沉降进入高山湖泊,成为POPs 在生态圈传递的一个重要的“汇”。POPs 进入湖泊后能够在水柱、悬浮物以及沉积物之间迁移和转化,并通过表面渗透或捕食等过程为有机体吸收[65]。欧盟AL:PE项目对欧洲高山湖泊有机污染监测结果表明,湖泊沉积物和鱼类体内含有多环芳烃、有机氯农药、溴代阻燃剂醚等多种典型POPs,且浓度随湖泊海拔升高而增加[66-67]。Cheng 等[68]运用沉积学以及地球化学重建了青藏高原3个偏远山湖沉积物中POPs历史变化趋势,结果显示湖泊中的滴滴涕浓度自20 世纪80 年代急剧升高,与中国和印度历史使用农药的趋势相符合,间接反应了环境介质中POPs浓度水平与该区域POPs使用种类和强度有关。
高山湖泊所处的气候条件(如温度范围、沉降形式、气流运动方式等)以及湖泊自身参数差异导致不同高山湖泊POPs 污染种类和浓度相差很大。在温度较高的热带高山地区,它对分子量较大、相对难挥发(如多氯联苯)的POPs 捕获效率要高于温带高山。区域大气沉降形式及沉降通量的不同将导致POPs 浓度和单体特征有所差异[69]。降雪和降雨有利于捕获水溶性大和挥发性低(如六氯环己烷)的POPs,且湿沉降的POPs 富集效率相比干沉降也要更高。除高山区域气候条件影响外,各湖泊的水力停留时长、水域连通性以及食物链长短等自身特点也会对沉降入湖污染物的迁移与转化产生影响。如长时间的水力停留将有助于污染物的释放进而在沉积物中大量留存,而水位较浅的湖泊受风浪影响会扰动表层沉积物后并通过再悬浮重新进入水体,进而造成二次污染[70]。尽管高山湖泊POPs污染已成不争的事实,但受偏远地区采样以及POPs的源解析技术的限制,高山湖泊的POPs污染研究相对较少,而随着面源污染的不断增多,针对高山湖泊POPs 的采样监测、时空分布规律分析、污染源追踪及模型预测等相关研究应尽快提上议事日程。
5 结论与展望
高山湖泊是山地系统中的重要自然地理单元,由于自身敏感性和脆弱性,其生态过程受到气候变化深刻且复杂的影响。相较于低海拔平原地区,海拔依赖性增暖使山区气温变化剧烈,增暖速率加快。在持续增暖的影响下,高山湖泊表现出明显的增温趋势,热力分层周期提前并延长,溶解氧浓度下降,相伴随的是间冰生长期和初级生产增加,水生植物群落朝着藻类占优的方向发展。高强度紫外辐射触发了高山湖泊水生生物的级联效应,建立了从个体水平到细胞、分子等不同层次的紫外线防御机制,而由气候变暖以及降水模式改变引发的外源CDOM 输入及浮游藻类增殖有助于提高湖泊不透光度进而减轻紫外辐射伤害。受山区降水模式改变的影响,通过大气沉降向高山湖泊的物质转移在提高了高山湖泊外源营养盐负荷,放松了生态系统的养分限制。而大气持久性污染物在冷凝结以分馏效应使高山湖泊POPs富集效应更加突出,成为了POPs传递中的一个重要汇区,严重威胁湖泊生态安全。
在气候变化加剧以及人类活动逐渐向山区延伸的背景下,处于低生态阈值位的高山湖泊正发生深刻的改变,其生态系统完整性和稳定性将面临着严重的威胁。鉴于复杂地形且气象数据稀缺,针对高海拔地区气候及湖泊水文的长期观测难以展开,限制了对高山湖泊生态环境的观测和分析,各气候因子变化下的湖泊生态响应研究也较为匮乏。因此可利用多种湖泊沉积记录来重现历史湖泊生态系统及气候变化。同时完善对高山湖泊水文、水质、生物数据采集和气候数据整合,以加强对气候变化下高山湖泊生态环境响应认知,旨在减轻气候变化对高山湖泊的不利影响。
