安罗替尼联合经导管动脉化疗栓塞术治疗晚期原发性肝癌的临床疗效
2023-03-17刘琳张凯周丽娟
刘琳,张凯,周丽娟
1药学部,2转化医学中心,郑州大学附属郑州中心医院,郑州 450007
原发性肝癌(primary hepatic carcinoma,PHC)是全球四大恶性肿瘤之一,位居癌症死因第2位,严重威胁了人类的生命健康[1]。PHC起病隐匿,约有70%~85%的患者发现时已是晚期,错失了最佳的手术根治时间[2]。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)可有效地阻断肿瘤血供,促进肿瘤细胞凋亡,已成为晚期PHC患者的首选局部治疗手段。然而,TACE术后残存的肿瘤组织可生成新生血管,可造成患者术后复发及转移[3]。安罗替尼作为我国自主研发的新型小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可对血管内皮生长因子受体、纤维母细胞生长因子受体等多靶点产生抑制活性,进而抑制肿瘤血管生成,发挥抗肿瘤作用[4]。相关研究发现[5],安罗替尼可直接抑制肝细胞癌的进展,且可抑制肝内胆管癌细胞的生长。基于此,本研究通过与单纯TACE进行比较,探讨安罗替尼联合TACE治疗晚期PHC患者的临床疗效和安全性,以期为临床治疗晚期PHC提供参考依据。现报道如下。
1 资料与方法
1.1 一般资料
本研究为前瞻性随机对照研究。选取2020年1月~2022年1月某院收治的80例晚期PHC患者作为研究对象,采用随机数字表法分为对照组和联合组,每组40例。对照组:男性34例,女性6例;年龄35~69岁,平均年龄(54.12±8.95)岁。联合组:男性32例,女性8例;年龄36~67岁,平均年龄(54.12±8.95)岁。两组患者一般资料比较无统计学差异(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有患者均知情并签署知情同意书。
纳入标准:①参照《原发性肝癌诊疗规范》(2019年版)[6]确诊为PHC者。②巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期为B/C期者。③肝功能Child-Pugh分级为A/B级者。④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分者。⑤预计生存期≥3个月者。⑥年龄≥18岁者。
排除标准:①合并重要脏器(如心、肺、肾)功能不全者。②合并其他类型恶性肿瘤者。③严重凝血功能障碍者。④存在化疗禁忌者。⑤联合使用其他抗肿瘤药物者。⑥临床资料缺失者。
1.2 研究方法
对照组:单纯TACE治疗,采用Seldinger技术,予以股动脉穿刺插管后选择性肝动脉造影,将注射用盐酸表柔比星[辉瑞制药(无锡)有限公司,国药准字H20000496,规格10mg]10mg、注射用奥沙利铂(江苏恒瑞医药股份有限公司,国药准字H20000337,规格50mg)50mg、碘化油注射液(上海旭东海普药业有限公司,国药准字H31021603,规格10ml)6ml充分乳化得到混合乳剂,经微导管由肿瘤供血动脉注入肿瘤病灶内,并予以明胶海绵进行血管栓塞。联合组:TACE基础上于术后第4天起口服盐酸安罗替尼胶囊[正大天晴药业集团股份有限公司,国药准字H20180004,规格按安罗替尼(C23H22FN3O3)计:12mg]12mg/次,qd,连续用药14天,再间隔7天。21天为1个疗程,治疗1个疗程。
1.3 观察指标
(1)生活质量。于治疗前和TACE术后1个月,以Karnofsky评分评估患者的生活质量,评分越高说明患者生活质量越好[7]。(2)血清甲胎蛋白(alpha-fetoprotein,AFP)及肿瘤生长相关因子。于治疗前和TACE术后1个月,采集患者空腹外周静脉血5ml,采用Eppendorf 5417R离心机(德国Eppendorf公司,r=7.5cm),3500r/min 4℃离心10min。取上清,采用BKI1100全自动免疫化学发光检测仪(济南爱来宝仪器设备有限公司)检测血清AFP水平,并采用酶联免疫吸附法检测基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、血管内皮生长因子(vascular endothelial growth factor,VEGF)及胰岛素样生长因子-2(insulin-like growth factor-2,IGF-2)水平。试剂盒购自上海沪尚生物科技有限公司。(3)临床疗效。根据实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)1.1[8]对TACE术后1个月的临床疗效进行评价。①完全缓解(complete response,CR):目标病灶消失。②部分缓解(partial response,PR):目标病灶肿瘤最大径退缩≥30%。③疾病进展(progressive disease,PD):目标病灶肿瘤最大径增大≥20%或有新病灶出现。④疾病稳定(stable disease,SD):不符合CR、PR或PD。疾病控制率(disease control rate,DCR)%=(CR+PR+SD)病例数/每组病例数×100%。(4)不良反应发生情况。根据常见不良事件评价标准(common terminology criteria adverse events,CTCAE)4.0[9]进行不良反应评价,分为0~4级,其中1~2级代表轻微不良反应,3~4级代表严重不良反应。
1.4 统计学方法
采用SPSS 28.0软件进行数据统计学分析。计量资料以±s表示,采用t检验;计数资料以n(%)表示,采用χ2检验或Fisher精确概率检验。P<0.05为具有统计学差异。
2 结果
2.1 两组患者基线资料比较
两组患者基线资料比较均无统计学差异(P>0.05),具有可比性。见表1。
表1 两组患者基线资料比较 n=40,n(%),±s
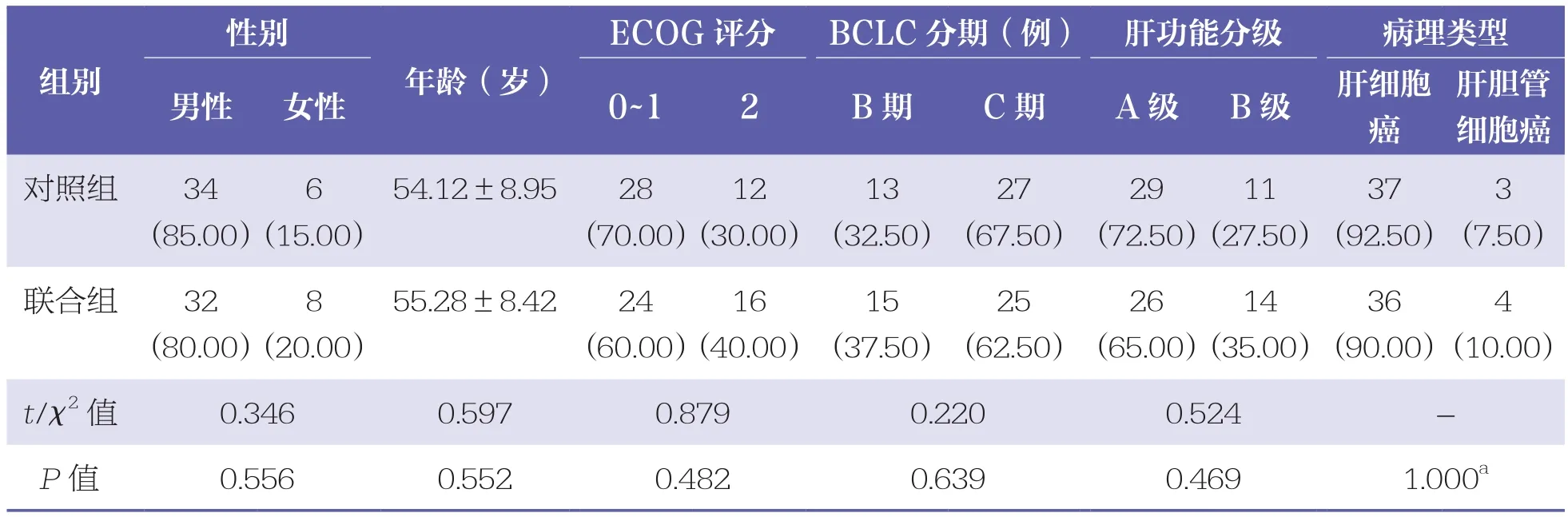
表1 两组患者基线资料比较 n=40,n(%),±s
ECOG评分:美国东部肿瘤协作组(Eastern Cooperative Oncology Group)评分;BCLC分期:巴塞罗那临床肝癌(Barcelona clinic liver cancer)分期;a:Fisher精确概率检验结果
性别肝胆管细胞癌对照组 34(85.00)组别ECOG评分 BCLC分期(例) 肝功能分级 病理类型男性 女性 0~1 2 B期 C期 A级 B级 肝细胞癌年龄(岁)6 3(10.00)t/χ2 值 0.346 0.597 0.879 0.220 0.524 -P值 0.556 0.552 0.482 0.639 0.469 1.000a(7.50)联合组 32(80.00)(15.00)54.12±8.95 28(70.00)12(30.00)13(32.50)27(67.50)29(72.50)11(27.50)37(92.50)8 4(20.00)55.28±8.42 24(60.00)16(40.00)15(37.50)25(62.50)26(65.00)14(35.00)36(90.00)
2.2 治疗前后两组患者Karnofsky评分及血清AFP水平比较
治疗前,两组患者Karnofsky评分及血清AFP水平比较均无统计学差异(P>0.05)。术后1个月,两组患者Karnofsky评分均升高(P<0.05),且联合组高于对照组(P<0.05)。两组患者血清AFP水平均降低(P<0.05),且联合组低于对照组(P<0.05)。见表2。
表2 两组患者Karnofsky评分及血清AFP水平比较 n=40,±s
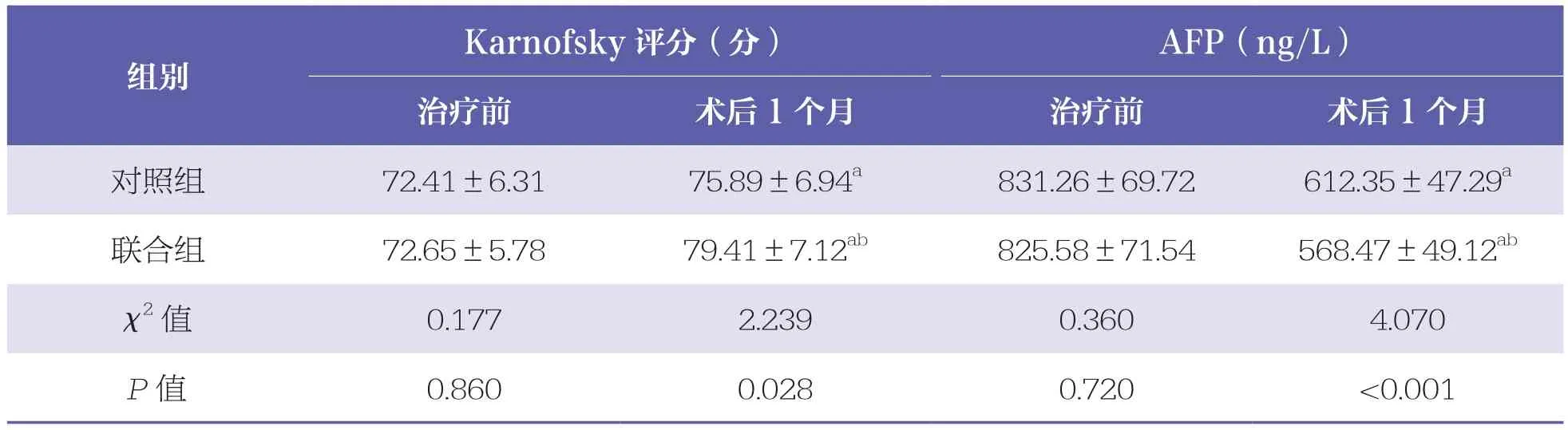
表2 两组患者Karnofsky评分及血清AFP水平比较 n=40,±s
AFP:血清甲胎蛋白与同组治疗前比较,a:P<0.05;与对照组相比,b:P<0.05
Karnofsky评分(分) AFP(ng/L)治疗前 术后1个月 治疗前 术后1个月对照组 72.41±6.31 75.89±6.94a 831.26±69.72 612.35±47.29a联合组 72.65±5.78 79.41±7.12ab 825.58±71.54 568.47±49.12ab χ2值 0.177 2.239 0.360 4.070 P值 0.860 0.028 0.720 <0.001组别
2.3 治疗前后两组患者血清MMP-9、VEGF和IGF-2水平比较
治疗前,两组患者血清MMP-9、VEGF和IGF-2水平比较均无统计学差异(P>0.05)。术后1个月,两组患者MMP-9、VEGF和IGF-2水平均降低(P<0.05);且联合组低于对照组(P<0.05)。见表3。
表3 两组患者血清MMP-9、VEGF和IGF-2水平比较 n=40,±s,ng/L
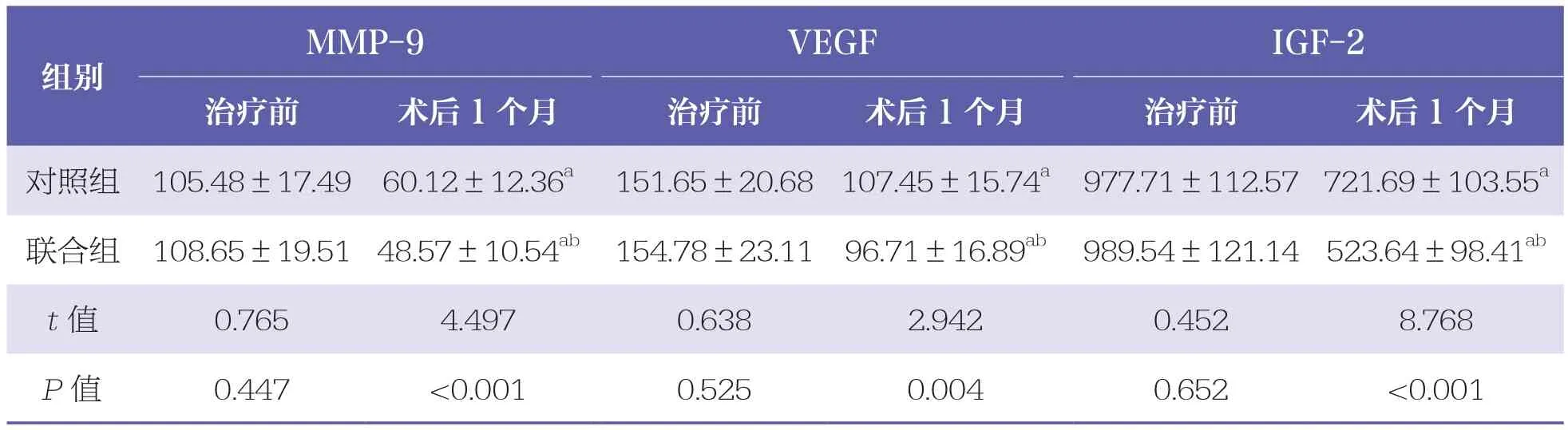
表3 两组患者血清MMP-9、VEGF和IGF-2水平比较 n=40,±s,ng/L
MMP-9:基质金属蛋白酶-9;VEGF:血管内皮生长因子;IGF-2:胰岛素样生因子-2与同组治疗前比较,a:P<0.05;与对照组相比,b:P<0.05
MMP-9 VEGF IGF-2治疗前 术后1个月 治疗前 术后1个月 治疗前 术后1个月对照组 105.48±17.49 60.12±12.36a 151.65±20.68 107.45±15.74a 977.71±112.57 721.69±103.55a联合组 108.65±19.51 48.57±10.54ab 154.78±23.11 96.71±16.89ab 989.54±121.14 523.64±98.41ab t值 0.765 4.497 0.638 2.942 0.452 8.768 P值 0.447 <0.001 0.525 0.004 0.652 <0.001组别
2.4 两组患者临床疗效比较
治疗后,联合组患者DCR(87.50%)高于对照组(67.50%,P<0.05)。见表4。

表4 两组患者临床疗效比较 n=40,n(%)
2.5 两组患者不良反应发生情况比较
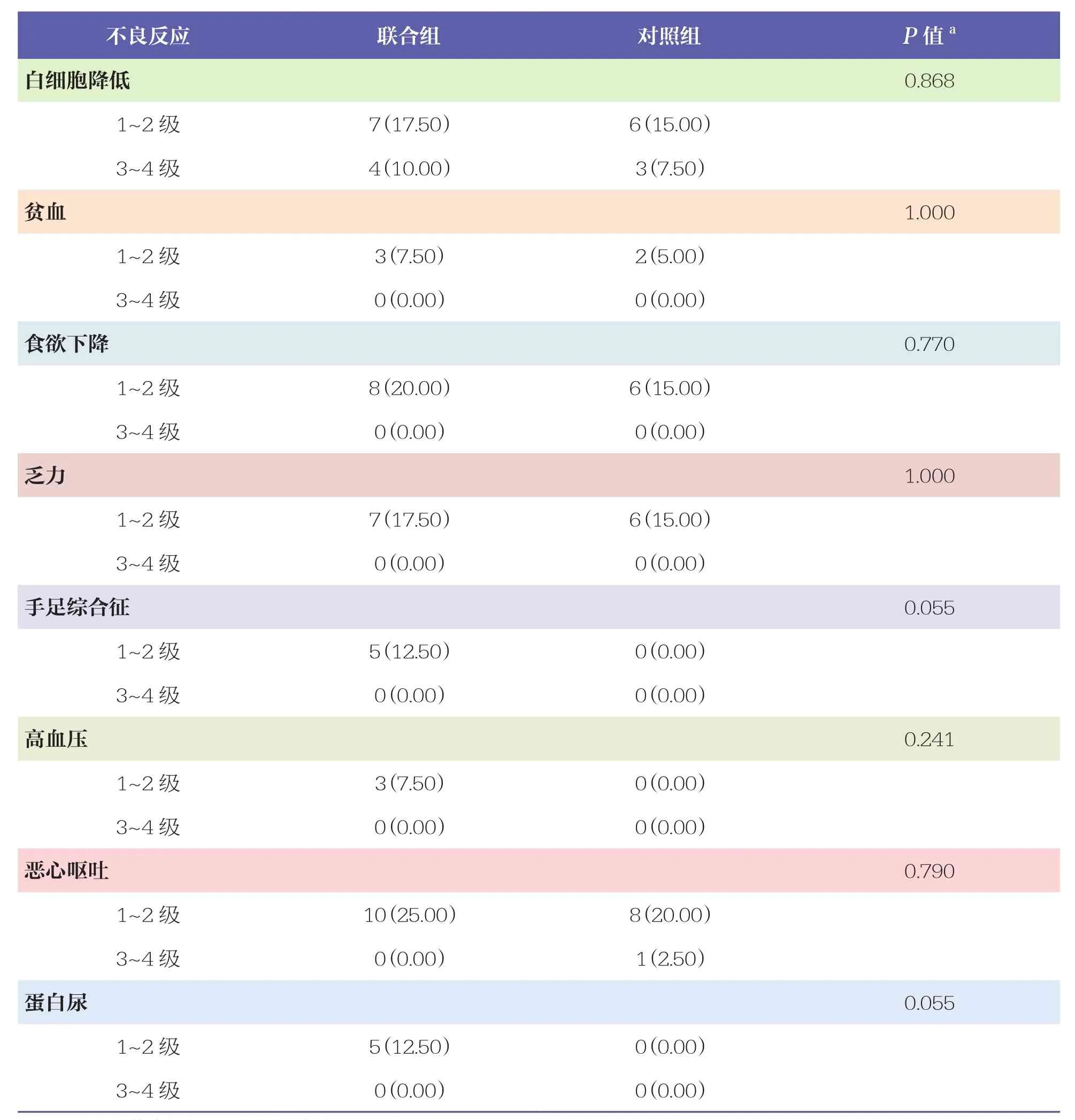
两组患者均出现中性粒细胞减少、血小板减少、白细胞降低、贫血等不良反应,共111例次,以1~2级为主。联合组出现了手足综合征、高血压、蛋白尿等不良反应,均为1~2级,未见3级及以上不良反应。两组患者不良反应发生情况比较无统计学差异(P>0.05)。见表5。

表5 两组患者不良反应发生情况比较 n=40, n(%)
续表
3 讨论
TACE是目前公认的PHC首选治疗方法,但患者术后易复发,预后极差。研究表明[10],由于TACE术后肿瘤缺血缺氧,会激活肿瘤细胞缺氧反应基因如缺氧诱导因子(hypoxia inducible factor 1α,HIF-1α)的转录,使得VEGF分泌增多,进而促进肿瘤微血管新生,最终造成肿瘤的复发及转移。因此,抗血管生成药联合TACE可能有助于提高患者的抗肿瘤效应。目前,索拉非尼已被批准用于PHC的一线治疗,联合TACE可抑制肿瘤血管生成,减少患者术后复发[11]。然而,索拉非尼存在价格昂贵及部分患者耐药等问题,大大限制了其临床应用。
安罗替尼作为中国自主研制的一种新型小分子TKI,是由索拉非尼改造而来,其既可以阻断肿瘤血管生成,又能直接抑制肿瘤生长,且患者耐受性较好[12]。目前,关于安罗替尼治疗胃癌、甲状腺癌及食管癌等多种恶性肿瘤的Ⅱ/Ⅲ期临床试验均已开展[13]。研究显示[14],安罗替尼可抑制人肝内胆管细胞癌细胞系HCCC-9810的增殖及转移,且与索拉非尼相比,其与HCCC-9810的亲和力更强。目前,鲜有关于安罗替尼治疗晚期PHC的研究报道,其临床疗效尚待验证。本研究结果显示,联合组Karnofsky评分高于对照组(P<0.05),且治疗后联合组DCR(87.50%)高于对照组(67.50%,P<0.05),提示安罗替尼联合TACE可提高晚期PHC患者的临床疗效,改善生活质量。推测可能与安罗替尼抑制肿瘤血管生成、抗肿瘤作用及提高TACE术后DCR有关。王亚梦等[15]的研究提示,安罗替尼治疗晚期PHC的临床疗效及安全性较好,但该研究未设置对照组。本研究通过与单纯TACE治疗相比,探索了安罗替尼联合TACE治疗晚期PHC的临床疗效。AFP由肝细胞癌变时产生,对肝癌的诊断和预后评估具有重要意义。研究显示[16],AFP水平升高与肝癌术后复发密切相关,被认为是评估患者术后复发的重要生物标志物。此外,AFP还可作为PHC患者TACE术后疗效评价指标[17]。本研究中,术后1个月,联合组血清AFP水平低于对照组(P<0.05),再次验证了安罗替尼联合TACE的临床疗效。
浸润、转移是肿瘤恶性程度的决定因素,而肿瘤表面细胞外基质的降解、破坏是其浸润、转移的基础条件[18]。MMP-9作为基质金属蛋白酶类的重要成员,是参与细胞外基质水解的重要蛋白水解酶,在肿瘤浸润、转移中发挥着关键作用[19]。VEGF作为重要的血管生成因子,可刺激肿瘤血管新生,其表达水平与肿瘤侵袭、转移紧密关联[20]。IGF-2作为一种生长调节素,可增强VEGF促血管生成的作用,进而参与肿瘤的增殖、转移[21]。因此,检测血清MMP-9、VEGF和IGF-2对患者病情进展及疗效评价具有重要意义。本研究结果表明,与单用TACE治疗相比安罗替尼联合TACE治疗可更有效地降低患者血清MMP-9、VEGF和IGF-2水平,从而发挥更强的抗肿瘤作用。
本研究结果显示,两组患者不良反应发生情况比较无统计学差异(P>0.05)。联合组出现了手足综合征(12.50%)、高血压(7.50%)、蛋白尿(12.50%)等不良反应,均为1~2级,未发生3级及以上不良反应。在Lu等[22]关于阿帕替尼联合TACE治疗晚期肝癌的研究报道中,手足综合征(55%)、高血压(80%)和蛋白尿(45%)的不良反应发生率均高于本研究,提示本研究使用安罗替尼治疗晚期PHC的用药安全性较好。然而,本研究也存在一些局限和不足,如样本量较小、随访时间短、缺乏远期生存预后分析等。对于安罗替尼治疗晚期PHC的临床疗效仍有待进一步开展大样本量研究及完善患者生存期指标来验证。此外,关于安罗替尼与其他分子靶向药物治疗晚期PHC的疗效差异对比,也是今后研究的重要方向。
综上所述,本研究结果表明,安罗替尼联合TACE治疗晚期PHC可提高临床疗效,降低血清MMP-9、VEGF和IGF-2水平,改善患者生活质量且安全性良好。
安罗替尼
