小鼠巨噬细胞极化与焦亡的关系研究①
2023-03-17张敏敏广西医科大学第一附属医院急诊科南宁530021
张敏敏 宁 宗 (广西医科大学第一附属医院急诊科,南宁 530021)
巨噬细胞作为固有免疫的重要组成细胞,在器官发育、急慢性炎症、机体抵抗病原体、组织修复和稳态及免疫调节等生理和病理过程中发挥重要作用。巨噬细胞具有显著可塑性,可根据体内外微环境变化而改变其生理功能,产生具有不同功能的细胞群体,这个过程称为极化。根据表型和分泌细胞因子差异可将巨噬细胞分为经典活化的巨噬细胞(M1 型,促炎表型)和替代活化的巨噬细胞(M2 型,抗炎表型)[1-2]。M1 型巨噬细胞由脂多糖(lipopolysaccharide,LPS)和/或IFN-γ 诱导,分泌促炎细胞因子,如TNF-α、IL-1β、IL-6、IL-12 等,抗原提呈能力和杀菌能力增强,在炎症早期能够清除病原体,但也可能损伤宿主正常组织;M2 型巨噬细胞由IL-4 和/或IL-13诱导,分泌抗炎因子,如IL-4、TGF-β、IL-10、IL-13 等,在炎症晚期能抑制炎症反应,促进组织修复和伤口愈合,在过敏反应、抵御寄生虫和真菌感染中发挥重要作用[2-5]。
近年越来越多的研究发现脓毒症、LPS 可诱发巨噬细胞另一种程序性死亡——焦亡[6-10]。焦亡是一种新发现的伴有细胞炎症因子产生和释放的程序性细胞死亡。2001年COOKSON 等[11]首次将这种依赖于炎症体的细胞死亡称为“pyroptosis”,源于希腊语中与火或热有关的词根“pyro-”,细胞焦亡的 概念被首次定义。已知介导细胞焦亡的途径有 两个:依赖caspase-1 的经典途径和依赖caspase-11 (小鼠)/-4/-5(人)的非经典途径[12-14]。与其他细胞死亡方式不同,细胞焦亡具有两个最为明显的特征:①活化的caspase-1/11 能够切割GSDMD 蛋白,使其产生具有活性的N 端片段GSDMD-NT,并聚集于质膜形成孔洞,使质膜完整性破坏,细胞肿胀并发生渗透性溶解,最后发生焦亡[15-18];②活化的caspase-1能促进炎症因子IL-1β 和1L-18 前体成熟,使大量IL-1β 和IL-18 通过质膜孔释放,最终导致局部或全身炎症反应[12,19-20]。
巨噬细胞极化后,M1/M2 比例失衡引起促炎和抑炎因子比例失控,导致局部或全身炎症性疾病。而细胞焦亡释放大量炎症因子,也可导致炎症反应级联扩大,甚至出现炎症风暴,焦亡和巨噬细胞极化在这方面作用十分相似。研究表明LPS能诱导巨噬细胞焦亡,但发生M0、M1还是M2型尚不清楚,又或者均能发生,但三者发生的焦亡是否存在差异仍是未知的。但巨噬细胞极化为M1 型后引发的炎症反应与焦亡更为相似,于是提出假设,巨噬细胞焦亡可能以M1 型为主,如果用抑制剂精确靶向M1 型,阻断caspase-1/11 介导的M1 型焦亡,或许能减少促炎因子释放、减轻局部或全身炎症反应,从而缓解甚至治疗相关疾病。目前巨噬细胞极化相关研究较多,巨噬细胞焦亡相关研究也越来越多,但尚未有巨噬细胞极化和焦亡关系的研究报道。因此,本研究通过极化实验和检测焦亡相关指标观察诱导极化后的巨噬细胞是否出现焦亡,并探讨巨噬细胞极化类型与焦亡的关系,阐明巨噬细胞极化与焦亡的关键联系,从而发现治疗炎症相关疾病的新方法。
1 材料与方法
1.1 材料 RAW264.7 小鼠巨噬细胞及完全培养基购自武汉普诺赛有限公司;LPS购自美国Sigma公司;Recombinant Mouse IFN-γ、IL-4、IL-13购自Pepro-Tech 公司;FITC Anti-Mouse CD80 及PE Anti-Mouse CD86 购 自BD Pharmingen 公 司;APC Anti-mouse CD206 购 自 美 国Invitrogen 公 司;Flow Cytometry Staining Buffer 购自美国eBioscience 公司;Anti-caspase-1 antibody、Anti-caspase-11 antibody、Anti-GSDMD antibody 均购自Abcam 公司;Rabbit Anti-Cyclophilin B antibody 购自Bioss 公司;荧光二抗Anti-rabbit IgG (H+L)购自Cell Signaling Technology公司;Trizol购自 索莱宝公司;caspase-1、caspase-11、GSDMD、GAPDH 引物购自上海生工生物工程有限公司;Thermo Revert Aid First Strand cDNA Synthesis Kit 逆转录试剂盒购自Fermentas 公司;SDS-PAGE 蛋白上样缓冲液(5×)购自碧云天公司;预染蛋白Marker购自Thermo公司;IL-1β、IL-18、TGF-β 小鼠ELISA 试剂盒购自 上海江莱生物公司;LDH 试剂盒购自南京建成生物公司。
1.2 方法
1.2.1 LPS 和细胞因子诱导M0型巨噬细胞定向分化为M1/M2 型 收集培养瓶里的M0 型巨噬细胞,离心弃上清,用含10%FBS 的完全培养基重悬细胞并调整浓度,1×106个/孔加入6 孔板,培养12 h 后更换培养基,分别在相应孔中加入LPS(100 ng/ml)+ IFN-γ(10 ng/ml)诱导极化为M1 型巨噬细胞,加入IL-4(20 ng/ml)+IL-13(10 ng/ml)诱导极化为M2 型巨噬细胞,M0 对照组中加入等量PBS 培养24 h,收集上清及细胞待测。
1.2.2 流式细胞术检测细胞表型 胰酶消化贴壁细胞,离心弃上清,加入破膜液混匀,冰上破膜25 min,加入配好的缓冲液,离心弃上清,加入流式缓冲液100 µl,加入相应流式抗体(M1:CD80、CD86;M2:CD206)混匀,4 ℃避光孵育30 min,加入缓冲液2 ml洗涤2 次,离心弃上清,每管加入300 µl流式缓冲液重悬细胞,过滤后上机检测。
1.2.3 ELISA 检测细胞上清中IL-1β、IL-18、TGF-β水平 按照说明书设置空白孔、标准品孔、待测样品孔,盖上封板膜37 ℃温育60 min,弃去液体,甩干,洗涤5 次,加入显色剂A 液和B 液,避光孵育 15 min,加入终止液,15 min 内酶标仪检测OD 值,空白孔调零,读出A值,计算标准曲线回归方程后代入样本A值计算IL-1β、IL-18及TGF-β浓度。
1.2.4 PI 染色和流式细胞术观察各组巨噬细胞焦亡程度 将诱导24 h的M0、M1和M2型巨噬细胞去上清,PBS 洗2 次,加入新的培养基,取1/10 培养基的PI(20 µg/ml)溶液加入各孔,37 ℃培养10 min,PBS 洗2 次,倒置荧光显微镜观察细胞形态及染色情况并拍照。收集6 孔板中的细胞至2 ml EP 管,离心弃上清,加入1 ml 流式缓冲液轻柔重悬细胞,离心弃上清,加入200 µl缓冲液重悬细胞,加入5 µl PI(100 µg/ml)室温孵育15 min,转至流式管,再加入100 µl缓冲液混匀,上机检测各组焦亡细胞阳性率。
1.2.5 Western blot 检测焦亡蛋白水平 收集M0、M1 和M2 型巨噬细胞,PBS 洗2 次,加入RIPA 裂解液裂解,提取总蛋白。采用BCA 法测蛋白浓度,取等量蛋白上样,SDS-PAGE 凝胶电泳、转膜,5%脱脂牛奶封闭1 h,分别加入一抗caspase-1(1∶1 000)、caspase-11(1∶1 000)、GSDMD(1∶1 000)和内参抗体4 ℃避光孵育过夜,1×TBS 洗3次,10 min/次,加入荧光二抗(1∶10 000)避光摇床室温孵育1 h,洗膜3次,10 min/次,Odyssey双色红外激光扫描显影仪扫描蛋白条带,Image J 软件分析结果,目的蛋白表达=目的蛋白条带灰度值/内参条带灰度值。
1.2.6 RT-PCR 测焦亡因子mRNA 水平 Trizol 法提取纯化M0、M1、M2 型巨噬细胞总RNA,采用 Revert Aid First Strand cDNA Synthesis Kit 试剂盒逆转录合成 cDNA 第一链,以GAPDH 为内参,Fast-Start Universal SYBR Green Master(Rox) 处理样本并上机检测焦亡标志指标caspase-1、caspase-11 和GSDMD mRNA水平。引物序列见表1。

表1 RT-PCR引物序列Fig.1 RT-PCR primer sequences
1.2.7 LDH 检测细胞活性 取各组经过处理的细胞上清,按照检测试剂盒说明书操作,酶标仪检测各组样本450 nm 处OD 值,并计算各组乳酸脱氢酶活性。
1.3 统计学处理 采用SPSS23.0软件进行统计学分析,单因素方差分析进行组间比较,数据用±s表示,P<0.05为差异有统计学意义。采用FlowJo v10、GraphPad Prism7.0 及Image J 软件进行图片采集和处理。
2 结果
2.1 M0 型巨噬细胞极化为不同表型后形态学改变 倒置相差荧光显微镜观察到M0 巨噬细胞形态饱满,大小均一,大部分细胞呈圆形或椭圆形,团聚生长较明显(图1A);LPS+IFN-γ 刺激24 h 后,诱导分化后的M1 型巨噬细胞形态更为多样,部分细胞呈长梭形,部分细胞膜上突起(伪足)明显,有的细长、有的短小,数量多且呈放射状(图1B);IL-4+IL-13刺激24 h 后,诱导分化的M2 型巨噬细胞大部分呈椭圆形或梭形,与M1相比伪足较短且数量少(图1C)。

图1 显微镜下各组巨噬细胞形态学表现(×40)Fig.1 Morphological manifestations of macrophages in each group under microscope (×40)
2.2 流式细胞术检测M1、M2型巨噬细胞特异性分子表达 CD80 和CD86 分子表达是判断M1 型巨噬细胞分化情况的特异性指标,如图2所示,未分化的M0型细胞表面CD80和CD86表达均<0.5%,而分化为M1 型巨噬细胞后,CD80 和CD86 表达明显上升,分别达到(78.20±3.29)%和(77.30±7.21)%。常用于鉴定M2 型巨噬细胞分化情况的特异性分子为CD206,未诱导的M0型细胞内CD206分子表达基本为阴性(<0.5%),而在M2型细胞中的表达明显增加, 为(82.61±7.12)%,说明巨噬细胞诱导极化成功。
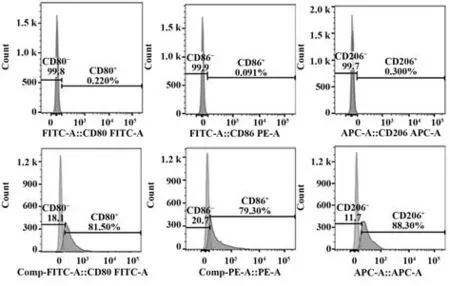
图2 M1/M2巨噬细胞特异性分子表达Fig.2 Specific molecular expression of M1/M2 macrophages
2.3 各组细胞上层清中炎症因子IL-1β、IL-18 及TGF-β 水平变化 ELISA 检测发现,与M0 型巨噬细胞相比,M1、M2 型巨噬细胞上清中促炎因子IL-1β和IL-18 含量升高(P<0.05);与M0、M1 型相比,M2型巨噬细胞上清中抑炎因子TGF-β 显著增加(P<0.05,图3)。表明M1 和M2 型诱导极化成功,且M1型巨噬细胞炎症反应更为明显,反映M1 型巨噬细胞焦亡程度更为明显。

图3 各组巨噬细胞上清中炎症因子IL-1β、IL-18及TGF-β表达Fig.3 Expressions of inflammatory factors IL-1β, IL-18 and TGF-β in supernatant of macrophages in each group
2.4 PI 染色定性和流式细胞术定量检测各型巨噬细胞焦亡阳性率 倒置荧光显微镜下观察PI 染色结果发现,与M0、M2型巨噬细胞相比,M1 型巨噬细胞PI 染色呈强阳性(图4A);M1 型细胞PI 染色阳性率也明显高于M0、M2 型细胞(图4B)。表明M0、M1和M2型巨噬细胞均出现焦亡现象,但LPS+IFN-γ刺激诱导分化的M1型巨噬细胞更为显著。

图4 各型巨噬细胞焦亡阳性率Fig.4 Positive rate of pyrophages in various types of macrophages
2.5 Western blot 检测各型巨噬细胞焦亡蛋白表达 caspase-1 和caspase-11 分别是介导焦亡经典途径和非经典途径的关键分子。Western blot 结果显示,M1 型巨噬细胞,caspase-1 和caspase-11 蛋白表达明显高于M0 和M2 型(图5),而GSDMD 蛋白在 三者中表达差异最小。

图5 各型巨噬细胞caspase-1/-11和GSDMD蛋白表达Fig.5 Expressions of caspase-1/-11 and GSDMD proteins in various types of macrophages
2.6 RT-PCR 检测各型巨噬细胞焦亡基因水平 RT-PCR 结果发现,仅加PBS 处理的M0 型巨噬细胞和IL-4+IL-13 刺激诱导的M2 型巨噬细胞焦亡目的基因caspase-1、caspase-11 和GSDMD 表达降低,且两者差异无统计学意义(P>0.05),而LPS+IFN-γ刺激诱导的M1 型巨噬细胞caspase-1、caspase-11、 GSDMD mRNA 表达均明显高于M0 和M2 组(P<0.05,图6)。
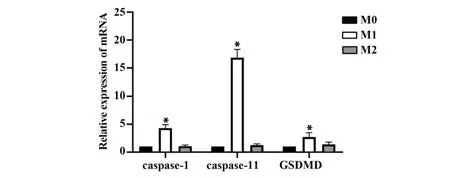
图6 各型巨噬细胞caspase-1/-11和GSDMD mRNA表达Fig.6 Expressions of caspase-1/-11 and GSDMD mRNA in various types of macrophages
2.7 LDH 检测各型巨噬细胞活性 各组细胞上清中LDH释放试验显示:与M0组相比,M1、M2组细胞LDH 释放增加(图7),提示细胞糖酵解增高,M1 型巨噬细胞发生焦亡的细胞占比较高。

图7 各型巨噬细胞上清中LDH释放量Fig.7 Release of LDH in supernatant of various types of macrophages
3 讨论
巨噬细胞是一种体内分布广泛的固有免疫细胞,其极化与多种疾病发生发展及预后密切相关。巨噬细胞极化后,促炎M1 型和抗炎M2 型比例失衡导致局部或全身炎症微环境失衡,引发“炎症因子风暴”,甚至导致多种疾病发生。巨噬细胞极化在微生物(细菌、病毒、寄生虫)感染、ALI/ARDS、肿瘤、代谢性疾病(动脉粥样硬化、肥胖、糖尿病)及自身免疫性疾病(系统性红斑狼疮、类风湿关节炎、炎症性肠病等)等发生发展中广泛存在[21-26],深入了解巨噬细胞极化在这些疾病中的作用机制,有望通过调节M1/M2平衡控制和预防这些疾病发生。
近年细胞焦亡逐渐成为程序性死亡领域研究热点,也是目前炎症反应机制研究新热点,与细胞凋亡和坏死不同的是,焦亡是一种依赖于gasdermin家族蛋白的炎症性细胞死亡,而GSDMD 是焦亡最终执行蛋白,其剪切体活化也是焦亡发生的标志[18]。焦亡在机体中的作用是把双刃剑,细胞焦亡过程中释放的IL-1β 和IL-18 是内源性免疫因子,可引起发热和刺激免疫细胞活化,促进淋巴细胞增殖和分泌抗体,加速免疫应答以抵抗病原体入侵,从而促进病原体清除,但IL-1β 和IL-18 释放失控会导致级联放大的炎症反应,甚至导致全身免疫性疾病[27-29]。目前已有研究表明细胞焦亡在炎症性疾病、败血症、ALI/ARDS、癌症、心血管疾病、免疫性疾病和代谢性疾病等疾病的发生发展中起重要作用[30-36]。
巨噬细胞极化和焦亡存在许多相似之处,如两者均与炎症反应发生有关,反应过程失控可导致炎症级联放大;两者均可导致多种疾病,且这些疾病均与炎症相关;两者对机体均具有双重意义,既可增强机体防御功能起保护作用,又可导致机体正常组织自我损伤。如能证实巨噬细胞极化与焦亡的关系,通过调控巨噬细胞极化,尤其是靶向抑制M1型巨噬细胞极化,或许能抑制焦亡发生发展;反之,亦能通过阻断焦亡的经典途径和非经典途径平衡M1/M2 比例,从而缓解局部甚至全身炎症反应,最终找到更多治疗极化和焦亡相关疾病的新方法。
本研究采用LPS+IFN-γ 诱导M0 型巨噬细胞极化为M1 型,IL-4+IL-13 诱导M0 型巨噬细胞极化为M2 型,是体外诱导巨噬细胞极化最主要的方法[37-38];随后采用流式细胞术检测M1 型巨噬细胞表面标志分子CD80 和CD86 表达,M2 型巨噬细胞表面标志分子CD206 表达[38-39],结果显示,诱导极化后的M1 型巨噬细胞形态学与M0 和M2 型差异显著,M1 型细胞表面伪足多且细长,与M1 型巨噬细胞摄取病原微生物和抗原提呈功能相符,且流式细胞术结果也表明此次M1、M2型巨噬细胞诱导极化成功。而关于巨噬细胞极化后的形态学改变,曾有文章报道人巨噬细胞极化后形态学改变[40],但小鼠中的变化尚未见文章报道。本研究结果可知,M0、M1、M2型巨噬细胞均可出现焦亡;但与M0 和M2 型相比,M1型巨噬细胞上清中IL-1β、IL-18 和LDH 水平均上升,PI 染色阳性细胞比例提高,焦亡相关指标caspase-1、caspase-11 和GSDMD mRNA 和蛋白水平提高,证实M1 型巨噬细胞焦亡程度更为显著,且在这一过程中,经典途径和非经典途径均可激活。此外,根据RT-PCR 和Western blot caspase-11 表达量结果推测,M1型巨噬细胞焦亡可能以非经典途径为主,对其进行干预或许可阻断巨噬细胞焦亡,进而减轻各种疾病中炎症反应级联扩大和失衡,但这一设想有待采用动物实验进行体内验证。
综上,LPS+IFN-γ 和IL-4+IL-13 可分别成功诱导M0 型巨噬细胞向 M1 和M2 型极化,且极化后的M1型形态学与M0、M2型差异显著;M0、M1和M2型巨噬细胞均可发生焦亡,M1 型最为显著;LPS 导致M1型巨噬细胞焦亡以非经典途径为主。