不同制备工艺对薯蓣皂苷元固体分散体体外溶出、物相特征、体内药动学的影响
2023-03-16常金花薛禾菲王雨欣刘翠哲周剑宇
刘 沛,常金花,薛禾菲,王雨欣,徐 林,张 领,刘翠哲,周剑宇
(承德医学院,河北省神经损伤与修复重点实验室,河北省中药研究与开发重点实验室,河北 承德 067000)
固体分散体是改善难溶性药物口服生物利用度的重要策略之一[1-3],制备工艺是其生产过程中的重要因素,同一药物制备工艺不同,其固体分散体性质也会有所差异。目前,相关研究大多集中于单一工艺上,故对多种工艺之间的差异,以及各工艺所得固体分散体的性质值得深入探讨。
薯蓣皂苷元广泛存在于豆科、薯蓣科植物中,难溶于水,可溶于甲醇、石油醚等有机溶剂[4],具有抗癌、免疫调节、心血管保护、降血脂等多种药理作用[5],但该成分具有强疏水性和低水溶性,导致生物利用度较低。Soluplus 具有两亲性,有着玻璃转化温度低、毒性小、热稳定性好的特点[6],是德国巴斯夫公司在2010 年专门设计用于通过热熔挤出技术生成难溶性药物固体分散体的载体[7]。为了提高薯蓣皂苷元溶解性和生物利用度,本实验以Soluplus 为载体,分别采用共沉淀法、微波淬冷法、冷冻干燥法制备固体分散体,对其溶出行为、物相特征进行考察,再通过测定接触角拟合曲线方程来揭示该剂型溶解机理,并对其进行药动学研究,以期为其他难溶性药物固体分散体的制备提供新思路。
1 材料
1.1 仪器 Agilent 1260 高效液相色谱仪(美国安捷伦公司);Waters ACQUITY UPLC H-Class 超高效液相色谱仪[沃特世科技(上海)有限公司];Triple Quad 5500 系统质谱仪(美国SCIEX 公司);AG-245 电子分析天平(瑞士梅特勒-托利多公司);RC806 溶出试验仪(天津市天大天发科技有限公司);DSC-250 差示扫描量热分析仪(美国TA 仪器公司);Tensor 27 傅里叶变换红外光谱仪(德国Bruker 公司);Jeol-JSM-7500F 扫描电镜(日本电子株式会社);PW3040/60 X-射线粉末衍射仪(荷兰帕纳科公司)。
1.2 试剂与药物 薯蓣皂苷元对照品(批号111539-200001,中国食品药品检定研究院);薯蓣皂苷元原料药(批号C27H4203,南京春秋生物工程有限公司)。Soluplus(德国巴斯夫公司);十二烷基硫酸钠(SDS,天津市福晨化学试剂厂)。色谱纯乙腈、甲醇(美国 Meridian Medical Technologies 公司);质谱纯乙腈、甲醇(美国赛默飞公司);其他试剂均为分析纯;水为娃哈哈纯净水(杭州娃哈哈集团有限公司)或屈臣氏蒸馏水[屈臣氏集团(香港)有限公司]。
1.3 动物 健康SD 大鼠,雄性,体质量180~220 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0006,实验前在实验室条件下适应10 d,自由喂养标准鼠粮和无菌水,实验开始时禁食12 h。所有动物相关方案均经承德医学院动物伦理实验委员会批准,并符合《国家实验动物使用法》 要求(伦理批准号CDMULAC-20180410016)。
2 方法与结果
2.1 固体分散体制备
2.1.1 色谱条件和方法学考察 Diamonsil Plus C18色谱柱(150 mm×4.6 mm,5 μm);流动相乙腈-水(84∶16);体积流量1 mL/min;柱温30 ℃;检测波长203 nm。在此条件下进行线性关系、专属性考察及精密度、重复性、稳定性、加样回收率试验,结果显示该方法简便灵敏,稳定可靠。
2.1.2 溶解度测定 在EP 管中加入4 mL 水、过量固体分散体,置于恒温气浴振荡器中,在25 ℃下振荡24 h 后取出,15 000 r/min 离心10 min,取上清液,过0.45 μm 微孔滤膜,在“2.1.1” 项色谱条件下进样测定。
2.1.3 溶出度测定 在漏槽条件下,取原料药、物理混合物、固体分散体适量(相当于5 mg 薯蓣皂苷元),按照2020 年版《中国药典》 二部附录XC 第二法,以900 mL 0.1% SDS 溶液为介质,在37 ℃、100 r/min 下 于5、15、30、45、60、90、120 min 各取样5 mL,0.45 μm 微孔滤膜过滤,在“2.1.1” 项色谱条件下进样测定,同时补充等量同温介质。
2.1.4 制备方法
2.1.4.1 共沉淀法 将原料药与Soluplus 分别按1∶2、1∶4、1∶6、1∶8、1∶10、1∶12 比例精密称定质量,无水乙醇超声至完全溶解,在旋转蒸发仪上挥干溶剂后冷冻30 min,置于50 ℃烘箱中干燥过夜后取出,粉碎,过80 目筛,即得,按“2.1.3” 项下方法测定溶出度,绘制体外溶出曲线,见图1A。
2.1.4.2 微波淬冷法 参考文献[8]报道,将原料药与Soluplus 分别按1∶2、1∶4、1∶6、1∶8、1∶10、1∶12 比例精密称定质量,装到真空袋中摇匀5 min 以尽量使两者混匀,置于坩埚中,放入微波炉中,高火(功率700 W)加热10 min 后趁热取出,-196 ℃液氮淬冷使其固化,转移至真空干燥箱中,取出,研细,过80 目筛,即得,按“2.1.3” 项下方法测定溶出度,绘制体外溶出曲线,见图1B。
2.1.4.3 冷冻干燥法 将原料药与Soluplus 分别按1∶2、1∶4、1∶6、1∶8、1∶10、1∶12 比例精密称定质量,溶于2%乙醇中,搅拌均匀后转移到培养皿中,保鲜膜封口,用针头扎出密集细小的孔,置于冷冻干燥机中48 h 后取出,混匀,研细,过80 目筛,即得,按“2.1.3” 项下方法测定溶出度,绘制体外溶出曲线,见图1C。
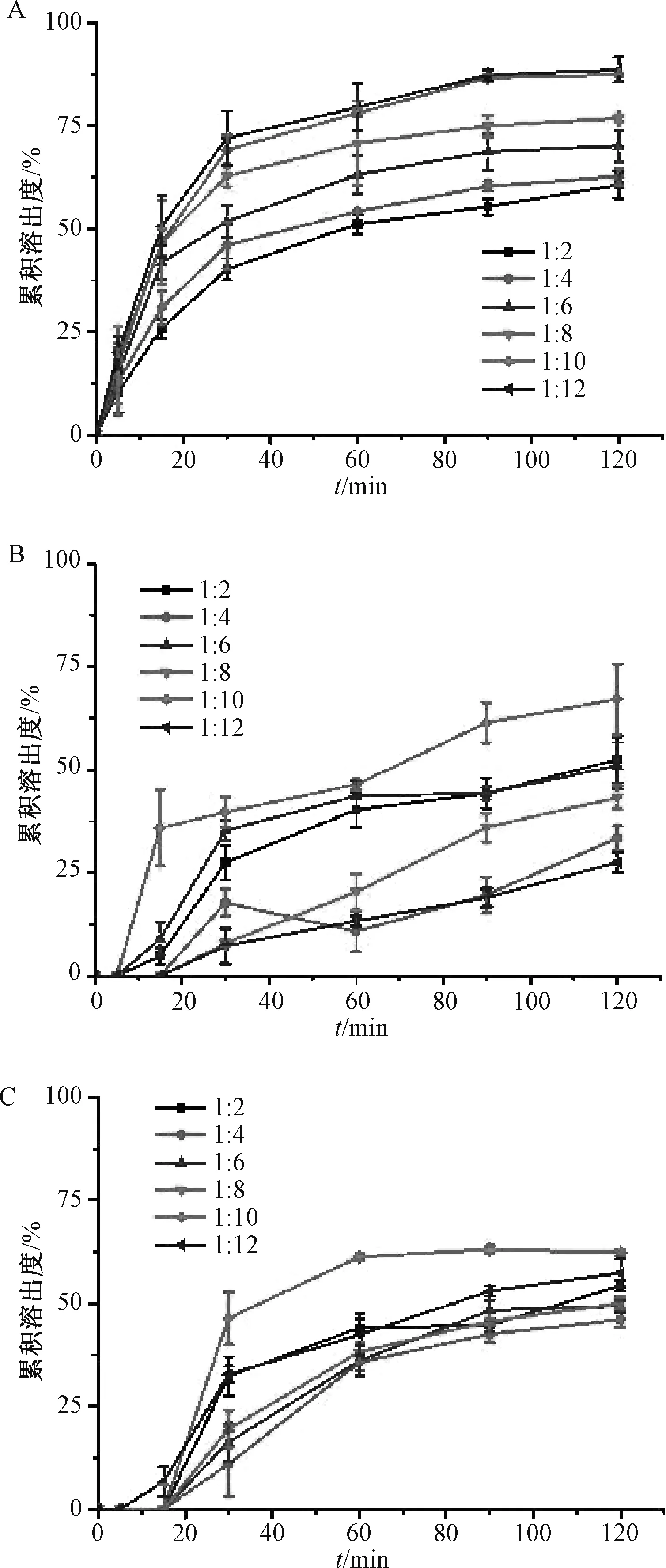
图1 不同药载比下薯蓣皂苷元体外溶出曲线(±s, n=3)Fig.1 In vitro dissolution curves for diosgenin under different drug-carrier ratios(±s, n=3)
2.1.4.4 结果分析 由图1 可知,药载比为1∶10 时溶出度最高,故以此比例制备固体分散体。
2.1.5 验证试验 按一定比例精密称取已过80 目筛的原料药和Soluplus,研磨后装到真空袋中,混匀,即得物理混合物。按“2.1.4.4” 项下最优药载比制备固体分散体、物理混合物各3 批,测定溶解度、累积溶出度,结果见图2。
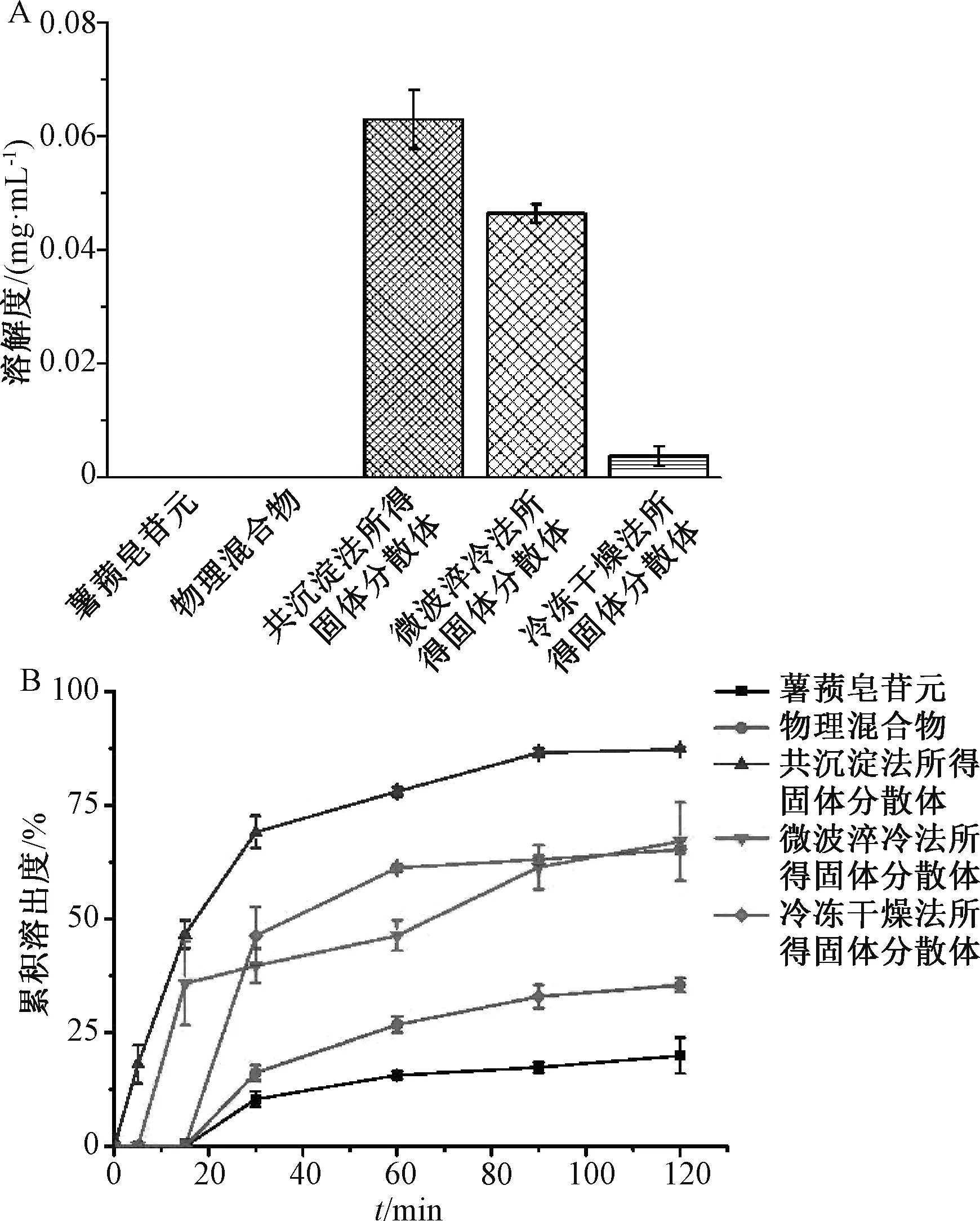
图2 薯蓣皂苷元固体分散体溶解度(A)、累积溶出度(B)(±s, n=3)Fig.2 Solubilities(A)and accumulative dissolution rates(B)of diosgenin solid dispersions(±s,n=3)
由图2A 可知,原料药、物理混合物溶解度几乎检测不到,而在固体分散体中前者溶解度明显提高,依次为共沉淀法所得>微波淬冷法所得>冷冻干燥法所得。由图2B 可知,在0.1% SDS 溶液中固体分散体溶出度明显高于原料药、物理混合物,其原因可能是药物在溶出介质中的润湿性的改善[9]及药物从结晶状态到无定形态的转变[10]。Shi等[11]报道,Soluplus 可通过自胶束化作用,在过饱和溶液中溶解药物并抑制其结晶。本研究发现,固体分散体中Soluplus 质量浓度为61 mg/L,高于其临界胶束浓度,从而也可能通过胶束形成来稳定地提高薯蓣皂苷元溶出。
2.2 物相特征研究
2.2.1 差示扫描量热分析(DSC)取原料药、Soluplus、物理混合物、固体分散体各约5 mg,精密称定,装入铝坩埚中,以空坩埚为参比进行DSC分析。设定工作条件为扫描速度10 ℃/min;N2吹扫气体积流量40 mL/min;N2保护气体积流量60 mL/min;扫描范围25~300 ℃,结果见图3。
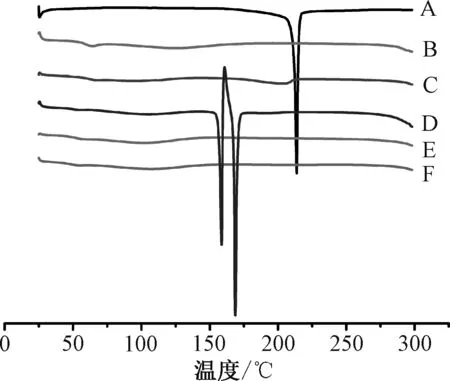
图3 各样品DSC 曲线Fig.3 DSC curves for various samples
由此可知,在213.67 ℃时原料药出现1 个明显的吸热峰,表明它为晶体结构;共沉淀法、微波淬冷法所得固体分散体中原料药吸热峰消失,推测它可能与载体混溶而形成无定形态,并且与Soluplus 的相溶性降低了其分子流动性,从而改善了物理稳定性;冷冻干燥法所得固体分散体中存在2 个以上吸热峰,可通过吸热过程失去溶剂,从而达到稳定的晶体形式,可能是因为制备时将原料药溶于含2%乙醇的水中而发生重结晶,导致表现出熔融介导的多态性,并且在158.6 ℃下熔融吸热后在160.8 ℃左右出现小放热,此时原料药再结晶成更稳定的形式,而168.7 ℃的第2 次吸热对应稳定形态的熔化;理论上,物理混合物应在213 ℃左右呈现原料药结晶熔化过程的吸热峰,但本实验并未发现这一点,可能是由于它在DSC 程序升温时先熔融的载体成为原料药良好的溶剂,使其到达熔点前就已逐渐溶解在熔融载体中(类似于采用熔融法制备固体分散体,原料药以分子状态溶解在Soluplus 中),或者只是药物结晶性受到Soluplus 的抑制而使原料药特征吸热峰消失,从而导致物理混合物、固体分散体DSC 曲线相似[12]。
2.2.2 粉末X 射线衍射(PXRD)取原料药、Soluplus、物理混合物、固体分散体适量,设定分析条件为Cu 靶;波长0.154 0 nm;管流强度40 mA;管电压40 kV;扫描角度10°~60°;步长0.02°;扫描频率8°/min,结果见图4。
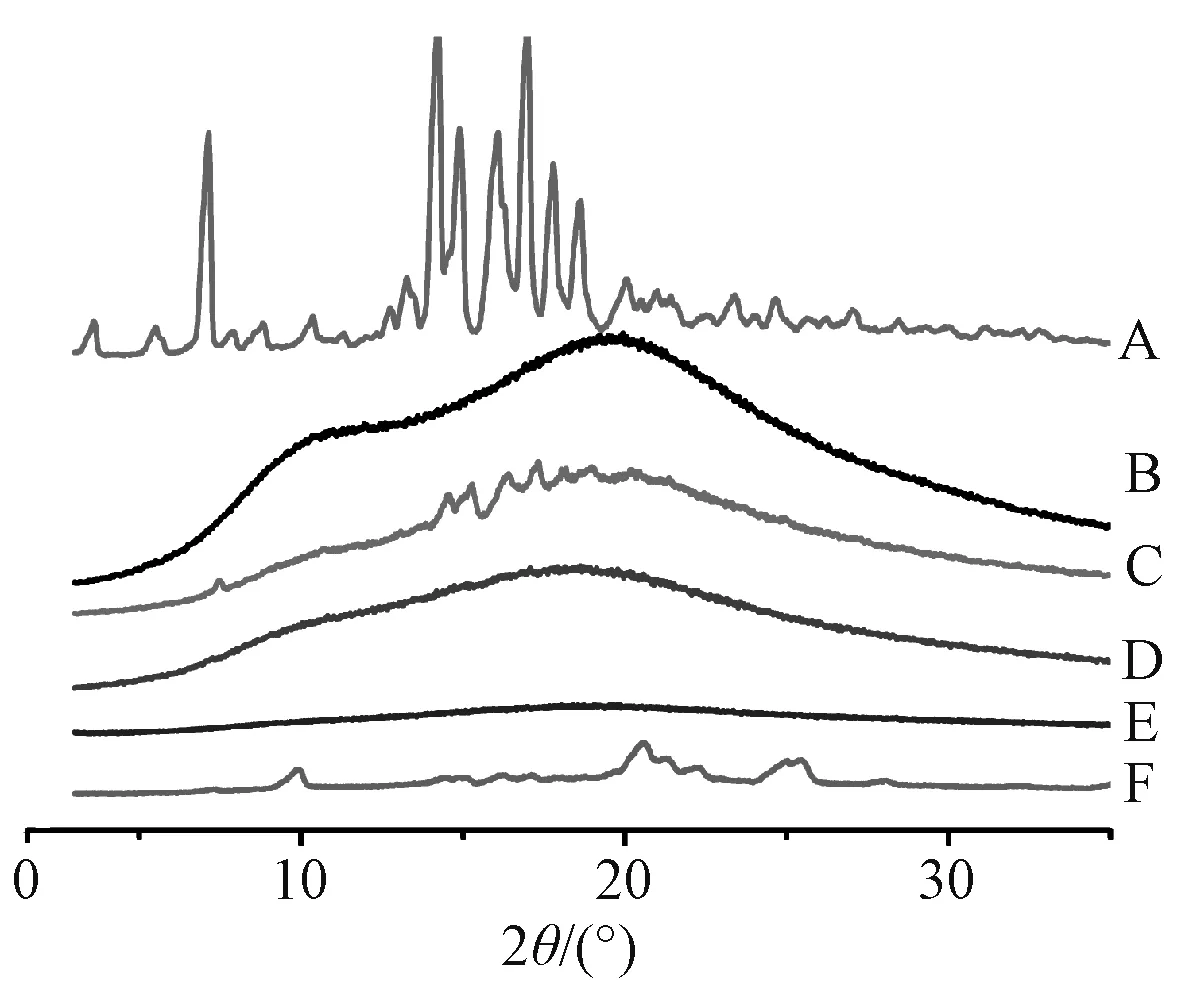
图4 各样品PXRD 图Fig.4 PXRD spectra for various samples
由此可知,原料药在5°~20°范围内有特征的晶体衍射峰,分别位于7.14°、14.22°、14.90°、16.08°、16.98°、17.78°、18.64°;物理混合物中可清楚观察到原料药所有主要特征晶体峰;共沉淀法、微波淬冷法所得固体分散体中原料药晶体特征峰消失,表明载体与原料药之间的相互作用可有效将药物晶体状态转变为无定形态,但两者衍射峰光晕不同,说明制备工艺的差异会导致整个体系的分子结构不同;冷冻干燥法所得固体分散体中仍存在部分原料药晶体衍射峰,表明它在冷冻过程中发生重结晶,与“2.2.1” 项下结果一致。
2.2.3 扫描电镜(SEM)取原料药、Soluplus、物理混合物、固体分散体适量,涂于干净的铜片上,喷金后观察其表面形态,结果见图5。由此可知,原料药呈棒状或粒状结晶结构;Soluplus 以无定形态存在;物理混合物中可观察到原料药晶体出现在载体中,而固体分散体中未发现,表明它以无定形态存在于固体分散体中。
2.2.4 傅里叶红外光谱(FTIR)取原料药、Soluplus、物理混合物、固体分散体适量,KBr 压片,在4 000~400 cm-1波数范围内进行FTIR 分析,结果见图6。
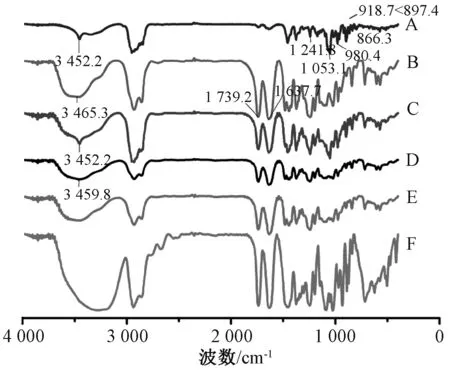
图6 各样品FTIR 图Fig.6 FTIR spectra for various samples
由此可知,原料药特征峰(cm-1)存在3 452.2(-OH)、1 241.5、1 053.1(3β-OH,Δ5)、980.4、918.7 <897.4、866.3(25R螺甾烷);Soluplus 存在-OH、O =C-S-、O =C-C =C-羰基的伸缩振动特征峰,分别位于3 465.3、1 739.2、1 637.7 cm-1;物理混合物红外光谱图与原料药基本相似,后者特征峰基本都存在,表明药物与载体之间只是简单混合,并没有发生相互作用;在固体分散体中原料药羟基峰发生了位移,提示药物与载体之间可能存在氢键,并且原料药特征峰3 452.2(-OH)的小尖峰消失,与Soluplus 的羟基峰合并为1 个宽钝的吸收峰,位于3 459.8 cm-1,-OH 的消失表明原料药羟基与Soluplus 羰基(氢键受体)之间存在分子间氢键。值得注意的是,药物与载体之间的相互作用有利于固体分散,因为它不仅可抑制药物结晶,还能增强药物在亲水性辅料中的固溶度[13]。
2.2.5 水接触角测定 取原料药、Soluplus、物理混合物、固体分散体适量,在2 000 psi(1 psi =6.895 kPa)压力下压片,采用Theta Flex 接触角分析仪,以纯化水为媒介,采用躺滴法对润湿性进行分析,设定测试条件为3 μL 纯化水;平衡时间0.8 s;采样时间间隔0.008 4 s,结果见图7。
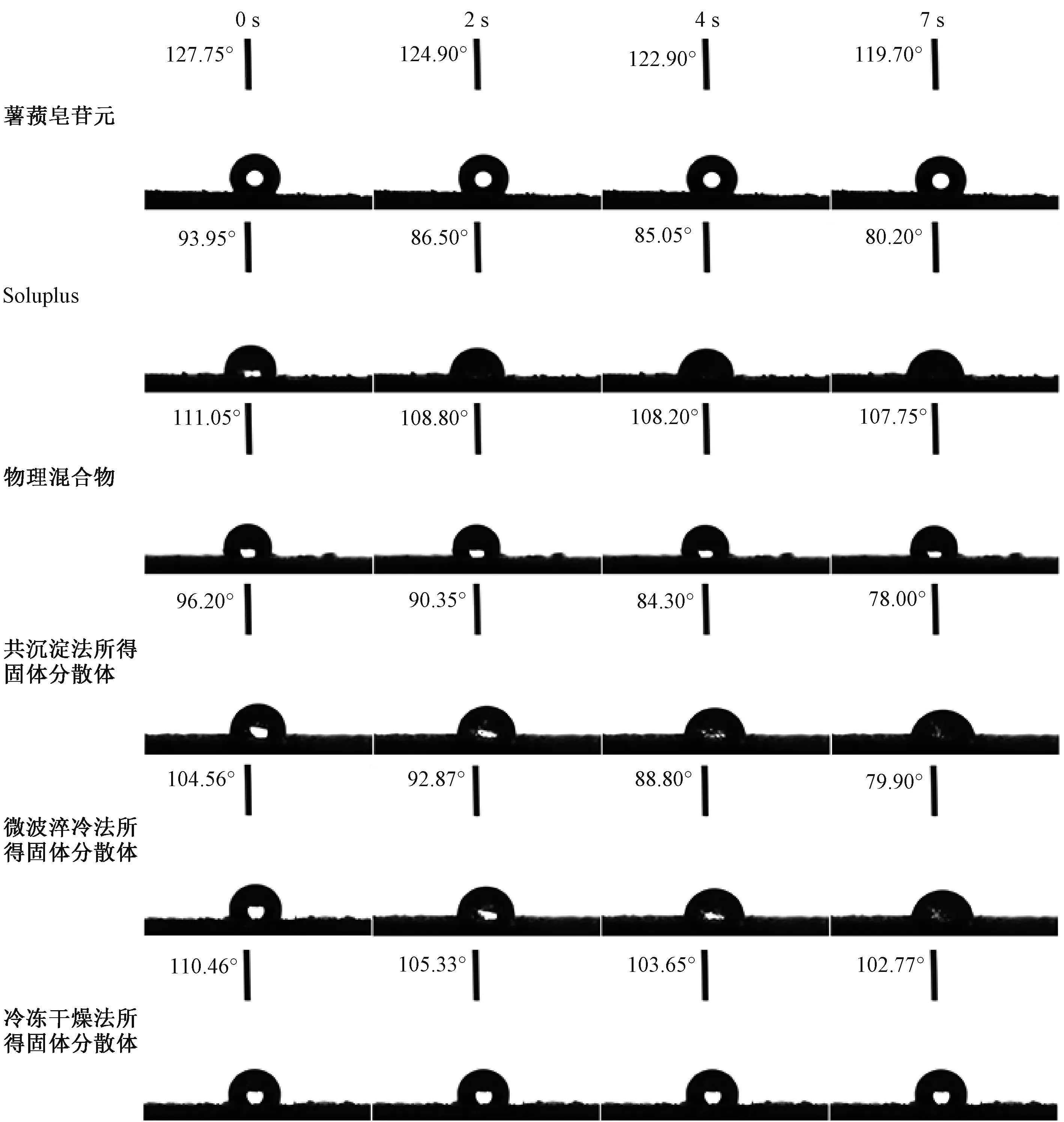
图7 各样品水接触角Fig.7 Water contact angles of various samples
由此可知,水接触角随着时间延长逐渐变小;与载体比较,原料药水接触角明显增大,说明水不易润湿水溶性较差的分子;物理混合物水接触角小于原料药,但大于载体,表明载体加入增加了原料药在物理混合物中的润湿性;共沉淀法、微波淬冷法所得固体分散体水接触角低于物理混合物、原料药,表明原料药无定形态的润湿性高于晶态,并且前者水接触角小于后者,即两者虽然均是无定形态,但前者具有更好的润湿性;冷冻干燥法所得固体分散体水接触角小于原料药、物理混合物,但原料药在冷冻过程中发生了重结晶,表明其润湿性仍明显弱于其他2 种制备工艺所得固体分散体。
再进一步拟合水接触角曲线,结果见图8。由此可知,固体分散体R2降低,表明原料药与载体的分子间相互作用对其润湿性有一定影响。
当系数、指数均接近纯载体方程中的图形时,溶出过程由载体控制;当两者均接近药物方程中的图形时,溶出过程由药物控制;在两者分别接近不同的条件下时,可得到药物、载体控制扩散的溶出过程[14]。图8 显示,共沉淀法、微波淬冷法所得固体分散体系数、指数更接近载体Soluplus 拟合方程,表明它们属于载体控制扩散;冷冻干燥法所得固体分散体两者均更接近原料药拟合方程,表明它属于药物控制扩散。
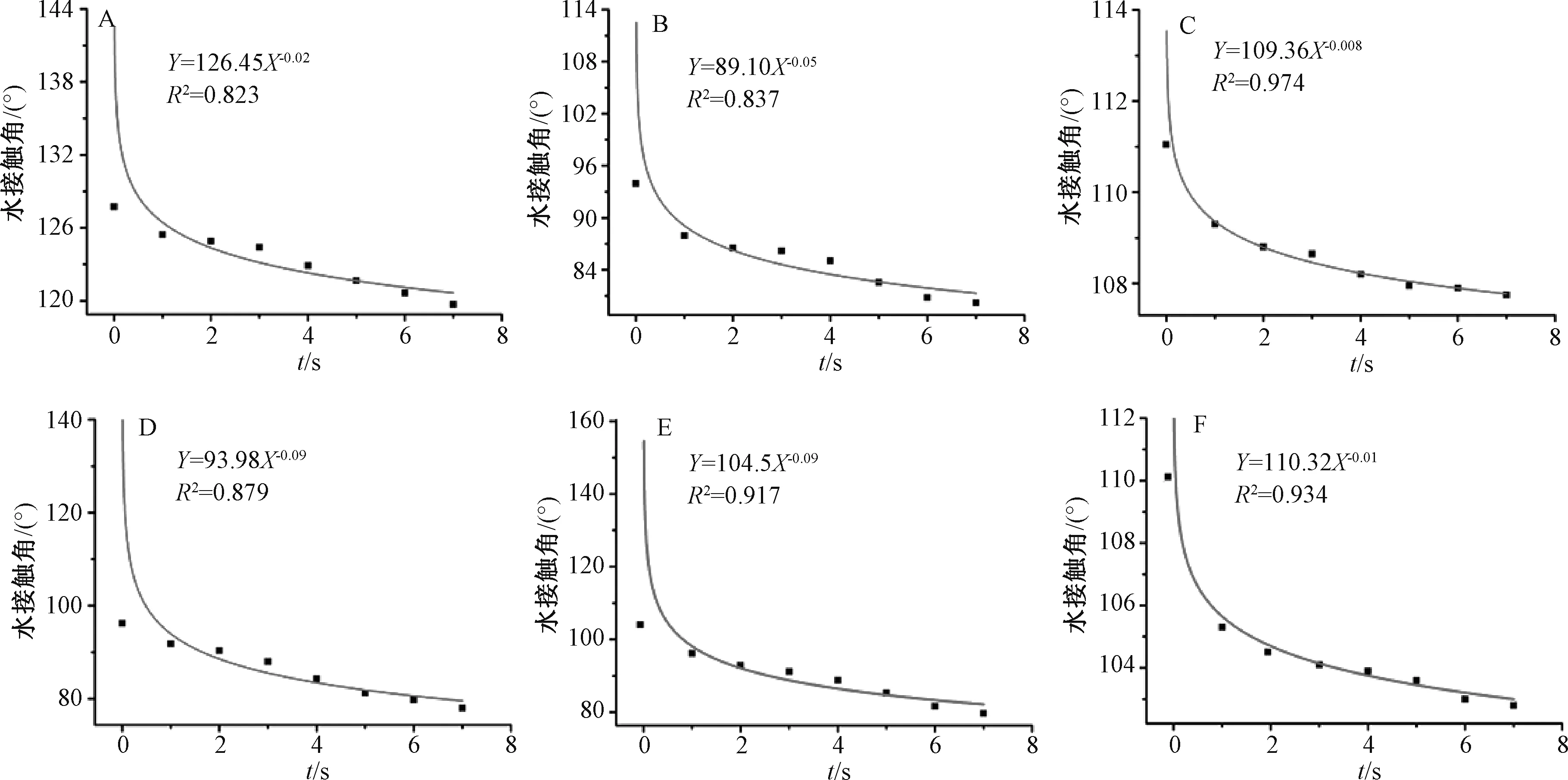
图8 薯蓣皂苷元固体分散体水接触角曲线Fig.8 Curves for water contact angles of diosgenin solid dispersions
2.3 体内药动学研究
2.3.1 分组、给药与采血 30 只大鼠随机分为5组,每组6 只,分别灌胃给予薯蓣皂苷元、物理混合物、3 种制备工艺所得固体分散体(均用含0.5% CMC-Na 的生理盐水搅拌均匀,配制成混悬液,给药剂量均为100 mg/kg),于0、0.083、0.25、0.5、0.75、1、2、3、4、6、8、12、24、36、48、72 h 眼眶取血,置于肝素处理的EP 管中,10 000 r/min 离心10 min 得血浆,保存于-80 ℃冰箱中。
2.3.2 UPLC-MS/MS 分析
2.3.2.1 色谱条件 Waters ACQUITYUPLC®BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相乙腈-水(含0.03% 甲酸)(80∶20);体积流量0.3 mL/min;柱温35 ℃;样品温度4 ℃;进样量2 μL。
2.3.2.2 质谱条件 电喷雾离子源(ESI);正离子扫描;薯蓣皂苷元去簇电压71.96 V,碰撞电压23.03 eV;丹参酮ⅡA 去簇电压120 V,碰撞电压25.92 eV;离子对m/z415.2~271.2(薯蓣皂苷元)、m/z295.2~277.1(丹参酮ⅡA)。
2.3.3 方法学考察 参照2020 年版《中国药典》附录生物样品定量分析方法验证指导原则,对专属性、线性范围、精密度与准确度、提取回收率与基质效应、稳定性进行方法学考察,发现均符合相关规定。
2.3.4 结果分析 精密量取50 μL 大鼠血浆,加入50 μL 内标溶液(41.85 ng/mL)涡旋30 s,再加入250 μL 甲醇-乙腈(1∶1)涡旋2 min,13 000 r/min 离心15 min,取上清液,在“2.3.2”项条件下进样测定,血药浓度-时间曲线见图9,主要药动学参数见表1。
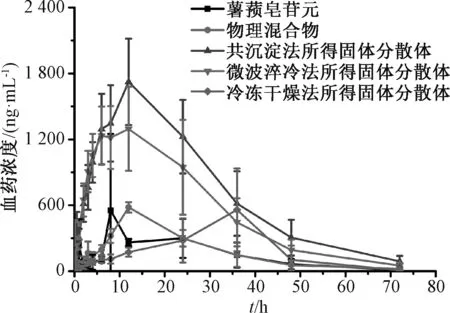
图9 薯蓣皂苷元血药浓度-时间曲线(±s, n=6)Fig.9 Plasma concentration-time curves for diosgenin solid dispersions(±s, n=6)
表1 薯蓣皂苷元主要药动学参数(±s, n=6)Tab.1 Main pharmacokinetic parameters for diosgenin(±s, n=6)
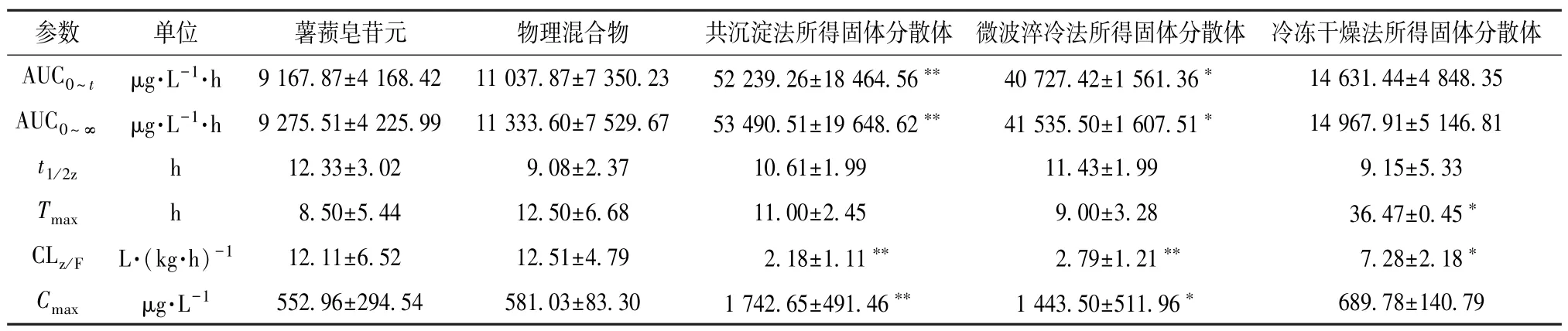
表1 薯蓣皂苷元主要药动学参数(±s, n=6)Tab.1 Main pharmacokinetic parameters for diosgenin(±s, n=6)
注:与薯蓣皂苷元比较,*P<0.05,**P<0.01。
由此可知,共沉淀法、微波淬冷法所得固体分散 体AUC0~t、AUC0~∞、Cmax高于原料药(P<0.05,P<0.01),以前者更明显(P<0.01);固体分散体Tmax较原料药均有所延长,但仅冷冻干燥法所得有显著差异(P<0.05),推测Soluplus 可能延缓薯蓣皂苷元吸收,但效果不明显;固体分散体CLz/F均低于原料药(P<0.05,P<0.01),以共沉淀法、微波淬冷法所得更明显(P<0.01)。再计算相对生物利用度F,公式为F=(AUC0~∞固体分散体/AUC0~∞原料药)×100%,测得共沉淀法、微波淬冷法、冷冻干燥法所得固体分散体分别为576.69%、447.80%、161.37%,即前2 种制备工艺可大大提高原料药生物利用度。
3 讨论
本实验发现,共沉淀法、微波淬冷法所得固体分散体中原料药以无定形态存在,药物与载体之间存在相互作用,润湿性提高,而药物润湿性的改善、从结晶状态到无定形的转变[10]、药物与载体分子间的氢键效应都有利于增强原料药溶出,进而提高其生物利用度。Karmwar 等[15]报道,虽然上述2 种制备工艺所得固体分散体中药物均为无定形态,但由于整个体系分子结构不同,故其溶出率也有所差异,与本实验结果一致。与原料药比较,冷冻干燥法所得固体分散体溶解度提高程度不明显,虽然采用0.1% SDS 作为溶出介质可增加其溶出度,但原料药在冷冻干燥过程中发生了重结晶,最终仍有一部分以结晶状态存在,这可能是其生物利用度较低、体内外不相关的原因。综上所述,共沉淀法所得固体分散体的性能优于其他制备工艺所得。
润湿性对药物的释放和吸收起到至关重要的作用,润湿程度或范围与在液体、固体之间界面形成的平衡接触角和润湿速度有关[16]。本实验采用动态模型拟合了水在压块上的接触角曲线,发现所有分布图均与幂函数方程拟合良好。水的渗透速率或扩散速率与拟合方程中指数的绝对值呈正相关,故可对薯蓣皂苷元固体分散体的溶解机理进行初步预测[17]。本实验发现,薯蓣皂苷元固体分散体幂方程指数的绝对值高于薯蓣皂苷元幂方程指数,表明Soluplus 的加入提高了水渗透性,同时在润湿过程中固液界面通过重排存在更多亲水基团,从而提高润湿速率。
不同方法所制备固体分散体的溶出速率、稳定性、形貌、粒径往往不同,因此有必要合理选择相关工艺。微波淬冷法是通过微波能源快速改变药物晶体状态,实现其快速无定形化,而且微波熔融物经过极速淬冷来保持无序化程度,这是它可增加药物溶出的重要原因[18-19],但在制备过程中没有实时搅拌等混合功能,可能会造成样品受热不均,进而导致药物和载体熔融不均匀,可能影响成品效果,同时微波加热温度会很高,可能使得药物不稳定,上述因素都会影响药物最终的溶出效果;冷冻干燥法所用溶剂为水,虽可溶解载体,但并不能使药物完全溶解,而是形成混悬液,在冷冻、升华过程中一部分可形成无定形态,但另一部分仍以晶体形式存在,故会影响药物溶出;共沉淀法采用有机溶剂将药物和载体混合均匀后呈现溶解状态,在溶剂挥发过程中形成均一的无定形态,而且经冷冻固化后保持了无定形态。薯蓣皂苷元由于脂溶性强,可能更适宜将其溶解成分子后再形成无定形态,本实验发现,共沉淀法对该成分溶出度、生物利用度的提高程度更明显。
