吲哚菁绿清除试验联合总胆红素留存率对人工肝治疗HBV相关慢加急性肝衰竭患者短期预后的评估价值
2023-03-14都泓莲马琳坤胡甜甜盛云建陈文邓存良
都泓莲, 李 烨, 王 波, 马琳坤, 胡甜甜, 盛云建, 陈文, 吴 刚, 邓存良
西南医科大学附属医院 感染科, 四川 泸州 646000
在我国,HBV相关慢加急性肝衰竭(HBV-ACLF)是最常见的肝衰竭类型[1],病死率高,及早判断病情及预后,早期干预,可明显提高救治率。对于肝衰竭患者的预后判断是临床上非常困难的问题,常用的评分系统包括Child-Turcotte-Pugh(CTP)评分、终末期肝病模型(model for end-stage liver disease,MELD)评分等。吲哚菁绿15分钟滞留率(indocyanine green retention rate at 15 minutes, ICG R15)和肝有效血流量(effective hepatic blood flow, EHBF)为临床上常用的反映肝脏储备功能的敏感指标,有研究[2-4]表明ICG R15可以预测HBV-ACLF患者的短期病死率,敏感度较高,联合预测模型对短期预后判断的准确性优于单一指标。人工肝支持系统可降低ACLF患者的病死率,为治疗ACLF的有效手段之一[5]。因此,对经人工肝治疗的肝衰竭患者,构建预测模型时应考虑人工肝这一治疗因素。反映人工肝治疗前后TBil变化水平的常用指标有TBil反弹率(total bilirubin rebound rate, TBRR)、TBil留存率(total bilirubin actual resident rate, TBARR)和TBil清除率(total bilirubin clearance rate, TBCR),有研究[6]证明TBRR能预测ACLF患者人工肝治疗后的短期病死率;亦有研究[7]发现TBARR对人工肝治疗后HBV-ACLF的预后预测能力优于TBRR。本研究在吲哚菁绿(indocyanine green, ICG)清除试验基础上联合了反映人工肝治疗前后TBil变化的指标,建立新的联合预测模型,探讨其对人工肝治疗HBV-ACLF短期预后的预测价值。
1 资料与方法
1.1 研究对象 选取2017年6月—2021年7月本院感染科住院的经人工肝治疗的HBV-ACLF患者。乙型肝炎的诊断符合我国《慢性乙型肝炎防治指南(2019年版)》[8],肝衰竭的诊断符合我国《肝衰竭诊治指南(2018年版)》[9]中ACLF诊断标准。排除标准:其他病因(包括自身免疫性、药物性、酒精性、中毒性、寄生虫性等)导致ACLF;合并甲、丙、丁、戊型肝炎病毒或巨细胞病毒、EB病毒等其他嗜肝病毒感染者;抗HIV抗体阳性者;临床诊断为原发性肝癌,行手术切除、γ射线治疗等;行肝移植术后者;合并其他严重的全身性疾病和精神病患者;妊娠或哺乳期妇女、尿毒症患者、甲状腺功能亢进患者、碘试剂过敏者;病历资料、实验室检测数据、ICG清除试验信息不完整者。
1.2 研究方法
1.2.1 治疗及分组 对于ACLF患者的治疗均按照《肝衰竭诊治指南(2018年版)》[9],进行内科标准治疗,包括针对病因如核苷(酸)类抗病毒药物治疗、促肝细胞生长素、甘草酸、多烯磷脂酰胆碱、输新鲜冰冻血浆等综合治疗,及针对并发症的相关处理。所有患者在内科标准治疗基础上,接受人工肝支持治疗,模式为血浆置换(plasma exchange, PE)联合双重血浆分子吸附系统(dual plasma molecular absorption system, DPMAS):经患者股静脉建立循环通路,先进行DPMAS治疗,血浆灌流量约6000 mL,随后进行PE,置换血浆总量1400 mL。每次人工肝治疗间隔2~3 d,每次约3 h。根据3个月(以入院确诊ACLF为起点计算)随访的转归情况将纳入患者分为存活组和死亡组。
1.2.2 临床资料及实验室指标的收集 患者的血常规、生化、电解质、凝血检验、乙型肝炎标志物、HBV DNA定量等检测均由本院检验科完成。记录患者的一般情况、主要临床特征和人工肝治疗情况。收集入院确诊ACLF时基线实验室指标:包括血常规(WBC、中性粒细胞计数、中性粒细胞百分比、淋巴细胞计数、Hb、PLT)、生化电解质(ALT、AST、ALP、GGT、TBil、Alb、肌酐、血清Na)、凝血(PT、PTA、INR)、乙型肝炎标志物、HBV DNA定量、AFP等指标,同时收集首次人工肝治疗前后(术前、术后即刻)及人工肝治疗48 h后(术后48 h)的TBil、INR、肌酐。采用第一次人工肝治疗前后TBil水平来计算相关指标:TBCR=(TBil术前-TBil术后即刻)/TBil术前×100%;TBRR=(TBil术后48 h-TBil术后即刻)/TBil术后即刻×100%;TBARR= TBil术后48 h/TBil术前×100%。参照CTP分级标准[10]计算基线CTP评分;利用公式[11]计算基线MELD评分,根据首次人工肝前后的指标计算出MELD差值(ΔMELD)=MELD术前-MELD术后即刻。
1.2.3 ICG清除试验检测ICG R15、EHBF ICG检测应用日本光电工业株式会社研发的DDG-3300K分析仪和配套分析软件,试剂为注射用ICG注射液(25 mg/支),由辽宁丹东医创药业有限责任公司生产。检查前应禁食6~8 h,禁饮4 h,将其Hb(g/dL)、体质量(kg)、身高(cm)输入DDG分析仪,以每公斤体质量0.5 mg用药来计算ICG给药量,以5 mL无菌注射用水稀释25 mg ICG,配成浓度为5 mg/mL的ICG溶液。患者取平卧位,将鼻探头消毒后连接于患者鼻翼处,观察血氧饱和度和脉率信号,待信号平稳后开始检测,自肘静脉处5~10 s内均匀注入配制好的ICG溶液,先得到血容量和K值(ICG血浆清除率),仪器自动拟算出ICGR15、EHBF指标。
1.3 统计学方法 应用SPSS 19.0软件和MedCalc软件进行统计分析。偏态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验。计数资料两组间比较采用χ2检验。应用二分类Logistic回归分析的方法,分析人工肝治疗HBV-ACLF患者短期死亡的影响因素,并结合临床实际,建立预测模型。应用受试者工作特征(ROC)曲线下面积(AUC)评估各种模型对人工肝治疗HBV-ACLF短期预后判断的准确性,AUC的比较采用Z检验;根据ROC曲线各点对应的敏感度和特异度获得Youden指数(敏感度+特异度-1)的最大值,确定最佳临界值。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入HBV-ACLF患者136例,其中男117例,女19例,年龄18~71岁,中位年龄为50(42~56)岁,肝硬化者70例。共行人工肝411次,每例患者1~7次,中位次数为3(3~4)次。3个月随访的转归情况显示,存活者92例,死亡者44例,病死率为32.35%(44/136)。
2.2 存活组和死亡组各项指标比较 存活组与死亡组的临床和生化等各项指标比较结果显示,死亡组的年龄、中性粒细胞百分比、中性粒细胞计数、ALP、TBil、PT、INR、TBRR、TBARR、MELD评分、ΔMELD、CTP评分、ICG R15及肝性脑病发生率高于存活组,而淋巴细胞计数、PLT、GGT、pAlb、Alb、血清Na、PTA、Fib、EHBF低于存活组,差异均有统计学意义(P值均<0.05)(表1)。
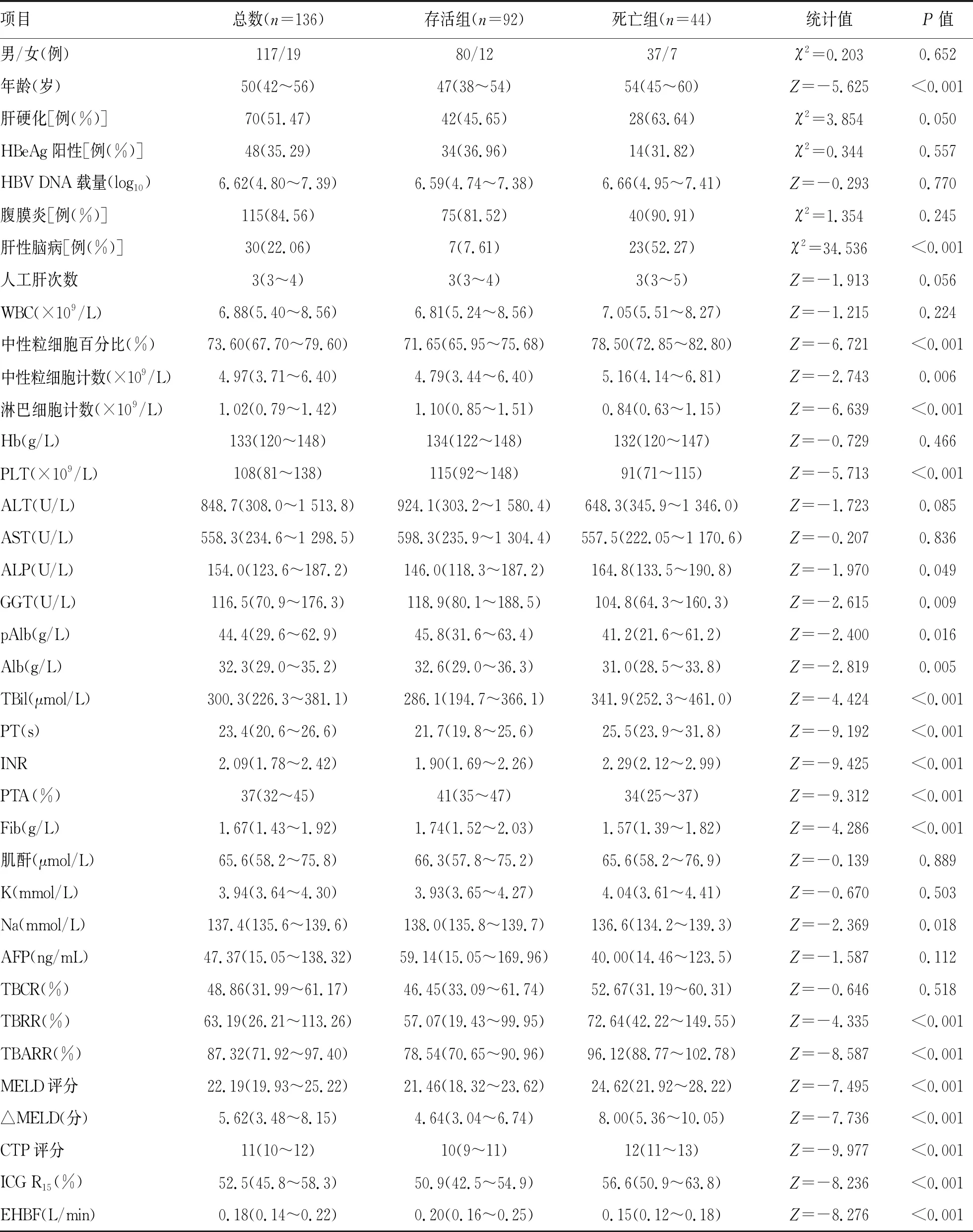
表1 存活组和死亡组各项指标比较
2.3 联合预测模型的构建及ROC曲线分析 用单因素分析中差异有统计学意义的指标作为自变量进行多因素Logistic回归分析,结果显示年龄(OR=1.096,95%CI:1.056~1.137,P<0.001)、中性粒细胞计数(OR=1.214,95%CI:1.044~1.411,P=0.012)、TBRR(OR=0.989,95%CI:0.982~0.996,P=0.001)、TBARR(OR=1.073,95%CI:1.049~1.098,P<0.001)、ΔMELD(OR=1.480,95%CI:1.288~1.701,P<0.001)、CTP评分(OR=2.081,95%CI:1.585~2.732,P<0.001)和ICG R15(OR=1.116,95%CI:1.067~1.168,P<0.001)是经人工肝治疗HBV-ACLF患者短期死亡的独立影响因素。将回归分析结果结合临床实际,进一步构建出4种联合预测模型:TBRR-ICG R15、TBARR-ICG R15、TBARR-ICG R15-ΔMELD、TBARR-ICG R15-ΔMELD-年龄,回归公式分别为0.009×TBRR+0.134×ICG R15-8.528、0.057×TBARR+0.121×ICG R15-12.151、0.055×TBARR+0.122×ICG R15+0.262×ΔMELD-13.606、0.054×TBARR+0.128×ICG R15+0.245×ΔMELD+0.057×年龄-16.698。4种联合预测模型的AUC分别为:0.830、0.867、0.900、0.917(图1,表2)。4种联合模型AUC两两比较结果显示,TBARR-ICG R15-ΔMELD和TBARR-ICG R15-ΔMELD-年龄的AUC明显高于TBRR-ICG R15,TBARR-ICG R15-ΔMELD-年龄的AUC明显高于TBARR-ICG R15(P值均<0.05)。单项指标AUC两两比较结果显示,TBARR、ΔMELD、MELD评分、CTP评分、ICG R15的AUC明显高于中性粒细胞计数,TBARR的AUC明显高于TBRR(P值均<0.05)。联合模型与单项指标间AUC两两比较结果显示,TBRR-ICG R15的AUC明显高于年龄、中性粒细胞计数、TBRR、ICG R15;TBARR-ICG R15的AUC明显高于除CTP评分以外的单项指标;TBARR-ICG R15-ΔMELD和TBARR-ICG R15-ΔMELD-年龄的AUC均显著高于所有单项指标(P值均<0.05)。联合模型TBARR-ICG R15-ΔMELD和TBARR-ICG R15-ΔMELD-年龄的敏感度和特异度均较高(>80%)(表2)。
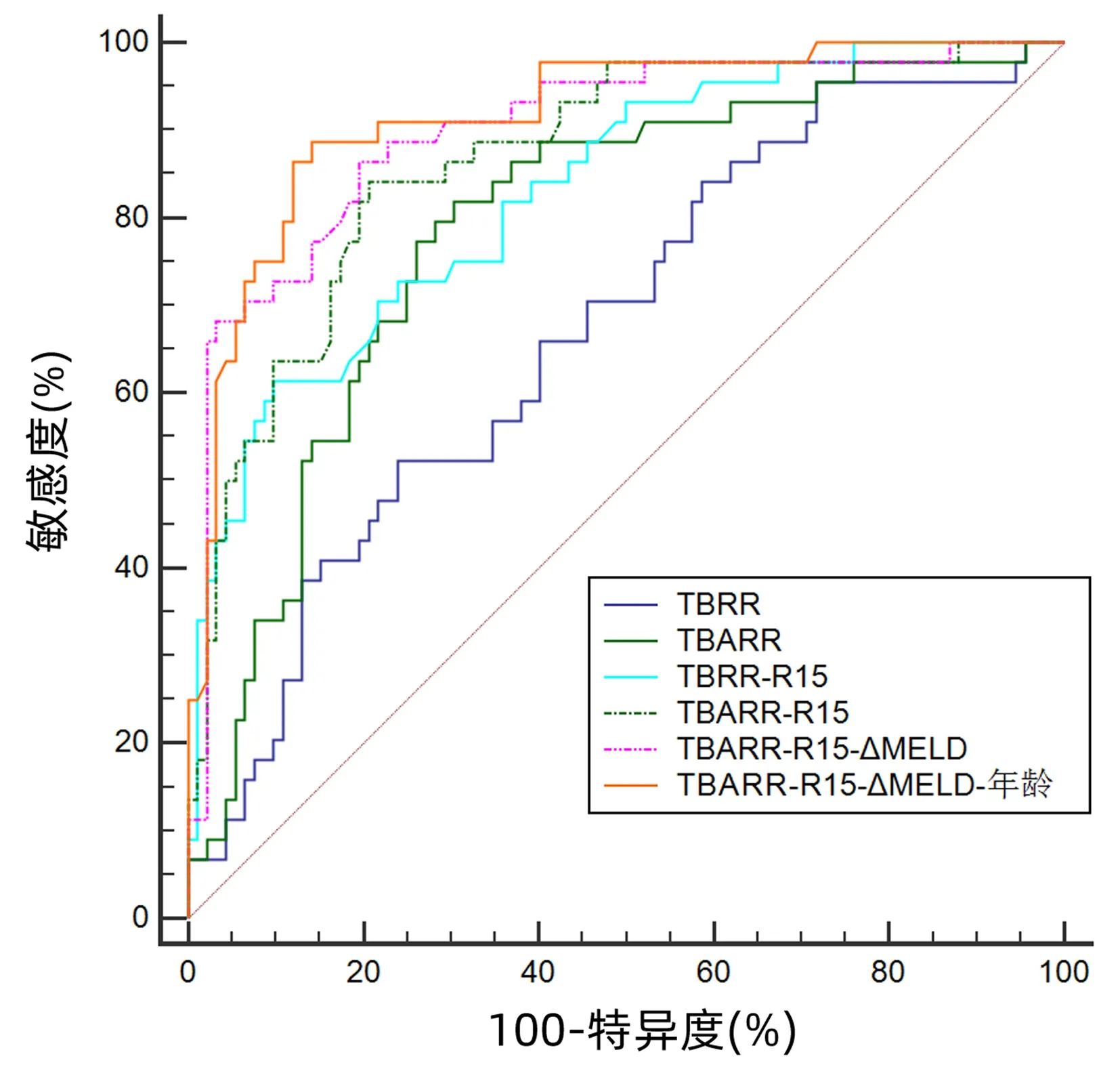
图1 部分单项指标和联合预测模型的ROC曲线
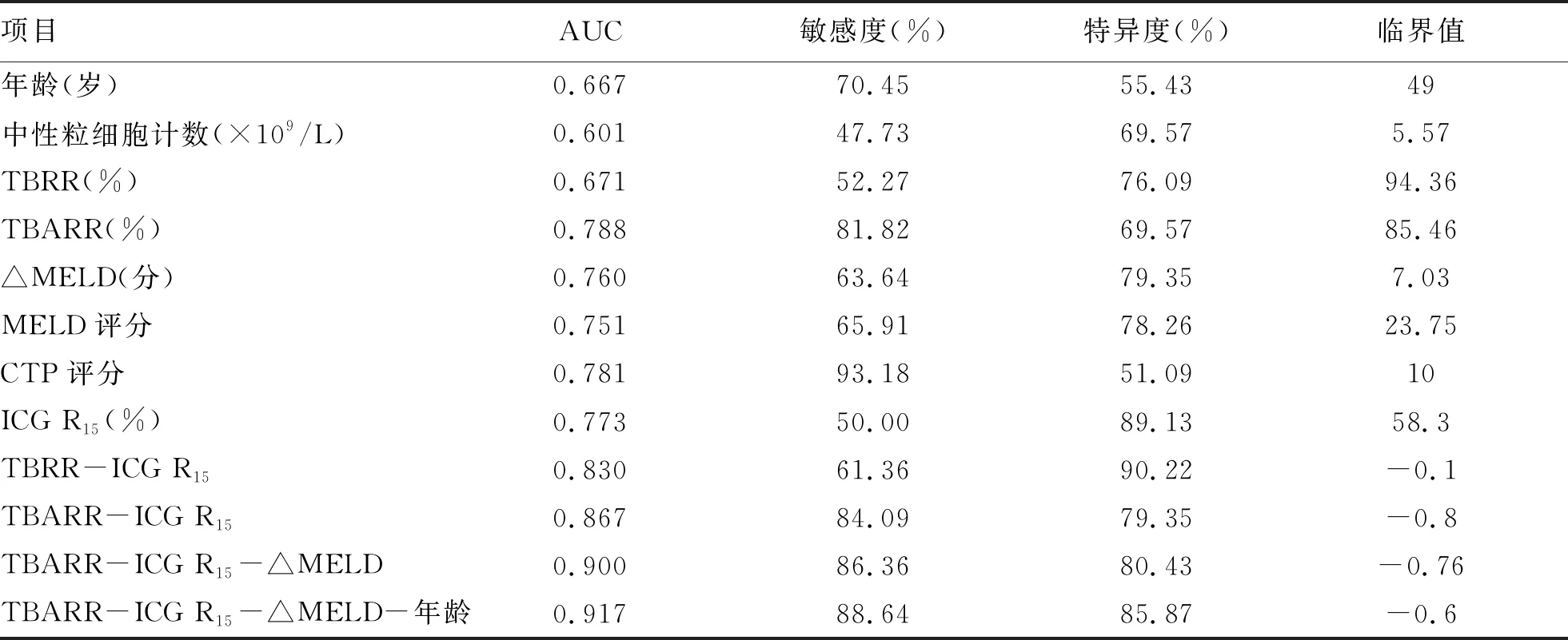
表2 单项指标和联合预测模型的AUC、敏感度、特异度及临界值
3 讨论
ACLF是在慢性肝病基础上,因急性诱因的作用,短期内发生急性肝功能失代偿的严重肝病综合征,因其进展迅猛、病死率高,一直是临床面临的难题[12]。虽然肝移植仍是最有效的救治方法[13],然而因肝源有限、费用昂贵及移植排斥反应等众多因素的限制,难以成为ACLF的主流治疗手段。因此,对于HBV-ACLF患者,在抗病毒、保肝、输注新鲜冰冻血浆、对症等内科综合支持治疗基础上进行人工肝支持治疗仍是目前主要的治疗手段。人工肝支持治疗不仅能清除肝衰竭患者血液中过量的胆红素及促进肝细胞坏死的炎性介质、细胞因子等有毒物质,还能补充大量凝血因子,为肝细胞再生及肝功能恢复争取时机、创造环境,其确切疗效及安全性已经被临床所认可[14]。有学者[15]通过对898例HBV-ACLF患者的研究发现,血浆灌注联合PE治疗显著逆转了器官衰竭,降低了HBV-ACLF患者的死亡风险。与单纯PE相比,DPMAS联合PE可更有效地改善ACLF患者的TBil水平,提高HBV-ACLF中晚期患者的28 d生存率,因此,DPMAS+PE可能是治疗HBV-ACLF的一种有效方法[16]。
人工肝支持系统已被证明可显著降低ACLF患者的病死率,短期疗效确切,已成为肝移植外另一有效手段,更是终末期肝衰竭患者等待移植的关键桥梁[5,17]。在应用人工肝治疗肝衰竭的临床实践中发现,即使积极给予人工肝干预,也不能完全避免部分患者病情进展恶化甚至死亡,而人工肝较之标准内科治疗也存在费用较贵、使用更多血浆资源的问题。如果能在疾病早期或人工肝治疗初期对肝衰竭患者的预后作出较准确的评估,对临床治疗方案的选择及医疗资源的合理分配具有指导意义。MELD评分和CTP评分为国内外较常用的传统预后评分系统,在本研究中,死亡组患者人工肝治疗前的基线MELD评分、CTP评分显著高于存活组,二者的AUC分别为0.751、0.781,提示MELD评分与CTP评分对经人工肝治疗后HBV-ACLF患者的短期预后有较好的预测价值。CTP评分在肝性脑病和腹水的判断评估方面易存在主观性,腹水的增减会受利尿剂影响,Alb水平亦与是否输注Alb相关,且CTP评分的特异度较低,为51.09%,临床使用上可能存在差异。MELD评分较CTP评分相对客观,本研究发现ΔMELD的AUC(0.76)稍高于MELD,虽无统计学差异,但有一定趋势,提示MELD的动态水平变化对疾病预后的评估可能更为准确。ICG清除试验是动态反映肝脏储备功能的经典且较敏感的方法,ICG R15为临床上评估肝储备功能的常用指标,笔者团队的前期研究[4]表明ICG R15可以预测HBV-ACLF患者的短期预后,其AUC为0.787,构建的联合预测模型MELD-ICG R15较单项模型在HBV-ACLF预后评估中的准确性更优。本研究中ICG R15的AUC为0.773,与CTP评分、MELD评分及ΔMELD比较差异无统计学意义,提示ICG R15与传统的指标相比具有相似的预测效力。
然而肝衰竭发病机制复杂,疾病最终的转归往往由患者年龄、病情轻重、治疗方案选择、并发症发生以及合并症等综合因素共同决定,故单一指标预测HBV-ACLF患者的病死率价值有限,利用逻辑回归的方法建立包含多项指标的联合模型是目前的研究方向[18-20]。人工肝支持系统已经成为治疗ACLF的重要治疗手段,因此在构建联合预测模型时,除了纳入反映患者病情严重程度的基线指标,还需兼顾人工肝治疗因素的影响。高胆红素血症是肝衰竭典型临床表现之一,人工肝治疗后血清TBil水平即有明显下降,随后多数患者不可避免地会出现不同程度的TBil反弹现象,反弹高低与患者病死率呈正相关[21-22]。TBRR、TBARR等为常用的评估人工肝疗效的指标,其以人工肝治疗前后TBil变化为基础,计算简单,但二者对肝衰竭患者预后的预测能力高低,以往研究结果不一致[6-7]。本研究发现TBRR、TBARR在死亡组和存活组之间差异有统计学意义(P值均<0.001),为患者短期死亡的独立影响因素;进一步行ROC曲线分析,TBARR的AUC为0.788,高于TBRR(AUC=0.671),差异有统计学意义(P<0.05)。与TBRR相比,TBARR除了反映人工肝治疗后胆红素反弹情况,同时兼顾了治疗前基线的胆红素水平,故TBARR预测价值更大,与临床上常通过比较患者两次人工肝治疗前的胆红素变化来粗略评估疗效一致。本研究结果显示,除TBRR、TBARR以外,人工肝后HBV-ACLF患者短期死亡的独立危险因素还有年龄、中性粒细胞计数、ΔMELD、CTP评分以及ICG R15,结合临床客观性考量及预测效能,最终,笔者构建的4种联合预测模型(TBRR-ICG R15、TBARR-ICG R15、TBARR-ICG R15-ΔMELD、TBARR-ICG R15-ΔMELD-年龄)的AUC均>0.8,其中,联合模型TBARR-ICG R15-ΔMELD、TBARR-ICG R15-ΔMELD-年龄的AUC分别为0.900、0.917,高于所有单项模型,且二者敏感度和特异度均在80%以上,提示其对人工肝治疗HBV-ACLF患者短期预后的预测价值更高。
本研究针对经过人工肝治疗的HBV-ACLF患者探讨短期预后评估模型,在评估肝脏储备功能敏感指标(ICG R15)基础上联合了反映人工肝疗效的指标(TBARR),考虑了人工肝治疗措施对预后的影响,同时纳入ΔMELD和年龄指标,建立新的联合预测模型,预测效能良好,为临床决策制订提供参考,利于提高患者生存率和节约医疗资源。但仍存在纳入研究对象例数有限的不足,未来可继续扩大样本量以减少偏倚风险,纳入不同中心来源的数据对预测模型进行验证,并可继续研究其动态监测疾病预后的价值,进一步探索验证,希望能够构建判断人工肝治疗HBV-ACLF患者短期预后的理想模型。
伦理学声明:本研究方案于2022年1月7日经由西南医科大学附属医院伦理委员会审批,批号:KY2022003。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:都泓莲、李烨、盛云建负责课题设计,资料分析,撰写论文;都泓莲、王波、马琳坤、胡甜甜参与收集数据,修改论文;陈文、吴刚、邓存良负责拟定写作思路,指导撰写文章。
