基于药物代谢酶的乌头碱配伍鞣花酸、甘草苷减毒机制研究
2023-03-11李晗宋玲高云航陈腾飞侯红平彭博张广平叶祖光
李晗,宋玲,高云航,陈腾飞,侯红平,彭博,张广平,叶祖光
中国中医科学院中药研究所,北京 100700
蒙医药是蒙古族人民与疾病抗争过程中积累的特色医学理论与用药方法,是我国四大民族医药之一。草乌为毛茛科植物北乌头的干燥块根[1],作为蒙药传统药材之一,具有杀“黏”、燥“协日乌素”及止痛功效[2]。草乌代表成分为双酯型生物碱,主要包括乌头碱、次乌头碱与新乌头碱等,这些成分既是毒性成分也是药理成分。由于草乌具有毒效并存的特点,蒙医药常用诃子汤炮制法、诃子及甘草与草乌配伍等方式减毒[3-4]。诃子,蒙语“阿如拉”,为使君子科植物诃子或绒毛诃子的干燥成熟果实,具有调理体素、解毒之效,被誉为“蒙药之王”[5]。诃子含有大量鞣质,其中具有抗炎、抗氧化、护肝作用的鞣花酸为代表成分之一[6]。甘草为豆科植物甘草、胀果甘草、光果甘草的干燥根和根茎,在中药和蒙药中均有解毒功效[7]。甘草苷作为甘草黄酮类代表成分之一,具有护肝、抗肿瘤等药理作用[8]。课题组前期通过动物实验研究草乌配伍诃子、甘草对细胞色素P450(CYP450)酶的调控作用,发现草乌可下调CYP1A2和CYP3A4表达,而诃子、甘草与草乌配伍后可上调其表达,减少乌头类生物碱在体内的蓄积时间,起到减毒作用[9]。本研究观察各药物代表性成分乌头碱、鞣花酸与甘草苷配伍对CYP450的调控作用,明确其减毒作用机制。
1 材料与方法
1.1 细胞
人肝癌HepG2细胞株,购于中国医学科学院基础医学研究所。
1.2 药物与试剂
乌头碱(批号110720-200410),中国药品生物制品检定所;鞣花酸(批号L941795)、甘草苷(批号L468830)、CYP3A4诱导剂利福平(批号L588536)、CYP2C9诱导剂卡马西平(批号L72556),北京百灵威科技有限公司;CYP1A2诱导剂2,3,7,8-四氯二苯并二噁英(TCDD,批号ED-901-A),美国Cerillant公司;胎牛血清(批号10099-141),美国Gibco公司;CCK8细胞增殖试剂盒(批号CK04-202107),日本Dojindo公司;Hoechst33342(批号C1022-20210331)、乳酸脱氢酶(LDH)细胞毒性试剂盒(批号20210614),上海碧云天科技有限公司;MitoTrackerTMRed CMXRos(批号2256813)、CellROX®Green Reagents染料(批号2201587),美国Invitrogen公司;反转录试剂盒、(批号P20329)、RT-PCR试剂盒(批号M51219),北京全式金生物技术股份有限公司;BCA蛋白定量试剂盒(批号VJ312549),美国Thermo Scientific公司;Western blot配胶试剂盒(批号CW0022M),北京康为世纪公司;CYP1A2(货号19936-1-AP)、CYP2C9(货号16546-1-AP)、CYP3A4(货号18227-1-AP)一抗,美国Proteintech公司; HRP标记山羊抗兔IgG(货号ab205718),英国Abcam公司。
1.3 仪器
HERA cell 150i细胞培养箱(美国Thermo公司),Microfuge 22R型台式高速离心机(美国Beckman公司),CKX53型倒置显微镜(日本Olympus公司),MK100-4A微孔板恒温孵育器(上海珂淮仪器有限公司),Cytation 5细胞成像多功能检测系统(美国Bio-Tek公司),NanoDrop One核酸浓度测定仪(美国Thermo公司),SpectraMax i3x型多标记酶标仪(美国Molecular Devices公司),CFX96 Touch Real-Ti型RTPCR仪(美国Bio-Rad公司),SCILOGEX 180-E摇床(杭州奥盛仪器有限公司),Amersham Imager 680凝胶成像仪(美国GE公司)。
1.4 细胞培养
HepG2细胞用含10%胎牛血清、1%非必需氨基酸和1%青链霉素的DMEM培养基,置于37 ℃、5%CO2饱和湿度培养箱培养,待细胞融合至70%~80%时,以1∶3比例传代,取对数生长期细胞用于实验。
1.5 CCK8法测定细胞活力
HepG2细胞以2×105个/孔接种于96孔板,常规培养,待细胞融合至80%时,换为空白DMEM培养基饥饿培养12 h,将细胞分为乌头碱组、鞣花酸组、甘草苷组、乌头碱+鞣花酸组、乌头碱+甘草苷组、乌头碱+鞣花酸+甘草苷组,各药物终浓度分别为10、20、50、100 μmol/L,另设空白组(只接种细胞、不加药)和调零组(不接种细胞、加入空白培养基),分别培养24、48 h后,加入CCK8 10 μL继续孵育30~60 min,测定光密度(OD值),计算细胞存活率。细胞存活率(%)=(OD实验组-OD调零组)÷(OD空白组-OD调零组)×100%。
1.6 LDH法检测细胞毒性
将细胞按“1.5”项下方法处理,另设空白组和最大酶活性组(均接种细胞、不加药),继续培养24、48 h,于24、48 h前1 h取出培养板,向最大酶活性组加入原液总体积10%的LDH释放试剂,继续孵育至24、48 h,吸取上清液,向上清液中加入检测工作液60 μL,室温避光振摇30 min,测定OD值,计算细胞死亡率。细胞死亡率(%)=(OD实验组-OD空白组)÷(OD最大酶活性组-OD空白组)×100%。
1.7 高内涵分析
HepG2细胞以2×105个/孔接种于黑色板壁透明板底96孔板,常规培养,待细胞融合至80%时,分别加入20 μmol/L乌头碱(乌头碱组)和20 μmol/L乌头碱+鞣花酸+甘草苷(配伍组),另设空白组(只接种细胞、不加药),培养48 h后弃去原培养基,PBS洗细胞2次。将Hoechst33342、CellROX®Green Reagents、Mito TrackerTMRed CMXRos染料加入各孔内(100 μL/孔),37 ℃、5%CO2培养箱继续孵育45 min,弃染料混合液,PBS清洗,每孔加PBS 100 μL,上机检测,第一通道波长350、461 nm,第二通道波长485、520 nm,第三通道波长579、599 nm。采用Gen5软件进行分析,细胞数目为第一通道荧光数目,细胞核内DNA含量为第一通道荧光强度,活性氧(ROS)含量为第二通道细胞质与细胞核的荧光强度,线粒体膜电位(MMP)为第三通道细胞质荧光强度。
1.8 RT-PCR检测
HepG2细胞以1.2×106个/孔接种于6孔板,置于37 ℃、5%CO2培养箱培养,待细胞融合至80%时,换为空白DMEM培养基培养12 h,将细胞分为诱导剂组(5 nmol/L TCDD+10 μmol/L卡马西平+10 μmol/L利福平)、乌头碱组(20 μmol/L)、鞣花酸组(20 μmol/L)、甘草苷组(20 μmol/L)和配伍组(乌头碱+鞣花酸+甘草苷,均为20 μmol/L),分别处理细胞48 h。提取总RNA,测定RNA浓度和纯度,将RNA反转录为cDNA,采用SYBER Green法进行RT-PCR。反应条件:94 ℃预变性30 s,94 ℃、5 s,60 ℃、30 s,72 ℃、10 s,共40个循环。2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。

表1 各基因PCR引物序列
1.9 Western blot检测
将细胞按“1.8”项下方法处理,收集细胞,加入预冷RIPA裂解液100 μL,冰上裂解30 min,4 ℃、12 000 r/min离心10 min,BCA法进行蛋白定量,100 ℃变性5 min,50 μg蛋白经8%SDS-PAGE,将蛋白转移至PVDF膜,室温脱脂牛奶封闭1 h,分别加入CYP1A2、CYP2C9、CYP3A4一抗(均为1∶1 000)和GAPDH一抗(1∶2 000),4 ℃孵育过夜,TBST洗膜3次,滴加二抗(1∶2 000),室温孵育1 h,ECL发光显影,采用Image J软件计算蛋白灰度值,以目的蛋白与GAPDH灰度值比值表示目的蛋白相对表达量。
1.10 统计学方法
2 结果
2.1 乌头碱配伍鞣花酸、甘草苷对HepG2细胞活性的影响
培养24、48 h时,随着药物浓度增加,乌头碱、鞣花酸、甘草苷组细胞存活率较空白组均有下降趋势,其中100 μmol/L乌头碱组差异有统计学意义(P<0.01,P<0.001);鞣花酸、甘草苷与乌头碱配伍给药后,在浓度为100 μmol/L时细胞存活率显著降低(P<0.001),见表2。因此,选择各药物浓度为20 μmol/L进行后续实验。
表2 各组HepG2细胞存活率比较(±s,%)
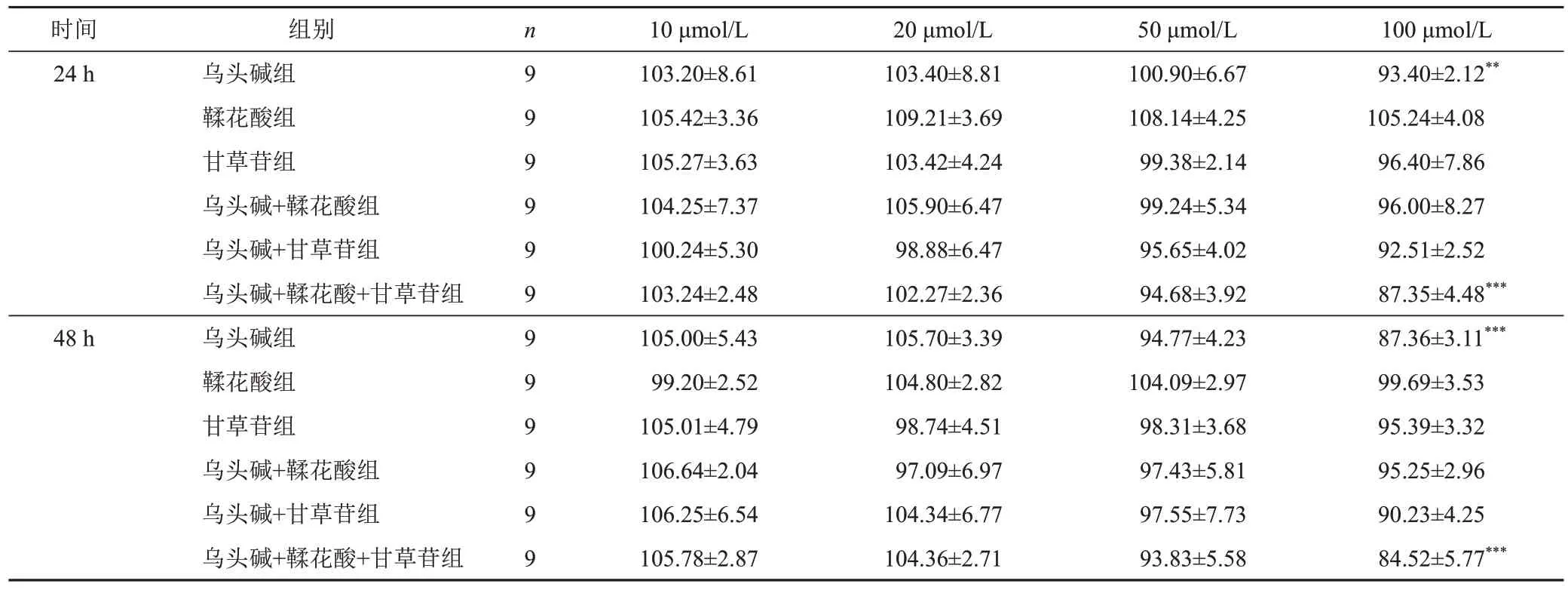
表2 各组HepG2细胞存活率比较(±s,%)
注:空白组细胞存活率以100%计;与空白组比较,**P<0.01,***P<0.001
时间24 h 48 h组别乌头碱组鞣花酸组甘草苷组乌头碱+鞣花酸组乌头碱+甘草苷组乌头碱+鞣花酸+甘草苷组乌头碱组鞣花酸组甘草苷组乌头碱+鞣花酸组乌头碱+甘草苷组乌头碱+鞣花酸+甘草苷组n 9 9 9 9 9 9 9 9 9 9 9 9 10 μmol/L 103.20±8.61 105.42±3.36 105.27±3.63 104.25±7.37 100.24±5.30 103.24±2.48 105.00±5.43 99.20±2.52 105.01±4.79 106.64±2.04 106.25±6.54 105.78±2.87 20 μmol/L 103.40±8.81 109.21±3.69 103.42±4.24 105.90±6.47 98.88±6.47 102.27±2.36 105.70±3.39 104.80±2.82 98.74±4.51 97.09±6.97 104.34±6.77 104.36±2.71 50 μmol/L 100.90±6.67 108.14±4.25 99.38±2.14 99.24±5.34 95.65±4.02 94.68±3.92 94.77±4.23 104.09±2.97 98.31±3.68 97.43±5.81 97.55±7.73 93.83±5.58 100 μmol/L 93.40±2.12**105.24±4.08 96.40±7.86 96.00±8.27 92.51±2.52 87.35±4.48***87.36±3.11***99.69±3.53 95.39±3.32 95.25±2.96 90.23±4.25 84.52±5.77***
2.2 乌头碱配伍鞣花酸、甘草苷对HepG2细胞毒性的影响
培养24、48 h时,与空白组比较,随着药物浓度增加,乌头碱、鞣花酸与甘草苷组细胞死亡率呈上升趋势,其中100 μmol/L乌头碱组、100 μmol/L乌头碱+甘草苷组、100 μmol/L乌头碱+鞣花酸+甘草苷组细胞死亡率显著升高(P<0.05,P<0.01,P<0.001);100 μmol/L乌头碱+鞣花酸组48 h细胞死亡率显著升高(P<0.01)。结果见表3。
表3 各组HepG2细胞死亡率比较(±s,%)

表3 各组HepG2细胞死亡率比较(±s,%)
注:空白组细胞死亡率以0%计;与空白组比较,*P<0.05,**P<0.01,***P<0.001
时间24 h 48 h组别乌头碱组鞣花酸组甘草苷组乌头碱+鞣花酸组乌头碱+甘草苷组乌头碱+鞣花酸+甘草苷组乌头碱组鞣花酸组甘草苷组乌头碱+鞣花酸组乌头碱+甘草苷组乌头碱+鞣花酸+甘草苷组n 9 9 9 9 9 9 9 9 9 9 9 9 10 μmol/L 0.779±0.426-3.076±2.192-1.316±0.491-2.880±0.351-2.559±1.533-3.178±0.345-0.991±0.178-1.794±1.595-2.638±1.182-2.828±1.464-2.874±1.656-3.307±1.048 20 μmol/L-0.923±0.339 0.539±0.771-1.302±0.492-2.002±1.249-2.224±1.801-1.541±1.685-2.732±1.218-2.004±1.349-2.554±1.498-2.914±0.501-2.534±1.884-2.448±2.048 50 μmol/L 0.338±0.590 0.927±0.462 0.138±0.930 0.922±3.436 0.749±3.108-1.244±4.413-1.878±1.093 1.692±1.190 0.315±0.642 0.817±4.155 2.543±3.201 0.865±3.851 100 μmol/L 4.314±2.105***2.044±2.694 1.367±3.318 3.283±1.776 4.733±2.871*8.517±2.406**5.256±2.166***3.058±1.512 2.094±1.962 7.905±2.070**6.784±0.948**8.386±3.140**
2.3 乌头碱配伍鞣花酸、甘草苷对HepG2细胞数目、DNA含量、活性氧含量和线粒体膜电位的影响
与空白组比较,乌头碱组细胞ROS含量显著增加,MMP显著降低(P<0.05),细胞数目和DNA含量差异无统计学意义,配伍组细胞数目、DNA和ROS含量、MMP差异均无统计学意义(P>0.05),见图1、表4。
表4 各组HepG2细胞高内涵分析比较(±s)
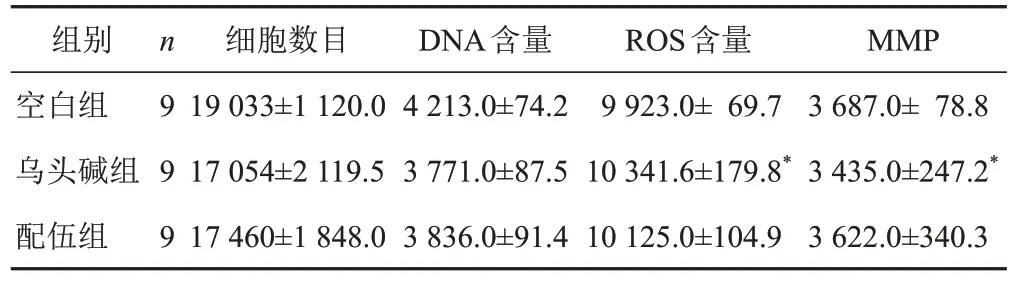
表4 各组HepG2细胞高内涵分析比较(±s)
注:与空白组比较,*P<0.05
组别空白组乌头碱组配伍组n 9 9 9细胞数目19 033±1 120.0 17 054±2 119.5 17 460±1 848.0 DNA含量4 213.0±74.2 3 771.0±87.5 3 836.0±91.4 ROS含量9 923.0± 69.7 10 341.6±179.8*10 125.0±104.9 MMP 3 687.0± 78.8 3 435.0±247.2*3 622.0±340.3
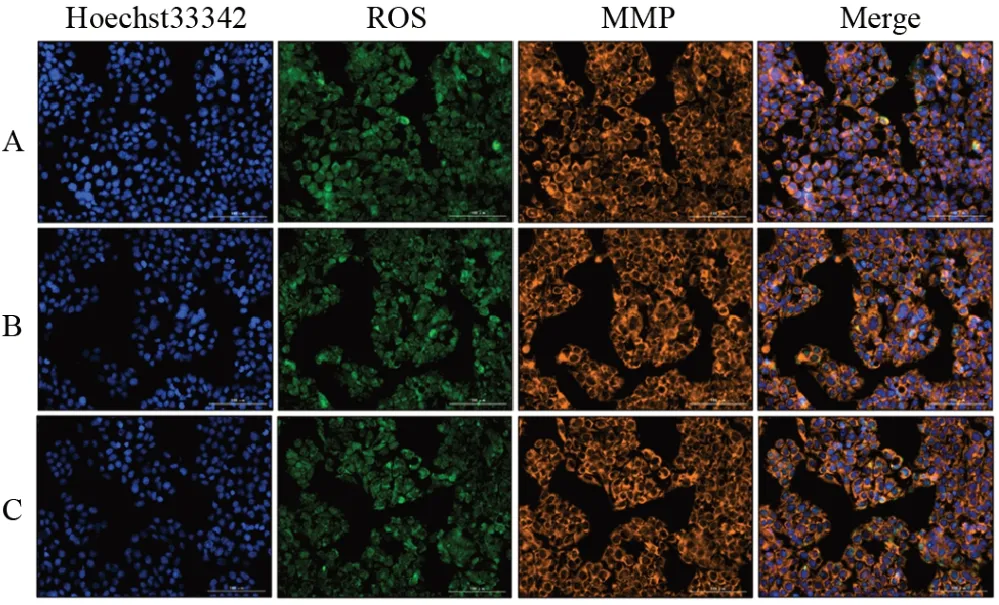
图1 各组HepG2细胞高内涵分析(×20)
2.4 乌头碱配伍鞣花酸、甘草苷对HepG2细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达的影响
与空白组比较,诱导剂组细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达显著升高(P<0.001),乌头碱组细胞CYP1A2、CYP3A4 mRNA表达显著降低(P<0.05),鞣花酸组细胞CYP1A2、CYP2C9 mRNA表达降低,CYP3A4 mRNA表达升高,但差异无统计学意义(P>0.05),甘草苷组细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达显著升高(P<0.01,P<0.05),配伍组细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达升高,但差异无统计学意义(P>0.05);与乌头碱组比较,配伍组细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达显著升高(P<0.01,P<0.05)。结果见表5。
表5 各组HepG2细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达比较(±s)
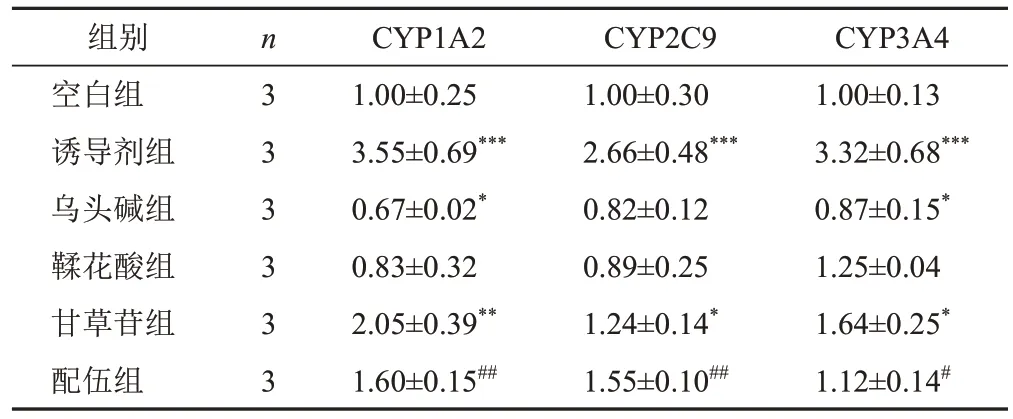
表5 各组HepG2细胞CYP1A2、CYP2C9、CYP3A4 mRNA表达比较(±s)
注:与空白组比较,*P<0.05,**P<0.01,***P<0.001;与乌头碱组比较,#P<0.05,##P<0.01
组别空白组诱导剂组乌头碱组鞣花酸组甘草苷组配伍组n 3 3 3 3 3 3 CYP1A2 1.00±0.25 3.55±0.69***0.67±0.02*0.83±0.32 2.05±0.39**1.60±0.15##CYP2C9 1.00±0.30 2.66±0.48***0.82±0.12 0.89±0.25 1.24±0.14*1.55±0.10##CYP3A4 1.00±0.13 3.32±0.68***0.87±0.15*1.25±0.04 1.64±0.25*1.12±0.14#
2.5 乌头碱配伍鞣花酸、甘草苷对HepG2细胞CYP1A2、CYP2C9、CYP3A4蛋白表达的影响
与空白组比较,诱导剂组细胞CYP1A2、CYP2C9、CYP3A4蛋白表达显著升高(P<0.001),乌头碱组细胞CYP1A2、CYP3A4蛋白表达显著降低(P<0.05),鞣花酸组细胞CYP1A2、CYP2C9蛋白表达降低,CYP3A4蛋白表达升高,但差异无统计学意义(P>0.05),甘草苷组细胞CYP1A2、CYP2C9、CYP3A4蛋白表达显著升高(P<0.01,P<0.05),配伍组细胞CYP1A2、CYP3A4蛋白表达显著升高(P<0.01,P<0.05);与乌头碱组比较,配伍组细胞CYP1A2、CYP3A4蛋白表达显著升高(P<0.001)。见图2、表6。
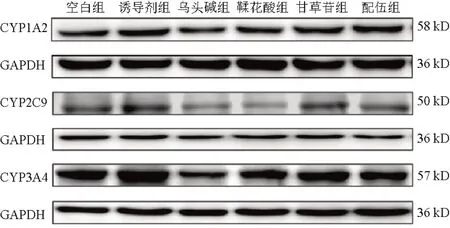
图2 各组HepG2细胞CYP1A2、CYP2C9、CYP3A4蛋白免疫印迹
表6 各组HepG2细胞CYP1A2、CYP2C9、CYP3A4蛋白表达比较(±s)

表6 各组HepG2细胞CYP1A2、CYP2C9、CYP3A4蛋白表达比较(±s)
注:与空白组比较,*P<0.05,**P<0.01,***P<0.001;与乌头碱组比较,###P<0.001
组别空白组诱导剂组乌头碱组鞣花酸组甘草苷组配伍组n3 3 3 3 3 3 CYP1A2 1.00±0.00 2.13±0.08***0.81±0.09*0.82±0.22 1.51±0.14**1.49±0.16**###CYP2C9 1.00±0.00 2.23±0.28***0.85±0.15 0.81±0.18 1.41±0.38*1.14±0.05 CYP3A4 1.00±0.00 2.51±0.18***0.72±0.07*1.14±0.11 1.58±0.16**1.38±0.10*###
3 讨论
草乌又称“泵嘎”,蒙医理论认为其味辛,性温、效轻,有大毒,具有治疗“赫依”“赫如虎”“陶赖”、脖颈僵直与游痛症等功效,临床多用于治疗肺心病、脑萎缩、脑血管病、急慢性肠刺痛及丹毒等。药理研究发现,草乌具有抗炎、抗氧化、抗肿瘤、强心、扩张血管及镇痛等作用[10]。根据《中华人民共和国卫生部药品标准·蒙药分册》记载,在145个蒙药中含草乌成分的有20个(13.79%)[11]。查阅相关蒙医药历史文献发现,草乌配伍解毒方法可追溯至公元前200年。临床除外用生草乌外,蒙医多以炮制品入药,即选择与诃子配伍或以诃子汤炮制[12]。19世纪《蒙药正典》指出,含草乌的方剂必须搭配诃子[13]。在中医与蒙医理论中,甘草均具有调和众药与降低毒性作用,因此临证多将草乌等有毒药材与诃子、甘草进行配伍使用[14-15]。现阶段关于诃子、甘草解草乌之毒的机制研究颇多,其热点多集中于药物配伍比例[16]、配伍后物质基础变化[17-18]及胃肠道吸收动力改变[19]等,然而相关作用机制尚未明确。本实验从CYP450角度出发,选取草乌、诃子、甘草的代表性成分乌头碱、鞣花酸与甘草苷,通过检测其对HepG2细胞CYP1A2、CYP2C9、CYP3A4 mRNA和蛋白表达的影响,探讨乌头碱配伍鞣花酸、甘草苷减毒的作用机制。
CYP450是其基因超家族编码的一群蛋白酶,作为重要的Ⅰ相代谢酶,参与多种内源物与外源物的生物转化。大部分CYP450酶分布于肝脏,因此肝脏成为药物代谢最重要的器官[20]。肝脏与药物代谢密切相关的酶为CYP1、CYP2、CYP3[21]。研究发现,若一种药物对CYP450酶活性产生影响,受影响的CYP450酶能使其本身或其他药物代谢发生改变,影响药物之间相互作用,进而参与药物减毒增效机制的关键环节[22]。同时,相较于酶诱导产生的不良反应,因酶抑制而引发的不良反应占比更高[20]。
乌头类生物碱作为草乌最具代表性的毒效并存成分,在人及啮齿类动物体内主要通过水解代谢、脱甲基代谢、脱氢代谢和羟化代谢等途径代谢,此部分代谢主要由CYP1A、CYP2C、CYP3A介导[23-25]。本研究结果显示,乌头碱能下调CYP1A2和CYP3A4表达,使有毒的乌头类生物碱在体内蓄积时间延长,毒性增加。而与鞣花酸、甘草苷配伍后,CYP1A2和CYP3A4表达上调,减少乌头碱在体内蓄积时间,从而起到减毒作用。因此,我们推测草乌配伍诃子、甘草减毒的机制主要是乌头碱配伍鞣花酸、甘草苷后,上调CYP450相关mRNA转录及蛋白翻译,使乌头碱在体内代谢加快,减少蓄积毒性。本研究可为草乌的合理应用提供实验基础,并为传统民族医药现代化研究提供新思路。
