罗格列酮对小鼠卵母细胞体外成熟的影响
2023-03-08张笑梦金庆国
张笑梦,金庆国*
(1.延边大学 农学院 吉林省延边黄牛种质资源保护工程研究中心,吉林 延吉 133002;2.延边大学 东北寒区肉牛科技创新教育部工程研究中心,吉林 延吉 133002)
胚胎体外培养是大量生产胚胎的有效途径之一。在胚胎体外培养过程中,培养基的营养结构、pH值、渗透压、环境中氧气浓度以及温度湿度等培养条件都影响着胚胎的体外发育[1]。在哺乳动物卵母细胞成熟过程中,应激因素的存在,使卵母细胞内的氧化代谢产物增加或自身抗氧化保护机制不足,引起卵母细胞内活性氧(ROS)堆积。
在生理条件下,ROS有多种来源,包括线粒体呼吸链(主要来源)、NADPH 氧化酶、黄嘌呤氧化酶、脂氧合酶、一氧化氮合酶和环氧合酶[2]。由于ROS的强氧化性,过度堆积时会攻击卵母细胞的生物大分子物质,如核酸、蛋白质、脂质等[3]。大量研究表明,ROS的堆积会导致细胞内稳态破坏[4],影响线粒体功能[5]、诱导卵母细胞凋亡,影响纺锤体正常组合从而影响卵母细胞减数分裂,进而影响卵母细胞的体外成熟。卵母细胞的体外成熟是体外胚胎生产的关键,卵母细胞的成熟发育能力对后续的受精率、分裂率以及囊胚率都有直接影响[6]。
为了提高体外胚胎生产效率,抗氧化剂已广泛应用到卵母细胞体外成熟中。罗格列酮(RSG)为过氧化物酶体增殖物激活受体γ(PPARγ)的强效激动剂。PPAR是配体激活型转录因子,它们能与视黄醇X受体形成异二聚体(RXRs),从而调节各种基因转录[7]。有研究表明,RSG可以提高心肌细胞中超氧化物歧化酶(SOD)的表达水平,抑制心肌细胞的凋亡[8]。杨芸瑞等[9]研究发现,RSG可以提高糖尿病大鼠血清中SOD和谷胱甘肽(GSH)的活性,显著降低氧化应激造成的损伤。RSG在肺脏组织中表现出了抗炎抗氧化的特性[10]。虽然RSG已在许多领域获得了广泛关注,但在动物生殖领域,特别是在雌性配子发育过程中的作用鲜有报道。本试验通过在M16成熟培养基中添加RSG,来探究RSG对小鼠卵母细胞体外成熟质量的影响。
1 材料与方法
1.1 实验动物4~6周龄体质量约28 g昆明小鼠,购自延边大学动物实验中心。
1.2 主要试剂及仪器孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)(宁波第二激素厂);M2培养液和M16培养液(南京爱贝生物公司);RSG(Selleck,BRL 49653);体视显微镜(OLYMPUS公司);CO2培养箱(赛默飞世尔科技公司);荧光显微镜(Nikon公司)。
1.3 卵母细胞的采集4~6周龄昆明小鼠腹腔注射10 IU的PMSG,48 h后采用颈部脱臼法处死小鼠,摘取卵巢,放入预平衡过的M2小滴中,在体视显微镜下用注射器划开卵泡,使卵丘-卵母细胞复合物流出,收集卵丘细胞包裹完好的卵母细胞。
1.4 卵母细胞的培养将收集的卵母细胞放入预平衡的M16成熟培养基中,对照组和试验组(RSG组)分别用0,20 μmol/L[11]RSG的M16成熟培养液清洗4次,于38.5℃、5% CO2饱和湿度环境中培养12 h。
1.5 卵母细胞内ROS水平检测用0.1 mol/L PBS按1∶1 000稀释DCFH-DA(南京建成E004-1-1),DCFH-DA工作浓度为10 μmol/L。小鼠卵母细胞经1% BSA的PBS清洗4次后放入10 μmol/L的DCFH-DA中,38.5℃避光培养。15 min后取出卵母细胞,经1% BSA的PBS清洗4次后,置于倒置荧光显微镜下成像,使用Image J软件对荧光图像进行分析。
1.6 卵母细胞内GSH水平检测用0.1 mol/L PBS按1∶1 000稀释CMF2HC,CMF2HC工作浓度为10 μmol/L。小鼠卵母细胞经1% BSA的PBS清洗4次后,放入10 μmol/L的CMF2HC中,38.5℃ 避光培养。15 min后取出卵母细胞,经1% BSA的PBS清洗4次后,置于倒置荧光显微镜下成像,使用Image J软件对荧光图像进行分析。
1.7 卵母细胞内线粒体功能的检测用0.1 mol/L PBS按1∶1 000稀释JC-1,将小鼠卵母细胞经1% BSA的PBS清洗4次,放入稀释的JC-1中,38.5℃培养20 min,取出后用1% BSA的PBS清洗4次,置于倒置荧光显微镜下成像,使用Image J软件对荧光图像进行分析,红色荧光和绿色荧光的比值高低代表线粒体功能强度。
1.8 实时荧光定量qRT-PCR每组收集20个成熟卵母细胞,使用DynaBeads mRNA Direct Kit试剂盒(Dynal Asa,挪威)提取其mRNA,逆转录合成cDNA。实时荧光定量PCR反应体系(20 μL):cDNA 2 μL,SYBR mix 10 μL,引物0.8 μL,ROX Low 0.4 μL,ddH2O 6.8 μL。采用KAPA SYBR®FAST荧光定量试剂盒(Kapa Biossystem,南非)。qRT-PCR反应程序:95℃ 3 s,60℃ 20 s,72℃ 1 s。用2-ΔΔCt法对qRT-PCR结果进行分析。

表1 实时荧光定量PCR引物序列
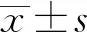
2 结果
2.1 RSG对小鼠卵母细胞第一极体排出率的影响由表2可知,与对照组相比,20 μmol/L RSG处理组的卵母细胞第一极体排出率显著高于对照组(P<0.05)。

表2 RSG对小鼠卵母细胞第一极体排出率的影响
2.2 RSG对小鼠卵母细胞ROS水平的影响由图1可知,20 μmol/L RSG处理组的卵母细胞ROS水平显著低于对照组(P<0.05)。

A.ROS荧光染色图;B.ROS柱状分析图。相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下同
2.3 RSG对小鼠卵母细胞GSH水平的影响由图2可知,20 μmol/L RSG处理组的卵母细胞GSH水平显著高于对照组(P<0.05)。

A.GSH荧光染色图;B.GSH柱状分析图
2.4 RSG对小鼠卵母细胞线粒体功能的影响由图3可知,使用20 μmol/L RSG处理小鼠卵母细胞可显著提高线粒体膜电位水平(P<0.05),提高线粒体功能。
2.5 RSG对小鼠卵母细胞氧化应激相关基因表达的影响由图4可知,与对照组相比,添加20 μmol/L RSG处理小鼠卵母细胞中抗氧化相关基因GPX-3、CAT和SOD-2的mRNA表达水平显著提高(P<0.05)。
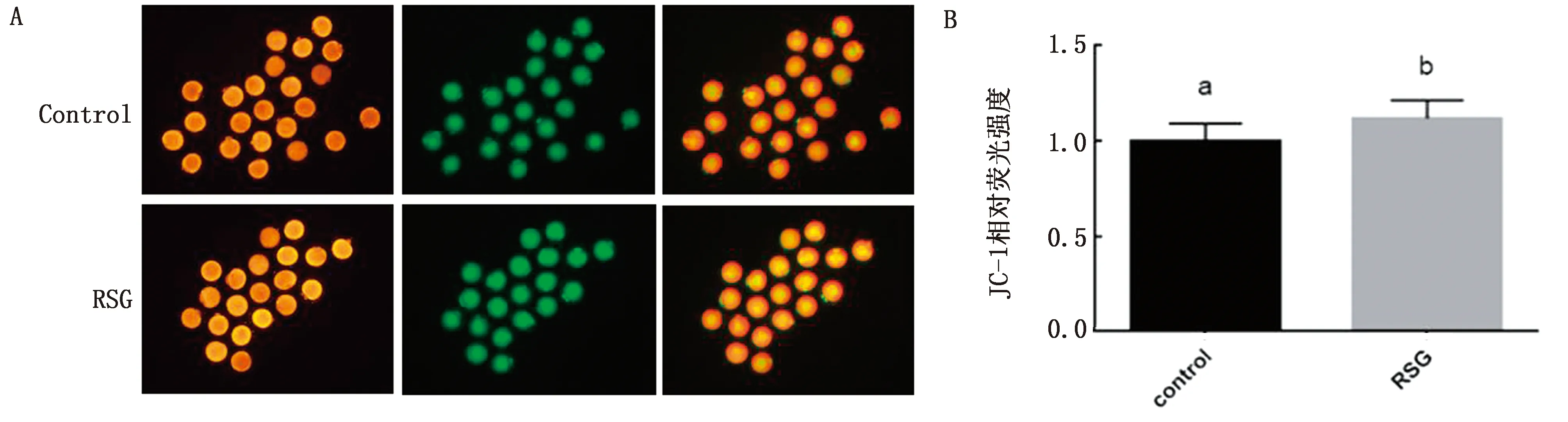
A.JC-1荧光染色图;B.JC-1柱状分析图

图4 RSG对小鼠卵母细胞氧化应激相关基因表达的影响
3 讨 论
本试验向M16培养基中加入20 μmol/L的RSG,通过计算小鼠卵母细胞成熟率,检测小鼠成熟卵母细胞ROS、GSH水平、线粒体功能及抗氧化相关基因的表达来探究RSG对小鼠卵母细胞体外成熟的影响。结果表明,RSG显著降低了卵母细胞内ROS水平,提高了谷胱甘肽酶的活性,改善了线粒体功能,抗氧化相关基因表达相对提高,进而提高了卵母细胞成熟率。
由于暴露于氧化环境和卵母细胞从卵泡保护性抗氧化环境中被分离,卵母细胞内产生的ROS不能被及时中和,使得卵母细胞发育能力遭到破坏造成氧化应激[12]。有研究表明, PPARγ的噻唑烷二酮类药物表现出抗氧化性和抑制细胞凋亡的活性[13]。本试验中,在体外成熟过程中添加RSG后,卵母细胞中ROS的含量明显降低,说明RSG可以有效清除卵母细胞中的ROS。GSH 是一种直接抗氧化剂和几种抗氧化酶的底物[14]。GSH通过谷氨酸半胱氨酸连接酶和谷胱甘肽合成酶催化的双酶反应合成,因其本身含有巯基极易被氧化,所以具有清除自由基以及保护蛋白质和酶等生物大分子巯基的功能,因此GSH水平的高低反映了细胞的还原能力[15]。在本试验中,RSG组相较于对照组,GSH的水平显著提高,这与EL-NAA等[16]的研究结果一致。有研究表明,RSG可以通过促进PPARγ的转录活性,上调CAT和SOD的表达,从而起到抗氧化作用[17],这与本试验结果一致。因此,RSG可以通过调节氧化还原平衡,减少氧化应激造成的损伤。
细胞内的生命活动都离不开线粒体提供能量,因此线粒体功能也是衡量卵母细胞质量的重要指标[18]。线粒体功能障碍会导致卵母细胞质量下降并干扰胚胎发育[19]。在卵母细胞成熟过程中,线粒体功能影响着卵母细胞第一极体排出率以及影响卵母细胞成熟后mtDNA的拷贝数,mtDNA拷贝数对后续的受精和早期胚胎的发育具有重大影响[20]。在本试验中,添加RSG可以提高线粒体膜电位,改善线粒体功能,这与DUNNING等[11]的研究结果一致。
综上所述,在小鼠卵母细胞成熟培养基中添加RSG可以降低卵母细胞内ROS水平,提高GSH水平,改善线粒体功能,提高抗氧化相关基因的表达,提高小鼠卵母细胞成熟率,从而提高了小鼠卵母细胞的质量。
