重组猪干扰素α的原核表达及抗病毒活性
2023-03-08李秀丽张武超雷白时袁万哲
李秀丽,韩 颖,赵 款,张武超,梁 飞,杨 欢,雷白时*,袁万哲*
(1.河北农业大学,河北 保定 071001;2.河北省兽医生物技术创新中心,河北 保定 071001;3.石家庄市动物基因工程药物技术创新中心,河北 石家庄 050800;4.河北伯瑞动物药业有限公司,河北 正定 050800;5.山东省莒南县动物疫病预防控制中心,山东 莒南 276600)
20世纪30年代,人们发现机体感染一种病毒后,会出现阻止另一种毫无关系的病毒增殖的干扰现象(viral interference)[1]。1957年,有报道利用鸡胚绒毛尿囊膜研究流感病毒的干扰现象时,发现被感染的细胞能产生一种因子,称为干扰素(IFN)[2]。IFN在病毒感染和细胞免疫中起着至关重要的作用,是体内的第一道防线。IFN家族分为3种不同的类型:即Ⅰ、Ⅱ、Ⅲ型。Ⅰ型IFN包括IFN-α、IFN-β、IFN-ε、IFN-ω、IFN-κ、IFN-δ、IFN-τ、IFN-ζ[3],IFN-α是其中之一。Ⅱ型仅有γ型1种,含有内含子。Ⅲ型IFN家族(IFN-λ) 由IL-29(IFN-λ1)、IL-28A(IFN-λ2)和IL-28B(IFN-λ3)组成[4]。
在人医方面,IFN的研究较为全面,在动物方面,猪IFN(porcine interferon)是被最早研究的动物IFN之一,20世纪80年代就有关于猪IFN的报道。在各种类型的IFN当中,IFN-α的抗病毒作用最强,是异质性的,可以分为不同的亚型,目前已知有20余种亚型[5]。IFN通过结合细胞膜上的特异性受体,引发信号放大过程,将信号最后传递到细胞核内,对信号下游的基因表达进行调控,引发各种生理反应。在病毒侵袭的各个阶段都有IFN刺激基因(ISGs)的参与,如Mx1、OAS、IFIT1、ISG15等,它们具有抗病毒及免疫调节等多种功能,能够通过不同的途径抵御病毒入侵和复制[6-7]。
我国是养猪大国,病毒性猪病种类繁多,危害巨大。这些猪病的流行特点是病毒变异速度快,发病特征非典型性,并且容易暴发。由于猪IFN-α是一类具有广谱抗病毒、抗肿瘤和免疫调节等多种作用的糖蛋白,所以被广泛应用于病毒性疾病的治疗和预防,这已逐渐引起研究人员的关注[8]。脑心肌炎病毒(EMCV)是一种重要的人畜共患病病原体,感染后可引起动物和人类发生脑炎和心肌炎,以及神经系统疾病、糖尿病和繁殖障碍等多种疾病[9]。猪伪狂犬病病毒(PRV)感染主要是通过控制转录水平实现的,减压阀的基因表达可以分为3个阶段:立即早期基因(IE)、早期基因(E)和晚期基因(L)[10]。已有研究证实PoIFN-α可以有效治疗口蹄疫[11]、猪流行性腹泻[12]、猪繁殖与呼吸综合征等[13]病毒性疾病,但rPoIFN-α是否可以有效抑制EMCV和PRV,相关研究报道较少。
近年来,基因重组技术迅速发展,己广泛应用于各种生物制品的生产。基因工程重组人IFN-α是应用重组技术生产的最早的蛋白药品之一[14],也是当今能自主生产的少数基因工程药物之一,利用基因重组技术获得的人IFN,不仅实现了产业化,同时保留了蛋白的天然活性。鉴于此,本试验将猪IFN-α基因克隆入原核表达载体上,转入大肠杆菌中,由此获得工程菌株,实现高表达。经一系列的体内体外研究发现,rPoIFN-α在体内外均具有良好的抗病毒活性,这为进一步重组蛋白生产的工业化提供了理论依据。
1 材料与方法
1.1 主要材料DMEM培养基、胎牛血清(FBS)购自美国Gibco公司;小鼠96T ELISA试剂盒购自北京冬歌生物技术有限公司;EMCV、PRV、猪睾丸细胞(ST)和猪肾细胞(PK-15)均由本实验室保存;水泡性口炎病毒(VSV)由中国农业科学院上海兽医研究所惠赠;BALB/c小鼠购自北京华阜康生物科技股份有限公司。
1.2 rPoIFN-α的表达、纯化和复性参照GenBank登录的PoIFN-α序列(登录号:KF414740.1)将信号肽序列去除,优化后合成重组质粒pET-32a-PoIFN-α。将重组质粒pET-32a-PoIFN-α 转入感受态细胞 BL21(DE3),使用引物PoIFN-F和PoIFN-R(表1)对单菌落进行鉴定。阳性菌进行扩大培养,按体积比1∶100接种LB中(含Amp),37℃、200 r/min培养,待D600为0.4~0.6时,加入终浓度1.0 mmol/L 的IPTG,诱导4 h,离心收集菌体,超声波破碎(360 W、30%、10 min)2次后,分离上清液和沉淀,进行SDS-PAGE检测。参照Ni-Agatose Resin的纯化步骤进行纯化,采用透析复性法对蛋白进行复性。用0.22 μm 滤膜过滤除菌,分装,-20℃ 保存。
1.3 重组蛋白Western blot检测以Anti-His MousemAb为一抗,按照1∶5 000进行稀释,充分混匀后覆盖在PVDF膜上,室温孵育1 h。以Goat Anti-MouseIgG作为二抗,按照1∶10 000进行稀释,室温孵育1 h,使用ECL显色。
1.4 rPoIFN-α的细胞毒性检测用MTT法测定rPoIFN-α作用PK-15和ST细胞后的活性。PK-15细胞在96孔细胞培养板生长至单层后,取制备好的重组蛋白用含2% FBS的DMEM营养液进行4倍倍比稀释,共稀释8个梯度,每个梯度8个重复孔。每孔100 μL,同时设置蛋白阳性对照孔及细胞阴性对照孔,孵育16~24 h后不弃培养基,加入10~20 μL MTT(质量浓度为5 g/L),包裹锡纸避光,37℃ 4 h。弃掉培养基,加入DMSO,100 μL/孔,避光摇匀,15 min内测定D450值。
1.5 rPoIFN-α在体外的抗病毒活性采用细胞病变抑制法测定rPoIFN-α蛋白在PK-15细胞上抗VSV增殖活性。PK-15在96孔细胞培养板生长至单层后,4倍倍比稀释IFN,共稀释9个梯度,每个梯度8个重复孔。每个梯度取100 μL加至96孔板中,于37℃、5% CO2细胞培养箱中孵育12~16 h,弃去培养液。将保存的VSV、PRV和EMCV溶液用含 2% FBS的DMEM营养液稀释至100 TCID50,每孔加 100 μL。同时设计阳性对照(只用病毒处理),阴性对照(共稀释 64 倍的蛋白处理)和正常细胞对照(不做处理)。当观察到的阳性对照组细胞出现75%以上病变时判定结果,按照Reed-Muench 法计算重组蛋白的抗病毒活性。
1.6 IFN刺激基因的表达水平使用能够完全抑制VSV感染且剂量较低的rPoIFN-α蛋白对PK-15进行孵育,于不同时间(6,12,24,36,48 h)收集细胞,同时设置DMEM组,TRIzol法抽提细胞总RNA,将总RNA样品反转录得到cDNA,引物序列见表1。RT-qPCR反应体系20 μL:2×AgueGreen qPCR Master Mix 10 μL,上、下游引物各1 μL,cDNA模板1 μL,ddH2O 7 μL。反应条件:95℃ 5 min;95℃ 20 s,58℃ 20 s,72℃ 20 s,45个循环;进行熔解曲线分析,95℃ 10 s,65℃ 60 s,97℃ 1 s。
1.7 rPoIFN-α在小鼠体内的抗病毒活性6周龄BALB/c 小鼠25只随机分为5组,分别为对照组、EMCV组、PRV组、 EMCV+rPoIFN-α组和PRV+rPoIFN-α组,EMCV病毒液3×105TCID50/0.1 mL,0.1 mL/只腹腔注射;PRV病毒液5×102TCID50/0.1 mL,0.1 mL/只背部皮下注射,攻毒1 d后腿部肌肉注射重组蛋白,50 μg/只。给药后3,5,7,10,14 d每组尾尖采血,测定血清细胞因子TNF-α、IL-6、IL-10和IL-1β的变化;第14天全部处死,收取脑、心脏、肝脏和脾脏组织测定病毒载量,同时脑部组织测定IE180、EPO转录水平;在整个试验期间记录体质量变化以及根据临床症状进行打分。
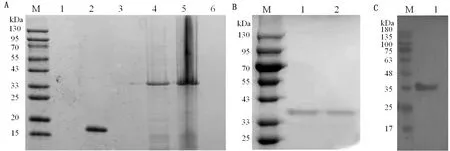
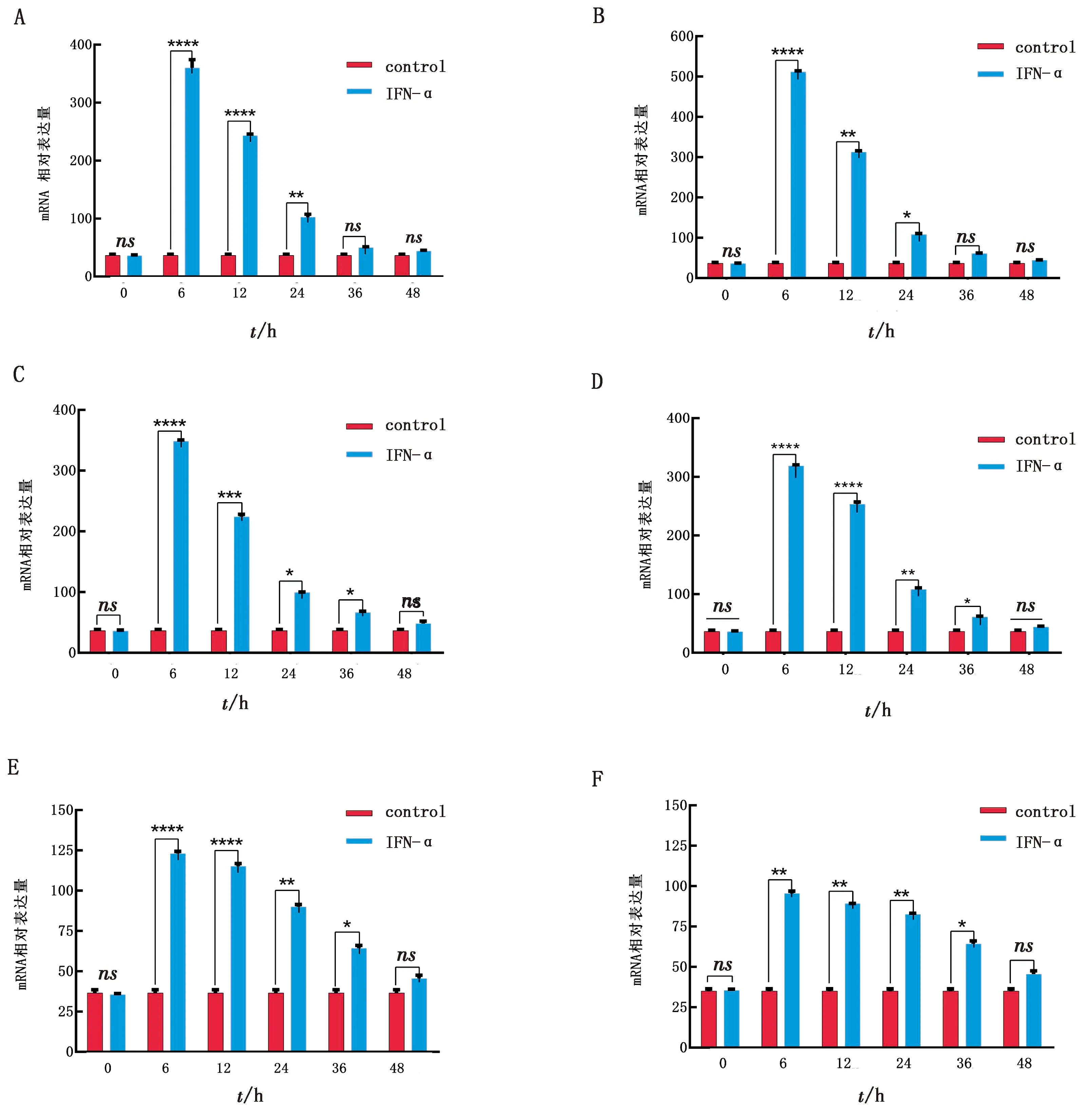
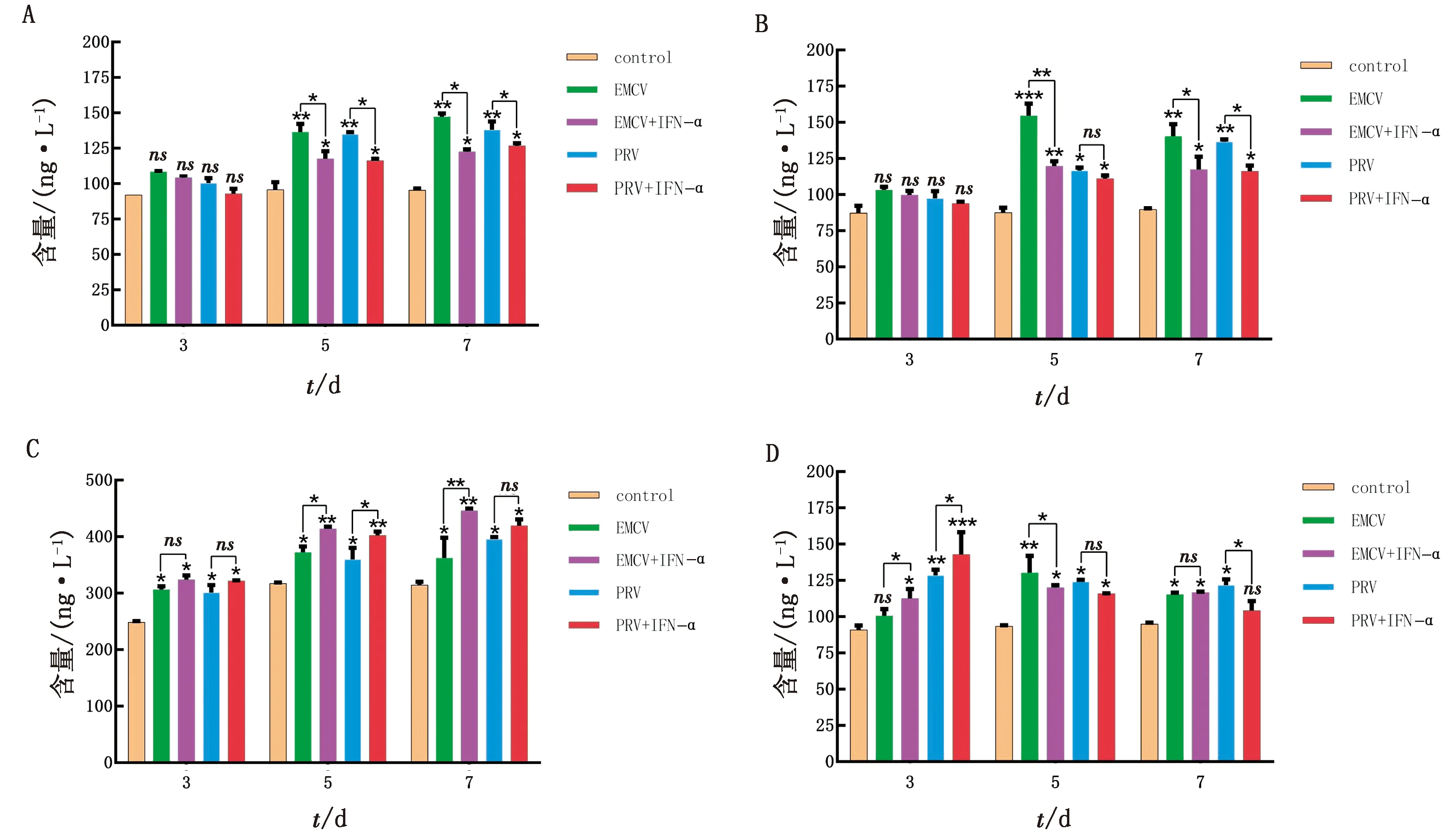
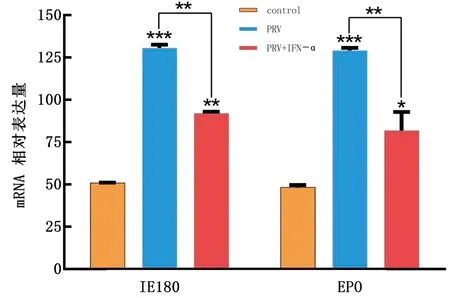
1.8 统计分析每个试验重复3次。所有统计分析均采用SPSS 16.0软件进行,通过RT-qPCR 检测后,数据处理采用 2-△△Ct法计算。以*0.01 表1 引物信息 2.1 rPoIFN-α的表达、纯化和复性将合成的rPoIFN-α小提质粒转入BL21中,经T7通用引物和序列特异性引物鉴定。将成功转化后的阳性菌诱导表达,在1.0 mmol/L的IPTG诱导下进行可溶性分析,分别取诱导前全菌、诱导后的上清、沉淀和空载质粒进行SDS-PAGE分析,结果表明rPoIFN-α为包涵体表达;按照Ni-Agatose Resin的包涵体蛋白纯化说明书进行蛋白的纯化,透析复性后使用Nano Drop2000测定蛋白质量浓度平均为1.0 g/L,并进行SDS-PAGE鉴定,由图1可知,纯化复性后蛋白大小正确(35 kDa),条带单一。经Western blot验证,成功获得特异性目的蛋白。 A.重组蛋白的可溶性鉴定(M.蛋白Marker;1~6.pET-32a空载体未诱导、pET-32a空载体诱导、全菌未诱导、全菌诱导、沉淀、上清);B.重组蛋白纯化与复性(M.蛋白Marker,1~2.分别为纯化和复性后SDS-PAGE,大小为35 kDa);C.重组蛋白Western blot验证(M.蛋白Marker;1.重组蛋白) 2.2 rPoIFN-α的细胞毒性如图2所示,MTT法测定rPoIFN-α对细胞活力的影响,在PK-15和ST细胞上,随着蛋白稀释倍数的增加,其对细胞活性的影响越接近对照组,当稀释度为4-4时,80%以上的细胞未受损伤,这为后续试验提供可能。 A.蛋白作用后PK-15细胞活力;B.蛋白作用后ST细胞活力。**示P<0.01。下同 2.3 rPoIFN-α在体外抗病毒活性通过PK-15/VSV系统检测rPoIFN-α蛋白的抗病毒活性,参照Reed-Muench法,计算距离比例为(高于50%细胞无病变百分比-50%)/(高于50%细胞无病变百分比-低于50%细胞无病变百分比),可得重组蛋白的活性效价为1.25×105U/mL。同理测得rPoIFN-α在PK-15和ST细胞上抗EMCV和PRV的活性(表2)。 表2 rPoIFN-α在不同细胞上抗病毒活性 U/mL 2.4 ISGs转录水平的测定收取rPoIFN-α作用后的PK-15细胞,测定Mx1、OAS、IFIT1、ISG15、MHC-Ⅰ和MHC-Ⅱ的转录水平。结果显示,重组IFN孵育细胞后,与DMEM对照组相比显著上调了各细胞因子,且在6 h时,表达水平达到峰值(图3)。 A~F.ISG15、Mx1、OAS、IFIT1、MHC-Ⅰ和MHC-Ⅱ在0,6,12,24,36,48 h时的表达水平 2.5 rPoIFN-α在小鼠体内抗病毒作用 2.5.1生存曲线 根据试验期间小鼠的死亡情况绘制了生存曲线,如图4所示,EMCV、PRV组在4 d 出现死亡,EMCV、PRV组分别在9,10 d全部死亡,病死率为100%,EMCV治疗组病死率为20%,PRV治疗组病死率为0%。 图4 病毒感染组以及IFN治疗组小鼠的死亡情况 2.5.2各组织器官病毒载量 第14天处死全部小鼠,取脑、心脏、脾脏、肝脏组织,测定各组织的病毒载量,如图5所示,EMCV治疗组脑中病毒载量低于EMCV阳性对照组,呈极显著差异;脾脏中EMCV载量也显著低于对照组。 A.EMCV感染组和rIFN-α治疗组心脏、肝脏、脾脏和脑的病毒载量;B.PRV感染组和IFN-α治疗组心脏、肝脏、脾脏和脑的病毒载量 2.5.3血清细胞因子水平的变化 EMCV和PRV感染后,IL-6、IL-1β、TNF-α的水平升高,重组IFN治疗后5~7 d,三者水平较未感染组略有升高,但仍低于感染组,而治疗组IL-10的水平在3,5,7 d均高于病毒感染组(图6)。 A~D.依次为3,5,7 d时,小鼠血清中TNF-α、IL-1β、IL-10和IL-6的含量 2.5.4临床症状 病毒感染后,观察记录小鼠表现,当出现体质量减轻、被毛粗乱、互相啃咬、采食量降低和神经症状时分别记1分,没有症状记为0分,根据所得分值绘制曲线。结果显示,在第3天时病毒感染组开始出现症状,而重组IFN治疗后在第5天才开始出现轻微的症状(图7)。 2.5.5IE180、EPO的转录水平 取小鼠脑组织,测定其相对表达量。结果显示,病毒感染后IE180和EPO的表达水平均显著高于未感染组和治疗组,这说明用重组IFN治疗后,通过减少2种蛋白的转录,抑制了PRV的增殖,起到抗病毒效果(图8)。 图7 小鼠临床症状得分情况 图8 PRV感染组和IFN-α治疗组小鼠脑组织中IE180、EPO的表达水平 当今猪病形势复杂,病毒性疾病占主导地位,特别是近几年暴发的猪流行性腹泻、猪伪狂犬病给养殖业造成了巨大的经济损失[15]。IFN生物制剂由于其自身优势成为了新的研究热点。1986年,LEFEVRE等[16]首次利用大肠杆菌表达PoIFN-α,因其具有速效多能、无残留、无副作用等特点,且不会对人类健康造成危害,已成为替代化学合成抗病毒药物的理想新药。因此我国学者也相继开展了PoIFN-α的研究,实现了PoIFN-α的体外表达,在生产实践中操作简单、产量大,有良好的应用前景[17]。 本试验成功获得稳定表达的rPoIFN-α,并使用多种体外系统进行了活性测定。其中,VSV/PK-15系统是猪IFN抗病毒活性检测系统中使用最广泛的活性测定方法[18]。本研究表达的rPoIFN-α抗病毒比活性达到1.67×106IU,MTT法测定rPoIFN-α细胞的增殖活性,结果发现,当重组蛋白稀释到4-4时,80%以上的细胞未损伤,这说明rPoIFN-α对猪源PK-15和ST细胞的损伤均在可控范围内,与吴梦矾[19]的研究相比有了较大提升。Ⅰ型 IFN 通过 JAK-STAT 信号通路发出信号,以刺激 ISGs 等抗病毒效应物的产生。通过检测IFN信号通路下游ISGs 的转录水平,能够更直观地证实重组融合蛋白的抗病毒潜力。试验获得的rPoIFN-α在作用PK-15细胞后6 h显著上调Mx1、OAS、IFIT1、ISG15基因的表达水平,结果与报道相一致[20],在检测的细胞因子中,MHC-I和 MHC-Ⅱ的表达不显著,这与其抗病毒机制有关。 在小鼠体内,EMCV和PRV感染组各组织器官的病毒载量均高于IFN-α治疗组,病毒滴度在脑内最高,其原因可能与PRV和EMCV属嗜神经病毒有关。结果表明,rPoIFN-α可以有效抑制病毒粒子在脑、心脏、肝脏和脾脏中的增殖,与病毒感染组相比具有显著性差异。细胞因子参与免疫和炎症反应,在保护身体免受外来病原体侵害方面发挥关键作用,TNF-α、IL-Iβ和IL-6属于促炎因子,参与促进急性炎症反应以防御感染。本研究中,病毒感染后促炎细胞因子IL-1β、IL-6和TNF-α水平升高;这提示PRV和EMCV激活了先天免疫[21]。而rPoIFN-α治疗组,这些促炎细胞因子水平在5 d时低于感染对照组,提示rPoIFN-α可在感染早期减弱炎症反应,抑制病毒复制,在7 d时逐渐恢复正常,避免严重炎症的发生;与此同时,rPoIFN-α治疗组的小鼠体内IL-10水平在5,7 d显著上升,高于病毒感染组,IL-10作为抗炎因子之一,结果表明rPoIFN-α起到了积极的抗病毒作用。根据EMCV和PRV感染小鼠后出现的症状,设置打分标准,对试验期间的小鼠进行观察记录,同时记录小鼠的死亡情况,结果显示,EMCV和PRV感染组在4 d出现死亡,于9,10 d全部死亡,而PRV治疗组全程未出现死亡,EMCV治疗组在6 d死亡2只,其余均存活;根据打分结果,治疗组小鼠出现临床症状较感染组晚,且症状较轻。 病毒复制的关键步骤包括病毒基因转录,因此,通过阻断基因转录抑制病毒增殖是一种有效的方法。IE180是PRV唯一的直接早期基因,是一种可启动早期基因转录的转录激活因子。EPO是PRV复制周期的早期蛋白之一,其水平的高低意味着PRV增殖的快慢。在本研究中,重组猪IFN治疗组IE180和EPO的表达水平均低于PRV感染组,即PRV在小鼠体内增殖速度减慢,这也说明了重组猪IFN可在小鼠体内起到抗PRV的作用。 本试验结果表明,原核表达rPoIFN-α具有理想的体内外抑制PRV和EMCV的活性,为今后rPoIFN-α抑制PRV和EMCV的临床试验奠定了基础。
2 结果





3 讨论
