黄芪丹参提取物改善急性呼吸窘迫综合征大鼠肺损伤的作用和机制研究❋
2023-03-07沈桢巍吴珊珊李佳敏
沈桢巍,石 怡,吴珊珊,李佳敏,陈 伟△
(1.上海中医药大学,上海 201203;2.上海太平康复医院,上海 201315;3.上海中医药大学附属龙华医院,上海 200032)
急性肺损伤(acute lung injury,ALI)是一种因异物或者病原体入侵而导致的以肺水肿为主要特征的临床综合征,发病多为非心源性因素导致,其典型的病理特征为进行性低氧血症并伴随呼吸窘迫(氧合指数<300 mmHg)。ALI快速进展可导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)和患者死亡事件[1,2]。根据2012年欧洲危重症协会主持修订的ARDS诊断标准,临床上依据患者氧合状况将ARDS分成轻、中和重度3级。由于ARDS多发于中老年或体弱者群体,近年来病例数量的上升给我国医疗资源带来了极为沉重的负担。随着经济发展和医疗手段的革新,现阶段对ARDS的临床诊疗也有了极大的进步和改善。但由于ARDS致病因素较为复杂,易被感染、创伤、中毒和(或)理化吸入等多种条件诱发,故其临床诊疗仍是危重症医学所要应对和解决的难题[3,4]。截至目前,虽然已有众多关于ARDS发病机理的解释,但普遍认为ARDS是机体炎症反应的结果。相关研究表明,病原体入侵导致的炎症反应以及肺部中性粒细胞异常且持续性活化与ARDS患者肺组织损伤之间可能存在某种关联[5,6]。在ARDS进展中,患者肺部会呈现一个局部缺氧的环境,低氧条件下中性粒细胞数量会增加,而中性粒细胞的活化又会加剧炎症因子释放和炎症介质的形成,因此中性粒细胞在病理条件下的活化与ARDS患者肺部病变的严重程度可能具有正向关联性[7]。白细胞介素(interleukin,IL)4与其受体IL-4Rα组成的IL-4/IL-4Rα调控通路一直被认为是中性粒细胞炎症活化的重要途径[8]。而黄芪丹参药对已被证实对于各类缺血再灌注导致的心肌、脑组织损伤均具有良好的改善作用,其药效发挥主要基于其抗炎活性[9]。本研究对黄芪和丹参提取物在ARDS大鼠肺损伤中的作用进行评价并初步阐明其作用机制。
1 材料
1.1 动物
40只8周龄健康SD大鼠,体质量180~200 g,购于苏州西山科技有限公司,动物许可证号:SYXK(沪)2017-0003,分笼饲养于海军军医大学动物实验中心SPF级、恒温恒湿环境中,温度为20~24 ℃,相对湿度在(50±0.5)%,实验期间所有大鼠均自由饮水和标准喂食。所有实验操作严格遵守卫生部及海军军医大学动物实验管理条例,伦理学批件编号:2020LCSY065。
1.2 主要药物、试剂与仪器
黄芪丹参提取物由海军军医大学药理教研室提取完成,其中测得黄芪总皂苷含量68.5%,丹参总酚酸含量62.8%。黄芪丹参提取物使用无菌磷酸盐缓冲液配制为1 mg/mL保存母液,黄芪总皂苷与丹参总酚酸的配比为2:5,-20℃条件下保存。
细胞及组织蛋白提取定量试剂盒(货号:785012,78510),化学底物发光试剂盒(货号:32109),肿瘤坏死因子(tumor necrosing factor,TNF)-α、IL-1β和IL-6含量检测试剂盒(货号:ERA56RB, BMS630,KMC0061),RPMI1640细胞培养基(货号:12633012),胎牛血清(货号:10099141),荧光定量检测试剂盒(货号:A25742)和RNA提取试剂(货号:15596018)均购于于美国赛默飞公司;蛋白IL-4Rα,半胱氨酸蛋白酶3水解体(Caspase 3-cleaved)与β肌动蛋白(β-actin)一抗(货号:sc-28361、sc-373730、sc-8432)购于Santacruz公司;羊抗兔二级抗体(货号:ab6721),髓过氧化物酶(myeloperoxidase,MPO)活性检测试剂盒(货号:ab105136)、细胞凋亡检测试剂盒(货号:ab14082)均购于英国艾博抗公司;细菌脂多糖(lipopolysaccharide,LPS)(货号:L2630)和油酸(货号:O1383)为sigma公司产品;中性粒细胞分离液(货号:17-0891-01)购于联硕生物;RNA反转录试剂盒(货号:FSQ-201)为日本TOYOBO公司产品。PCR引物合成由上海生工生物工程有限公司完成。
Varioskan LUX型酶标仪、Attune CytPix型流式细胞仪为美国赛默飞公司产品,DMi1型倒置显微镜为德国徕卡公司产品,CW-SAR-830型小型动物呼吸机为美国CWE公司产品,C7型荧光定量PCR仪为北京同洲维普科技有限公司产品。
2 方法
2.1 给药及ARDS造模
大鼠适应性喂养1周后随机分为5组(n=8)。假手术组:不做处理但通过尾静脉注射给予造模试剂等体积的磷酸盐缓冲液(phosphate buffer saline,PBS);ARDS模型组:通过油酸与LPS诱导法建立ARDS模型;黄芪和丹参提取物(低剂量)治疗组:10 mg/(kg·d)每天灌胃1次,连续给药3 d后,ARDS造模;黄芪和丹参提取物(高剂量)治疗组:30 mg/(kg·d)每天灌胃1次,连续给药3 d,后ARDS造模;IL-4Rα沉默且黄芪和丹参提取物(高剂量)治疗组:给药前24 h通过鼻腔滴加50 μL重组慢病毒Lv-shRNA-IL-4Rα,再予黄芪和丹参提取物高剂量给药和ARDS造模。ARDS模型建立参照Wei Y等[1]大鼠ADRS模型制备方案,即SD大鼠经尾静脉注射0.05 mL/kg油酸,过30 min后再次尾静脉注射2.5 mg/kg的LPS构建ARDS模型。
2.2 标本获取
动物标本获取之前先进行大体观察:监测指标包括大鼠饮食、精神、毛发、应激特征以及步态等外表是否异常,鼠尾是否发绀,呼吸是否困难等。在ARDS造模后6 h,通过异氟烷吸入法麻醉实验大鼠,腹主动脉采血,完整摘除肺组织,去除肺门大血管,在近气管分叉处结扎右主支气管,右肺后叶组织用于肺湿干重比计算,其余右肺组织于液氮中保存。将去尖的注射器针头进入左主支气管,缓慢注入3 mL无菌PBS进行左肺灌洗,约30 s后缓慢、均匀回收PBS洗液。操作共进行3次,肺泡灌洗液(bronchoalveolar lavage fluid,BALF)回收率一般要求大于80%。BALF回收完成后,摘取左肺并在肺内注入4%多聚甲醛溶液,再整体转移至10%福尔马林溶液中固定,进行石蜡包埋和组织切片,用于病理染色。
2.3 肺组织湿干重比检测
剪取大鼠右肺后叶组织,吸水纸清理后,立即转移至铝箔纸,电子天平称重,真空干燥箱55 ℃烘烤72 h,称取组织干重,并计算各组动物的肺湿干重比。
2.4 BALF样本来源中性粒细胞制备及免疫印迹检测
向15 mL无菌离心管中加入3 mL中性粒细胞分离液,再放入3 mL BALF,室温2000×g离心20 min,后溶液出现4层,从上到下依次为:单核细胞层、分离液、中性粒细胞、其余的分离液及其他细胞沉淀。小心吸取自上而下第3层细胞至干净的2 mL离心管,加入1.5 mL的Hank’s缓冲液,离心后丢弃上清液,保留沉淀。重复2次即获得中性粒细胞。提取细胞总蛋白后用于IL-4Rα及Caspase 3-cleaved蛋白表达检测,免疫印迹检测使用浓度为10%的分离胶,兔抗鼠一抗使用稀释比例依次为IL-4Rα,1:500、Caspase 3-cleaved,1:300和β-actin,1:1000。羊抗兔二抗使用稀释比例为1:3000。蛋白相对表达量为目标条带与内参β-actin蛋白的光密度比值。
2.5 肺组织病理学检测及肺损伤评分
肺组织病理切片及HE染色按照常规方案进行。染色完成后将切片置于120×放大倍数光镜下随机选取5个视野,参照肺损伤评分标准(表1)进行评分。对肺泡间隔厚度、肺泡出血情况、肺泡腔或血管壁炎症细胞浸润程度、肺泡内纤维蛋白沉积4项指标,分别依据病变轻重评为0~3分,总分12分。4项评定分数根据相关权重相加所得总分即为肺损伤评分,最后取5个视野肺损伤评分的平均值为最终得分。

表1 肺损伤的组织病理学评分表
肺损伤评分=[平均每视野肺泡间隔增厚点数+平均每视野肺泡出血点数+2×(平均每视野肺泡内炎症细胞浸润点数)+3×(平均每视野肺泡内纤维蛋白沉积点数)]/肺泡总数。
2.6 BALF来源中性粒细胞凋亡检测
将制备好的中性粒细胞重悬于细胞凋亡试剂盒自带的细胞重悬缓冲液,震荡充分混匀后即加入5 μL的Annexin-V/FITC和10 μL体积的碘化丙啶染液,充分混匀后转移至避光处静置15 min,流式细胞仪检测细胞凋亡率。
2.7 BALF炎症因子及肺组织中MPO含量检测
BALF中炎症因子TNF-α,IL-1β和IL-6含量,大鼠肺组织中MPO活性检测,均通过即酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)进行检测,检测步骤及方法严格参照ELISA试剂盒说明书进行。
2.8 肺组织中趋化因子mRNA检测
取液氮保存的大鼠肺组织约100 mg,Trizol法提取总RNA,反转录制备cDNA进行荧光定量PCR检测。PCR反应体系和条件参数设置参照荧光定量检测试剂盒说明书。CCL2上游引物:5’-GTCGGCTGGAGAACTAC-3’,CCL2下游引物:5’-CTTATTGGGGTCAGCACAGA-3’;CCL3上游引物:5’-CCCGACTGCCTGCTGCTTCT-3’,CCL3下游引物:5’-GATCTGCCGGTTTCTCTTGGTCA-3’;CCL17上游引物:5’-ACCAATGTAGGCCGAGAGTGC-3’,CCL17下游引物:5’-GGCCCCCTTGAAGTAGTCCA-3’;β-actin上游引物:5’-GGCCGGGACCTGACAGACTACCTC-3’,β-actin下游引物:5’-GTCACGCACGATTTCCCTCTCAGC-3’。数据分析以β-actin为内参,通过2-ΔCt法计算目标基因表达相对值。
2.9 统计学方法
使用SPSS25.0软件对实验数据进行组间差异分析,数据用均数±标准差表示,GraphPad Prism 7.0作图,两两比较釆用独立样本t检验。以P<0.05表示差异有统计学意义。
3 结果
3.1 肺组织湿干重比测定及肺组织病理学观察及肺损伤评分
与假手术组比较,ARDS模型组大鼠肺组织湿干重比明显增加(P<0.01),而黄芪丹参提取物给药能够以剂量依赖的方式明显降低ARDS大鼠肺组织湿干重比(P<0.05)。结果还表明,IL-4Rα沉默能够明显逆转药物的上述作用,即Lv-shRNA-4Rα感染且黄芪丹参提取物给药的ARDS大鼠肺组织湿干重比明显高于高剂量药物处理组(P<0.05),见图1A。HE染色结果表明,与假手术组比较,ARDS模型组大鼠肺泡上皮明显肿胀,毛细血管扩张充血,肺泡腔体内可见大量介质渗出和大量炎性浸润,肺泡间质呈现明显增生状,肺组织损伤评分明显升高(P<0.01),而黄芪丹参提取物处理组大鼠肺组织的上述病变有所减轻,且药物作用呈现剂量依赖性,其中高剂量治疗组与ARDS模型组比较,差异有统计学意义(P<0.01)。结果还表明,Lv-shRNA-IL-4Rα感染能够明显逆转药物的上述作用,即IL-4Rα沉默且黄芪丹参提取物给药的ARDS大鼠肺组织损伤评分明显高于高剂量药物处理组(P<0.01),见图1B、C。

注:**与Sham组比较P<0.01;#与ARDS组比较P<0.05,##与ARDS组比较P<0.01;^与CASE-H+ARDS组比较P<0.05,^^与CASE-H+ARDS组比较P<0.01。Sham:假手术组;ARDS:模型组;CASE-L+ARDS:黄芪丹参提取物低剂量治疗组;CASE-H+ARDS:黄芪丹参提取物高剂量治疗组;IL-4Rα-RNAi+CASE-H+ARDS:IL-4Rα基因沉默且黄芪丹参提取物高剂量治疗组。A.大鼠肺湿干重比分析(n=8);B.肺组织HE染色(×120放大倍数);C.肺组织损伤评分(n=8)
3.2 中性粒细胞凋亡率检测结果
ARDS模型组大鼠BALF来源中性粒细胞凋亡率稍低于假手术组,但差异无统计学意义(P>0.05),而黄芪丹参提取物处理组大鼠BALF来源中性粒细胞凋亡率与模型组比较明显上调,且呈剂量依赖性(P<0.01)。Lv-shRNA-IL-4Rα感染能够明显逆转药物的上述作用,即与高剂量治疗组比较,IL-4Rα沉默且黄芪丹参提取物处理组ARDS大鼠BALF来源中性粒细胞凋亡率再次降低(P<0.01),见图2。

注:细胞凋亡率表示为前期凋亡和后期调亡率之和;**与Sham组比较P<0.01;^^与CASE-H+ARDS组比较P<0.01。Sham:假手术组;ARDS:模型组;CASE-L+ARDS:黄芪丹参提取物低剂量治疗组;CASE-H+ARDS:黄芪丹参提取物高剂量治疗组;IL-4Rα-RNAi+CASE-H+ARDS:IL-4Rα基因沉默且黄芪丹参提取物高剂量治疗组。
3.3 BALF炎症因子及肺组织中MPO含量检测结果
ELISA检测结果表明,与假手术组比较,ARDS模型组大鼠BALF中炎症因子TNF-α,IL-1β和IL-6含量明显上升(P<0.01)。与模型组比较,黄芪丹参提取物给药的ARDS大鼠BALF中炎症因子TNF-α,IL-1β和IL-6含量明显降低,且呈剂量依赖性,其中高剂量治疗组与ARDS模型组比较,差异有统计学意义(P<0.01)。结果还表明,Lv-shRNA-IL-4Rα感染能够明显逆转药物的上述作用,即IL-4Rα沉默且黄芪丹参提取物给药的ARDS大鼠BALF炎症因子含量再次上调,且明显高于高剂量药物处理组(P<0.05)。MPO活性检测数据表明,MPO在各组动物肺组织中含量与BALF炎症因子变化趋势完全一致,见图3。

注:**与Sham组比较P<0.01;##与ARDS组比较P<0.01;^与CASE-H+ARDS组比较P<0.05,^^与CASE-H+ARDS组比较P<0.01。Sham:假手术组;ARDS:模型组;CASE-L+ARDS:黄芪丹参提取物低剂量治疗组;CASE-H+ARDS:黄芪丹参提取物高剂量治疗组;IL-4Rα-RNAi+ CASE-H+ARDS:IL-4Rα基因沉默且黄芪丹参提取物高剂量治疗组。A.TNF-α;B.IL-1β;C.IL-6;D.MPO
3.4 BALF来源中性粒细胞中IL-4Rα与Caspase-3cleaved蛋白表达检测结果
免疫印迹检测结果表明,与假手术组比较,ARDS模型组大鼠BALF来源中性粒细胞中IL-4Rα表达明显减弱(P<0.01),而黄芪丹参提取物给药组大鼠BALF来源中性粒细胞中IL-4Rα表达明显升高,且呈剂量依赖性,其中高剂量组与ARDS模型组比较,差异均具有统计学意义(P<0.01)。Lv-shRNA-IL-4Rα感染能够明显逆转药物的上述作用,即IL-4Rα沉默且黄芪丹参提取物给药组ARDS大鼠BALF来源中性粒细胞IL-4Rα表达再次下调,且明显低于高剂量药物处理组(P<0.05)。检测结果还表明,Caspase3-cleaved表达变化趋势与IL-4Rα完全一致,见图4。

注:**与Sham组比较P<0.01;##与ARDS组比较P<0.01;^^与CASE-L+ARDS组比较P<0.01;&&与CASE-H+ARDS组比较P<0.01。Sham:假手术组;ARDS:模型组;CASE-L+ARDS:黄芪丹参提取物低剂量治疗组;CASE-H+ARDS:黄芪丹参提取物高剂量治疗组;IL-4Rα-RNAi+ CASE-H+ARDS:IL-4Rα基因沉默且黄芪丹参提取物高剂量治疗组。A.IL-4Rα;B.Caspase 3-cleaved;C.免疫印迹检测目的条带
3.5 肺组织中趋化因子含量检测结果
荧光定量PCR检测表明,与假手术组比较,ARDS模型组大鼠肺组织中趋化因子CCL2,CCL3和CCL17 mRNA表达量显著上升(P<0.01),而黄芪丹参提取物给药组ARDS大鼠肺组织中CCL2,CCL3和CCL17 mRNA表达量明显降低,且呈剂量依赖性,其中高剂量组与ARDS模型组比较,差异具有统计学意义(P<0.05)。Lv-shRNA-IL-4Rα感染能够明显逆转药物的上述作用,即IL-4Rα沉默且黄芪丹参提取物给药组ARDS大鼠肺组织中CCL2,CCL3和CCL17 mRNA表达量再次上调,且明显高于高剂量药物处理组(P<0.05),见图5。
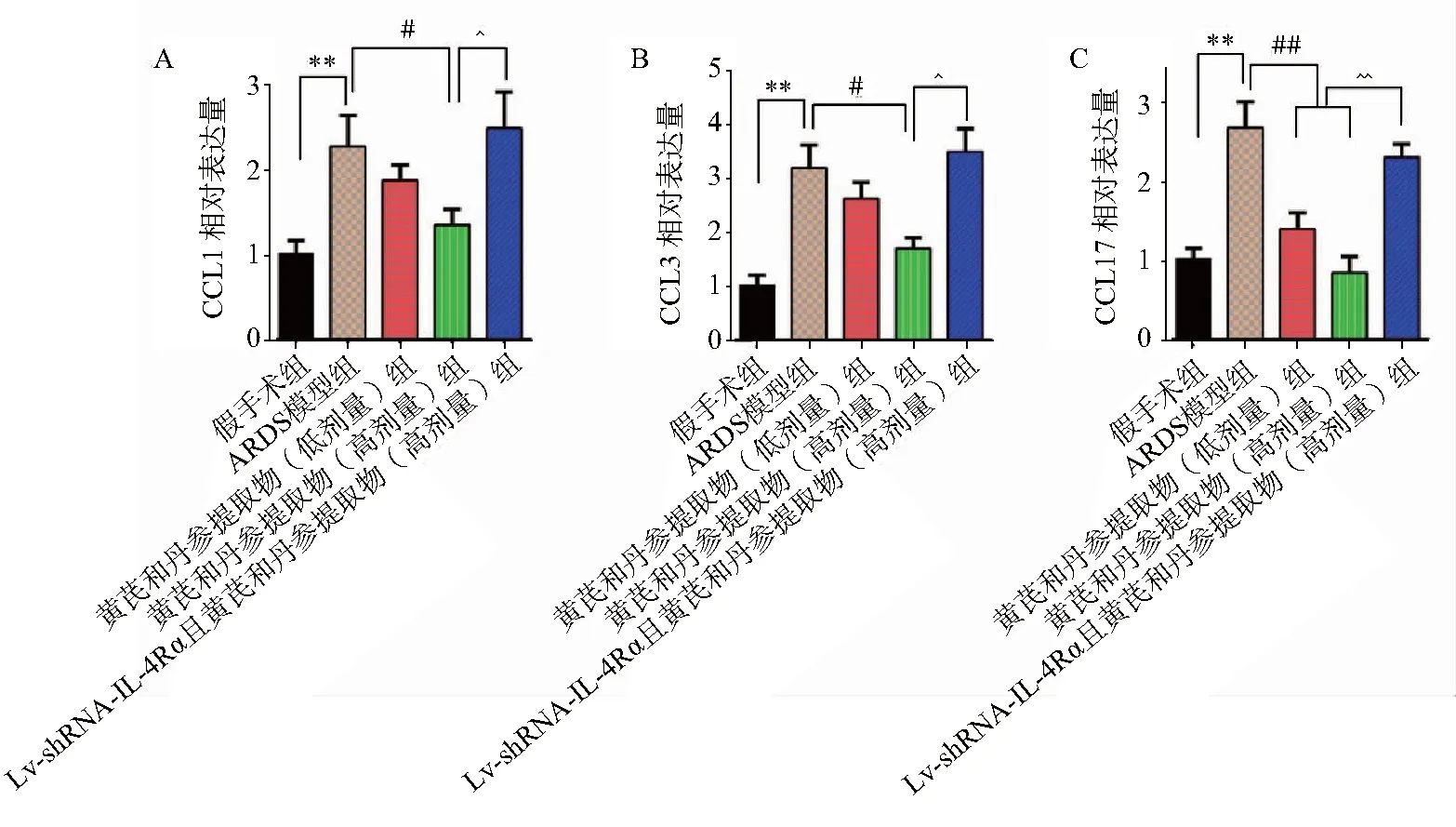
注:**与Sham组比较P<0.01;#与ARDS组比较P<0.05,##与ARDS组比较P<0.01;^与CASE-H+ARDS组比较P<0.05,^^与CASE-H+ARDS组比较P<0.01。Sham:假手术组;ARDS:模型组;CASE-L+ARDS:黄芪丹参提取物低剂量治疗组;CASE-H+ARDS:黄芪丹参提取物高剂量治疗组;IL-4Rα-RNAi+ CASE-H+ARDS:IL-4Rα基因沉默且黄芪丹参提取物高剂量治疗组。A.CCL2;B.CCL3;C.CCL17
4 讨论
中性粒细胞活化在ARDS导致肺损伤进展过程中起到关键作用[10],ARDS患者外周血中的中性粒细胞会被招募至肺部病变组织,并在低氧条件下活化,释放炎症因子和介质,进一步导致肺组织损伤及纤维化病变[11]。现有研究均表明中性粒细胞有潜力成为ARDS治疗的靶标细胞[12],积极摸索开发和完善以中性粒细胞功能调控为核心的ARDS治疗方案,对于改善ARDS所致肺损伤无疑具有重大意义,其核心内容即为在ARDS发生初期,通过阻断中性粒细胞迁移以防止肺部炎性反应进展[13-16]。中性粒细胞在ARDS肺损伤中的相关作用虽已被研究多年[10-12],但其具体作用和机制仍未完全阐明而有待进一步深入探究。近年来,IL-4在炎症调控中的作用被广泛研究和证实。中性粒细胞在严重缺氧条件下能够被活化,具体表现为生存能力获得明显的提升以及能够促进炎症因子大量释放。有研究表明IL-4在ARDS小鼠肺组织中表达降低,通过添加外源IL-4无论在体内亦或是体外均能有效降低ARDS病理条件下中性粒细胞生存率[7]。IL-4能够以脯氨酰羟化酶-2依赖性的方式降低人和小鼠中性粒细胞在体外缺氧模型中的细胞活性及存活率[8]。这一研究结论与IL-4长期以来被认为具有组织修复、平衡等基本功能是一致的[17]。Alison J等[8]研究表明,急性肺损伤时IL-4/IL-4Rα途径被激活,通过抑制低氧条件下缺氧诱导因子(hypoxia-inducible factor,HIF)1α的表达,促进ARDS病理条件下中性粒细胞的凋亡,并最终抑制病变部位炎症因子含量和促进炎性反应消退。动物研究数据表明,LPS诱导会导致动物肺部内源性IL-4被大量释放,并促进中性粒细胞中IL-4Rα表达上调,这说明可能在炎症反应早期即存在IL-4/IL-4Rα调控通路[18,19]。以上均提示通过IL-4/IL-4Rα通路活化,降低ARDS病理条件下中性粒细胞存活率,或为限制ARDS进展初期剧烈炎性反应出现的有效途径。
ARDS属于中医“喘证”“喘脱”“暴喘证”范畴。中医认为喘为气亏不足以息所致,而《灵枢》曰:“宗气不下,脉中之血,凝而留止”[20]、《医林改错》又曰:“元气既虚,必不能达于血管,血管无气,必停留而瘀”,说明肺气亏虚,宣发肃降失司,肺气上逆或气无所主致喘,而肺气不行则血脉不利,血停致瘀,故临床可选用补气活血之法治疗ARDS。相关研究显示补气活血法代表方药补阳还五汤可通过改善病理、抑制炎症因子及胶原蛋白、调控高迁移率族蛋白(high mobility group protein,HMG)B1信号通路、抑制细胞外调节蛋白激酶(extracellular regulatory protein kinases,ERK)1/2信号通路等途径以多机制、多通道、多靶点发挥抗肺纤维化作用[21]。而本研究选取了补气活血经典药对黄芪、丹参提取物作为研究靶点,其中黄芪作为补气诸药之最,能够益元气而补三焦,丹参有“一味丹参,功同四物汤”之效,可活血祛瘀生新,二者相配能补气活血,补而不滞。现代药理学研究表明,黄芪具有调节免疫、抑制炎症反应、抗氧化、抗感染等作用,而丹参能够改善微循环、抗血小板聚集、扩张血管、抗氧化应激、抑制炎症反应[21]。王丽娜等[22]研究发现黄芪-丹参药对可有效抑制小鼠肺泡炎症和控制肺纤维化进展,其作用机制可能与抑制TNF-α、人磷酸化κB抑制蛋白激酶(human phosphorylatedκB inhibitory protein kinase,P-IKK)、核因子κB(nuclear factor kappa-B,NF-κB)、IL-1β等表达有关。丹参有效成分丹参酮可显著减轻博莱霉素所致的大鼠肺泡炎和肺纤维化程度,其机制可能与抑制炎症反应细胞的浸润活化、细胞外基质沉积及调控尿激酶型纤溶酶原激活物及其抑制物之间的平衡有关[23]。
在本研究中,首先对大鼠进行黄芪丹参提取物灌胃给药,采用油酸与LPS打击建立大鼠ARDS模型,后通过多项指标对ARDS大鼠肺损伤进行综合评价。实验结果表明,黄芪丹参提取物给药能够明显降低ARDS大鼠肺组织的湿/干重比、炎性浸润、MPO和趋化因子CCL2,CCL3和CCL17 mRNA含量以及BALF中炎症因子TNF-α,IL-1β和IL-6相对含量。此外还从大鼠BALF中分离中性粒细胞用于IL-4/IL-4Rα成员蛋白表达检测,数据显示药物预处理能够显著提高ARDS大鼠BALF来源中性粒细胞中IL-4Rα以及凋亡诱导因子Caspase 3-cleaved表达,这与HIF-1α通过降低Caspase-3蛋白水解而关闭细胞程序死亡的报道是一致的,同时亦从侧面再次验证了黄芪丹参提取物、中性粒细胞生存率与ARDS患者肺损伤三者之间存在密切联系。在研究中还用慢病毒途径在大鼠肺部靶向IL-4Rα,依据其是否能够逆转提取物抗ARDS损伤作用来对IL-4Rα在药物反应过程中的关键作用进行评价。
总之,本研究表明黄芪丹参提取物能够改善ARDS导致的大鼠肺损伤,作用途径与其能够上调中性粒细胞IL-4Rα表达并促进凋亡诱导因子Caspase-3的水解活化有关,Caspase-3水解活化后诱导中性粒细胞程序性死亡为黄芪丹参提取物降低和改善ARDS病理条件下肺部炎性级联反应和组织损伤的直接原因。
