上海市养殖水产品及环境中副溶血性弧菌的流行、毒力及耐药性分析
2023-03-07刘军军刘单阳李达容王慧赵勇孙晓红
刘军军,刘单阳,李达容,王慧,赵勇,2,3,孙晓红,2,3*
1(上海海洋大学 食品学院,上海,201306)2(农业部水产品贮藏保鲜质量安全风险评估实验室,上海,201306)3(上海水产品加工及贮藏工程技术研究中心,上海,201306)
副溶血性弧菌(Vibrioparahaemolyticus)是一种革兰氏阴性、嗜盐菌,广泛存在于海洋、河口和淡水环境中,人类感染V.parahaemolyticus可引起腹泻、肠胃炎等[1]。据中国食源性疾病监测系统和美国疾病控制中心统计,V.parahaemolyticus是食源性细菌中毒的主要原因之一[2]。联合国粮食及农业组织统计数据表明,2019年全球人均水产品消费量为20.5 kg,其中水产养殖产量高于捕捞量[3]。据文献统计,V.parahaemolyticus在养殖虾类中检出率为50%~100%[4],在养殖淡水鱼类中检出率为5.80%~13.13%[5]。V.parahaemolyticus在水产养殖中的高污染率增加了人类致病风险。
水产养殖过程中抗生素的使用及残留易导致V.parahaemolyticus产生耐药性。国内对流通环节、餐饮和临床中V.parahaemolyticus耐药性研究较多,而对养殖水产品中V.parahaemolyticus耐药性研究较少。目前研究发现分离自养殖水产品中的V.parahaemolyticus对四环素类、喹诺酮类、头孢菌素和氯霉素类等临床药物具有耐药性[6-7]。其中,四环素和环丙沙星作为临床用于治疗V.parahaemolyticus引起的重症或长期疾病[8],其耐药性的产生将对临床治疗造成不良影响。因此,耐药菌株的出现对临床和水产养殖中有效治疗V.parahaemolyticus感染存在安全隐患。
持续监测养殖水产品中V.parahaemolyticus致病性和耐药性对保障人类健康和水产品质量及指导水产养殖业合理使用抗生素具有重要意义。本研究分离了上海市主要养殖水产品及养殖环境中的V.parahaemolyticus,分析其血清型、毒力基因、耐药表型和遗传多样性,为上海市水产养殖中V.parahaemolyticus的深入研究提供数据支撑。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
大肠埃希菌(ATCC 25922)、副溶血性弧菌(ATCC 17802、ATCC 33847),美国菌种保藏中心。
1.1.2 药品试剂
3% NaCl碱性蛋白胨水(alkaline peptone water, APW)、TCBS培养基、阳离子调节肉汤,北京陆桥技术股份有限公司;细菌基因组DNA提取试剂盒-TIANamp Bacteria DNA Kit,天根生化科技有限公司;琼脂糖、Gelred核酸染料、1×TAE粉末颗粒、DNA Marker L2000,上海擎科生物股份有限公司;PremixTaqDNA聚合酶,南京诺唯赞股份有限公司;引物由上海生工生物股份有限公司合成;氨苄西林(ampicillin,AMP)、美罗培南(meropenem,MEM)、头孢唑啉(cefazolin,CZ)、头孢吡肟(cefepime,FEP)、四环素(tetracycline,TE)、环丙沙星(ciprofloxacin,CIP)、磺胺甲恶唑(sulfamethoxazole,SMZ)、甲氧苄啶(trimethoprim,TMP)、阿奇霉素(azithromycin,AZ)、氯霉素(chloramphenicol,C)和呋喃妥因(nitrofurantoin,NIT),上海麦克林生化科技有限公司;亚胺培南(imipenem,IPM)、头孢西丁(cefoxitin,FOX),上海源叶生物科技有限公司;头孢噻肟钠(cefotaxime,CTX)、强力霉素盐酸盐(doxycycline,DOX)、氧氟沙星(ofloxacin,OFL)、红霉素(erythromycin,E)、硫酸卡那霉素(kanamycin,K)、硫酸庆大霉素(gentamicin,CN),上海生工生物股份有限公司。
1.1.3 仪器与设备
Airstream®A2型二级生物安全柜,Esco China公司;TProfessional Standard Thermocyler,Biometra公司;Bio-Tek酶标仪,美国伯腾仪器有限公司;凝胶电泳仪,苏州赛恩斯仪器有限公司;Bio-Rad凝胶成像分析仪,美国伯乐公司。
1.2 实验方法
1.2.1 水产样品采集
2020年6月—2021年10月,从上海市27家养殖场共采集水产品(南美白对虾、草鱼、鲫鱼、河蟹)及养殖环境样本(养殖水和底泥)234份。样品置于4 ℃采样箱运回实验室,当天进行处理。
1.2.2 副溶血性弧菌的分离纯化与鉴定
V.parahaemolyticus分离参照GB 4789.7—2013进行,疑似菌株进一步通过PCR扩增V.parahaemolyticus种特异性基因tlh[9],引物如表1所示。取5 μL扩增产物在1%琼脂糖凝胶中120 V电泳30 min后,经凝胶成像系统分析。阳性扩增产物测序后,与NCBI上Blast数据库比对确定。分离的V.parahaemolyticus菌株与25%(体积分数)甘油混合冻存于-80 ℃中。
1.2.3 副溶血性弧菌毒力基因检测
挑取冻存管中菌液分别于3% NaCl APW肉汤中,200 r/min 37 ℃培养6~12 h,根据细菌基因组DNA提取试剂盒提取菌株基因组DNA。参考NARAYANAN等[10]和郭书林等[11]方法,通过PCR检测V.parahaemolyticus热稳定性直接溶血素基因(tdh)和热稳定性相关溶血素基因(trh),急性肝胰腺坏死编码基因pirA,引物及退火温度如表1所示。25 μL反应体系为Mix 12.5 μL、ddH2O 9.5 μL、10 μmol/L上下游引物各1 μL、模板1 μL。扩增条件:95 ℃,5 min;94 ℃ 30 s,58/55/53 ℃(依次对应tdh、trh、pirA)30 s,72 ℃ 1 min,30个循环,72 ℃ 7 min。以ATCC 17802(tdh-、trh+、pirA-)、ATCC 33847(tdh+、trh-、pirA-)为阳性对照菌株。
1.2.4 副溶血性弧菌血清型检测
V.parahaemolyticus的O群血清型检测参考NARAYANAN等[10]方法,多重PCR分别为,组1:O1、O2、O4、O5、O6、O10;组2:O3/O13、O7、O8、O9、O11、O12。反应体系为Mix 12.5 μL、10 μmol/L上下游引物各0.5 μL、模板1 μL,以ddH2O补足25 μL反应体系。多重PCR程序优化后,进行血清型检测。引物及退火温度如表1所示。

表1 实验所用引物
1.2.5 副溶血性弧菌抗生素敏感性分析
参考美国临床与实验室标准委员会(Clinical and Laboratory Standards Institute, CLSI)规定,使用微量肉汤稀释法检测V.parahaemolyticus对10类19种抗生素敏感性。抗生素测试浓度范围及判断标准如表2所示。大肠埃希氏菌ATCC 25922为质控菌株,依据CLSI M45 2015版药敏准则进行结果判定,分别为敏感(susceptible,S)、中介(intermediate,I)和耐药(resistant,R)。根据结果计算V.parahaemolyticus抗生素多重耐药(multiple antibiotic resistance,MAR)指数[12]。

表2 抗生素测试浓度范围及敏感性判断标准
1.2.6 肠杆菌基因间重复序列(enterobacterial repetitive intergenic consensus sequence, ERIC)-PCR聚类分析
ERIC-PCR引物序列及反应条件参照谢腾飞[13]的方法,ERIC-PCR扩增引物:Eric1:5′-ATGTAAGCTCCTGGGGATTCAC-3′;Eric1:5′-AAGTAAGTGACTGGGGTGAGCG-3′;25 μL反应体系为Mix 12.5 μL、ddH2O 8.5 μL、10 μmol/L上下游引物各1 μL、模板2 μL。扩增条件为:95 ℃,5 min;94 ℃ 45 s,52 ℃ 1 min,72 ℃ 1 min,35个循环,72 ℃ 10 min。取8 μL扩增产物在1%琼脂糖凝胶中100 V电泳45 min,经凝胶成像系统得到电泳图进行分析,有条带记为1,无条带记为0。输出结果经NTsys-pc软件使用非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)进行聚类分析。
1.3 统计学分析
实验重复平行3次,使用SPSS 25.0软件进行统计分析,P<0.05认为统计学上有差异。
2 结果与分析
2.1 水产品中副溶血性弧菌污染分析
234份养殖水产品及环境样本中V.parahaemolyticus总检出率为30.8%。如表3所示,不同水产品养殖类型中南美白对虾养殖中V.parahaemolyticus检出率最高,为53.2%,其次为河蟹和淡水鱼养殖,检出率分别为21.1%、6.9%。南美白对虾、草鱼、鲫鱼和河蟹4种水产品中南美白对虾中V.parahaemolyticus检出率最高(78.4%),且不同水产品检出率之间存在显著性差异(χ2=27.686,P<0.05)。不同类型水产品中V.parahaemolyticus检出率高于对应养殖环境样本。
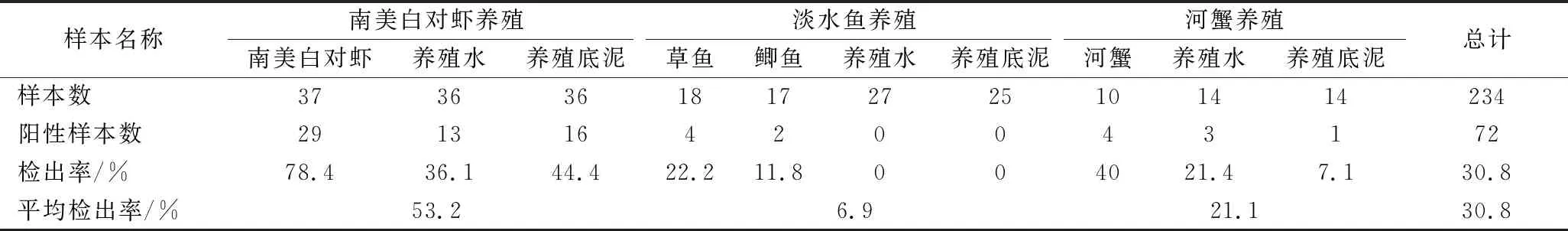
表3 上海市水产样本中副溶血性弧菌的检出率
2.2 不同季节样本中副溶血性弧菌污染分析
为进一步表征V.parahaemolyticus的丰度是否受季节温度影响,对水产养殖中V.parahaemolyticus在不同季节的分布进行统计分析。如表4所示,夏季检出率最高,为51.4%,其次为秋季、春季,检出率分别为35.6%、9.5%,冬季未检出,不同季节V.parahaemolyticus检出率之间存在显著差异(χ2=59.005,P<0.05)。
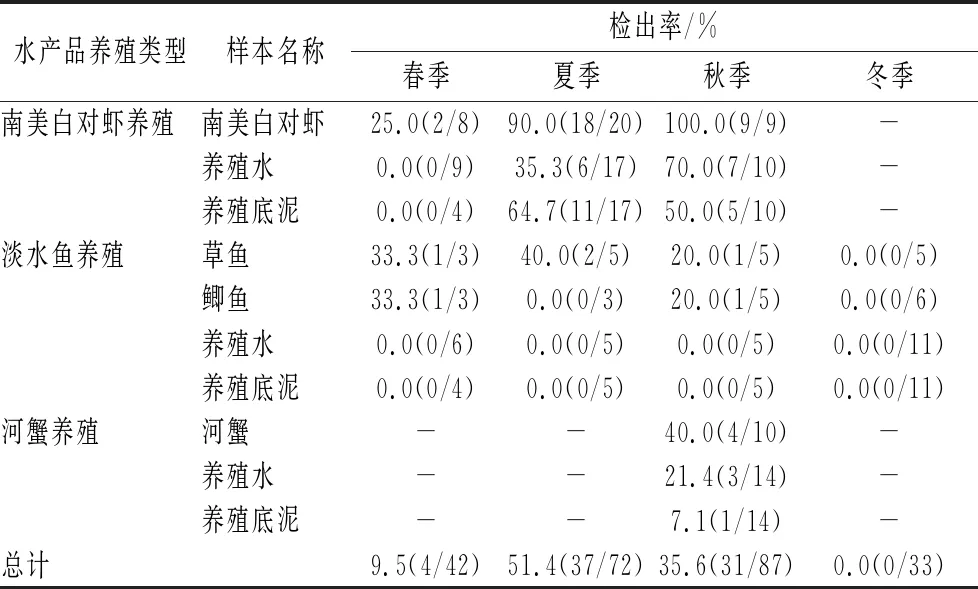
表4 不同季节样本中副溶血性弧菌检出率
2.3 副溶血性弧菌毒力基因检测结果
毒力基因tdh、trh和pirA分别是判断V.parahaemolyticus对人类和水产品是否具有致病潜力的指标。采用PCR法分别对分离的V.parahaemolyticus进行tdh、trh和pirA基因扩增。检测结果表明,所有分离株均未检出相关毒力基因。
2.4 副溶血性弧菌血清型检测结果
为了解水产养殖中V.parahaemolyticus血清型分布,采用多重PCR检测V.parahaemolyticus血清型。如表5所示,72株V.parahaemolyticus可分为10种血清型,血清型分布具有多样性。其中,O1血清群为优势血清群(66.7%),其次为O3/O13血清群(9.7%),其他7种血清群检出菌株数均<5株。南美白对虾养殖中V.parahaemolyticus血清型多样性最高,共检出8种。

表5 不同样本类型中副溶血性弧菌血清型分布
2.5 药敏试验结果
2.5.1 抗生素敏感性实验结果
采用微量肉汤法检测72株V.parahaemolyticus对10类19种抗生素的敏感性。如图1所示,V.parahaemolyticus对青霉素类、碳青霉烯类、头孢菌素类、氯霉素类、磺胺类和大环内酯类抗生素均有抗性,其中对AMP和SMZ耐药率均为100.0%,所有菌株对一代头孢菌素CZ和大环内酯类E均耐药(CZ:93.1%;E:72.2%)或中介(CZ:6.9%;E:27.8%)。除一代头孢菌素CZ外,V.parahaemolyticus对三代(CTX)、四代(FEP)头孢菌素也有耐药或中介(<5%)。对磺胺类SXT的耐药率为18.1%。此外,分别有1株V.parahaemolyticus对IPM(V.parahaemolyticus321)和C(V.parahaemolyticus188)耐药,3株对K中介的V.parahaemolyticus分别分离自南美白对虾、南美白对虾养殖底泥和草鱼。72株V.parahaemolyticus对包括碳青霉烯类、四环素类、氯霉素类、喹诺酮类、氨基糖苷类和硝基呋喃类的6类抗生素高度敏感(>90%),所有菌株对MEM、FOX、TE、DOX、CIP、OFL、AZ、CN和NIT敏感。

图1 副溶血性弧菌抗生素敏感性实验结果
2.5.2 耐药谱分析
为研究水产养殖中V.parahaemolyticus耐药模式分布及多样性,对菌株耐药谱进行统计分析。如表6所示,所有菌株至少耐2类抗生素,耐3类、4类、5类抗生素的菌株分别有22.2%(16/72)、72.2%(52/72)、1.4%(1/72)。72株V.parahaemolyticus表现为10种耐药谱,主要耐药谱型为AMP-SMZ-CZ-E,菌株占比54.2%。菌株MAR指数介于0.11~0.37,其中73.6%的菌株MAR指数高于0.2。

表6 副溶血性弧菌抗生素耐药谱
2.5.3 不同养殖类型水产品中抗生素耐药水平比较
为对比不同水产品中V.parahaemolyticus是否存在耐药水平差异,分析了3类水产样本中V.parahaemolyticus抗生素耐药水平。如表7所示,不同类型水产样本中V.parahaemolyticus均对AMP、CZ、SMZ和E高耐药(69%~100%)。南美白对虾养殖中V.parahaemolyticus耐抗生素种类最多,耐6类8种抗生素,其中包括耐IPM(n=1)、FEP(n=3)和C(n=1)菌株。淡水鱼养殖和河蟹养殖均耐5种抗生素,其中河蟹养殖中V.parahaemolyticus对SXT耐药率(37.5%)高于南美白对虾养殖和淡水鱼养殖,但与南美白对虾和淡水鱼养殖无统计学差异(χ2=2.305,P>0.05)。

表7 三类养殖水产品中副溶血性弧菌耐药水平比较
2.6 ERIC-PCR聚类分析结果
根据不同菌株所含肠杆菌基因间重复序列的分布和拷贝数不同,ERIC-PCR得到具有不同位置和数量的指纹图谱,聚类分析结果如图2所示。72株V.parahaemolyticus扩增条带为2~8条,条带大小分布在100~5 000 bp,聚类为52个ERIC基因型(E01~E52),带型相似度为7%~100%,带型分散,无明显优势群组,基因型多样性高。不同水产品养殖类型、采样季节、采样地区与V.parahaemolyticus基因型之间均存在显著差异性(P<0.05)。

图2 副溶血性弧菌ERIC-PCR聚类指纹图谱
3 讨论
本研究分析了上海市水产养殖中V.parahaemolyticus污染情况,总检出率为30.8%,高于大部分淡水养殖[8,14-15],低于咸/海水养殖[4,6,16]。其中,高养殖盐度的南美白对虾中V.parahaemolyticus检出率高于淡水鱼和河蟹,夏、秋季节检出率高于春、冬,表明V.parahaemolyticus的丰度和分布受盐度、水温等环境因素影响,与文献[4,17-18]报道一致。不同水产品V.parahaemolyticus检出率高于对应养殖环境样本,表明水产品更易富集V.parahaemolyticus[18-19]。JIANG等[6]对浙江养殖场和市场水产品中V.parahaemolyticus污染情况分析发现,不同水产品或人为交叉污染会进一步增加V.parahaemolyticus污染,增加人类感染风险。因此,应继续监测水产品中V.parahaemolyticus污染情况,尤其是夏季、以南美白对虾为代表的水产品,以预防V.parahaemolyticus感染。
自1996年O3∶K6血清型V.parahaemolyticus引起大流行被报道以来,近年来中国临床分离V.parahaemolyticus菌株仍以O3∶K6血清型为主,而环境源V.parahaemolyticus血清型分布具有多样性[20-23]。与本研究结果类似,72株V.parahaemolyticus血清型分布为10种,以O1血清型为主。值得注意的是,O1群V.parahaemolyticus中O1∶K20血清型曾在1982年引起大流行[24],尽管近年来该血清型不在临床致病V.parahaemolyticus菌株中流行,但也应对其加以警惕,尤其是V.parahaemolyticus感染发生集中的夏季。
抗生素耐药性的出现可能与水产养殖系统以及人类和农业中抗生素滥用有关[4]。因此,了解水产养殖中V.parahaemolyticus耐药性对养殖业和临床治疗V.parahaemolyticus感染具有重要意义。本研究中,V.parahaemolyticus对AMP、CZ、SMZ和E表现为高耐药率,与魏文娟[25]、JIANG等[5]研究结果一致。AMP、CZ、SMZ和E在临床和养殖业的长期使用可能是导致V.parahaemolyticus对其产生普遍耐药的原因[26]。本研究中V.parahaemolyticus对SXT耐药率(18.1%)高于XIE等[27]和SILVA等[18]报道的临床源和环境源V.parahaemolyticus对SXT的耐药率。头孢菌素是广泛用于临床中的一类抗生素,其中第三、四代头孢菌素可有效治疗V.parahaemolyticus引起的严重感染[21],本研究中V.parahaemolyticus对三代头孢CTX和四代头孢FEP有低耐药率(<5%)。水产养殖中出现对SXT和第三、四代头孢菌素等抗生素耐药的菌株,表明临床抗生素和耐药菌正在环境中逐渐积累,已对养殖环境造成污染,并存在成为耐药基因贮存库的风险。
ERIC-PCR由于其便捷、快速等优点,相比脉冲场凝胶电泳更适用于大量菌株分型研究。ERIC-PCR结果表明养殖水产品中分离的V.parahaemolyticus具有高度遗传多样性,几乎所有菌株都聚类在不同的分支中,与SU等[28]和XIE等[29]研究结果一致,表明不同来源分离株在基因型上具有较大的差异性。此外,XIE等[27]对临床和水产分离的V.parahaemolyticus聚类结果表明,不论临床还是环境分离株,V.parahaemolyticus均表现为遗传多样性。
综上,上海市水产养殖中V.parahaemolyticus污染严重,菌株检出率受季节温度和盐度影响,致病潜力较低,并有较高的遗传多样性。水产养殖中V.parahaemolyticus主要对临床和水产养殖常用抗生素AMP、CZ、SMZ和E耐药,应加强对磺胺类SXT和头孢菌素类等抗生素的使用监测,以预防菌株广泛耐药性的产生。
