米糠多糖-乳清分离蛋白美拉德反应及其产物表征
2023-03-06沈汪洋胡中泽黄文晶
吴 爽,王 涵,王 展,2,沈汪洋,2,胡中泽,2,周 坚,2,黄文晶,2,*
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430048;2.大宗粮油精深加工省部共建教育部重点实验室,湖北 武汉 430048)
乳清分离蛋白(whey protein isolate,WPI)是一种优质蛋白,含多种必需氨基酸与生物活性成分[1],其分子中含有的两亲性基团,赋予了其极佳的表面活性,从而使其制备的纳米乳液具备包载疏水性物质的特性。研究表明WPI在高温、高盐和酸等加工方式的影响下易变性或聚集,进而导致产品的品质不稳定,这些因素极大限制了WPI在食品纳米工程中的应用。为拓宽WPI的应用领域,对WPI修饰改性被广泛研究。近年来,以美拉德反应为机理的蛋白质-糖接枝改性方法得到了研究人员的广泛关注[2-4],改性后的蛋白功能特性得到了极大的改善[5-6],Wang Luhui等[7]发现鸭蛋清蛋白-麦芽糊精复合物乳化性更稳定,能承受离子浓度和酸性条件变化对乳化性的影响。Yi Jiang等[8]用β-乳球蛋白-葡聚糖复合物包载β-胡萝卜素,显著提高β-胡萝卜素在胃环境中的稳定性(P<0.05)。报道表明定向的美拉德反应可有效改善蛋白的乳化活性和乳化稳定性,此方法操作简单、绿色健康,在食品的加工中被广泛应用[9]。
我国是全球水稻生产量和消费量最大的国家[10-11],而米糠作为主要加工副产物,主要部分被应用于饲料加工行业,应用附加值相对较低[12-13]。米糠多糖(rice bran polysaccharide,RBP)是米糠的主要成分之一,是天然可再生资源,具有无毒、生物相容性高和可生物降解等独特优点[14]。研究表明RBP能够提高人体免疫力,具有抗氧化、抗炎、抗肿瘤、降血脂和降血糖等多种生理功能[15-19],在保健品、乳制品、面包等食品工业领域都有广泛应用。天然多糖分子链上含有大量的羟基和醛基等活性位点,非常有利于修饰,能可控改变其物理化学性质,赋予多糖新的特性,如增加多糖的亲水性或疏水性,改变多糖的分子质量、凝胶性、流变学性和成膜性等,便于拓宽多糖的应用领域,特别是在多糖载体的研究和开发应用等方面。多糖修饰常用的方法有物理法、生物法和化学法[20]。物理法一般通过挤压、超声波、微波等方式改变RBP的糖苷键[20-24];生物法一般采用生物发酵法和酶法修饰RBP的主链或侧链[25];化学法用化学反应方式对RBP的结构进行修饰,最常用的是硫酸化[26-27]。RBP的大分子链上也存在众多活泼基团如羟基、羧基或醛基等易被修饰改性,可以与蛋白和多肽等大分子发生美拉德反应,形成共价化合物,相比其他化学修饰方法,美拉德反应修饰多糖更符合食品工业“绿色安全标签”需求;且多糖对胃液中的胃蛋白酶的水解能力具有较高的抵抗性,可展现良好的消化稳定性[28-29],具有提升WPI消化稳定性的潜力。与其他单糖和多糖相比,RBP属于杂聚糖,其分子质量较大,与WPI改性结合后吸附在油滴表面的吸附层也会更厚,因此具有乳化性能更强的潜力[30]。Delahaije等[31]研究了单糖(木糖、葡萄糖)、麦芽三糖和麦芽五糖对糖基化马铃薯蛋白制备乳液稳定性的影响,结果表明,与单糖相比,麦芽三糖和麦芽五糖显著增加了乳液的稳定性,该研究说明多糖修饰的蛋白相比单糖修饰的蛋白乳化性更好。因此本研究选择RBP修饰WPI,期望发挥两者的协同作用,优化WPI的乳化性、耐热性、耐酸性等功能特性[32-33],同时发挥RBP的多种生理功能,不仅可得到高效稳定的口服新型乳化剂,还可开拓RBP的应用领域,对推动我国水稻产业绿色高值发展具有重要意义。
因此,本实验采用干热法制备WPI和RBP的美拉德反应产物,以A294nm、褐变程度、色泽变化、游离氨基含量等变化监测美拉德反应进程,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定产物的分子质量,对美拉德反应产物的粒径、乳化性和微观结构等进行表征,旨在为RBP用于WPI的美拉德反应改性提供理论基础,拓展RBP应用领域、满足人们对营养健康食品的消费需求。
1 材料与方法
1.1 材料与试剂
WPI(纯度90%) 美国Hilmar 公司;RBP(纯度96%,分子质量5~450 kDa) 陕西金润生物科技有限公司;邻苯二甲醛(1,2-phthalic dicarboxaldehyde,OPA) 南京都莱生物技术有限公司;考马斯亮蓝R-250 柯意哲(上海)机电工程有限公司;蛋白质Marker(分子质量10~180 kDa) 碧云天试剂公司;金龙鱼大豆油(食品级) 益海嘉里有限公司;其他所有化学试剂均为分析纯。
1.2 仪器与设备
UV-1800PC紫外-可见分光光度计 上海美普达仪器有限公司;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;LGJ-18真空冷冻干燥机 北京松源华兴科技发展有限公司;ST3100 pH计 奥豪斯仪器(常州)有限公司;101型电热鼓风干燥箱 北京科伟永兴仪器有限公司;S-3000扫描电子显微镜(scanning electron microscope,SEM) 日本日立仪器公司;CS-10型色差仪 杭州彩谱科技有限公司;ZEN3600激光粒度仪 英国马尔文仪器有限公司。
1.3 方法
1.3.1 WPI-RBP糖基化产物的制备
将WPI与RBP按照1∶1(m/m)比例溶于0.1 mol/L的磷酸盐缓冲液(pH 8.0)中,保证固形物质量分数为6%,调节溶液pH 8.0,在恒温磁力搅拌器中连续搅拌5 h,将其充分混合后冷冻干燥,冻干后的粉状物过100 目筛后放置于干燥器中(容器底部放置饱和KBr溶液),将干燥器置于鼓风干燥箱中并调节温度60 ℃从而保持干燥器内相对湿度为79%,反应6、12、18 h后即得WPI-RBP接枝物,所得产物置于-20 ℃冰箱中储存。
1.3.2A294nm和褐变程度的测定
用超纯水稀释蛋白样品至2.5 mg/mL,以超纯水作空白样,采用紫外-可见分光光度计测定A420nm,即产物的褐变程度;而美拉德反应的中间产物常用294 nm波长处吸光度表示,将待测样品稀释到1 mg/mL,测定A294nm。
1.3.3 色差分析
参考夏明敬等[34]的方法并稍作修改。称取适量样品于透明密封袋中,色差仪校准黑白背景板后,测量蛋白的L*、a*和b*值。每个密封袋上取3 个点测定,以WPI为参考对照。根据下式计算样品总颜色变化ΔE:
式中:ΔE为色差;L*为亮度值(0~100为表示由黑到白);a*为红色(+)或者绿色(-);b*为黄色(+)或者蓝色(-)。
1.3.4 游离氨基含量的测定
参考Mu Lixia等[35]的方法并稍作修改。称取40 mg的OPA溶解于1 mL的甲醛中,分别加入200 g/L的SDS溶液2.5 mL、0.1 mol/L的四硼酸钠溶液25 mL、100 μLβ-巯基乙醇,添加超纯水定容至50 mL,配制OPA试剂。测定时,用移液枪取OPA试剂4 mL于离心管中,分别注入200 μL待测液,涡旋30 s混匀后于35 ℃的水浴锅中反应2 min,使用紫外分光光度计在340 nm波长处测其吸光度,以加入200 μL水的OPA试剂为空白样,两者之差ΔA为自由氨基的净吸光度。以赖氨酸作出标准曲线,根据ΔA计算样品中自由氨基的含量,以未经改性的乳清蛋白为标准,计算各样品中游离氨基含量的相对百分比。
1.3.5 SDS-PAGE分析
参考Qin Xingang等[36]的方法并稍作修改。配制12%的分离胶和4%的浓缩胶。用0.1 mol/L磷酸盐缓冲液(pH 7.0)溶解蛋白样品,使其保持相同的蛋白浓度,然后在低速离心机中以5000 r/min离心5 min,取上清液40 μL,加入10 μL的5×上样缓冲液,然后在沸水浴中加热5 min后上样。电泳过程中保持恒压,浓缩胶电压为60 V,分离胶电压调至120 V。电泳结束后将凝胶取出,用考马斯亮蓝染色30 min,使用脱色液脱色至透明,用凝胶成像系统进行成像处理。
1.3.6 乳化性能测定
参考朱巧梅等[37]的方法并稍作修改。乳状液的乳化性质用乳化活性指数(emulsification activity index,EAI)和乳化稳定性指数(emulsification stability index,ESI)表示。取0.1 g样品蛋白溶于10 mL 0.2 mol/L的磷酸盐缓冲液(pH 7.0)中,加入4 mL的大豆油,在10000 r/min高速分散3 min后,分别于第0分钟和第10分钟从溶液底部吸取50 μL乳浊液,加到5 mL、0.1% SDS溶液中,于500 nm波长处测定吸光度,以0.1% SDS溶液为空白。EAI和ESI计算公式如下:
式中:A0为乳状液第0分钟500 nm波长处的吸光度;A10为将乳状液静置10 min后所测得的吸光度;10为两次测定乳化稳定性时间间隔(min);DF为稀释倍数;C为蛋白质量浓度/(g/mL);θ为油相占体积分数;Φ为比色皿光程。
1.3.7 SEM分析
用导电双面胶将样品固定在样品台上,取适量样品撒在双面胶上,用洗耳球吹去多余的粉末,真空喷金后置于SEM中观察并拍摄样品形貌照片。
1.3.8 粒径分析
将不同反应时间的样品溶于超纯水中,配制成1 mg/mL,使用ZEN3600粒度仪测量粒径分布。
1.3.9 纳米乳液稳定性分析
1.3.9.1 纳米乳液的制备
取一定质量的蛋白溶于磷酸盐缓冲液(pH 7.0)室温下搅拌使蛋白溶解,以一定的比例加入大豆油,在10000 r/min高速剪切5 min,在通过单因素试验高压均质得到纳米乳液。
1.3.9.2 纳米乳液制备高压均质单因素试验
以纳米乳液粒径和聚合物分散性指数(polymer dispersity index,PDI)为评价指标,探究均质压力、均质循环次数、乳化剂质量分数、油相体积分数对纳米乳液的影响。
1)改变均质压力为4000、7000、10000、13000、16000 psi,固定均质循环6 次、WPI质量浓度1 g/100 mL、大豆油体积分数4%;2)改变均质循环次数为2、4、6、8、10 次,固定均质压力16000 psi、WPI质量浓度1 g/100 mL、大豆油体积分数4%;3)改变WPI质量浓度为1、3、5、7、9 g/100 mL,固定均质压力16000 psi、均质循环6 次、大豆油体积分数4%;4)改变大豆油体积分数为2%、6%、10%、14%、18%,固定均质压力16000 psi、均质循环6 次、WPI质量浓度5 g/100 mL。
1.3.9.3 pH值、盐离子浓度对乳液稳定性的影响
用1.3.9.2节得出的单因素条件制备原始蛋白和改性蛋白稳定的纳米乳液,考察不同pH值、盐离子浓度对乳液粒径的变化。
pH值对乳液稳定性的影响:用NaOH和HCl溶液将乳液调至不同pH值梯度(4.0、5.0、6.0、7.0、8.0)后,测定乳液粒径及其PDI。
盐离子浓度对乳液稳定性的影响:分别配制一定浓度的WPI以及糖基化WPI溶液,向其中添加NaCl,使溶液中NaCl浓度分别为0.1、0.2、0.3、0.4、0.5 mol/L,分别测量不同NaCl浓度下的乳液粒径及其PDI。
1.4 数据处理
2 结果与分析
2.1 A294nm和褐变程度的分析
美拉德反应中间阶段常用294 nm波长处吸光度表示,而A420nm是最终产物的评价指标之一,WPI与RBP的接枝反应会发生颜色的褐变,其褐变与美拉德反应进行的程度呈正相关[38]。如图1所示,随着美拉德反应时间的延长,WPI-RBP接枝物在294 nm和420 nm波长处的吸光度均显著上升(P<0.05),说明体系发生了美拉德反应,在干热处理过程中,WPI的结构部分展开,蛋白质的ε-氨基与RBP的羰基受热结合在一起,生成了中间产物;同时,部分中间产物发生凝聚聚合生成类黑素,使蛋白的褐变程度上升[39]。

图1 WPI及WPI-RBP接枝物反应体系A294nm及A420nm变化Fig.1 Changes in the absorbance of MRPs at 294 and 420 nm with reaction time
2.2 色泽变化
WPI和RBP美拉德反应产物随反应时间的延长颜色变化如图2所示,随着美拉德反应时间的延长,WPIL*值由87.75逐渐减小,反应18 h后降低到63.46;WPIa*值显著提高(P<0.05),由原始的2.97逐渐变大到10.63;b*值由原始的16.09逐渐增加到25.20;ΔE值也显著提高到45.65,说明颜色逐渐变暗,红色与黄色逐渐加深,与原始蛋白的色差随反应时间的延长越来越大,这表明美拉德反应时间越长,WPI与RBP间的糖基化程度越高,颜色变化越明显。与此结果类似的是,王晨莹[40]研究表明蛋清蛋白与低聚异麦芽糖的反应随美拉德反应时间的延长,与原始蛋清蛋白的色差越大。
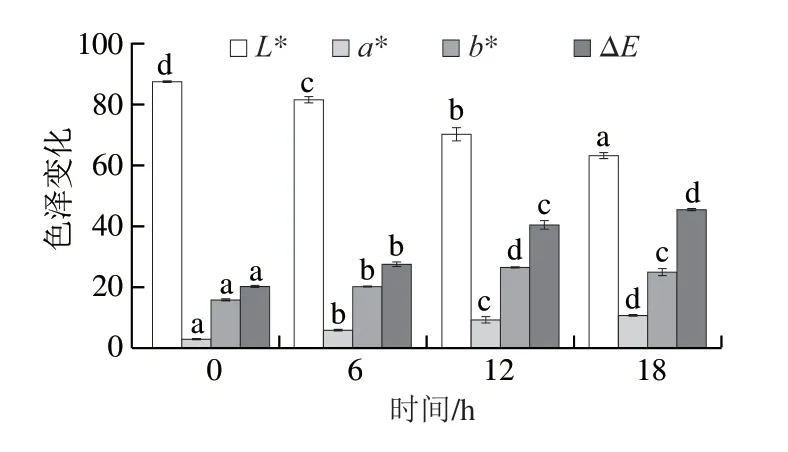
图2 WPI及WPI-RBP接枝物反应体系色差分析Fig.2 Change in the color difference of MRPs with reaction time
2.3 游离氨基含量的测定结果
如图3所示,蛋白质的游离氨基含量呈先减小后增大的趋势,这与王麒等[41]的研究相符。由于美拉德反应初期,WPI结构部分展开,WPI与RBP受热后逐步结合,游离氨基含量下降,但进一步加热时,WPI中的部分赖氨酸会被破坏,另外加热也会使WPI蛋白结构充分延展,蛋白分子之间的相互作用增强,导致蛋白质凝聚,接枝概率下降,不利于WPI和RBP之间接技反应的进行,最终反而导致接枝度降低,游离氨基含量升高。陈又铭等[42]研究发现玉米醇溶蛋白与菊粉的干热反应中,随美拉德反应的时间延长,接枝度先增后减。美拉德反应中接枝度的增加代表着游离氨基含量的减少,杨旭等[43]对茶渣蛋白的糖基化改性也得出同样的结论。
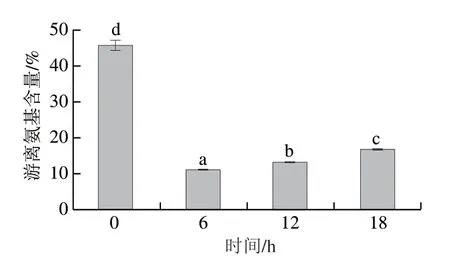
图3 WPI及WPI-RBP接枝物游离氨基含量Fig.3 Change in the free amino acid content of MRPs with reaction time
2.4 SDS-PAGE结果
由图4 可知,泳道2 中乳清蛋白的分子质量为15 kDa,反应6、12、18 h的蛋白分子质量分别为17.3、17.0、16.9 kDa,与原WPI相比平均增加2.1 kDa,这是因为RBP的糖链接枝到WPI上,增加了WPI的分子质量。同时可以看到美拉德反应后的蛋白样品条带颜色变淡,这也是蛋白发生美拉德反应后的一个显著特征,这进一步验证,经干热处理,WPI与RBP确实发生了以共价键形式结合为基础的接枝反应,生成了分子质量较大的物质。
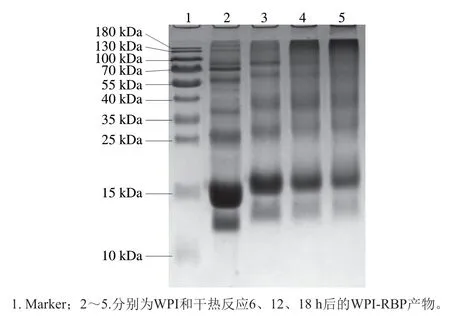
图4 WPI及WPI-RBP接枝物SDS-PAGE图谱Fig.4 SDS-PAGE profiles of WPI before and after glycation
2.5 乳化性能测定结果
如图5所示,随干热时间的延长,WPI-RBP共聚物的乳化性显著增强(P<0.05),加热处理18 h的WPI-RBP糖基化产物EAI由初始值87.86 m2/g增加至422.29 m2/g;与原WPI相比WPI-RBP接枝物ESI值增加了86%,这均表明,糖基化反应显著改善了WPI的乳化活性和乳化稳定性(P<0.05),可能的原因有两个:一方面RBP接枝到蛋白上后,带来的空间位阻效应能使得接枝物更加紧密地吸附在油-水界面上,形成致密的界面膜,从而提高WPI的乳化活性;另一方面加热使WPI的疏水基团暴露,提高了其乳化性[44]。孙炜炜[45]用葡聚糖(分子质量分别为67、150 kDa)对WPI糖基化改性,与WPI相比,WPI-G67和WPI-G150的EAI分别提高43.2%和52.7%,ESI分别提高18.96%和27.52%,且WPI-G150的EAI和ESI都比WPI-G67大。这是因为多糖的分子质量越大,与WPI改性结合后吸附在油滴的吸附层更厚,因此具有更佳的乳化性能[30-31],此外,多糖的分子质量大,也能够提供更大的空间位阻阻止油滴聚集,提高WPI乳化性[46]。而RBP是大分子多糖,与WPI美拉德反应改性后的蛋白与其他单糖和多糖相比具有更好的乳化性。Li Yue等[47]也得出同样的结论,其研究的葡萄糖和葡聚糖对糖基化大米蛋白乳化特性的影响,结果表明葡聚糖的乳化性能显著高于葡萄糖(P<0.05)。
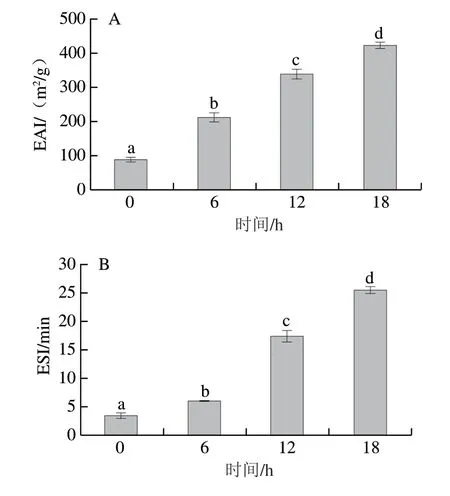
图5 WPI及WPI-RBP接枝物的EAI(A)和ESI(B)Fig.5 EAI (A) and ESI (B) of WPI and WPI-RBP conjugates with different reaction times
2.6 SEM分析
由图6可知,WPI的表面结构与其接枝物明显不同,WPI是典型的球蛋白,其呈现球状结构且表面较为光滑;而接枝物以混乱的聚集团状结构形式出现,这可能是由于WPI与RBP糖分子共价结合后,WPI的二级结构遭到破坏,分子充分伸展开来,RBP糖分子结合在蛋白分子表面,导致WPI蛋白分子球状结构的丧失。

图6 WPI及WPI-RBP接枝物SEM图谱Fig.6 SEM images of WPI and WPI-RBP conjugates with different reaction times
2.7 粒径分析
从图7可以看出,WPI@(WPI制备的纳米乳液)及WPI-RBP@(WPI-RBP改性制备的纳米乳液)的粒径大小依次为WPI-RBP(6 h)@<WPI-RBP(12 h)@<WPI@<WPI-RBP(18 h)@,蛋白在糖基化反应18 h后粒径显著增加,随着美拉德干热反应的进行,蛋白的热聚集程度增大,WPI蛋白聚集产生粒径较大的颗粒,这进一步验证了2.6节的结论,且WPI@和WPI-RBP(18 h)@还呈现一些小峰,粒径分布不均匀,这是因为随着美拉德反应的进行,WPI的溶解度上升,对水的吸附能力增强,因此粒径变小;但随着反应时间的延长,WPI分子的疏水基团暴露,溶解度下降,粒径变大。

图7 WPI@及WPI-RBP@接枝物粒径分布Fig.7 Particle size distribution of WPI@ and WPI-RBP@ conjugates
2.8 纳米乳液稳定性分析
从图8可知,随均质次数的增加,粒径和PDI呈先减小后增大的趋势,均质6 次测得的粒径和PDI较小,这是因为在均质过程中随着均质次数的增加,乳液的粒径会更小,粒径分布更均匀,乳液分散的更稳定,但随着均质次数的继续增加,粒径又会有增加的趋势,乳液变得不稳定,可能是因为均质次数增加,导致乳液温度升高,打破了已形成的乳液体系,乳液失稳;随压力的增加,粒径和PDI呈下降的趋势,在压力为16000 psi时,乳液粒径和PDI最小,考虑到均质机在压力过大时由于自我保护会暂停,且压力过大时,温度会随之升高,会造成油脂的氧化,因此选择均质压力为16000 psi;随WPI质量浓度的增加,乳液粒径和PDI呈现先下降后上升的趋势,在WPI质量浓度为5 g/100 mL时粒径和PDI最小,WPI质量浓度低时,蛋白不足以完全包裹住油滴,使油滴聚集,粒径增大,当WPI质量浓度高时,又会使蛋白质之间会发生聚集,使粒径增大;随油相含量增加,粒径和PDI呈上升趋势,此时蛋白质不足以完全包裹大豆油,使大豆油聚集,粒径增大。由此得出制备纳米乳液的条件为均质6 次、均质压力16000 psi、WPI质量浓度5 g/100 mL、大豆油体积分数6%。该条件制备的纳米乳液符合实验需求,可用于后续实验。
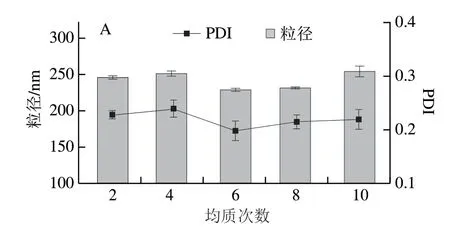
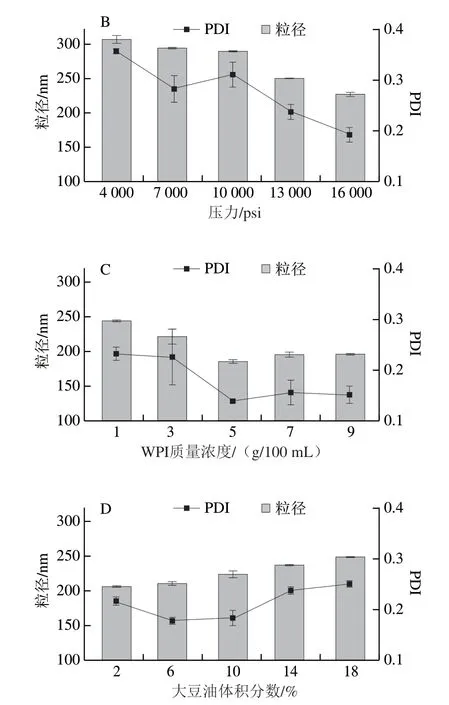
图8 均质次数(A)、压力(B)、WPI质量浓度(C)和大豆油体积分数(D)对纳米乳液粒径和PDI的影响Fig.8 Effects of number of homogenization cycles (A),pressure (B),WPI concentration (C) and oil phase concentration (D) on particle size and PDI of nanoemulsion
如图9A所示,纳米乳液WPI-RBP(12 h)@在不同pH值存在条件下粒径小于纳米乳液WPI@,说明纳米乳液WPI-RBP(12 h)@的pH值稳定性显著优于纳米乳液WPI@,WPI@在pH 5时的粒径为700 nm左右,PDI达到0.367,乳液接近失衡,而WPI-RBP(12 h)@粒径恒定维持在200 nm左右,展现了其耐酸的功能特性,这是因为WPI的等电点在5左右,蛋白质在等电点附近时的表面净电荷为0,WPI因失去静电斥力作用,分子间作用力减弱,蛋白质会絮凝、沉淀,而改性WPI-RBP在等电点处的静电斥力增强,蛋白分散较为均匀,提升了纳米乳液的耐酸稳定性。纳米乳液WPI-RBP(12 h)@在pH 4时粒径上升至335 nm,这是因为美拉德反应后WPI等电点偏移到4左右,但PDI仅为0.251,说明纳米乳液均一性较好,且其粒径和PDI仍显著低于WPI@的粒径和PDI,表明改性后的WPI共价接入RBP糖链后,亲水性提高,阻止了蛋白的聚集,提升了纳米乳液耐酸功能特性。
纳米乳液的稳定性的影响因素除了pH值外,盐离子浓度也是重要因素之一[48]。如图9B所示,盐离子浓度对纳米乳液粒径的影响与未改性的纳米乳液WPI@相比,纳米乳液WPI-RBP(12 h)@相对稳定,PDI在0.2左右,说明其粒径分散均匀;在NaCl浓度为0.5 mol/L时,WPI@粒径相比WPI-RBP(12 h)@增加了19%,PDI接近0.3,WPI在盐离子存在下由于盐析作用会发生沉淀,而WPIRBP糖基化改性后蛋白质在一定程度上能够抵抗盐离子对体系的影响,提高了乳液的盐离子稳定性。
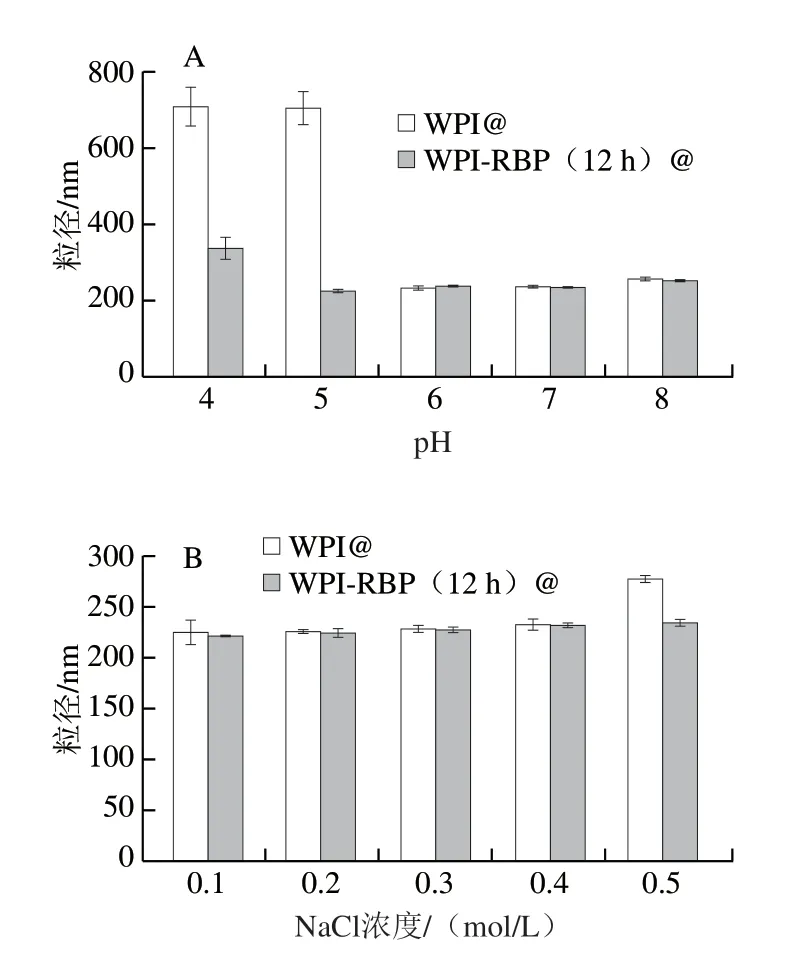
图9 pH值(A)和盐离子浓度(B)对纳米乳液粒径的影响Fig.9 Effects of pH (A) and salt ion concentration (B) on particle size of nanoemulsion
上述结论表明,本研究对WPI采用美拉德反应方式改性,显著提升了WPI-RBP@纳米乳液的耐酸耐盐功能特性,可进一步提升该纳米乳液体内消化稳定性,有助于递送脂溶性营养素的口服吸收研究,拓展该纳米乳液应用领域。
3 结论
通过干热法调控WPI与RBP发生美拉德反应,实现对WPI修饰改性,探究反应时间对其产物结构和功能特性的影响。通过分析A294nm和褐变程度、色泽变化及游离氨基含量的变化,调控混合体系发生美拉德反应的程度;采用SDS-PAGE分析WPI美拉德反应产物分子质量的变化,接枝后蛋白分子质量比WPI分子质量增加2.1 kDa;美拉德反应时间12 h后的产物显著提高了WPI的乳化活性和乳化稳定性,其制备纳米乳液粒径相对较小且分布均匀;纳米乳液WPI-RBP(12 h)@比纳米乳液WPI@粒径小且稳定,能抵抗酸性条件下和盐离子存在条件下对乳液的不利影响,有助于递送脂溶性营养素的口服吸收。因此,WPI和RBP之间的美拉德反应为改善WPI功能性开辟了一条新的途径,糖基化WPI-RBP产物可作为一种新型的乳化剂用于包载疏水性物质,同时可加强对米糠资源的综合利用研究,提高米糠的利用率,对深入研究和开发米糠资源意义重大。
