基于改善脱水白萝卜复水特性的黑木耳多糖组分筛选及结构鉴定
2023-03-06王贲香文连奎
苏 鑫,王贲香,焦 璇,张 弛,文连奎,*,贺 阳,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林师范大学博达学院食品科学与工程学院,吉林 四平 136000)
多数新鲜蔬菜中的水分含量都高达90%以上,微生物易于繁殖,贮藏期较短,且不利于运输,限制农民经济来源[1]。因此,将蔬菜干制脱水,是目前蔬菜贮藏上应用最广泛的一种技术,可使微生物腐败和变质反应降到最低,同时,还可以减少贮藏运输过程中所占的空间和重量[2-3]。但是蔬菜在干燥过程中,随着水分脱离,细胞出现皱缩、卷曲或断裂变形,易导致感官品质的降低及复水性差等缺点[4],而复水性是评价干制品食用品质的重要指标,因此提高蔬菜干制品的复水特性具有重要意义。
对蔬菜进行渗透预处理提高其复水性既可缩短干燥时间,还可提升干制品品质[5]。在渗透预处理中常用的渗透液主要有糖类[6-7]、盐[8]、乙醇[9]等,其中糖类物质在提高脱水制品复水特性中被广泛应用。生产上常用的糖类有单糖中的葡萄糖,双糖中的蔗糖、麦芽糖、海藻糖以及一些多糖等。如Agnieszka等[10]利用葡萄糖作为渗透液,显著提高了样品复水比,证明分子质量小且具有吸水作用的糖,可增强样品细胞在复水过程中对水分的吸收。另外,双糖作为渗透液在改善脱水制品复水特性也有显著效果,如蔗糖可以通过稳定磷脂和蛋白质保护植物细胞膜功能,进而改善脱水制品的复水特性[11];Hincha等[12]研究证明了海藻糖在渗透过程中具有保护细胞成分和状态的能力;也有研究表明蔗糖、麦芽糖和海藻糖这些双糖可以通过增加果胶与果胶之间的相互作用保持细胞壁的结构性质,防止组织结构损伤[11,13]。以上研究证明了单糖和双糖已经广泛应用于提高脱水制品的复水特性,但是对于多糖在脱水制品复水特性中的研究报道较少。先前将黑木耳液真空渗入茄子中[14],研究结果显示,黑木耳液可明显提高茄子复水比,推测这可能与黑木耳液中的黑木耳多糖有关。
黑木耳(Auricularia auricula)又名树耳、树鸡,主要分布于中国黑龙江、吉林、浙江等省[15-16]。以每100 g黑木耳干品可食用部分计,其内部约含有水分12 g、碳水化合物65 g、粗纤维7 g、蛋白质10.6 g、脂肪0.2 g、灰分4.3 g、矿物质0.4 g、多种维生素35 mg。黑木耳经反复干燥、复水后仍保持高复水能力,有研究表明黑木耳的高复水能力与自身的多糖分子结构及分子质量大小相关[17]。因此,探究黑木耳多糖是否可以改善其他脱水制品的复水特性具有一定意义。
白萝卜(Raphanus sativus)又名菜头,为根茎类蔬菜。以每100 g白萝卜可食用部分计,其内部约含有水分92.8 g、碳水化合物4.2 g、膳食纤维1.1 g、蛋白质1 g、脂肪0.15 g、矿物质0.3 g、多种维生素31 mg,营养丰富,具有抗氧化和促消化等多种功能,是人们饮食生活中最常食用的蔬菜之一[18]。萝卜在保藏过程中易变糠,将萝卜干制成为传统贮藏方法之一[19]。但是白萝卜在干制后复水性较差,复原率较低,这可能是因为白萝卜营养成分中没有多糖存在,因此,本研究以白萝卜为实验对象,真空渗透黑木耳多糖组分,探究黑木耳多糖对白萝卜复水特性的影响,筛选出可改善脱水白萝卜复水特性的黑木耳多糖组分并进行结构鉴定,分析产生差异的原因。本实验旨在为改善白萝卜复水特性提供一种新思路,并为黑木耳多糖组分改善更多种类蔬菜复水特性的广泛应用提供理论依据。
1 材料与方法
1.1 材料与试剂
优级黑木耳干品(初始含水率为12%,粉碎成末)、白萝卜(品种:长春大根,产地:吉林长春,初始含水率为92.8%,切成3 mm×4 cm×4 cm圆片状)市售;DEAE-52纤维素、Sephadex G-100填料 源叶生物有限公司;无水乙醇、正丁醇(均为分析纯) 北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
CR-400色差计 杭州彩谱科技有限公司;ST-Z16质构仪 山东盛泰仪器有限公司;YDDC-550Z真空渗糖装置 安徽一鼎节能科技有限公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司;IRPrestuge-21傅里叶变换近红外光谱仪、LC-20AT高效液相色谱系统 日本岛津公司。
1.3 方法
1.3.1 黑木耳多糖制备
参考许海林[20]的方法提取黑木耳多糖,液料比30∶1(mL/g)、搅拌转速200 r/min、提取时间70 min、粒度80 目、提取温度100 ℃,得黑木耳粗多糖。在脱蛋白处理后的粗多糖中缓慢加入95%乙醇溶液直至乙醇体积分数达到10%,随后在收集的上清液中继续加95%乙醇溶液直至乙醇体积分数达到80%为止,上述分步醇沉后得到的沉淀再进行DEAE-52纤维素、Sephadex G-100分离纯化,得到不同多糖组分。
1.3.2 黑木耳多糖组分筛选
根据预实验结果,将纯化后获得的各组分多糖以质量浓度0.8 mg/mL、真空度0.08 MPa、抽空时间30 min、渗透温度40 ℃条件下真空渗透入白萝卜中,沥干多糖液后于60 ℃烘干,按预实验复水条件,在60 ℃复水至质量恒定,测定复水比、膨胀性、持水性、色泽及质构,以未渗透黑木耳多糖脱水白萝卜为空白(CK)组,筛选具有提高白萝卜复水特性的黑木耳多糖组分。每组分析方法测量3 次,取平均值。
1.3.2.1 复水比测定
经渗透、干燥后的白萝卜样品在(60±2)℃条件下复水至质量恒定,记录质量,进行复水比的测定[21]。复水比计算公式如下:
式中:Gf为样品复水后沥干质量/g;G0为干制品样品质量/g。
1.3.2.2 膨胀性测定
经渗透、干燥后的白萝卜样品在(60±2)℃条件下复水至质量恒定,记录质量、体积,进行膨胀性的测定[22]。膨胀性计算公式如下:
式中:V1为样品膨胀前体积/mL;V2为样品膨胀后体积/mL;W为样品质量/g。
1.3.2.3 持水性测定
经渗透、干燥后的白萝卜样品在(60±2)℃条件下复水至质量恒定,放置在离心管底部,并在白萝卜样品下面平铺足量的纱布以吸收离心过程中排出的水分,以4000 r/min进行离心处理,每次离心持续20 min以使白萝卜中水分充分排出[21]。通过测定离心前后样品的质量计算持水性,公式如下:
式中:Wt为复水后样品中全部水的质量/g;WRCF为离心出水的质量/g。
1.3.2.4 色泽测定
经渗透、干燥后的白萝卜样品在(60±2)℃条件下复水至质量恒定后进行色差测定。采用CR-400型色差计测定新鲜白萝卜及复水白萝卜的L*、a*、b*值[23],并计算色差值∆E。∆E计算公式如下:
式中:L0、a0、b0为新鲜组样品测得值;L*、a*、b*为处理组样品测得值。
1.3.2.5 质构测定
经渗透、干燥后的白萝卜样品在(60±2)℃条件下复水至质量恒定后进行质构测定[24]。
质构仪测定条件:两次测定时间的间隔为5 s,测试速率为1 mm/s,压缩程度为50%,触发力为0.3 N,数据收集率1 kHz。探头型号为TMS-50 mm。检测样品的硬度、弹性、咀嚼性、内聚性。
通过上述实验筛选出对脱水白萝卜复水特性结果差异较大的多糖组分进行结构鉴定。
1.3.3 黑木耳多糖结构鉴定
1.3.3.1 紫外全扫描检测
用蒸馏水配制多糖样品成1 mg/mL的多糖溶液3~5 mL,微孔滤膜过滤后,置于石英比色皿中,在200~400 nm波长处进行紫外全扫描[25]。
1.3.3.2 红外光谱检测
称量干燥后的多糖样品及溴化钾按质量比1∶100研磨压片,进行红外光谱扫描,扫描范围选择4000~400 cm-1[26]。
1.3.3.3 分子质量测定
采用高效液相凝胶色谱法测定多糖分子质量[27]。
色谱条件:Shimadzu高效液相色谱系统;TSK-gel G 43000 PWXLcolumn(7.8 mm×300 mm)色谱柱;RID-20A折射率检测器;样品质量浓度1 mg/mL;进样体积20 μL;流动相:0.2 mol/L NaCl溶液;流动速率0.6 mL/min。
1.3.3.4 单糖组成测定
采用1-苯基-3-甲基-5-吡唑啉酮柱前衍生化和高效液相色谱测定样品中单糖组成[28]。
色谱条件:Shimadzu高效液相色谱系统;色谱柱:COSMOSIL 5C18-PAQ(4.6 mm×250 mm);SPD-20A紫外检测器;流动相:磷酸盐缓冲盐水(0.1 mol/L,pH 7.0)-乙腈(81∶19,V/V);流速:1 mL/min;进样量:10 μL;检测波长:245 nm。
1.4 数据分析
采用SPSS中ANOVA测试,对不同处理组之间的差异进行统计分析,图和表中不同字母、符号表示差异显著,记为P<0.05,采用Origin 7.5软件进行绘图。
2 结果与分析
2.1 黑木耳多糖制备结果
用不同浓度NaCl溶液(0、0.2、0.4、0.6、0.8、1.0、2.0 mol/L)洗脱、95%乙醇溶液醇沉至乙醇体积分数为10%、80%后得到AAP-10、AAP-80两种黑木耳粗多糖,通过苯酚-硫酸法进行检测追踪,经DEAE-52纤维素纯化得到的洗脱曲线如图1所示,AAP-10、AAP-80各获得3 个组分,并按洗脱顺序对出现的主峰分布的管数进行收集,再分别对6 个组分进行Sephadex G-100层析柱进一步分离,期间用蒸馏水洗脱,通过苯酚-硫酸法进行检测追踪。

图1 AAP-10和AAP-80过DEAE-52层析柱的洗脱曲线Fig.1 Elution curves of AAP-10 and AAP-80 on DEAE-52 cellulose column
利用Sephadex G-100层析柱对DEAE-52纤维素洗脱AAP-10得到的3 个组分进一步纯化,洗脱曲线结果如图2所示,分别命名为AAP-10-I、AAP-10-II、AAP-10-III,并对出现主峰位置的管数进行收集,浓缩、冻干后进行渗透白萝卜实验。

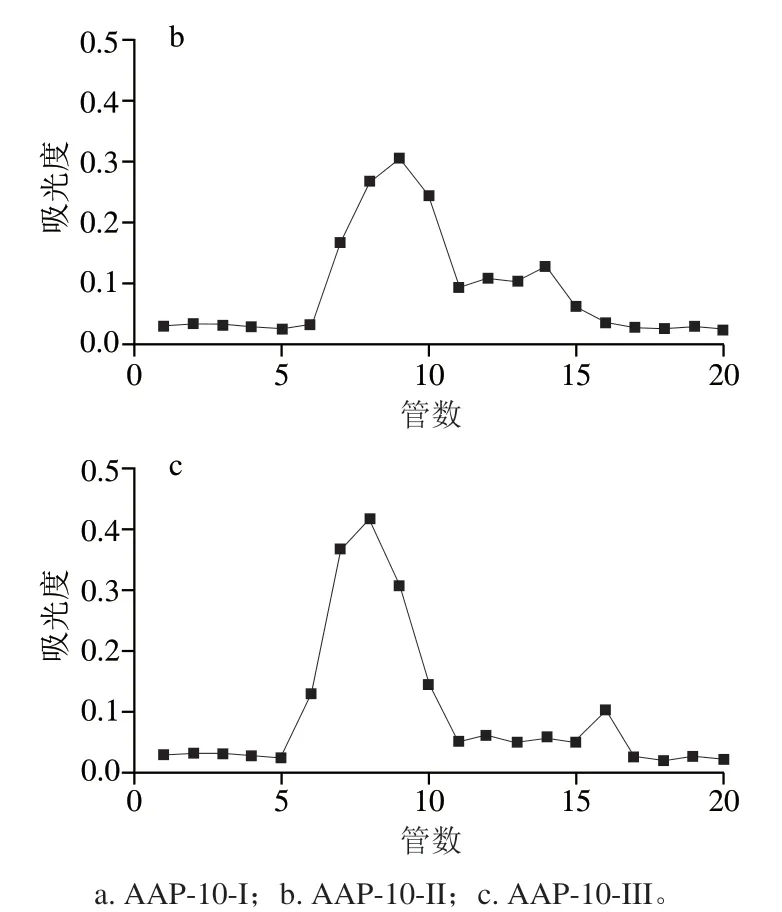
图2 AAP-10黑木耳粗多糖Sephadex G-100层析柱的洗脱曲线Fig.2 Elution curves of AAP-10 on Sephadex G-100 column
利用Sephadex G-100层析柱对DEAE-52纤维素洗脱AAP-80得到的3 个组分进一步纯化,洗脱曲线结果如图3所示,分别命名为AAP-80-I、AAP-80-II、AAP-80-III,并对出现主峰位置的管数进行收集,浓缩、冻干后进行渗透白萝卜实验。

图3 AAP-80黑木耳粗多糖Sephadex G-100层析柱的洗脱曲线Fig.3 Elution curves of AAP-80 on Sephadex G-100 column
2.2 黑木耳多糖各组分对脱水白萝卜复水特性的影响
2.2.1 黑木耳多糖各组分对脱水白萝卜复水比的影响
复水比越高,表明物料在干燥时内部受损程度越小,即越接近恢复到新鲜状态[29]。由图4可知,与CK组相比,渗透不同的黑木耳多糖组分均可提高脱水白萝卜复水比,且多数组分呈现显著差异。其中AAP-80-III组分渗透白萝卜后复水比最大,为7.32;AAP-10-I组分渗透后复水比最小,为6.39,差异不显著。有研究表明糖溶液渗透预处理后的样品具有足够的结构强度和机械强度承受热风干燥时的冲击[30],主要原因是糖可以取代大分子极性残留物周围的水分子,稳定磷脂和蛋白质,防止它们变性以及保持细胞的完整性,因此提高了复水过程中细胞对水分的吸收,复水比显著增加[31]。本实验结果与上述研究结果相似,说明不同的黑木耳多糖组分对白萝卜组织及细胞也有保护作用,进而提高其复水比。
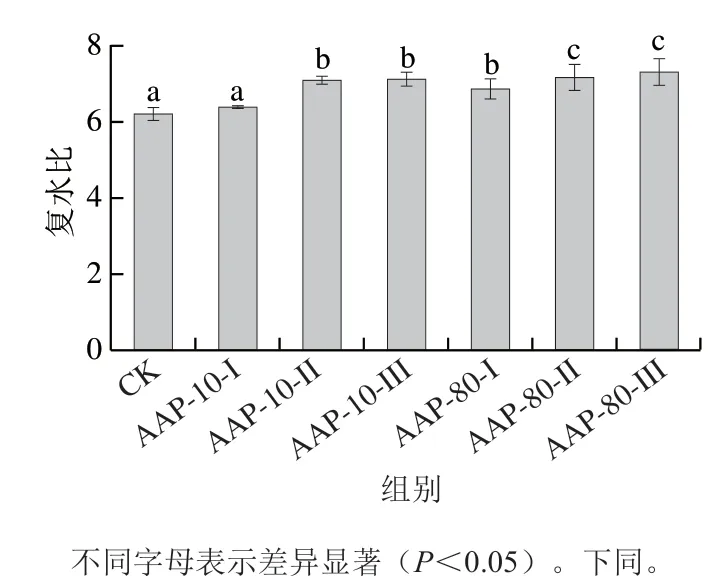
图4 各组分对脱水白萝卜复水比的影响Fig.4 Effects of AAP fractions on the rehydration ratio of dehydrated radish
许海林[20]研究表明,10%乙醇醇沉的多糖分子质量比较大,而80%乙醇醇沉的多糖分子质量较小,所以AAP-80-III组分比AAP-10中各组分更能提高白萝卜复水比,这可能与分子质量大小有关。
2.2.2 黑木耳多糖各组分对脱水白萝卜膨胀性的影响
膨胀性指样品的体积随含水率的增减而胀缩的特性。膨胀性升高,说明样品内部结构吸水能力强,体积膨胀,从而使原料的复水性能提升[32]。由图5可知,与CK组相比,渗透不同的黑木耳多糖组分均可提高脱水白萝卜复水后的膨胀性,且多数呈现显著差异。其中AAP-80-III组分处理的脱水白萝卜膨胀性为3.22 mL/g;AAP-10-I组分膨胀性最小,为2.68 mL/g,与CK组膨胀性相比差异不显著。相关研究表明[33],适当糖液的渗入,一定程度上支撑样品内部果胶的骨架,抑制体积收缩,从而增加了膨胀性。随着膨胀性升高,内部孔隙结构增多,原料的复水性能随之提升。且渗透过程中,不同渗透液羟基基团与样品内部羟基基团通过氢键结合的作用程度不同,导致组织细胞在干燥过程产生不同程度收缩。上述研究表明,本实验中不同黑木耳多糖组分对脱水白萝卜膨胀性的影响不同,可能原因是内部存在的羟基基团含量或者与白萝卜作用程度不同因此产生差异。
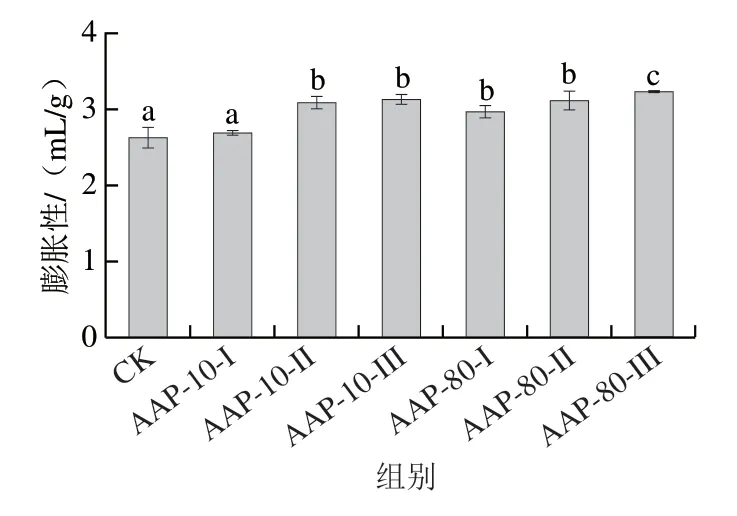
图5 各组分对脱水白萝卜膨胀性的影响Fig.5 Effects of AAP fractions on the expansibility of dehydrated radish
2.2.3 黑木耳多糖各组分对脱水白萝卜持水性的影响
持水性使复水后的样品更好保持原有的感官特性,而影响持水性的主要原因是组织中蛋白质网状结构对水分子的束缚作用。由图6可知,与CK组相比,渗透不同的黑木耳多糖组分均可提高白萝卜复水后的持水性,且多数组分呈显著差异。其中AAP-80-III组分对脱水白萝卜持水性最显著,持水性最大,为87.2%;AAP-10-I组分对脱水白萝卜持水性最小,为84.4%。有研究表明[25],大多数天然多糖具有亲水性基团,如—OH、—COOH、—CONH2和—SO3H,它们容易和生物组织形成非共价键,延长吸收部位的停留时间。因此,渗透多糖组分能提高脱水白萝卜持水性,原因可能是多糖中存在的亲水基团与白萝卜内部组织结合,增强对水分子的束缚能力,从而提髙白萝卜的持水性。而AAP-10-I和AAP-80-III渗透产生差异的原因可能是AAP-80-III中的亲水基团含量更多。

图6 各组分对脱水白萝卜持水性的影响Fig.6 Effects of AAP fractions on the water-holding capacity of dehydrated radish
2.2.4 黑木耳多糖各组分对脱水白萝卜色泽的影响
复水后样品的颜色更接近鲜品则表明色素及营养素的保留程度[22]。从表1可以看出,CK组样品和渗透多糖样品复水后的a*值与新鲜白萝卜样品相比相差不大,差异不显著,但L*值、b*值有显著性差异。其中L值越大说明颜色越白,b值越大说明颜色越接近纯黄色[34]。综合对比发现渗透过多糖的样品亮度更接近新鲜样品,L*值较CK组样品有增大趋势,b*值有减小趋势。其中,经AAP-80-III渗透后样品具有更好的色泽(L* 62.68±0.17、a*-1.06±0.02、b* 4.23±0.09)及硬度、咀嚼性。并且,ΔE结果表明,AAP-80-III渗透后样品色泽保存较好,影响较小。未渗透多糖的样品色泽影响最大,说明渗透多糖组分可明显改善复水后样品色泽。
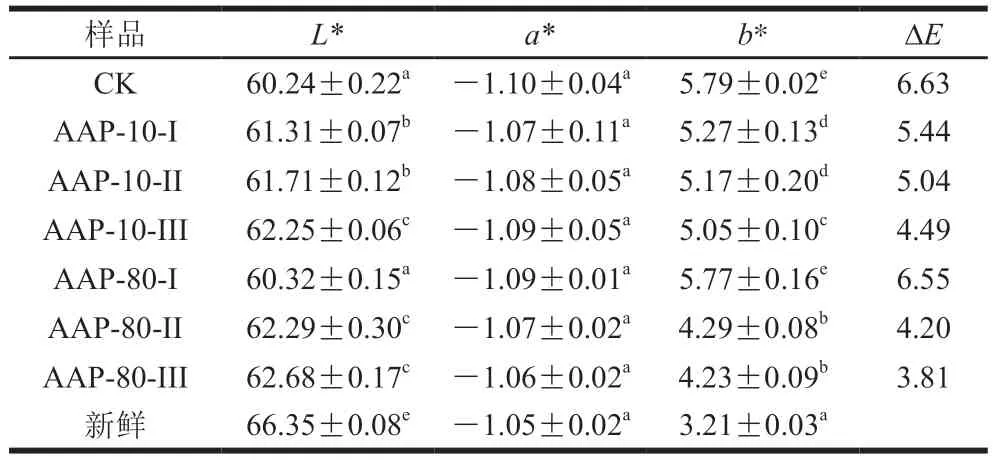
表1 渗透不同多糖组分对复水白萝卜色泽的影响Table 1 Effect of AAP fractions on color parameters of rehydrated radish
由于干燥过程中水分损失,发生了不可逆的蛋白质变性,在此过程中,质膜也受损伤,这些结构损伤导致植物细胞生物学功能的丧失,从而使酶及其各自的底物不再被分解,最终可能会发生影响最终产物的感觉和营养质量的反应,其中包括酶促褐变和颜色降解。因此酶活性的降低与干燥过程中结构损伤水平低有关,但是渗透糖溶液可以稳定磷脂和蛋白质,防止结构损伤[12]。并且也有研究表明,渗透糖溶液在抗坏血酸保留和颜色稳定性方面表现出更强的保护作用[35]。因此本实验渗透多糖组分后的样品呈现出与新鲜样品更接近的颜色,可能的原因是多糖组分在白萝卜干燥过程中降低了对其结构损伤,维持了颜色稳定性。
2.2.5 黑木耳多糖各组分对脱水白萝卜质构的影响
质构是衡量干制品复水后品质的一项重要指标[36]。从表2可以看出,渗透多糖组分对复水白萝卜的弹性和内聚性均无显著差异。但是对复水白萝卜的硬度和咀嚼性均有不同程度的提高,且呈显著差异,其中AAP-80-III组分与其他组分相比,对复水白萝卜硬度的保留效果更明显((1746.14±11.9)N),且具有更好的咀嚼性((1207.09±9.39)N)。Levi等[37]发现,样品在干燥过程中组织结构被破坏,果胶释放,使得样品复水后的硬度显著降低。Taiwo等[38]研究表明,与未渗透糖液的样品相比,渗透糖液的样品复水后硬度增加,这是因为糖可以增加果胶-果胶相互作用影响细胞壁的结构性质,使得复水后样品硬度得到一定保留。本实验结果显示,渗透不同多糖组分后脱水白萝卜的硬度、咀嚼性同样得到较好保留。
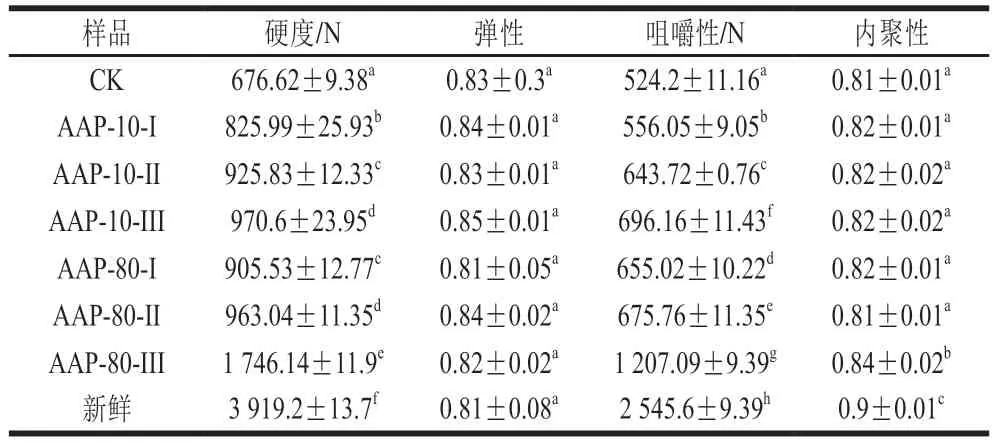
表2 渗透不同多糖组分对复水白萝卜质构的影响Table 2 Effects of AAP fractions on texture properties of rehydrated radish
2.3 黑木耳多糖组分结构鉴定
AAP-80-III可有效提高脱水白萝卜复水特性,同时对比发现,AAP-10-I提高脱水白萝卜的复水特性不显著,为探究产生差异的原因,选取AAP-10-I、AAP-80-III进行结构鉴定。
2.3.1 紫外全扫描测定结果
AAP-10-I和AAP-80-III进行紫外光谱扫描,图7显示,两种多糖在260、290 nm波长处都没有明显吸收峰出现,表明这两种多糖均不含有蛋白质及核酸[39]。

图7 AAP-10-I和AAP-80-III紫外光谱图Fig.7 UV spectra of AAP-10-I and AAP-80-III
2.3.2 红外光谱测定结果
由图8得知,两种多糖的红外光谱图极其相近,出现吸收峰的位置均在相近范围内,二者在3413 cm-1处强吸收峰是—OH伸缩振动引起的吸收[40];2927 cm-1处是—CH2—、—CH3引起的伸缩振动吸收,是糖类化合物的典型代表[28];二者在1618 cm-1和1400 cm-1附近的吸收峰被认为是—COOH引起的振动[40];在1085 cm-1附近是吡喃糖环结构的特征吸收峰,说明二者均含有吡喃糖环[41];865 cm-1附近出现的吸收峰则是β-糖苷键的特征吸收峰,说明两种多糖分子间均以β-糖苷键连接为主[40]。以上结果表明两种多糖均含有—OH、—COOH等亲水性基团,所以白萝卜渗透多糖组分后膨胀性、持水性变好的原因与多糖内部存在的亲水性基团密切相关。

图8 AAP-10-I和AAP-80-III红外光谱图Fig.8 Infrared spectra of AAP-10-I and AAP-80-III
2.3.3 分子质量测定结果
测定葡聚糖标准品系列的标准曲线结果为y=-0.2061x+1.0962,R2=0.992。AAP-10-I、AAP-80-III分子质量分布测定结果如图9所示,经计算,AAP-10-I的平均分子质量为22 kDa,AAP-80-III的平均分子质量为1.5 kDa。有研究表明,低分子质量的黑木耳多糖组分由于松散的构象更易被组织吸收,从而使多糖进入细胞及内部组织的阻力更小[42-43]。且李卓豪等[44]研究显示,小分子质量溶质渗透液具有更高的渗透压,更容易进入植物组织内部。本实验分子质量测定结果表明,AAP-80-III的分子质量远小于AAP-10-I的分子质量,更容易进入白萝卜组织进而提高复水性。因此,黑木耳多糖分子质量大小与脱水白萝卜复水特性存在密切关系。

图9 AAP-10-I(a)和AAP-80-III(b)分子质量分布Fig.9 Molecular mass distribution of AAP-10-I (a) and AAP-80-III (b)
2.3.4 单糖组成测定结果
由图10可知,在两个样品中,AAP-10-I检测出葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、阿拉伯糖(arabinose,Ara)、甘露糖(mannose,Man)、半乳糖醛酸(galacturonic acid,GalA)5 种单糖,其物质的量比为96.1∶1.2∶1.3∶0.9∶0.5。AAP-80-III中鉴定出Glc、Ara、Gal、Man、葡萄糖醛酸(glucuronic acid,GlcA)、鼠李糖(rhamnose,Rha)、GalA、岩藻糖(fucose,Fuc)8 种单糖,其物质的量比为37.2∶29∶14.9∶7.3∶5.2∶2.7∶2.6∶1.1。结果表明两种多糖中Glc含量均最高,但AAP-80-III中,Ara含量也占较大比例,两种多糖的单糖组成有明显差异。在西兰花保水能力的研究中[45],实验发现西兰花中的Ara侧链结构将水分子保持在细胞壁网络内,增加西兰花组织吸水能力,从而提高复水特性。因此AAP-10-I、AAP-80-III渗透白萝卜后复水特性产生差异的原因与二者单糖组成中Ara含量有关,Ara含量越高,脱水白萝卜复水特性越好。

图10 AAP-10-I(a)和AAP-80-III(b)单糖组成Fig.10 Monosaccharide compositions of AAP-10-I (a) and AAP-80-III (b)
3 讨论
通过对黑木耳多糖组分结构分析,结果表明本实验提取出的黑木耳多糖具有分子质量低且含有Ara的特点。通过不同来源物质中多糖组分的结构信息表明,瓜蒌皮[46]、牛蒡根[47]、甘草[48]、银耳[49]中的多糖分子质量相对于本实验黑木耳多糖分子质量大的多,并且,不同种类的黑木耳中黑木耳多糖的分子质量有所不同[27,50-51]。研究表明[52],分子质量小的糖类物质具有较大的渗透压,在改善样品复水特性中有较好的效果,这正是本实验中黑木耳多糖可改善白萝卜复水性的主要原因之一。通过已有报道中黑木耳多糖的结构信息表明,不同的黑木耳多糖中单糖组成各不相同[27,50-51]。研究表明[45],Ara在蔬菜组织中具有吸水能力,这说明本研究所提取多糖中的Ara在提高脱水蔬菜复水性也起到了促进作用。
另外,实验对比了黑木耳多糖中不同组分的分子质量和单糖组成与脱水白萝卜复水特性的关系,研究结果表明,不同组分的黑木耳多糖均含有亲水性基团,这在一定程度上可以提高白萝卜复水性,然而,分子质量较低的AAP-80-III,更容易进入白萝卜组织,改善脱水白萝卜复水特性。同时,在AAP-80-III中,Ara含量占比较大,更大程度上增强了脱水白萝卜的吸水能力。在实验中还发现相比于AAP-80-II和AAP-80-III,AAP-80-I改善脱水白萝卜复水特性的效果欠佳,这可能归因于AAP-80-I的分子质量低到无法形成复杂的空间结构,对白萝卜组织保护能力较弱。因此,后续研究可从探究多糖空间结构对脱水白萝卜的影响,或是确定出可改善脱水白萝卜复水特性的黑木耳多糖分子质量的范围等方面进一步探索。
本实验成功将多糖应用在改善蔬菜复水特性上,并取得很好的结果,在今后研究渗透液种类上提供了新思路。同时,为黑木耳多糖组分在未来改善脱水蔬菜品质的领域中提供技术及理论支持。
4 结论
通过热水浸提法对黑木耳多糖进行提取,将分离纯化后获得的组分对白萝卜进行真空渗透,筛选出可提高脱水白萝卜复水特性的组分,并对其进行结构鉴定。复水特性实验结果表明,AAP-80-III可有效改善脱水白萝卜复水特性,较好地保持复水后样品的色泽、硬度及咀嚼性;而AAP-10-I对改善脱水白萝卜复水特性以及色泽、质构的差异不显著。对二者进行结构鉴定,结果表明,AAP-10-I和AAP-80-III均含有亲水性基团,而对脱水白萝卜复水特性产生差异的原因是二者分子质量不同,AAP-80-III分子质量远小于AAP-10-I,更易被白萝卜细胞组织吸收,可减轻在干燥过程中的损伤,对白萝卜细胞具有保护作用,进而提高脱水白萝卜复水特性,并且两种的单糖组成具有差异,AAP-80-III中Ara占有更高比例,增强白萝卜保水能力。综上,分子质量和单糖组成不同的多糖组分与白萝卜作用程度不同,进而对复水特性的影响不同。上述研究结果将为多糖在提高脱水蔬菜复水性的应用中提供理论依据,对脱水蔬菜的综合开发利用具有重要意义。
