磷酸二酯酶4D纯合子敲除小鼠的构建
2023-03-02朱振铎苏甜甜程慧娟江春如方茹红管秋韵葛明丽汪庆童
朱振铎,苏甜甜,程慧娟,江春如,方茹红,管秋韵,何 凤,葛明丽,魏 伟,汪庆童
磷酸二酯酶(phosphodiesterase, PDE)是21个基因编码的11种不同亚型酶(PDE1-PDE11)的超级大家族[1],PDE4D亚型在心脏、肝脏、肾脏等组织中表达较高。PDE4D的主要功能是通过与环磷酸腺苷(cyclic adenosine monophosphate,cAMP)结合并将其降解为5′-腺嘌呤核苷酸(adenosine 5′-monophosphate,5′AMP)[2]。PDE4D表达升高会增加房颤的易感性和心源性中风的风险,也在非酒精性脂肪肝、阿尔茨海默病等疾病的发生发展中发挥重要作用[3],PDE4D可能为这些疾病的潜在治疗靶点。构建PDE4D基因敲除小鼠对充分阐明PDE4D的病理作用机制及药物靶点的明确具有重要意义。该研究与江苏集萃药康生物科技有限公司合作,利用CRISPR/Cas9技术构建PDE4D基因纯合敲除(PDE4D-/-)小鼠,对后代子鼠进行基因型鉴定,检测PDE4D-/-小鼠主要器官组织中PDE4D蛋白的表达水平,超声影像学和HE染色观察小鼠主要器官形态、功能与组织学特征,从而验证PDE4D-/-小鼠构建的结果,为以PDE4D为靶点的疾病和药物研究提供基因工程动物模型。
1 材料与方法
1.1 实验动物小鼠在SPF级实验室饲养及繁殖。实验室光照和黑暗时间各12 h交替,小鼠饲料、垫料以及饮用水均经过高温高压消毒灭菌处理。本研究经安徽医科大学临床药理研究所动物实验伦理审查委员会批准,伦理审查批准号为LLSC 20190307。
1.2 主要试剂及仪器PGK1.1线性载体由江苏集萃药康生物科技有限公司提供;核酸染料购自中国Meilunbio公司;琼脂糖凝胶购自中国Biosharp公司;Genotyping Mix 购自中国Vazyme公司;抗 GAPDH抗体购自美国Proteintech公司;抗PDE4D抗体购自美国Proteintech公司;辣根酶标记的山羊抗鼠 IgG 购自美国Jackson公司。Tanon-1600全自动数码凝胶图像分析系统购自上海天能公司,Visual Sonics Vevo 2100系统购自加拿大 FUJI FILM公司,Pannoramic MIDI高分辨玻片扫描系统购自匈牙利3D HISTECH公司,Tanon-5200成像系统购自上海天能公司。
1.3 方法
1.3.1先导RNA载体构建 PDE4D基因共有20个转录本,由至少18个外显子组成,分布在150 kb的基因组DNA上。根据PDE4D基因的结构特点,选择PDE4D的外显子4、外显子5 (ENSMUST00000122041.7)为敲除区域,该区域包含229bp的编码序列,敲除该区域将导致PDE4D蛋白质缺失(图1)。利用CRISPR Design软件设计筛选得到先导RNA(single guide RNA, sgRNA),分别为5S1-(GTGAGCCGACTGTAAAGTGC)、5S2-(AAG GTACAACTTGGACCATC)、3S1-(AATGGGACCTTGA ATACCTT)、3S2-(AGATCTACCCAAGGTATTCA),各自识别前间区序列邻近基序CGG、CGG、GGG、AGG。构建sgRNA表达载体,将载体线性化和纯化后作为模板用于体外转录。
1.3.2PDE4D-/-小鼠获得 将Cas9 mRNA和转录后的sgRNA显微注射到C57BL/6J小鼠的受精卵原核中,然后移植入C57BL/6J假孕雌性小鼠子宫中,繁育后获得阳性F0(PDE4D+/-)小鼠,阳性F0代小鼠与C57BL/6J小鼠交配产生具有杂合基因型(PDE4D+/-)的稳定F1后代模型。PDE4D+/-小鼠之间进一步杂交产生F2代纯合子小鼠(PDE4D-/-),通过PCR和基因测序确认小鼠基因序列。

图1 利用CRISPR/Cas9系统构建PDE4D基因敲除策略
1.3.3基因型鉴定
1.3.3.1鼠尾DNA的提取 子代小鼠在14日龄时剪尾,剪取组织长度约0.2 cm。在EP管中加入鼠尾裂解液(50 ml裂解液中含25 ml Tris HCl, 0.292 3 g NaCl, 10 ml EDTA pH=8, 0.5 g SDS, 37.5 ml ddH2O)和蛋白酶K(10 mg/ml),涡旋后置入60 ℃水浴锅过夜。次日煮沸10 min终止裂解。高速离心10 min去除组织或毛发残留,吸取上清液,加入等体积预冷的异丙醇,上下轻柔颠倒。室温静置10 min,离心去上清液,加入预冷的70%乙醇溶液,离心去上清液。室温30 min,待乙醇挥发,加入20 μl DEPC水,溶解作为DNA样本保存在4 ℃。
1.3.3.2PCR扩增反应 引物设计策略为F1、R1针对KO小鼠设计,F2、R2针对野生型小鼠设计(图2)。引物由上海生工公司合成。引物序列为F1(GCATGAAGGATACTTCCCAAGACTG)、R1(GACTGGGGTGCCTCTGAGCTTTTA)、F2(GAACAGACATAGAGCACCTTCCACA)、R2(CCTTGAGCCTGTTAGTGCTGGGAT)。PCR反应体系总体积共25μl,包含2×Taq Master Mix 12.5 μl,ddH2O 9.5 μl,正向引物1 μl,反向引物1 μl,DNA样本1 μl。PCR反应程序依次为95 ℃ 5 min,(98 ℃ 30 s,65 ℃ 30 s,72 ℃ 45 s)共20个循环,(98 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s)经过20个循环,72 ℃ 5 min, 4 ℃ 保存。

图2 引物设计策略
1.3.3.3凝胶电泳 配制1%琼脂糖凝胶电泳,琼脂糖0.3 g加入1×TAE buffer 30 ml中。加入3 μl的核酸染料,取上述PCR扩增产物10 μl电泳,电压120 V,电泳30 min,在全自动数码凝胶图像分析系统中观察分析条带。
1.3.4超声影像学检查 为评价PDE4D小鼠心脏结构和功能,用Visual Sonics Vevo 2100系统和MS 550探头监测经胸超声心动图。褪去小鼠胸腹部毛发,异氟烷诱导麻醉。当小鼠被麻醉后,置于加热垫上,心率保持在每分钟400~500次。在B-mode下扫描短轴切面获得乳头肌切面,用M-mode分析心脏收缩功能,得到3个心脏周期的左心室射血分数(ejection fraction,EF)和左心室缩短分数(fractional shortening, FS)。使用脉冲波多普勒评估心脏舒张功能。从脉冲波多普勒频谱波形中,测量二尖瓣E/A比值(mitral valve E to A ratio, MV E/A)、左心室等容舒张时间(left ventricular isovolumic relaxation time, IVRT)。转换探头角度获取肝脏和肾脏的超声图像,观察其所在位置、大小、形态及内部回声情况。
1.3.5小鼠体质量和重要器官的HE染色 将野生型小鼠、PDE4D+/-和PDE4D-/-称重后,麻醉小鼠处死取其心脏、肝、肾组织,用4%多聚甲醛固定,包埋在石蜡中切成4 μm的切片进行苏木精-伊红(HE)染色。使用高分辨玻片扫描系统收集HE染色的图像。
1.3.6主要器官PDE4D蛋白水平检测 麻醉小鼠后处死取其心脏、肝、肾提取组织蛋白。使用含有10 mmol/LPMSF和10 mmol/L磷酸酶抑制剂的裂解缓冲液中提取蛋白质。制备SDS聚丙烯酰胺凝胶,电泳,将目的蛋白转移到PVDF膜上。5%脱脂牛奶37 ℃封闭2 h,在PDE4D一抗中4 ℃过夜。用相应的二抗在37 ℃下孵育2 h。最后在成像系统上应用ECL底物对膜进行成像,ImageJ软件对条带进行半定量分析。

2 结果
2.1 获得PDE4D杂合敲除F1代小鼠将sgRNA显微注射到C57BL/6J小鼠的受精卵中,获得阳性F0代小鼠,通过基因测序对其进行基因型鉴定,测序结果比对野生型小鼠基因序列(图3A),可以确定在小鼠的基因组序列中,PDE4D基因缺失。为了构建稳定遗传的PDE4D-/-小鼠,F0代PDE4D+/-小鼠与C57BL/6J小鼠交配得到F1代小鼠,编号为39、41、43、45。F1代子鼠DNA经过PCR扩增后,凝胶电泳结果显示在383 bp处和385 bp处均有阳性条带(图3B),表明成功繁育出PDE4D+/-小鼠。
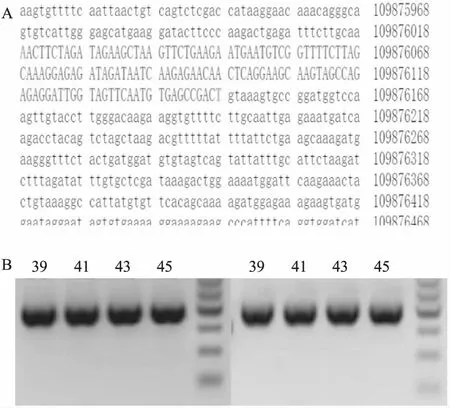
图3 F0代和F1代小鼠基因鉴定
2.2 获得PDE4D基因纯合敲除小鼠为获得PDE4D-/-小鼠,F1代PDE4D杂合子小鼠交配繁育得到F2代小鼠,通过PCR扩增对其进行基因型鉴定(图4)。编号13、21、33为纯合子小鼠。凝胶电泳结果显示编号13、21、33号在383 bp处有阳性条带,而385 bp处没有阳性条带,提示成功建立PDE4D-/-小鼠,且具有稳定遗传性。

图4 F2代小鼠基因鉴定
2.3 验证PDE4D敲除对小鼠体内主要脏器的影响与PDE4D+/+小鼠相比,PDE4D-/-小鼠外观及生理表现未见明显异常。称重后发现同窝小鼠PDE4D敲除小鼠体质量相比于PDE4D+/+小鼠减轻(P<0.01)(图5A)。获取小鼠心脏、肝、肾等体内重要脏器的超声图像和超声指标。超声心动图结果显示PDE4D敲除小鼠心脏形态无明显改变。红圈和蓝圈区分肾脏和肝脏超声图像。肝脏大小正常,包膜光滑,肝脏下缘角锐利。肾形态大小均一,肾实质回声均匀(图5B)。心脏收缩功能参数EF和FS与PDE4D+/+小鼠相比没有明显改变,心脏舒张功能参数E/A、IVRT指标也无明显变化(图5C)。小鼠麻醉后,取出其心脏、肝肾组织包埋后染色,HE结果显示PDE4D-/-小鼠的心脏乳头肌部位心肌细胞排列整齐,心肌细胞大小无明显差异。肝细胞形态完整,胞核无明显改变,肝小叶形态完整。肾脏组织结构正常,肾小球无萎缩,肾小管排列紧密(图5D)。以上结果可提示PDE4D敲除对小鼠生长有抑制作用,但对体内重要器官心、肝、肾等无明显影响。
2.4 PDE4D敲除小鼠体内PDE4D表达情况为验证PDE4D小鼠的敲除情况,用PDE4D小鼠心脏、肝、肾提取组织蛋白。结果显示,在心脏、肝脏、肾脏组织中,PDE4D+/-小鼠PDE4D蛋白表达与PDE4D+/+小鼠相比明显降低(P<0.05),PDE4D-/-小鼠PDE4D蛋白几乎无表达(P<0.001)(图6),以上结果验证了PDE4D基因在小鼠体内成功敲除,且敲除效果较好。
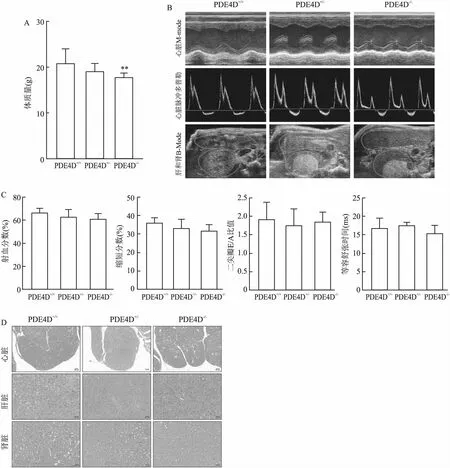
图5 PDE4D+/+、PDE4D+/-和PDE4D-/-小鼠体质量及心、肝和肾的超声图像和心功能各指标变化和组织变化比较

图6 PDE4D+/+、PDE4D+/-和PDE4D-/-小鼠主要组织中PDE4D的表达情况
3 讨论
通过PCR扩增后凝胶电泳和基因测序技术以及Western blot实验验证PDE4D-/-小鼠PDE4D蛋白的表达情况,可以确定已经繁育出稳定遗传的PDE4D纯合子敲除小鼠。PDE4D-/-小鼠体质量比同年龄野生型小鼠低,有研究报道称PED4D敲除小鼠生长延迟、排卵障碍、出生后生存能力降低[4]。PDE4D纯合雌性小鼠表现出生育能力下降,研究者认为是排卵障碍和颗粒细胞对促性腺激素的敏感性降低所致。本研究显示雌性PDE4D-/-小鼠生育率低于野生型小鼠,雌性PDE4D-/-小鼠每笼生育4~6只,野生型小鼠每笼生育6~8只。为确定敲除PDE4D后是否对体内脏器有影响,本研究采用超声影像学技术检测重要脏器心脏的功能、肝和肾的形态以及HE染色观察心、肝、肾的病理变化,结果显示PDE4D敲除小鼠体内主要器官无明显的病变,可以确保下一步动物实验的顺利开展。
PDE4D属于磷酸二酯酶家族,在心血管疾病、自身免疫性疾病、神经系统疾病、肿瘤等的发生发展中起到重要作用。PDE4D的表达是由胰岛素受体、胰岛素受体底物和G蛋白偶联受体激酶2(G pro-tein-coupled receptor kinase 2,GRK2)和β-arrestin2依赖的β2肾上腺素受体(β2adrenergic receptor,β2AR)-细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号级联反式激活介导。高脂饮食饲养使小鼠心脏中PDE4D的表达增加,导致心脏收缩和舒张功能障碍[5]。糖尿病大鼠心脏中同样观察到cAMP水平增加,PDE4D表达特异性上调[6]。PDE4D通过激活肝脏中的CD36-转化生长因子-β1(transforming growth factor,TGF-β1)信号传导,在非酒精性脂肪肝和相关高血压的发病机制中起重要作用[7]。这些研究共同证实PDE4D是人体系统功能不可缺少的调节因子,正在逐渐成为临床上疾病诊断治疗靶点。因此,哺乳动物PDE4D敲除小鼠为特定疾病的病理生理机制的研究提供了非常有价值的动物模型。
虽然可以使用PDE4D抑制剂整体降低PDE4D的表达或活性用以探索其功能,但均存在局限性。常见的PDE4D抑制剂有多肽片段,重组腺相关病毒包裹的PDE4D短发夹RNA(short hairpin RNA,shRNA)和小分子化合物等。抑制性多肽的半衰期通常较短,给药途径受限;重组腺相关病毒的组织特异性较差,干扰效率差异较大。已知小分子化合物BPN14770和CP-671305可选择性抑制PDE4D的活性,BPN14770对PDE4D3的半抑制浓度(half maximal inhibitory concentration, IC50)为7.4 nmol/L,对PDE4D7的抑制IC50为7.8 nmol/L,而对其他PDE4D亚型的抑制率有待确定,CP-671305抑制PDE4D的IC50为3 nmol/L,但在较大浓度时,其也可以抑制PDE4的其他同工酶[8]。采用CRISPR/Cas9基因编辑技术构建PDE4D基因敲除小鼠,具有成本较低、周期短和效率高等优点,可明确减少PDE4D的表达,为研究提供可靠的动物模型[9]。
综上所述,本研究成功建立了可稳定遗传的PDE4D纯合敲除小鼠,敲除PDE4D未发现对体内主要脏器产生明显的影响,可用于PDE4D为靶点的疾病模型探索和新药研发。
