储藏过程中不同涂膜处理方式对槟榔鲜果品质的影响
2023-02-27唐敏敏张玉锋罗诗怡
刘 璨,陈 华,3*,唐敏敏,宋 菲,张玉锋,罗诗怡
1.华中农业大学食品科学技术学院,湖北武汉 430070;2.中国热带农业科学院椰子研究所,海南文昌 571339;3.海南省槟榔产业工程研究中心,海南文昌 571339
槟榔(Areca catechuL.)是海南省的重要经济作物,是海南东部、中部和南部地区200多万农民重要的经济来源[1]。槟榔作为我国四大南药之一,含有生物碱、酚类、缩合鞣质等生物活性成分,具有抑菌、抗炎、抗氧化、抗溶血、抗疲劳、抗衰老等作用[2]。鲜食槟榔是我国槟榔消费的主要产品之一,且其活性功能的开发潜力巨大。常见的槟榔保鲜方法有:利用茉莉酸甲酯、脱氢乙酸钠、氯化钙、6-苄氨基腺嘌呤(6-BA)、甲基硫菌灵、赤霉素(GA3)、1-甲基环丙烯(1-MCP)、次氯酸钠、硫化氢、果蜡等涂膜,物理方法则包括冷藏、气调、辐照保鲜处理等,已有报道采用60Co-γ辐照与100 mg/L赤霉素、100 mg/L 6-BA、50%果蜡复配涂膜相结合,能有效控制因霉菌引起的果实腐烂,并能降低槟榔碱损失[3-8]。涂膜保鲜是指在产品表面人为添加一层其本不具有的可食性包覆薄膜,常见的有多糖类、脂类、聚乙烯醇、蛋白质类基质,可显著增加果蔬光亮度、降低果实被外界致病菌感染的风险,同时调控呼吸强度、硬度、物质成分含量等品质指标,改善果皮通透性、细胞壁金属离子代谢通路及外源植物激素含量的方式来延缓或部分抑制鲜果自身代谢,从而达到延长保鲜期或提升品质的目的[9-10]。现关于百里香酚、茶多酚、壳聚糖对槟榔鲜果保鲜效果的研究报道较少,因此本研究从百里香酚、茶多酚、壳聚糖对槟榔鲜果的保鲜效果出发,探讨不同涂膜处理对槟榔鲜果品质的影响规律,为槟榔壳聚糖涂膜保鲜提供参考。
1 材料与方法
1.1 材料
槟榔鲜果:2021年 12月采摘于中国热带农业科学院椰子研究所槟榔种植基地,果形指数保持在1.8±0.1左右;所有鲜果经蒸馏水、1 mmol/L焦亚硫酸钠清洗后,统一对果蒂处进行抗氧化剂(叔丁基对苯二酚)封闭处理。
主要试剂:壳聚糖、茶多酚(国产市售)、三氯化铝,DG(18)培养基、PDA培养基、铁氰化钾、半乳糖醛酸、叶绿素a均购于麦克林试剂有限公司,没食子酸、芦丁标准品购于 Biotech sharp和Sangan Biotech公司,木质素、纤维素、蒽酮购于阿拉丁生化科技有限公司;1,1-二苯基-2-苦基肼标准品购于西格玛贸易有限公司;其他试剂均为国药AR级。
主要仪器:pH计pHS-3C;数码体视生物显微镜S8APO;培养箱DGZL-1000;色差计柯尼卡美CM-700d;高速中药粉碎机IKA ALL;超净工作台SW-CJ-1CU;人工气候箱杭州微松环境科技有限公司;食品物性分析仪FTC/TMS-PR;冷冻离心机HERMLEZ32HK;全自动荧光免疫分析仪Thermo Sci-Var-Flash;LED灯箱,-40℃低温速冻冰箱。
1.2 方法
1.2.1 鲜果预处理 样品经自来水清洗并以1 mmol/L Na2S2O5简单消毒后,3种处理:CK(含0.5142 g/L HCl,2.367 g/L 吐温 100)、T1(含0.5142 g/L HCl,11.83 g/L壳聚糖,2.367 g/L吐温100)、T2(含 0.5142 g/L HCl,11.83 g/L 壳聚糖,3.56 g/L茶多酚,1.75 g/L百里香酚,2.367 g/L吐温 100),所有复配体系在 13℃、100 r/min避光振荡2 h,超声脱气30 min后使用。将鲜果样品分别置于 CK、T1、T2涂膜处理剂中,均匀浸泡10 s后用滤网沥出,再把所有样品置于13℃通风避光环境下晾干12 h,再以PE带孔保鲜袋(厚度0.01 mm,孔径8 mm×8 mm无菌滤纸透气孔)进行封装,每袋约为10个左右,如图1所示,于13℃、相对湿度65%环境下储藏备用。

图1 槟榔鲜果预处理后包装成品Fig.1 Pretreated and packed fresh betel nut
1.2.2 样品制备方法 待测的鲜果弃其果蒂,洗净后切开得到果仁、果皮。果仁经-40℃速冻后置于50 mL离心管中并加入20 mL蒸馏水后,采用漩涡混合器进行研磨处理,得到的匀浆再加入20 mL蒸馏水,经真空抽滤后取上清液储存于-40℃冰箱备用。果皮经-40℃速冻后采用高速中药粉碎机粉碎 1 min,处理得到的均匀纤维置于50 mL离心管中,加入40 mL蒸馏水于4℃培养箱中振荡提取1 h后,经真空抽滤后取上清液,储存于-40℃冰箱备用。
1.2.3 物理指标测定 经过上述处理后,测定槟榔果实物理指标。
(1)失重率的测定。失重率=(初始重量-储藏第n天的重量)/初始重量×100%。
(2)腐烂率的测定。腐烂率=[Σ(单果腐烂面积×对应腐烂果个数)]/总个数×100%。
(3)色差的测定。色差值由色差计在LED灯箱内测定,最终结果表示为*L、*a、*b、ΔE值的均值,计算公式为:并计算得到色角度值H,计算公式为:H=arc(tanh),h=*b/*a;
(4)硬度的测定。利用食品物性分析仪测定样品,将槟榔鲜果沿纵径固定于横切面半径r=40 mm的泡沫半圆柱槽内,鲜果的横径最高点为挤压起始点,探头为直径75 mm的圆盘挤压探头,参数:最大触发力250 N,起始位移50 mm,挤压形变量10%,测试速度2 mm/s,挤压2次。
(5)呼吸强度的测定。植物呼吸强度常用乙烯释放量来表示,本研究在CO2静置吸收法上稍作修改[11-12]。在内置塑料网、体积 0.4 L、半径r=(5.0±0.1)mm的 PPE双旋口塑料瓶内进行呼吸强度测定。在塑料网上方放置已知重量的槟榔鲜果,下方加入4 mL 0.1 mol/L NaOH标准溶液。旋紧瓶身后统一置于13℃、相对湿度65%环境下反应,30 min后用2 mL去CO2蒸馏水将碱液洗至洁净锥形瓶中,另加 1 mL饱和 Na2CO3溶液和20 μL酚酞指示剂,用0.04 mol/L草酸滴定,体系由紫色变为白色且30 s内颜色不再改变为滴定终点,计算公式为:NCO2=2×(V1×0.04-V2×0.1);呼吸强度=NCO2×44×m-1×t-1;式中,N表示 CO2物质的量,单位为 mol;V1表示滴定至终点时所用0.04 mol/L草酸的体积,单位为L;V2表示0.1 mol/L NaOH标准溶液的使用体积,单位为 L;m表示鲜果重量,单位为 kg;t表示反应时间,单位为min;呼吸强度的单位为mg/(kg·min)。
(6)果仁褐变程度的测定。鲜果纵切后,立即在灯箱内以HUAWEI YAL-AL进行切面RGB图像的采集,设备的光圈值 f/1.4、曝光时间1/180 s、水平垂直分辨率均为 96 dpi,图像的分辨率为3000 pxiel×4000 pxiel。原始图像采集完成后,对图像分析处理后可用于特征值的表征[13]。以 Image J 2.4软件进行处理分析,图像类型为sRGB stack,采用 Interactive 3D surface plot对采集的图像进行3D处理,以X-Z投影面上Z轴像素点的分布来展示果仁的褐变程度。以采摘后发生褐变的鲜果为例,处理步骤见图2。
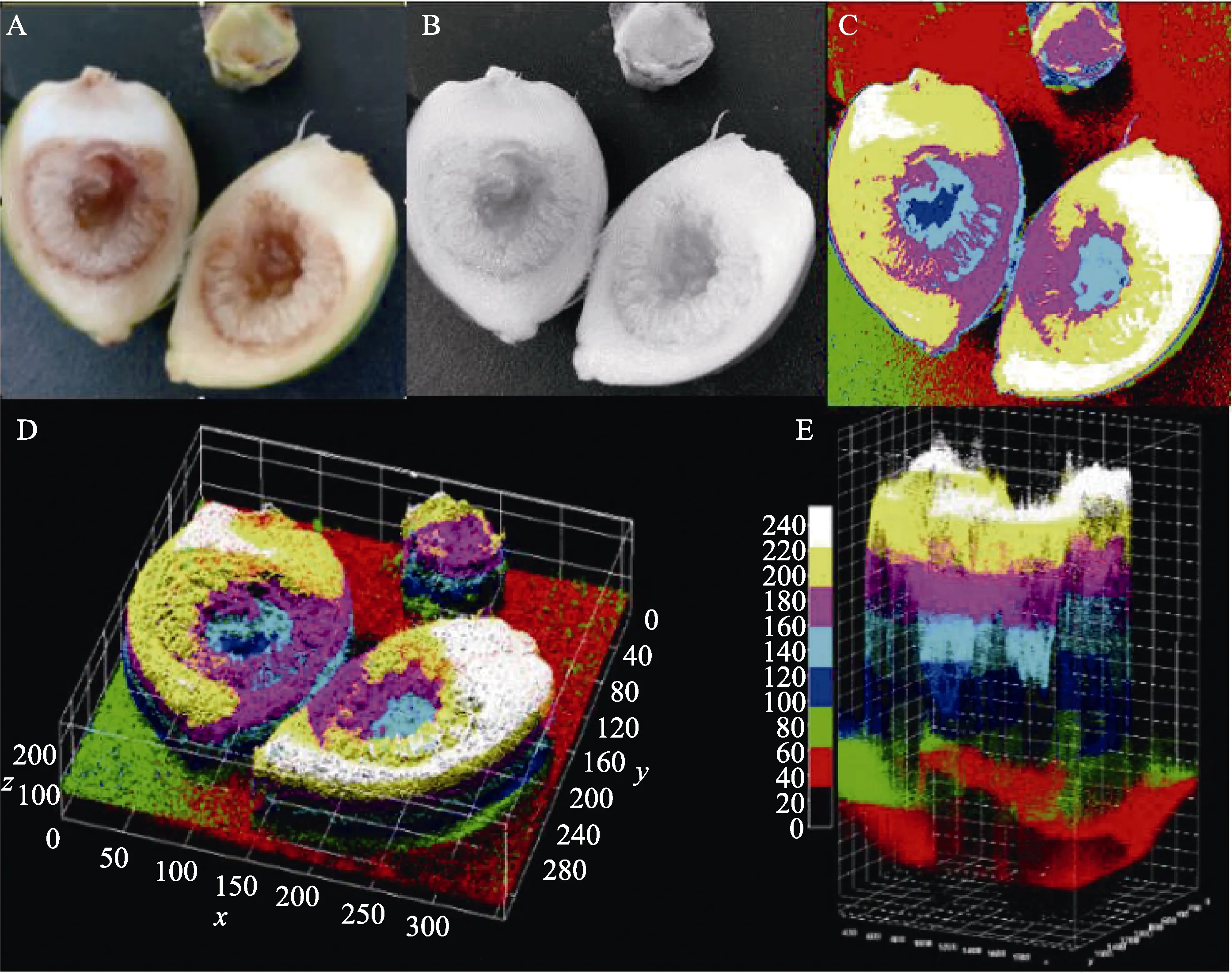
图2 果仁褐变程度处理步骤Fig.2 Steps of nuts browning degree treatment
1.2.4 酶活性的测定 经过1.2.2处理后,测定相关酶活性。
(1)果仁多酚氧化酶(PPO)活性的测定。参照《现代植物生理学实验指南》[14],并作适当修改;测定 410 nm处的吸光值,单个样品测定Δt=1 s,测试12次,取前10次计算多酚氧化酶活性,最终结果以吸光值每10 s内变化0.001为一个酶活性单位,以U来表示。
(2)叶绿素酶(CLH)活性的测定。参照文献[15]并作适当修改;取丙酮层10 μL于384微孔板中,测定665 nm处吸光值,单个样品Δt=1 s,测试12次,取前10次计算叶绿素酶活性,最终结果以吸光值每10 s内变化0.001为一个酶活性单位,以U来表示。
1.2.5 物质成分含量的测定 经过1.2.2处理后,测定物质成分含量。
(1)总糖含量的测定。总糖测定采用蒽酮水解法[16],无水葡萄糖标准曲线为y=0.0222x+0.0065,R²=0.992,可求得总糖含量。
(2)乙基纤维素和木质素含量的测定。乙基纤维素含量的测定参照文献[17],取粉碎均匀的果皮纤维,用蒸馏水反复冲洗至洗液无色后,65℃烘干备用。取0.1 g果皮纤维烘干至恒重,置于2 mL离心管中,加入 1 mL 0.1%(m/V)蒽酮(0.50 g蒽酮+50 g硫脲+500 mL 72%硫酸)溶液,80℃水浴10 min,迅速冷却后暗处静置20 min,4000 r/min离心2 min。取50 μL上清液测定620 nm处吸光度,查标准曲线y=0.0033x+0.036,R²=0.9802,求得乙基纤维素含量。木质素含量的测定参照文献[18]并作适当修改。取0.1 g果皮纤维烘干至恒重,置于2 mL离心管中,加入200 μL 25%(V/V)溴乙酰-冰醋酸,70℃加热30 min后,加入500 μL 2 mol/L NaOH标准溶液、500 μL 1 mol/L盐酸羟胺、500 μL冰乙酸,振荡均匀后10 000 r/min离心10 min,取30倍上清稀释液50 μL于UV板中测定280 nm处吸光值。标准曲线y=0.7254x-0.0032,R²=0.997,求得木质素含量。
(3)总黄酮含量的测定。采用 AlCl3-NaNO2法[19]测定果仁和果皮超滤液中的总黄酮含量,以芦丁当量表示,标准曲线为y=1.6416x+0.0766,R2=0.9924。
(4)总多酚含量的测定。采用福林酚法[20]测定果仁和果皮超滤液中的总黄酮含量,结果以没食子酸当量表示,标准曲线为y=0.0146x+0.0066,R²=0.991。
1.2.6 抗氧化能力的测定 (1)DPPH(1,1-二苯基-2-苦基肼自由基)清除率的测定。参照文献[21]并作适当修改,取0.1 mmol/L DPPH乙醇标准溶液加入384孔板中,每孔精确加入20 μL后置于-20℃冷冻储藏。测定时取出,于13℃静置5 min解冻,测定492 nm处吸光值作为初始值(A0),然后向每孔中加20 μL超滤样液,于25℃暗处反应20 min后再次测定492 nm处吸光值(Asamples)。DPPH清除率计算公式为:
式中,A0为样本在492 nm处的初始吸光值,Asample为样品在492 nm处的吸光值。
(2)Fe3+还原能力的测定。Fe3+还原能力可作为样品抗氧化能力的评价指标,测定方法参照文献[22],Fe3+还原能力计算公式为:
式中,Asample为样本在700 nm处的吸光值,Ablank为蒸馏水(对照)在700 nm处的吸光值,msample为样品质量,单位为mg。
1.3 数据处理
所有试验数据均来自3次平行试验均值,测试结果以平均值±标准偏差表示。采用 Excel 2019、Image J 2.4、SPSS 26.0软件进行数据分析和图像处理。
2 结果与分析
2.1 不同涂膜处理对槟榔鲜果物理指标的影响
2.1.1 失重率 储藏至10 d后,不同涂膜组失重率开始呈现出差异(P<0.05),在前10 d CK组失重率为 0,随储藏天数的增加失重率逐渐上升,第40天时达到最高,显著高于 T1、T2(P<0.05)。表明槟榔鲜果储藏时(>35 d),壳聚糖、壳聚糖-茶多酚-百里香酚涂膜处理对果实失重率上升有抑制作用,T2处理的抑制作用最明显,第40天时失重率仅为3%(图3A)。这可能是由于随着鲜果呼吸代谢,附着在果皮表面的壳聚糖载体对环境中的水分有一定吸收作用,外界水分的引入导致质量增加,从而一定程度上抵消了果实物质交换所损耗的质量,从而体现在失重率的上升被抑制。
2.1.2 腐烂率 槟榔鲜果储藏过程的腐烂主要由外界微生物侵染和自身衰老所致,前25 d内,所有鲜果在试验处理条件下的腐烂率均低于40%,有较好的保鲜意义。T1、T2鲜果在35 d时的腐烂率保持较好,腐烂率均低于30%。而T2处理的抑制腐烂作用优于T1处理,35 d时腐烂率仅为8%,但随后腐烂率迅速升至65%,虽仍具有食用价值但保鲜意义不大,而且随储藏时间的延长表面霉菌会快速生长繁殖,进而污染全部鲜果,最终失去储藏价值(图3B)。

图3 不同处理对槟榔鲜果失重率、腐烂率的影响Fig.3 Effect of weight loss rate and rotting rate in nuts under different treatments
2.1.3 色差 评价果蔬外观色泽时,常用到 CIE坐标体系(*L值、*a值、*b值、ΔE值)[23]。*L反映样品测试区灰度值,*a值反映测试区红绿通道数值,*b值反映测试区黄蓝通道。ΔE值则反映测试区的色泽稳定性,即 ΔE值越大,色泽稳定性越差分布越不均匀。
CK组内*L值在第 5天达到最高值后呈逐渐下降趋势(图4A)。T1组*L值在前25 d时较为稳定,而在第40天时*L值极显著下降(P<0.001)。壳聚糖涂膜、壳聚糖-茶多酚-百里香酚涂膜处理在储藏第1天时,即可显著增加果实表面的亮度(P<0.05),储藏至 25 d后果实亮度极显著高于CK组,表明其对果实亮度的保持最为有效。壳聚糖对槟榔鲜果表皮有一定的护色作用,而壳聚糖-茶多酚-百里香酚复配涂膜剂则较好地抑制了果实表面亮度的下降,利于鲜果保鲜。
*a值越小绿色分布区越大,*a值越大红色区分布越大。T2组的*a值呈先升后降的趋势(图4B),并且结合*L值、*b值的数据来看,这很好地反映出鲜果储藏时色泽由深绿变为浅绿而后趋于嫩绿色的现象。T1处理有效地抑制了果皮*a值上升,第40天时,果皮区域仍呈现较健康的绿色,无黄化现象,但此时果实暗度大于T2组。CK组在 13℃、65%RH环境下储藏,其*a值在一定程度上也受到了抑制,仅果蒂下方出现了一定的区域色泽变浅现象,但果皮整体颜色变化不大,均未出现大面积黄化现象。
*b值越大样品在黄色区域占比越大,*b值越小样品在蓝色区域的占比越大,综合*L、*a、*b值来看,CK组鲜果的*b值在第5天时最高(图4C),第 40天时 CK组的*b值显著高于 T1、T2处理,T1组在前 25 d时,*b值基本稳定在 30.0左右,储藏至第40天时*b值下降(P<0.05),这表明T1涂膜处理对鲜果在黄、蓝通道的影响并不明显,并且结合T1组*L值来看,T1涂膜处理对果实颜色的稳定起到了一定的作用。T2涂膜处理对鲜果表皮*b值的影响波动较大,在储藏至第 25天时,其*b值、*L值均显著高于CK、T1涂膜处理组(P<0.05),这表明此时鲜果趋向于亮绿色转变,而第40天时,其*b值又显著降低,即此时果实黄化现象并不显著,T2涂膜处理对鲜果的表皮色泽起到了一定的改善作用。
ΔE数值大小常用来表示样品的颜色变化程度,CK组ΔE值的变化趋势与其*L、*b值变化较为一致,即在前25 d内颜色变化最为明显而后趋于稳定。而T1组ΔE值在前25 d的变化并不明显,直至第40天时ΔE值才出现了较大变化(图4D),这表明壳聚糖涂膜处理可有效延缓鲜果果皮色泽的变化,利于色泽保持。
H值(色角度)可由 CIE坐标转换而来,H=arc(tanh)=arc[tan(b/a)]。h值域范围[24]为:h<10°紫 区 , 40°<h<75°橙 区 , 75°<h<95°黄 区 ,95°<h<235°绿区,235°<h<295°蓝区。0<H<1 表明其角度分布在第一象限内,H变化越大,则鲜果色泽变化越大。如图4E所示,CK组H值逐渐降低,在储藏至第40天时略低于另两组。并且,T1涂膜处理的鲜果前25 d内H值较稳定,说明涂膜处理有效维持了储藏前期鲜果色泽的稳定。

图4 不同处理对鲜果*L、*a、*b、ΔE、H值的影响Fig.4 Effect of different treatments on *L、*a、*b、ΔE、H values of fresh betel nut
2.1.4 硬度 所有处理的鲜果硬度最大值均出现在第25天(图5),其中,T2组在处理1 d内硬度低于CK、T1组,而第25天后极显著高于另两组(P<0.001)。综合来看,随着果实完全成熟硬度逐渐下降,储藏至第40天时,T1组硬度降至最低,而此时 T2组果实硬度极显著高于 T1组(P<0.001),且T2组硬度先升后降的变化趋势最为明显,这表明 T2组鲜果的代谢正常进行,有利于保持果实硬度在合适范围内,从而延缓果实腐烂软化。

图5 不同处理对鲜果硬度的影响Fig.5 Effect of different treatments on hardness of fresh betel nut
2.1.5 果仁褐变程度 以像素点在X、Z投影面的分布来表示果仁褐变程度(Z=0~240,褐变程度由低到高)。在第5天时,CK组褐变程度明显高于T1组和T2组,其像素点在Z≥100的分布明显多于 T1、T2组,且随着储藏时间的延长,CK组像素点在Z≤40的分布逐渐减少,表明果仁亮度下降(图6)。而 T1组果仁褐变程度明显低于CK组,这表明相同储藏条件下,储藏12 d内壳聚糖涂膜可有效减缓鲜果果仁褐变的发生,且可有效保持果仁亮度。综合来看,T2处理可明显抑制果仁褐变,但第12天时其果仁褐变程度明显高于CK、T1组,这可能是由于在第12天时,酚类物质在储藏初期积累至一定程度后多酚氧化酶活性增加从而导致果仁褐变突然增加。

图6 不同处理对鲜果果仁褐变程度的影响Fig.6 Effect of treatments on browning degree of fresh betel nut
2.2 不同涂膜处理对呼吸强度的影响
CK组呼吸强度在第12天达到呼吸高峰,随后第25天呼吸强度迅速下降,第40天时鲜果自身基本已不具备呼吸功能(图7)。T1组在涂膜处理完成后第1天时呼吸强度高于CK组,第一次呼吸峰出现在第5天,第二次呼吸高峰出现在第25天。T2组呼吸强度同样出现了二次呼吸高峰,且涂膜处理第1天时,T2组呼吸强度显著高于CK组,并且在第 25天时,呼吸强度再次明显高于CK、T1组,最终呼吸强度趋向于0。

图7 不同处理方式对鲜果呼吸强度的影响Fig.7 Effect of different treatment methods on respiration intensity of fresh betel nut
2.3 不同涂膜处理对槟榔鲜果酶活性的影响
第25天后,T2组果仁褐变程度明显低于CK组,结合多酚氧化酶活性来看,此时T2组果仁多酚氧化酶(PPO)活性并未降低反而呈递增趋势(图8A),这表明T2组鲜果此时的酚类物质代谢以苯丙氨酸代谢途径为主,并非倾向于醌类转变。
从色泽指标来看,T1、T2涂膜有效抑制了储藏期内鲜果黄化,因此测定了果皮中叶绿素酶(CLH)活性(图8B)。CK组鲜果在第25天时叶绿素酶活性才达到组内最高,且活性均较低,这表明未经壳聚糖、壳聚糖-酚类涂膜处理的鲜果其果皮生理代谢活性受到了储藏环境的抑制。而T1、T2组酶活性极显著高于 CK 组(P<0.001),这表明涂膜处理一定程度上减轻了低温(13℃)对鲜果生理代谢的抑制,并且结合色差数据来看,储藏后期涂膜组果皮绿色仍保持较好,说明经涂膜处理的鲜果叶绿素代谢一直在进行,但可能存在代谢后期受阻的现象,并未产生大量叶黄素类物质,从而达到较好护色效果。

图8 不同处理对果仁多酚氧化酶和果皮叶绿素酶的影响Fig.8 Effect of different treatments on kernel polyphenol oxidase and pericarp chlorophyllase
2.4 不同涂膜处理对槟榔鲜果物质成分含量的影响
2.4.1 总糖含量 在储藏40 d内,T1组果仁总糖含量在采后40 d内呈先升后降的趋势,第40天时其含量低于CK、T2组。T2组在前25 d内果仁均高于 CK组,随着储藏天数增加果实进行自身代谢,总糖在采后第12天时达到峰值,随后碳基化合物降解,总糖含量逐渐下降(图9A)。
2.4.2 木质素和纤维素 槟榔鲜果的木质素和纤维素集中分布于果皮内,其聚合程度和含量高低影响着果实软硬度和咀嚼性。采后 1 d时,T1组果皮纤维素、木质素含量均极显著高于 CK组(P<0.001),而储藏至第40天时CK组果皮木质素含量显著低于T1、T2组,此时CK组果皮已出现腐烂,但其硬度高于T1组,这主要是CK组果仁硬度快速上升所致,超出了木质素、纤维素含量对硬度的影响阈值(图9B,图9C)。

图9 不同处理对鲜果总糖、乙基纤维素、木质素的影响Fig.9 Effect of different treatments on total sugar, ethyl cellulose and lignin content of fresh betel nut
一般来说,未进行任何处理的槟榔鲜果木质素含量随储藏天数增加而增加,但本研究中 CK组木质素含量的变化未能很好地体现该现象,其原因可能是统一带有透气孔的 PE自发气调包装对鲜果木质化进程造成了影响。总的来说,不同涂膜处理对果皮木质素含量存在一定影响,储藏40 d时,CK、T1组果皮木质素含量均降至较低水平,对比之下,T2组果皮木质素含量波动较小,第40天木质素含量与第1天差异不大,表明T2处理可有效维持果皮木质素含量的稳定,有利于其形态结构的保持,在储藏后期,T2涂膜可能促进了果皮的莽草酸代谢,从而使其纤维素、木质素在第40天时均极显著高于另两组(P<0.001)。T1涂膜对第1天果皮木质素、纤维素的影响相同,即 T1处理可在储藏初期相对增加该类聚合物含量,以此提高果实抗病菌能力。
2.4.3 黄酮 CK组果仁黄酮含量在第 1天时极显著高于T1、T2组(P<0.001)。在储藏至第5天时,CK组、T1组果仁黄酮极显著下降(P<0.001),此时 T2涂膜处理有效延缓了果仁黄酮含量的下降。但25 d后,黄酮含量均下降到较低水平(图10A)。涂膜处理对果皮黄酮含量并无显著增加作用,相反地,T1、T2组果皮黄酮含量反而低于CK组(图10B),这可能是由于涂膜处理对鲜果有一定的保护作用,黄酮作为果蔬次生代谢产物,在逆境胁迫条件下其含量相对增高,CK组果皮黄酮含量在第40天时显著升高,也恰好说明了这一点,但此时其果皮纤维结构已发生松散,黄酮含量的增加也有可能是由于黄酮溶出率上升而导致的。
2.4.4 多酚 第1天时,对比CK组T1涂膜处理显著提高了果仁多酚含量(P<0.001),此时T2组果仁多酚含量最高,约是CK组的3倍(图10C)。表明 T1处理在储藏初期增加果仁多酚含量,而T2组果仁多酚含量显著提高可能是由于涂膜剂中茶多酚的添加所导致,酚类物质在果皮表面积累随着鲜果自身生理代谢进入到果实内部。储藏初期多酚含量高有利于提高果实抗菌能力、抑制微生物繁殖,达到保鲜效果。T1处理可极显著增加果皮多酚含量(P<0.001),这对槟榔鲜果保鲜具有积极意义,而T2组果皮多酚含量在40 d内均低于 CK组(图10D),这可能是由于 T2涂膜对果皮有保护作用,导致其不具有较为明显的抗逆现象,这也间接反映了T2涂膜剂中的酚类物质可通过果皮组织渗透进入果内部,而表面的交联残留对果皮中酚类物质的积累并无显著促进作用。
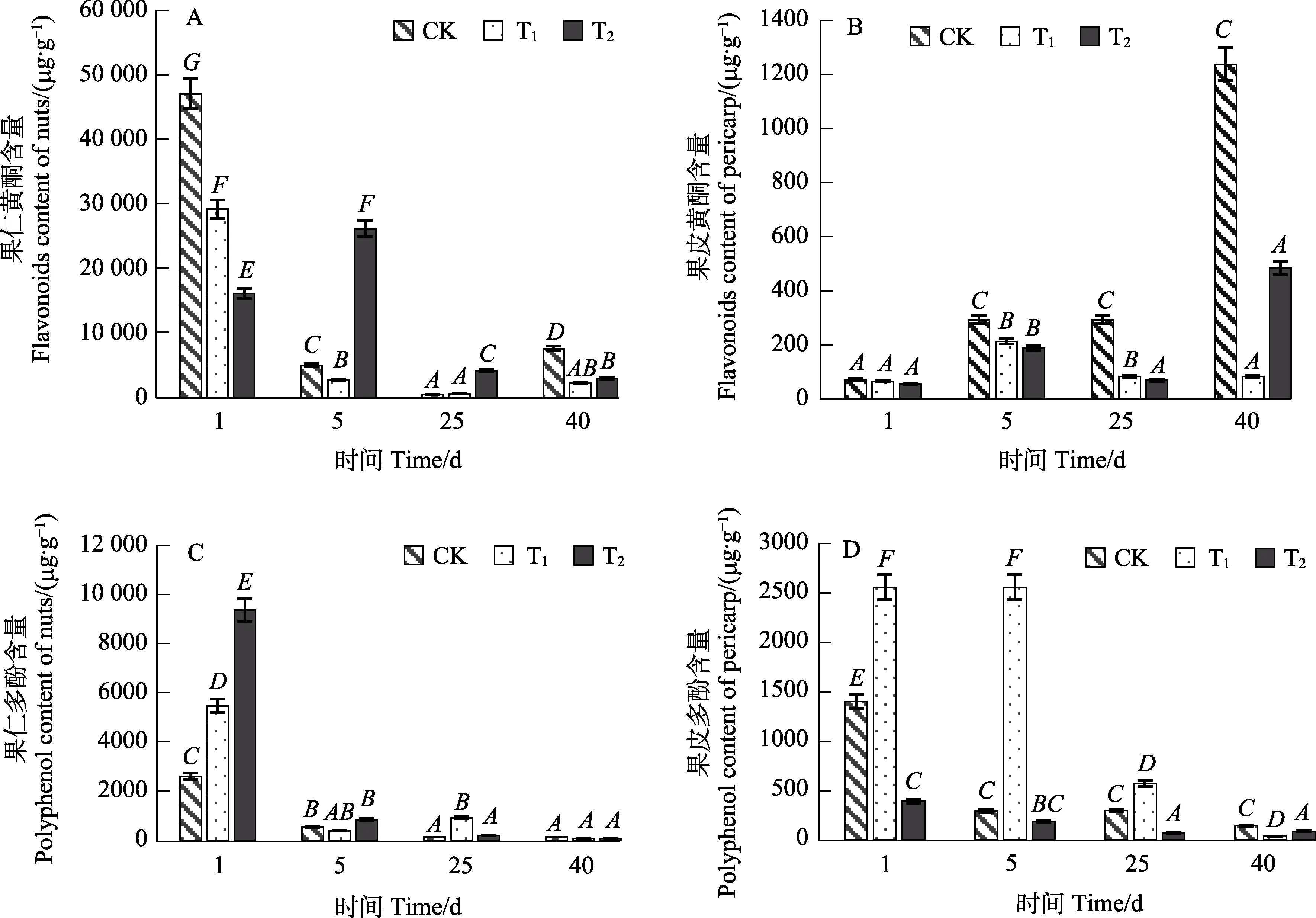
图10 不同处理对鲜果黄酮、多酚含量的影响Fig.10 Effect of different treatments on flavonoid and polyphenol content of fresh betel nut
2.5 不同涂膜处理对抗氧化能力的影响
T1组内果仁和果皮的DPPH自由基清除能力在第5天时显著高于另两组(图11A,图11B),表明T1涂膜可有效提高贮藏初期DPPH清除能力。T2涂膜处理反而抑制了果仁的 DPPH清除能力,但就果皮来看,第5天时T2涂膜可有效提高果皮的DPPH清除力,极显著高于CK、T1组(P<0.001)。
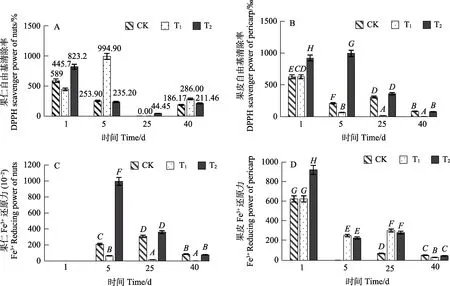
图11 不同处理方式对鲜果自由基清除率、Fe3+还原力的影响Fig.11 Effect of different treatments on DPPH scavenger power and Fe3+ reducing power of fresh betel nut
在储藏至第5天时,T2涂膜处理显著增加了果仁的Fe3+还原能力,而T1涂膜处理反而抑制了果仁Fe3+还原能力。在储藏第1天时,T2组内果皮Fe3+还原能力显著高于CK组、T1组,且在第25天,T1和 T2组果皮的 Fe3+还原能力均显著高于 CK组,第 40天时,所有处理组的果皮 Fe3+还原能力均处于较低水平,此时果皮已基本不具备抗氧化能力(图11C,图11D)。
3 讨论
传统的冷藏保鲜技术是通过降低鲜果代谢能力来达到延长保鲜期的目的,但并不适用于槟榔鲜果保鲜。槟榔鲜果作为热带果蔬,储藏温度普遍高于10℃[25],否则会发生较严重的冷害现象,因此,为达到预期保鲜目的,需联合其他技术共同处理。涂膜保鲜是近年来应用广泛、效果明显的果蔬保鲜方式之一,常见的槟榔鲜果涂膜保鲜剂有茉莉酸甲酯、脱氢乙酸钠、氯化钙、6-苄氨基腺嘌呤、甲基硫菌灵、赤霉素、1-甲基环丙烯、次氯酸钠、硫化氢、果蜡等等[3-7]。涂膜材料在果蔬内外发挥功效的同时,其致密透气、弹性缓冲的网膜结构还可避免外界胁迫所引起的鲜果机械损伤,例如在辐照保鲜槟榔鲜果时,在辐照前对鲜果进行100 mg/L赤霉素、100 mg/L 6-BA、50%果蜡涂膜处理[3,8],可有效提高鲜果辐照耐受剂量,更好地抑制微生物滋生、降低物质成分损耗。
本研究对比了无菌蒸馏水(CK)、壳聚糖(T1)、壳聚糖-茶多酚-百里香酚(T2)3组涂膜剂对鲜果的涂膜保鲜效果,提供了一种经济可行、简便高效的槟榔鲜果涂膜保鲜方法:T2处理可使常温储藏货架期仅为 5 d的槟榔鲜果货架期延长至35~40 d。其中,涂膜处理对鲜果的呼吸代谢具有重要的调控作用,槟榔鲜果在0~20℃储藏时,一般在第6天或第13天达到呼吸高峰[26-27],本研究中 CK组在第 12天达到呼吸高峰符合常见规律,随后呼吸代谢衰弱,第25天后呼吸代谢基本不再发生,而T1组呼吸强度在储藏第25天才达到峰值,随后逐渐下降,表明壳聚糖涂膜可有效延缓鲜果呼吸高峰的出现,并在一定程度上调节了果实自身代谢进程。T2组更好地反映了这一点,涂膜 1 d鲜果呼吸强度显著高于其他处理,随后逐渐降低,同样在第 25天时出现第二次呼吸高峰,表明T2涂膜处理对鲜果的呼吸代谢产生了较为积极的影响,使其自身生理代谢能力增强、呼吸峰值延迟,这均有利于鲜果品质的保持。研究中发现,在槟榔冷鲜保藏过程中,呼吸强度并非越低越好,通过干预使得鲜果对环境的适应力提高,利用鲜果自身代谢机制调控每一阶段物质转化的速率和转化量,例如先应激胁迫鲜果产生足量的次生代谢产物从而具备抵御外界病菌入侵的能力后,再转向成熟衰老,反而具有更好的保鲜效果。
综上,T1处理对抑制鲜果黄化有较为明显的效果。而T2处理综合保鲜效果最佳,增强了储藏初期鲜果抗氧化能力,显著抑制了失重率和腐烂率的上升,储藏至 35 d时腐烂率仅为8%,并可显著抑制果仁褐变,并且储藏25 d后,鲜果的硬度、纤维素和木质素含量、多酚氧化酶和叶绿素酶活性均表明 T2涂膜处理可稳定维持鲜果的生理代谢能力,使得25 d后鲜果仍具有较好的生理活性、呼吸高峰延后,保鲜效果显著优于单独冷藏的对照组。因此,壳聚糖联合酚类涂膜处理可作为一种多功能、高效、价廉的槟榔鲜果保鲜方式,而本研究中鲜果对涂膜剂的吸收渗透代谢机制仍有待探索。
