外科规范化营养管理及其实施
2023-02-23韩婷
韩婷
(同济大学附属第十人民医院临床营养科 上海 200072)
欧洲肠外肠内营养学会(European Society for Parenteral and Enteral Nutrition, ESPEN)将营养不良定义为“由于缺乏能量、蛋白质和其他营养素而导致的身体成分改变和机体细胞质量降低,引起身心功能紊乱,并损害疾病临床结局的状态”。对于外科患者来说,手术治疗会使机体产生创伤应激,引起机体代谢变化,若再合并营养不良,更易造成机体功能下降,对疾病本身和康复产生不良影响[1]。大量证据表明,营养不良是导致外科患者治疗效果不佳和不良临床结局(感染、死亡等)发生的主要因素之一。据统计,外科患者的营养不良发生率为20% ~ 60%[2],腹部手术患者的营养不良发生率为38.8%[3]。造成此种情况出现的主要原因包括术后摄食不足、手术创伤应激、胃肠功能不全和各种治疗的不良反应等,这些都会引起机体分解代谢增加,加之患者自身消耗供不应需,最终发生营养不良。患者营养不良可导致创口愈合减缓和低蛋白血症,降低术后免疫系统抵抗应激反应的能力,增加术后并发症(包括感染、吻合口漏等)发生率、病死率和医疗费用,延长住院时间。因此,营养不良的外科患者的手术风险和不良临床结局发生率都远远大于营养良好的患者,而合理、科学的外科营养管理则有助于及时改善患者的营养状态,减少不良临床结局的发生。本文就外科规范化营养管理及其实施作一概要介绍。
1 外科规范化营养管理
尽管数十年来临床营养技术已有很大进步,但住院患者的营养不良发生率却未明显下降[4-5],主要原因[6]为:①营养治疗不合理,应用不足和过度应用甚至滥用并存。一项对中国住院患者的调查研究结果发现,对恶性肿瘤和消化系统疾病(如急性胰腺炎、溃疡性结肠炎)患者的营养治疗率达50%,而对有营养不良风险的其余疾病患者的营养治疗率却不超过30%,且营养治疗大多采用肠外营养方式[7]。另一项对中国住院患者的调查也发现,对无营养不良风险患者给予肠外营养的现象较普遍,且采用单瓶串输的比率很高[8]。②临床医生对规范化营养管理的认识不足乃至缺乏。目前国内缺乏对临床医护人员进行规范化营养诊疗流程的专业培训,有研究显示仅51.6%的医生对营养治疗有一定认识,部分医生对营养管理的认识还停留在传统营养学阶段[9]。
外科规范化营养管理的核心是以临床营养诊疗路径为基础,通过贯穿于术前、术中、术后和出院后康复过程来实现营养治疗效果的最大化,使患者受益,具体包括营养筛查和评估、患者综合评价、营养治疗方案制订、营养制剂制备、营养治疗通道建立、营养制剂输注管理、营养治疗效果评价、并发症监测和管理、营养治疗护理等一系列内容。国内外相关指南均认为,标准且规范的临床营养诊疗路径为营养筛查—评估—诊断—治疗,这既是及时并精准判断患者营养状态的必要手段,也是正确并合理开展营养治疗、加速患者康复的基础保障。
2 外科规范化营养管理的实施
2.1 营养筛查
营养筛查的目的在于通过使用营养筛查工具来判断患者的营养风险,它是规范化营养诊疗过程的第一步,包括营养风险筛查和营养不良风险筛查,其中营养风险筛查主要关注可引起不良临床结局的营养因素,而营养不良风险筛查是指对能导致营养不良的风险的筛查。ESPEN将营养风险定义为现有的或潜在的、与营养因素相关的、会导致患者出现不良临床结局的风险,推荐使用营养风险筛查表(2002年)(nutritional risk screening 2002, NRS 2002)进行营养风险筛查(表1)[10]。

表1 NRS 2002[11]
NRS 2002是目前临床上广泛采用的一种营养风险筛查工具[11],具有简便易行的特点。国内外相关指南[12-14]都指出,营养风险筛查应当在患者入院后的24 h内进行,由受过专门培训的医生、营养师或护士操作。
2.2 营养评估
营养评估是一种通过询问病史、用药史、既往营养状态,以及人体测量学数据、实验室检查值等,进行多组合、多维度、多层面结合的营养问题诊断方法。根据营养状态对患者进行分类:营养良好或营养不良。对于营养不良患者,须评估营养不良的程度,从而给予相应的营养治疗。对外科患者开展营养评估的目的是发现其是否营养不良及营养不良的程度,通常从人体测量学、实验室指标和综合评价法3个方面来进行评估。
人体测量学数据主要包括体质量变化幅度、三头肌皮褶厚度、小腿围、上臂围等。若条件允许,还可于术前对患者进行人体成分分析,观察骨骼肌、蛋白质、细胞内外液水平等,借此来辅助判断患者的营养状态。目前,相位角也被认为是营养不良判断的有意义的参考值之一[15]。实验室指标值,如肝肾功能、酸碱平衡指标、免疫功能检测数据和血液蛋白相关检测值(血清白蛋白、前白蛋白、转铁蛋白水平等)等不但是营养评估所需指标值,而且也是营养治疗方案制订、实施和监测所必需的指标值。综合评价法在临床上应用广泛,国内常用的工具有主观全面评价、患者参与的主观全面评价和微型营养评价等方法。
关于营养不良,目前全球尚无统一的诊断标准,国内诊断大多采用营养不良三级诊断[16](图1)和全球领导人营养不良倡议(Global Leadership Initiative on Malnutrition, GLIM)标准[17-18](表2)这两种方法。

图1 营养不良三级诊断

表2 中、重度营养不良诊断的GLIM标准[17]
2.3 营养干预
2.3.1 术前营养支持
存在营养风险(NRS 2002总评分≥3分)的术前患者具有营养治疗指征,对他们应经营养评估后制订营养治疗方案,方案遵循营养不良五阶梯治疗模式[19](图2),以改善术前营养状态。对于术前存在高营养风险(NRS 2002总评分≥5分)的患者,营养治疗首选口服营养补充;若不能满足目标需要量,可再依次选用肠内营养(管饲)、补充性肠外营养和全肠外营养。《ESPEN实践指南:外科临床营养》[13]中推荐,对于所有营养不良的肿瘤患者或存在高营养不良风险的患者,腹部大手术前给予口服营养补充。
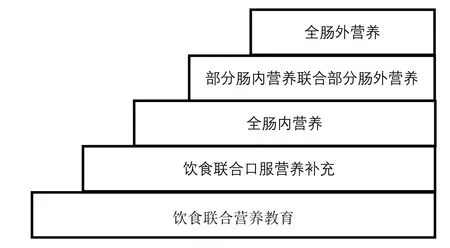
图2 营养不良五阶梯治疗模式
值得关注的是,《加速康复外科围术期营养支持中国专家共识(2019版)》[14]中指出,对于外科患者,术前也应注重蛋白质补充,以促进术后康复。建议保证肿瘤患者术前有>75 g/d的蛋白质摄入,其余患者术前有>54 g/d的蛋白质摄入,从而达到蛋白质目标需要量。
目前,国家要求规范开展加速康复外科(enhanced recovery after surgery, ERAS)工作,将ERAS的理念融入有关疾病的诊疗过程[20],而营养是ERAS实施中极为重要的一环。传统理念认为,患者术前8 ~ 12 h需要禁食、禁饮,但这会使机体处于代谢应激状态,诱导胰岛素抵抗,引发不利于患者术后康复的结果。现国内外ERAS相关指南/共识[13-14,21]均推荐,患者术前10和2 h应分别口服12.5%的碳水化合物饮品800和400 mL,并认为患者在麻醉诱导前2 h口服≤500 mL清流质是安全的。
2.3.2 术后营养支持
2.3.2.1 术后营养支持的时机
研究表明,患者术后早期经口进食可降低感染和并发症(如吻合口瘘)的发生率,减少住院天数和医疗成本[22-23]。另一项研究也显示,与延迟开始肠内营养的术后患者相比,术后早期经口进食患者的新发肺炎发生率和住院病死率较低,住院时间缩短[24]。
《ESPEN实践指南:外科临床营养》[13]中指出,对于判断为术后早期无法经口进食或经口进食量无法满足营养需要(<50%)且超过7 d的患者,应于术后24 h内给予肠内营养,特别是对于接受头颈部大手术或胃肠道肿瘤切除术的患者、脑损伤等严重创伤患者、围手术期表现为明显营养不良的患者。
2.3.2.2 术后营养支持的途径
术后营养支持的途径首选肠内营养,后者能满足多数患者的需要。在患者口服进食无法达到营养的目标需要量时,可依次考虑给予管饲肠内营养和肠外营养,不推荐术后早期应用肠外营养。对于需要肠内营养的接受上消化道或胰腺大手术的营养不良患者,应放置鼻肠管或空肠穿刺管。通常认为外科手术患者均会由于应激而引发肠黏膜缺血-再灌注损伤,只是程度轻重不同而已,严重者可出现全身急性反应,甚至脓毒症、多器官功能障碍等。而肠内营养有滋养肠道、维持肠黏膜结构与功能完整、降低肠源性高代谢反应等诸多益处[25],故术后早期给予患者肠内营养的一个主要原因就是其有肠黏膜滋养作用。
不过,刚接受复杂大手术的患者,他们术后早期常处于高度应激状态,并伴随血流动力学不稳定、电解质紊乱等。腹部外科手术或危重症患者术后也常伴随严重胃肠道功能障碍。这些都会增加患者术后早期肠内营养实施的困难[26]。研究表明,长时间的能量缺乏和负氮平衡往往与患者术后并发症和高死亡率相关,而及时应用补充性肠外营养可改善患者的临床结局[27]。因此,若患者术后因胃肠功能受限而致通过口服营养补充或管饲肠内营养不能满足营养目标需要量的60%且超过7 d时,应给予部分肠外营养,同时采用逐渐减少肠外营养、增加肠内营养供给的方式,顺利过渡到全肠内营养治疗,直至正常经口进食。《胃肠外科病人围手术期全程营养管理中国专家共识(2021版)》[28]中推荐,术后营养支持首选口服营养补充;对于无法经口进食或经口进食的营养量不足目标需要量50%的患者,应术后早期(24 h内)开始给予肠内营养;若肠内营养供给的能量和蛋白质不足目标需要量的50%,应联合应用肠外营养;对于无法给予或不能耐受肠内营养的患者(如肠梗阻患者),应及早开始给予肠外营养。
2.3.2.3 术后营养支持的策略
1)肠内营养制剂和特殊医学用途配方食品(food for special medical purpose, FSMP)
肠内营养制剂的常见配方类型包括要素型配方(氨基酸或短肽营养制剂)、非要素型配方(标准整蛋白配方制剂)、疾病(糖尿病、肿瘤、肾功能不全等)特异型配方和组件型配方。FSMP是为了满足进食受限、消化吸收障碍、代谢紊乱或处于特定疾病状态的人群对营养素或膳食的特殊需要,专门加工配制的配方食品。我国《特殊医学用途配方食品通则》(GB 29922—2013)按照适用人群及其疾病状态,将FSMP分为全营养配方、特定全营养配方和非全营养配方食品三类[29]。
对于胃肠功能正常的患者,宜选用非要素型肠内营养制剂、全营养配方食品或特定全营养配方食品;对于伴有消化吸收功能障碍的患者,可选用要素型肠内营养制剂(如氨基酸或短肽营养制剂)或非全营养配方食品。《ESPEN实践指南:外科临床营养》[13]中指出,非要素型肠内营养制剂适用于大部分患者。考虑到堵管和感染风险等,一般不推荐采用患者家庭自制的食物来开展肠内营养。
2)能量
患者术后接受营养支持的能量目标值为25 ~ 30 kcal/(kg·d)。要求达到这一目标值的时间则随患者不同而不同,通常需要经过5 ~ 7 d。鉴于患者术后可能出现早期胰岛素抵抗和营养代谢紊乱,故术后早期允许给予患者低热量营养支持,不强调尽快达到目标值,可先给予患者目标导向性的肠内营养支持,稳定内环境,而后再逐步接近目标值。一项研究表明,在有营养风险的择期腹部手术术后患者中,即刻给予目标值肠内营养患者的感染发生率高于逐步达到目标值肠内营养患者,且胃肠道不耐受事件发生率更高[30]。
3)蛋白质
患者术后接受营养支持的蛋白质目标值为1.5 ~ 2.0 g/(kg·d)。对于术后恢复期患者,应给予充足的蛋白质。有研究指出,患者术后摄入充足的蛋白质非常重要,且重要性高于摄入充足的热量。患者术后补充蛋白质有利于缓解肌肉流失,加快创口愈合,提高机体免疫力,进而促进康复。对于老年外科患者,无论是否给予充足的热量,只要给予蛋白质就能帮助维持机体的瘦组织群,降低因能量供给不足而引起虚弱的风险[31]。因此,除非存在绝对禁忌证(如严重胃肠功能损伤、肠梗阻等),否则都应保证术后患者能够摄入充足的蛋白质。
4)免疫营养素
目前,关于免疫营养素是否应常规应用于外科患者仍存争议。有研究显示,外科患者接受免疫营养治疗有利于提高机体免疫力,控制急性炎性反应,保护肠黏膜屏障功能,降低并发症发生率[32]。《ESPEN指南:肿瘤患者营养》[33]中推荐,对于围手术期肿瘤患者,给予免疫营养素,如谷氨酰胺、精氨酸、核苷酸、ω-3多不饱和脂肪酸等。该指南认为,在营养制剂中加用免疫营养素有益,但是否可单独补充精氨酸,临床证据尚不充分,暂无法给出明确意见。《加速康复外科围术期营养支持中国专家共识(2019版)》[14]也给出了类似意见。
3 结语
对于外科手术特别是腹部大手术患者,规范化营养管理是改善外科治疗效果和患者临床结局的关键环节,应贯穿于整个手术期间,包括术前、术中和术后。外科营养支持可帮助患者增加营养底物,纠正术后高应激、高代谢反应和负氮平衡,改善营养状态。营养支持对患者的胃肠道黏膜屏障和其他机体功能也有较好的保护作用。但是,目前临床上对于外科营养管理的规范化实施培训还待加强。各医院应尽早建立营养支持小组,并将营养治疗纳入围手术期临床路径,通过多学科协作方式,为患者制订个体化的营养支持方案,给予及时、安全、合理、有效的营养治疗,使之获得更好的临床结局。
