慢性疾病风险评分与肿瘤发生风险的队列研究
2023-02-23高鹰靳育静魏玮徐晓倩李书杨洪喜张卿
高鹰,靳育静,魏玮,徐晓倩,李书,杨洪喜,张卿*
慢性非传染性疾病包括肿瘤、心血管疾病、慢性呼吸系统疾病、糖尿病及慢性肾脏病,且占全球死亡率的71%[1],其中肿瘤位列死亡首因[2]。研究显示,2020年全球肿瘤疾病负担上升至1 930万新发病例,1 000万死亡病例和5 060万的5年患病病例[2],预计到2040年将有2 840万新发肿瘤病例,较2020年增加47%[2]。
根据全球疾病负担研究显示,在中高社会人口指数国家或地区中,排名前6位可归因伤残调整寿命年(DALY)的主要危险因素为烟草、高收缩压(systolic blood pressure,SBP)、高体质指数(body mass index,BMI)、高空腹血糖(fasting plasma glucose,FPG)、高低密度脂蛋白胆固醇及肾功能不全[3]。肿瘤与其他慢性疾病一样均呈多维状态,多种慢性疾病与肿瘤有共同危险因素[4-5],尤其是代谢异常指标,可直接或间接促进肿瘤的发生发展[6]。有研究表明,2型糖尿病或高血糖会增加肿瘤的发生风险[7-8]。也有研究表明,肿瘤风险与血压、心率、血脂、慢性肾脏病及尿酸等心血管疾病指标有关[4]。
单个慢性疾病指标与肿瘤发生风险之间的关联较弱,而慢性疾病常呈现诸多异常指标的聚集性。因此,本研究通过多个慢性疾病指标构建慢性疾病风险综合评分,探讨慢性疾病风险评分与肿瘤发生风险之间的关联。
1 对象与方法
1.1 研究对象 本研究以“天津市慢病风险与健康管理队列”为基础,研究对象为2015年1月至2019年12月在天津医科大学总医院健康管理中心接受每年或两年一次的综合体检者18 009名,常规收集其体检数据。大部分体检者为当地企事业单位组织的团检者,一部分为自费体检者。基线队列人群纳入标准:(1)年龄>18岁;(2)基线未诊断肿瘤;(3)基线所有慢性疾病指标数据完整。排除标准:(1)研究期间只参与1次健康体检;(2)随访1年内确诊肿瘤;(3)肿瘤复发或转移。
结局事件为原发肿瘤的发生。随访内容同基线健康体检,并通过问卷收集其过去1年肿瘤发病情况及诊断时间。随访结束于肿瘤事件发生日期或队列随访结束日期(2019-12-31),以最先发生的日期为准。本研究已通过天津医科大学总医院伦理委员会审批(批号:IRB2021-WZ-095),研究对象均已签署知情同意书。
1.2 数据收集 (1)问卷调查(基线):所有体检者完成健康风险评估问卷,收集其人口学信息(年龄、性别、婚姻状况、教育水平、经济收入)、生活方式(吸烟状况、饮酒状况、体育锻炼)、既往疾病史及近1年诊断疾病等信息。吸烟指连续或累积吸烟≥6个月。饮酒指每周饮酒至少1次并持续半年以上。(2)体格检查:包括身高、体质量、腰围、血压测量及心电图,由专业人员完成。体检者脱鞋、着薄衣站立在Inbody身高体质量仪(Inbody Co. Ltd,韩国)测量身高、体质量,并计算BMI。采用非弹性卷尺连续测量体检者腰围2次,取平均值。体检者静坐5 min后,采用TM-2655P型全自动血压计测量左臂SBP和舒张压(diastolic blood pressure,DBP),测量2次,取平均值。采用12导联心电图自动分析系统(MAC800)测量体检者心率。(3)实验室检查指标检测:采集所有体检者清晨空腹静脉血以检测FPG、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、血尿酸(serum uric acid,SUA)、总胆红素(total bilirubin,TBil)、血肌酐(serum creatinine,Sr),所有标本于采血后1 h内送至检验中心检验(日立7170全自动生化分析仪,日本)。采用改良的MDRD公式计算评估肾小球滤过率(estimated glomerular filtration rate,eGFR)=186×Sr-1.154× 年龄-0.203×0.742(女性)[9],各变量分类及赋值见表1[10-15]。

表1 慢性疾病指标变量类型及赋值Table 1 Types and assignment of chronic disease indicators
1.3 慢性疾病风险评分计算 采用SULLIVAN等[16]报道的疾病风险评分方法,计算慢性疾病风险评分。步骤如下:(1)分别以基线收集的各慢性疾病相关指标分类变量为自变量,以肿瘤是否发病为因变量,采用多因素调整〔包括年龄(以实测值纳入)、性别、吸烟状况、饮酒状况〕的Cox回归模型评估各慢性疾病指标与肿瘤发生风险;(2)通过将各自的回归系数除以常数计算每种慢性疾病指标中每个类别或水平的风险值,该常数表示最终风险评分系统中1个积分点的回归单元值,在Framingham研究众多评分系统中已证实基于年龄基础上计算该常数的重要性[16]。因此本研究中常数采用年龄每增长1岁的回归常数值,即Cox回归模型中年龄(连续变量)的系数(0.040 2)×中位随访时间(4.0年)=0.160 8表示;(3)将风险值四舍五入取整;(4)将每种慢性疾病指标的个体风险值相加,计算综合慢性疾病风险评分,慢性疾病指标、赋值及分类依据见表2。
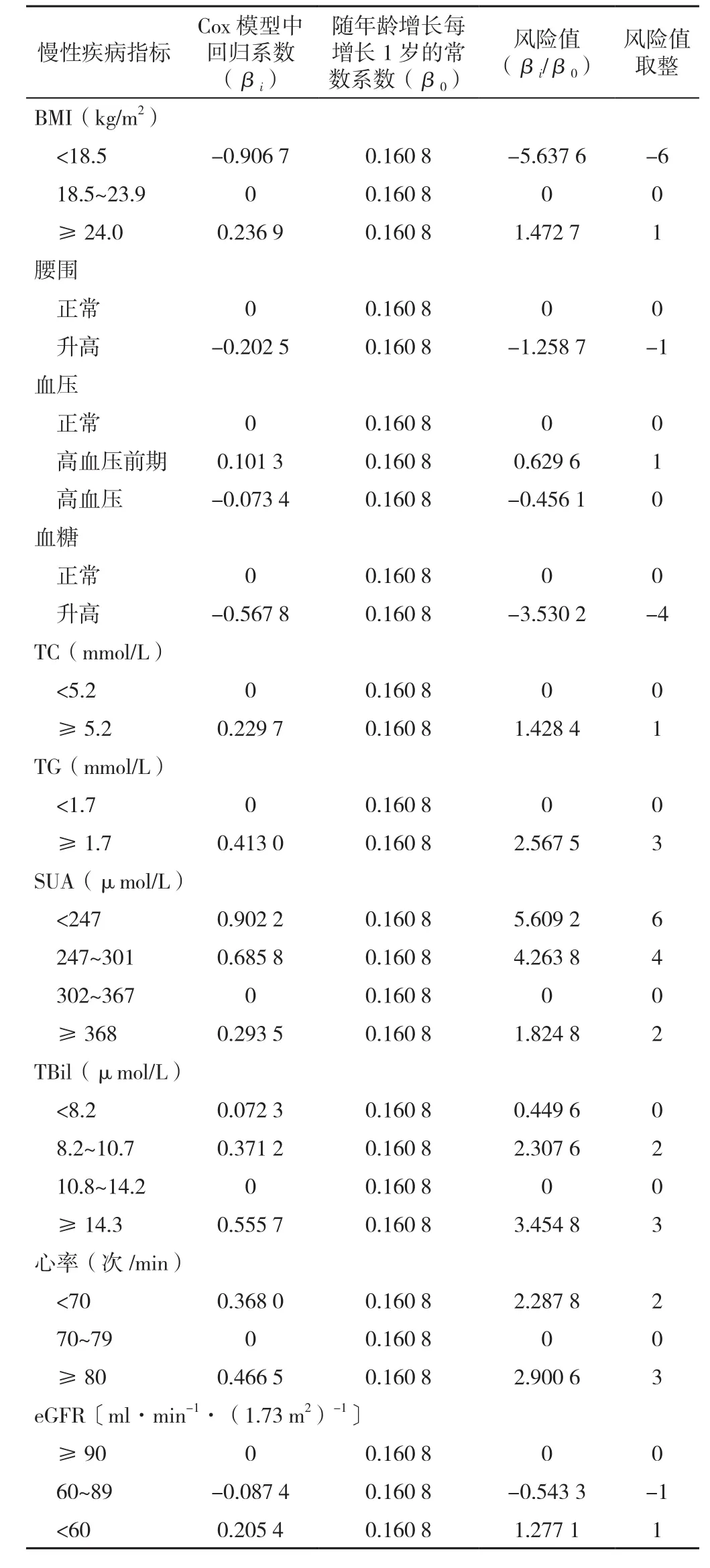
表2 慢性疾病风险评分的计算Table 2 The calculation of chronic disease risk score
1.4 慢性疾病风险评分分组 根据上述步骤计算的慢性疾病风险评分,依据其三分位数分为慢性疾病风险评分低分组(<6分)、慢性疾病风险评分中分组(6~8分)和慢性疾病风险评分高分组(≥9分)。
1.5 肿瘤确定 体检者完成检前健康风险评估问卷,收集其近1年诊断的疾病信息。如果体检者在随访期报告了任何肿瘤的确诊,则需提供诊断时的病理报告和知情同意。
1.6 统计学方法 使用Stata 13.0软件进行数据处理与统计学分析。年龄不符合正态分布,以M(P25,P75)表示,采用Mann-Whitney U秩和检验比较年龄在性别间的分布差异。吸烟状况、饮酒状况和所有慢性疾病指标分组变量以频数和百分比表示,采用χ2检验比较上述指标在性别间的分布差异。分别以慢性疾病风险评分分组变量及连续变量为自变量,以肿瘤发病为结局变量的Cox回归模型,计算慢性疾病风险评分与肿瘤发生风险关系,以HR及其95%CI表示,并进行比例风险假定检验。趋势性检验采用不同慢性疾病风险评分组中的得分中位值进行评估。以P<0.05为差异有统计学意义。
2 结果
2.1 受试者基本情况 共纳入符合研究标准的研究对象18 009例。共随访3.02~5.05年,中位随访4.00年;随访71 835人年;确诊肿瘤患者91例(男33例、女58例),其中甲状腺癌38例(41.8%)、乳腺癌17例(18.6%)、肺癌9例(9.9%)、结直肠癌5例(5.5%)、肾癌3例(3.3%)、前列腺癌3例(3.3%)、妇科肿瘤5例(5.5%)、肝癌2例(2.2%)、胃癌2例(2.2%)及其他类型肿瘤7例(7.7%);肿瘤患者平均诊断年龄(50.3±13.4)岁;从基线到肿瘤诊断平均时间(2.4±0.9)年。18 009例研究对象基线年龄18.4~89.1岁,中位年龄38.5岁;男8 987例(49.9%),年龄18.4~89.1岁;女性9 022例(50.1%),年龄19.4~88.3岁,见表3。

表3 18 009例研究对象基线资料情况〔n(%)〕Table 3 Baseline information of 18 009 subjects
2.2 不同性别研究对象基线特征比较 男性年龄大于女性,差异有统计学意义(P<0.05);不同性别体检者吸烟状况、饮酒状况、BMI、腰围、血压情况、血糖情况、TC、TG、SUA、TBil、心率、eGFR比较,差异有统计学意义(P<0.05),见表4。
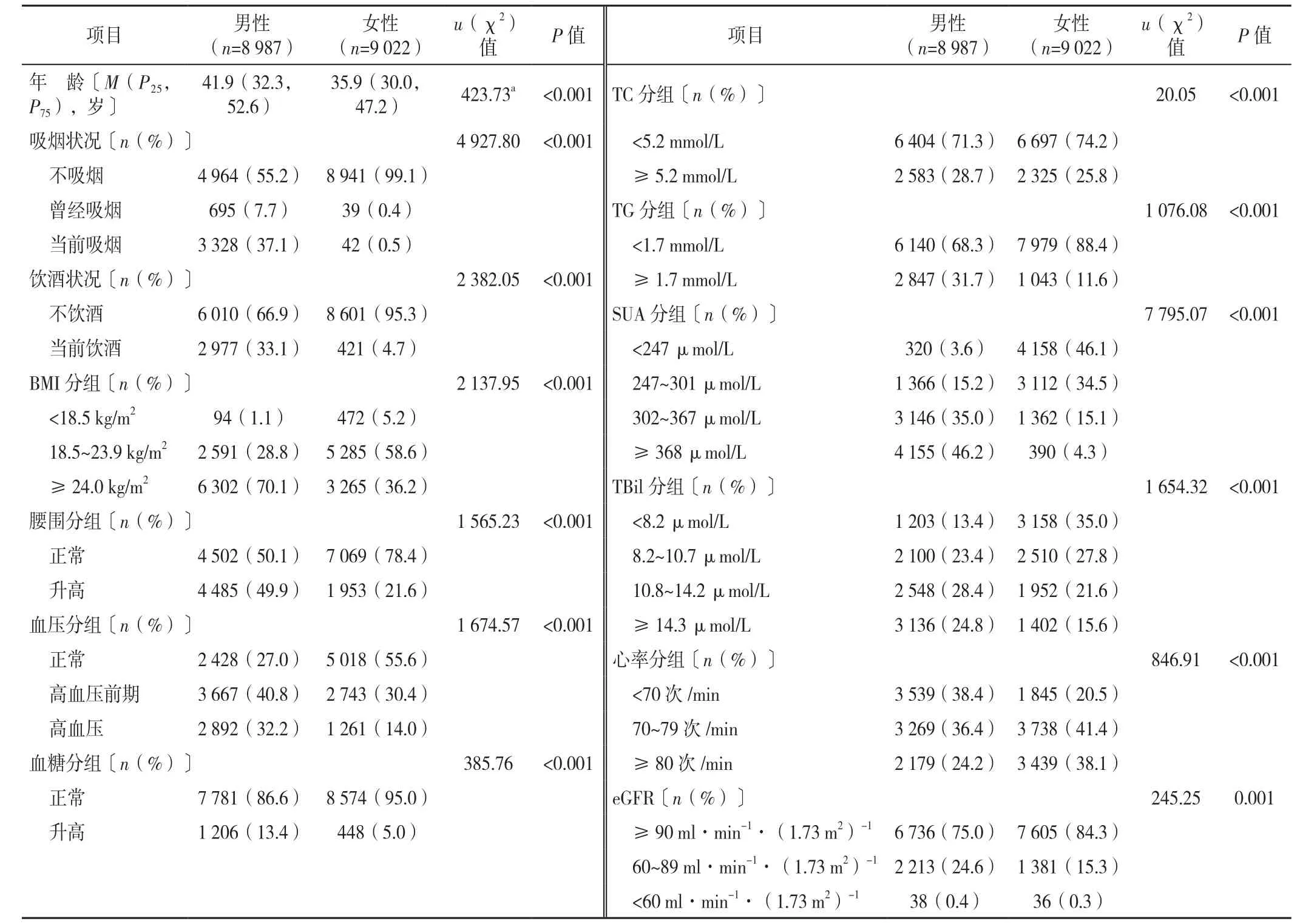
表4 不同性别研究对象基线资料比较Table 4 Comparison of baseline characteristics of male and female subjects
2.3 慢性疾病指标与肿瘤发生风险关联 以是否发生肿瘤为因变量(赋值:发生=1,未发生=0),以慢性疾病指标为自变量,进行单因素Cox回归分析,结果显示,TC、SUA是体检人群发生肿瘤的影响因素(P<0.05)。调整了年龄(连续变量)、性别(赋值:男性=1,女性=2)、吸烟状况(赋值:不吸烟=1,曾经吸烟=2,当前吸烟=3)、饮酒状况(赋值:不饮酒=1,当前饮酒=2),多因素Cox回归分析结果显示,与基线SUA水平为302~367 μmol/L的体检者相比,基线SUA水平<247 μmol/L、基线SUA水平为247~301 μmol/L的体检者肿瘤发生风险的HR(95%CI)值分别为2.46〔95%CI(1.19,5.07),P=0.014〕、1.98〔95%CI(1.01,3.88),P=0.045〕,见表5~6。

表5 91例肿瘤患者慢性疾病指标情况〔n(%)〕Table 5 Characteristics of chronic disease indicators in 91 cancer patients

表6 慢性疾病指标与肿瘤发生风险的多因素Cox回归分析Table 6 Multivariate Cox regression analysis of chronic disease indicators and cancer risk
2.4 慢性疾病风险评分与肿瘤发生风险关联 慢性疾病低分组、中分组、高分组分别为6 403例、6 459例、5 147例。分别以所有体检者、男性、女性是否发生肿瘤为因变量(赋值:发生=1,未发生=0),以慢性疾病风险评分的风险值为自变量,进行Cox回归分析,结果显示,与慢性疾病风险评分低分组(<6分)相比,慢性疾病风险评分中分组(6~8分)和高分组(≥9分)体检者肿瘤发生风险的HR(95%CI)值分别为2.16〔95%CI(1.20,3.90),P=0.011〕和 3.08〔95%CI(1.72,5.50),P<0.001〕(P趋势<0.001),满足比例风险假定检验(χ2=1.98,P=0.371);慢性疾病风险评分每增加1分,体检者肿瘤发生风险增加17%〔95%CI(9%,25%),P<0.001〕,满足比例风险假定检验(χ2=0.31,P=0.579)。女性体检者中,与慢性疾病风险评分低分组(<6分)相比,慢性疾病风险评分高分组(≥9分)肿瘤发生风险的HR(95%CI)值为3.00〔95%CI(1.32,6.82),P=0.009〕,满足比例风险假定检验(χ2=1.24,P=0.538);慢性疾病风险评分每增加1分,女性体检者肿瘤发生风险增加21%〔95%CI(10%,33%),P<0.001),见表7。

表7 慢性疾病风险评分与肿瘤发生风险的多因素Cox回归分析Table 7 Multivariate Cox regression analysis of chronic disease risk score and cancer risk
3 讨论
本研究结果显示,由BMI、腰围、血压、血糖、TC、TG、SUA、TBil、心率及eGFR构成的10个慢性疾病指标联合计算的慢性疾病风险评分越高,随访(中位随访时间4.00年)后肿瘤发生风险越高,且呈剂量反应关系。本研究结果与既往研究报道的多个代谢指标联合效应与肿瘤风险关联结果相一致[4,17]。TU等[4]采用健康体检人群的血压、TC、血糖、SUA、心率、尿蛋白及肾小球滤过率计算的慢性疾病风险评分,平均随访8.7年后风险评分最高组是最低组肿瘤发生风险的 2.21 倍〔95%CI(1.77,2.75)〕。STOCKS 等[17]采用BMI、血压、血糖、TC及TG 5个指标计算代谢风险评分,并评估与肿瘤发生风险关系,结果显示,代谢风险评分与肿瘤发生风险呈线性正相关,代谢风险评分每增加1个标准差,队列中男性和女性肿瘤发生风险分别增加5%〔95%CI(3%,8%)〕和8%〔95%CI(5%,11%)〕。本研究性别分层分析结果显示,女性慢性疾病风险评分高分组肿瘤发生风险是低分组的3.00倍〔95%CI(1.32,6.82)〕,而男性体检者并未出现有统计学意义的肿瘤风险增加,可能与本研究中肿瘤发病类型多为女性相关的甲状腺癌和乳腺癌有关。
本研究纳入的10个慢性疾病指标中,SUA在慢性疾病风险评分计算中的权重最大,次之为TG、TBil和心率,表明这些指标可能与肿瘤发生风险更为相关。有研究发现高SUA水平会增加肿瘤风险[18],也有研究指出SUA是连接指定代谢当量定义中四个核心成分的单一公共因素,包括胰岛素抵抗指数(HOMA-IR)测量、平均动脉压、TG与高密度脂蛋白胆固醇比值和腰围[19]。虽然SUA可以作为一种系统性抗氧化剂,但其促炎特性已被假定在肿瘤发病机制中发挥重要作用。另有观点认为高SUA水平可能是生活方式改变导致肿瘤风险增加的一个替代标志[20]。与生活方式改变相关的两个危险因素,即慢性炎症和代谢综合征,在肿瘤发生发展中起到重要作用[20]。代谢综合征和肿瘤有共同的潜在致病机制,如氧化应激、慢性炎症及胰岛素抵抗导致的代偿性高胰岛素血症[8,21]。肥胖是众多慢性疾病的危险因素,尤其是高血压、血脂异常、代谢综合征、2型糖尿病、心血管疾病及肿瘤[22],且已被证实会增加至少13种肿瘤的发生风险[22]。血清黄嘌呤氧化还原酶(XOR)水平与肥胖相关的代谢性紊乱有关,其衍生的活性氧、氮和SUA与高血压、血脂异常和胰岛素抵抗的发生共同作用,参与细胞转化和增殖及疾病的进展和转移过程[21]。肥胖、2型糖尿病、胰岛素抵抗、高血压、代谢综合征及痛风是一组与高尿酸血症、慢性炎症和激活的先天性免疫相关的综合征[23],其发生发展可能与SUA介导的中介效应有关,这些因素可导致肿瘤发生风险增加,并已在大型流行病学分析中被证实[8,20-22,24-26]。VITEK[27]认为低 TBil水平与肿瘤发病存在关联,而TBil水平轻微升高后肿瘤发生风险降低。SONG等[28]发现在我国肺癌患者中,血清TBil水平均高于正常对照人群水平。这些结果的不一致可能与血清TBil与肿瘤风险之间存在非线性剂量反应关系有关,而本研究结果也显示血清TBil水平与肿瘤风险存在非线性剂量反应关系。
有研究发现,静息心率>80次/min是静息心率<60次/min患者肿瘤死亡风险的1.66倍〔95%CI(1.23,2.26)〕[29],但未有研究报道心率与肿瘤发生风险的关联。有观点认为心率升高表明交感神经激活,从而导致自主神经的不平衡[30],这种不平衡增加刺激肾上腺素活动,产生刺激增殖的神经营养因子,影响炎症、血管生成、组织侵袭及细胞免疫反应和上皮-间质转化[31],进而增加肿瘤发生风险。XU等[32]研究发现eGFR与肿瘤发病呈U型关系,与eGFR为90~104 ml·min-1·(1.73 m2)-1相 比,eGFR ≥ 105 ml·min-1·(1.73 m2)-1及eGFR<90 ml·min-1·(1.73 m2)-1患者肿瘤风险均升高。肾功能障碍会导致慢性炎症和氧化应激状态[33],而炎症微环境又在肿瘤发生中起作用。心率及eGFR又受肥胖影响,两者有可能作为风险因子,参与肥胖介导的中介效应而增加特定类型的肿瘤风险[29,34]。
本研究的优势在于队列研究设计,且样本量较大。本研究仍存在局限性,首先研究对象均为单中心的体检者,经济和文化水平相对较好,可能存在选择偏倚;其次本研究中位随访时间4.00年,相对较短;最后肿瘤患者的确定是通过体检者完成检前健康风险评估问卷,收集其近1年诊断的疾病信息,可能会低估肿瘤的发病,未来需更长随访期进一步证实研究结果。
综上所述,肿瘤发生风险随慢性疾病风险评分增加而增加。肥胖和代谢性指标等危险因素的大幅流行,可能导致肿瘤发病率持续增长。因此,需将慢性疾病危险因素预防关口前移,这对我国肿瘤综合防控具有重要意义。
作者贡献:高鹰负责策划总体研究目的,撰写文章初稿,对研究内容进行验证,保证研究结果的可重复性;靳育静、魏玮管理元数据,数据整理及维护,建立模型;徐晓倩负责文献整理;李书、杨洪喜为研究的策划和执行进行管理和协调;张卿负责文章的质量控制。
本文无利益冲突。
