丛枝菌根真菌提高感染青枯菌番茄根际土壤细菌群落多样性和稳定性及有益菌属相对丰度
2023-02-22张嘉慧邢佳佳彭丽媛邬奇峰陈俊辉徐秋芳
张嘉慧,邢佳佳,彭丽媛,邬奇峰,陈俊辉,徐秋芳,秦 华*
(1 浙江农林大学环境与资源学院,浙江 杭州 311300;2 杭州市临安区农林技术推广中心,浙江 杭州 311300)
近年来,高强度集约化农业生产削弱土壤生态系统的稳定性与平衡性,病原菌入侵是土壤生态系统退化的重要标志[1]。病原菌与土著菌通过竞争资源与生态位等,对土壤生态系统产生显著影响。茄科雷尔氏菌 (Ralstonia solanacearum) 亦称青枯菌,是世界上分布区域最广、病害程度最高的十大病原菌之一,可通过植物根系伤口进入维管束组织,导致植物感病。青枯菌对包括马铃薯、番茄、辣椒和烟草等在内的茄科作物危害尤为严重,每年造成的农业经济损失难以量化[2–3]。番茄 (Solanum lycopersicum)是我国种植最广泛的经济作物之一,番茄青枯病是番茄栽培中发生普遍和危害严重的病害之一。据统计,轻病田块减产10%~30%,重病田块减产超过50%甚至绝收,严重制约了番茄种植业的发展和经济效益的提高[4–5]。
土壤微生物作为土壤生态系统的重要组成部分,在植物健康生长和农业可持续生产中起关键作用[6],植物、病原菌和土著微生物之间的相互作用决定植物病害的发生与发展。当病原菌入侵植物根际,植物感知胁迫后改变其根系分泌物的成分和浓度,并在根际产生信号传导效应[7],招募有益微生物来降低病原菌对宿主的侵害。如拟南芥在丁香假单胞菌 (Pseudomonas syringae) 的胁迫下通过增加根系分泌物中苹果酸的渗出而招募土壤中的枯草芽孢杆菌 (Bacillus subtilis) 在其根际定殖,枯草芽孢杆菌通过分泌脂肽抗生素以抑制丁香假单胞菌的侵染能力[8]。尖孢镰刀菌 (Fusarium oxysporum) 侵染黄瓜根系增加了根系分泌物中色氨酸的含量,并降低了棉子糖的浓度,促进土壤的解淀粉芽孢杆菌 (B.amyloliquefaciens) 在根际定殖,解淀粉芽孢杆菌通过生态位竞争降低尖孢镰刀菌的丰度[9]。研究病原菌入侵后的根际微生物变化有助于了解植物对病原菌入侵的响应,以及病原菌与土著微生物之间复杂的相互作用[10]。
丛枝菌根 (arbuscular mycorrhiza,AM) 真菌是土壤中分布最广的根际微生物之一,可定殖于植物根系皮层与宿主形成互惠共生体[11]。AM真菌在土壤中产生大量的根外菌丝网络,可显著增加宿主植物根系的吸收面积,并为植物制造的光合产物转移至土壤微环境中提供了直接途径[12]。已有许多研究表明,AM真菌定殖于植物根系会使宿主根际细菌数量和组成发生变化[12–13],如Andrade等[14]的研究发现摩西管柄囊霉 (Funneliformis mosseae) 等3种AM真菌侵染的高梁使其根际土壤细菌数量多于土体土壤。Artursson等[15]的研究发现,定殖在棉花根系的摩西管柄囊霉 (Funneliformis mosseae) 和球状巨孢囊霉(Gigaspora margarita) 在菌丝际富集了芽孢杆菌属(Bacillus) 、芽单胞菌属 (Gemmatimonadetes) 和黄杆菌属 (Flavobacterium) 等菌群。土壤细菌群落数量、组成和活性的变化可归因于定殖于植物根系的AM真菌改变宿主植物的根系分泌物的组成,或AM真菌通过根外菌丝为微生物的生长提供生态位,分泌的含碳化合物维持AM真菌与其它微生物之间的互惠关系[15–16]。
尽管已有大量研究表明青枯菌入侵推动了根际微生物群落的改变,但相关研究多集中于拮抗细菌的筛选与鉴定[5,17],关于AM真菌与土壤细菌群落互作对青枯菌入侵的响应机制鲜有报道。因此,本研究利用实时荧光定量 PCR (real-time quantitative PCR,qPCR) 和NovaSeq高通量测序技术,探索AM真菌和青枯菌接种对接入病原菌及根际细菌群落的影响,阐明土著细菌群落的多样性和组成及细菌物种之间的相互作用对青枯菌和AM真菌接种的响应,为利用AM真菌调控土壤微生物区系从而抑制土壤青枯菌提供理论依据。
1 材料与方法
1.1 供试材料
供试番茄为青枯病易感品种‘合作903’;供试AM真菌为摩西管柄囊霉 (Funneliformis mosseae)M47V;供试病原菌为茄科雷尔氏菌QL-RS 1115(GenBank:GU390462);供试土壤于2021年8月采自浙江省嘉兴市嘉善县番茄种植农业基地 (E120°59′,N30°48′),选取具有长期青枯病发病史的种植大棚,采集0—20 cm土层土壤,过6 mm 筛,备用。供试土壤理化性质为pH 7.04,有机碳13.7 g/kg,有效磷19.6 mg/kg,速效钾 116 mg/kg,硝态氮 5.44 mg/kg,铵态氮 1.01 mg/kg。
番茄种子用无菌水浸泡5 min后用5%的次氯酸钠溶液消毒5 min,无菌水冲洗5次,将番茄种子转移至30℃培养箱中催芽48 h。将萌发的番茄种子移入50孔育苗盘中,向每孔中加入20 g生升农业育苗基质土(主要成分:进口泥炭、进口椰糠、珍珠岩、腐殖质)和20 g摩西管柄囊霉菌剂,进行菌根化育苗,非菌根化育苗则加入20 g生升农业育苗基质土和20 g灭活菌剂。番茄苗置于气候箱中培养,相关参数设置如下:温度26℃,湿度50%,日照时长12 h,育苗 30 天。
青枯菌菌液制备:将青枯菌在SMSA培养基中活化,转接到NB液体培养基中,28℃、170 r/min摇床培养12 h,作为种子液,再转接于NB液体培养基,28℃、170 r/min 摇床培养 36 h,高速离心弃去上清液,用无菌水重悬菌体,通过稀释使菌悬液浓度达到 109cfu/mL。
1.2 试验设计
1.2.1 盆栽试验 盆栽试验在浙江农林大学农业试验基地 (E119º43’,N30º15’) 的温室大棚中进行,试验设置4个处理:1) 非菌根苗未接种青枯菌 (对照,CK);2) 菌根苗未接种青枯菌 (TN+AMF);3) 非菌根苗接种青枯菌 (TR–AMF);4) 菌根苗接种青枯菌 (TR+AMF)。每个处理3个重复,每个重复设置20盆番茄。除去番茄苗根系附着的育苗基质,将培育30 天后的番茄苗移入装有500 g 供试土壤的盆钵中,每盆移栽1株,调节土壤含水量至30%左右。移栽后缓苗一周,采用灌根法对TR–AMF和TR+AMF处理根系周围土壤接种5 mL R. solanacearum悬液(CK和TN+AMF处理则用等量的无菌水替代)。
1.2.2 样品采集 在接入青枯菌后的第1、7和14天,采集番茄根系和根际土壤样品。样品的采集:每个处理设置3个重复。在每个重复随机选定3株番茄,对选定番茄进行破坏性采样。采用抖根法收集粘附在番茄根系的根际土壤为1组混合根际土壤样品,收集番茄根系为1组混合根系样品,每个处理各得3组重复的根际土壤样品和根系样品。收集的根际土壤样品和根系样品保存于–70℃的冰箱中备用。将收集到的根系样品用于AM真菌侵染率的测定,番茄根际土壤用于土壤总DNA提取。
1.3 分析方法
1.3.1 青枯病发病率和病情指数 在番茄根部接入青枯菌后,每天观察番茄发病症状,并统计发生萎蔫的叶片数,记录各处理番茄的发病率、病情指数。将植物的发病症状分为5个等级,分级标准如下:0级,无叶片萎蔫;I级,1%~25%的叶片出现萎蔫现象;II级,26%~50%的叶片出现萎蔫现象;III级,51%~75%的叶片出现萎蔫现象;Ⅳ级,76%~100%的叶片出现萎蔫现象。发病率和病情指数的计算:发病率=(感病株数/总株数)×100%;病情指数=∑(各级病株数×相应级数)/(总株数×最高发病级数)×100%。
1.3.2 AM真菌侵染率的测定 将接入病原菌后的第1、7和14 天收集的番茄根系样品进行AM真菌侵染率的测定。AM真菌侵染率的测定:用20% KOH溶液脱色,用5%的醋酸墨水染色液进行染色,后用Sudan IV染色液进行复染,于体视显微镜下观察 AM 真菌在根系的侵染情况,侵染率采用根段频率标准法进行计算。
1.3.3 土壤总DNA提取 在接入病原菌后的第1、7和14 天,收集根际土壤样品用于土壤总DNA提取。采用 PowerSoilTMTotal DNA Isolation Kit 试剂盒提取土壤样品的总DNA。根据试剂盒说明书,称取0.25 g鲜土提取样品的总DNA,提取出的DNA样本通过核酸定量仪NanoDrop在A260/A280和A260/A230的吸光度比值检测其浓度及纯度,纯化的DNA样本保存于–40℃的冰箱中备用。
1.3.4 实时荧光定量PCR 通过实时荧光定量PCR(qPCR) 测定接入病原菌后的第1、7和14 天的番茄根际土壤中的青枯菌。青枯菌flic基因扩增使用引物对 flicF/flicR (5'–GAA CGC CAA CGG TGC GAA CT–3' / 5'–GGC GGC CTT CAG GGA GGT C–3')[18],将含青枯菌flic基因的质粒进行10倍稀释制成103~109copies/μL 的标准曲线。扩增体系为 10 μL TB Green,0.2 μL flicF 和 0.2 μL flicR,0.1 μL 土样DNA和9.5 μL无菌水,每组处理设置3个样品重复,3个测定重复,根据所测定的Ct值计算1 g干土样中flic基因的拷贝数,结果以对数形式l g(copies/g, 干土)呈现。
1.3.5 高通量测序 将接入病原菌后第1和14天收集的根际土壤样品送于深圳微科盟科技集团有限公司进行高通量测序。使用引物338F (5'–ACTCCTACGGGAGGCAGCAG–3') 和 806R (5'– GGACTACHVGGGTWTCTAAT–3') 通过聚合酶链反应(PCR) 扩增 16S rRNA 基因的可变 V3~V4 区,基于Illumina NovaSeq平台对测序样本进行双端测序,使用Qiime2软件中的DADA2插件对所有样品的全部原始序列 (input) 进行质量控制 (filtered),去噪(denoised),拼接 (merged),并且去嵌合体 (nonchimeric),四组处理的土壤样品在试验前期和后期分别得到1012154和1021142条序列,根据97%的相似性,分为7870和9343个细菌OTU,通过Silva数据库 (16S) 进行物种注释。设置置信度阈值为0.7,且四组处理的Alpha多样性稀释曲线 (rarefaction curve) 趋于平缓,表明测序数据量已足够反映当前样品包含的绝大部分的微生物多样性信息。
1.4 数据处理
所有数据处理分析基于IBM SPSS 20.0和R 3.5.3。采用双因素方差分析 (two-way ANOVA) 和Duncan’s函数对青枯菌flic基因丰度、土壤理化性质和Alpha多样性等指标进行显著性检验。采用Kruskal-Wallis检验对细菌门和细菌属进行显著性差异分析。基于细菌OTU表,通过Qiime中alpha_diversity.py脚本计算群落Alpha多样性指数;利用R语言中vegan软件包进行非度量多维尺度分析(NMDS),并进行ANOSIM相似性检验;采用spearman相关性分析法,构建网络的r和p阈值分别设定为0.7和0.01,构建共现网络拓扑结构,利用软件 Cytoscape (v3.8.0) 和 Gephi (v.0.92) 构建细菌可视化网络图。
2 结果与分析
2.1 AM真菌侵染率、土壤青枯菌丰度和番茄发病情况
菌根化育苗处理 (TN+AMF和TR+AMF) AM真菌侵染率在32%~40%,而非菌根化育苗处理 (CK和TR–AMF) AM真菌侵染率在4.0%~4.7%,前者显著高于后者 (P<0.05) (图 1a)。
接入病原菌后第1天,接种青枯菌处理 (TR–AMF和TR+AMF) 根际青枯菌flic基因丰度在5.19×108~6.22×108copies/g, 干土,未接种青枯菌处理 (CK 和TN+AMF) 根际青枯菌 flic基因丰度在 4.11×106~5.57×106copies/g, 干土,前者显著高于后者 (P<0.05)(图1b)。接入病原菌第7 天,接种青枯菌的TR–AMF和TR+AMF处理根际flic基因丰度分别为1.08×108和 7.38×107copies/g, 干土,而未接种青枯菌的 CK和TN+AMF处理根际flic基因丰度分别为5.24×106和 2.39×106copies/g, 干土,TN+AMF 处理根际 flic 基因丰度显著低于CK处理 (P<0.05),与第1天相比,CK处理根际flic基因丰度提高,而TR–AMF、TR+AMF和TN+AMF处理根际flic基因丰度降低,接种青枯菌处理根际flic基因丰度仍显著高于未接种青枯菌处理。接入病原菌第14 天,接种青枯菌的TR–AMF和TR+AMF处理根际flic基因丰度分别为1.99×107和 9.64×106copies/g, 干土,TR+AMF 处理根际flic基因丰度显著低于TR–AMF处理 (P<0.05),而未接种青枯菌的CK和TN+AMF处理根际flic基因丰度分别为 1.06×106和 3.70×105copies/g, 干土,TN+AMF处理根际flic基因丰度显著低于CK处理(P<0.05),与第7天相比,4个处理根际青枯菌flic基因丰度均降低,且接种AM真菌的处理根际flic基因丰度均显著低于未接种AM真菌的处理(P<0.05),接种青枯菌的处理根际flic基因丰度仍显著高于未接种青枯菌的处理 (P<0.05)。试验结果表明,接种青枯菌显著提高番茄根际病原菌的数量,而接种AM真菌在试验后期显著降低番茄根际青枯菌的数量。
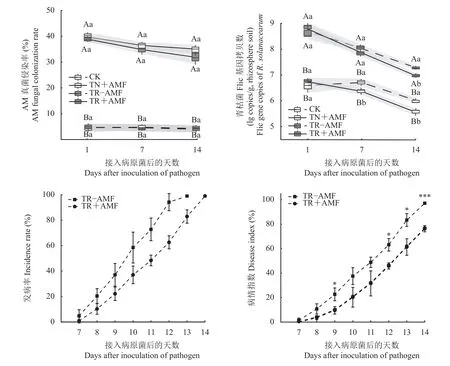
图1 AM真菌侵染率、青枯菌flic基因丰度、青枯病发病率和病情指数Fig. 1 AM fungal colonization rate, abundance of R. solanacearum flic gene, bacterial wilt incidence rate and disease index
试验过程中,未接种青枯菌的CK和TN+AMF处理未出现发病现象,接种青枯菌的TR–AMF和TR+AMF处理在接入青枯菌第7 天先后开始发病。通过比较TR–AMF和TR+AMF两组处理的发病率(图1),发现相比于TR+AMF处理,TR–AMF处理的发病速度更快,在接入病原菌第13 天已全部发病,由此推测AM真菌在一定程度上延缓了青枯病的发生,且TR+AMF处理在接入病原菌第9、12、13和14 天,其病情指数显著低于TR–AMF处理 (P<0.05) (图 1)。
2.2 接种青枯菌和AM真菌对番茄根际土壤细菌群落的影响
2.2.1 番茄根际土壤细菌群落组成 番茄根际土壤细菌群落因接种青枯菌和AM真菌而产生一系列变化。在接入病原菌第1 天,接种青枯菌显著提高番茄根际细菌中的变形菌门 (Proteobacteria) 的相对丰度 (P<0.05) (图2a),以及变形菌门下劳尔氏菌属 (Ralstonia)、不动杆菌属 (Acinetobacter)、砂单胞菌属 (Arenimonas)、多囊菌属 (Polyangium) 的相对丰度 (P<0.05) (图3a);而显著降低了酸杆菌门(Acidobacteria)、芽单胞菌门 (Gemmatimonadetes)、绿弯菌门 (Chloroflexi)、己科河菌门 (Rokubacteria)和放线菌门 (Actinobacteria) 的相对丰度 (P<0.05)。接种AM真菌未对番茄根际细菌门水平丰度产生显著影响,但对青枯菌入侵下番茄根际的部分细菌属的相对丰度产生显著影响。接种AM真菌显著提高变形菌门下的氢噬胞菌属 (Hydrogenophaga)、伯克氏菌属(Limnobacter)、伯克氏菌属 (Ramlibacter)、丛毛单胞菌属 (Curvibacter)、甲基杆菌属 (Microvirga) 和Inhella、Silvanigrella属以及拟杆菌门下的黄杆菌属(Flavobacterium) 的相对丰度 (P<0.05) (图 3a)。在接入病原菌第14 天,接种青枯菌显著提高番茄根际细菌中的变形菌门 (Proteobacteria)、芽单胞菌门(Gemmatimonadetes) 和己科河菌门 (Rokubacteria) 的相对丰度 (P<0.05) (图2b),以及变形菌门下的劳尔氏菌属 (Ralstonia)、鞘氨醇单胞菌属 (Sphingomonas)、溶杆菌属 (Lysobacter)、蛭弧菌属 (Bdellovibrio)、砂单胞菌属 (Arenimonas)、热单胞菌属 (Thermomonas)、假单胞菌属 (Pseudomonas)、多囊菌属 (Polyangium)、不动杆菌属 (Acinetobacter)、食酸菌属 (Acidovorax)、Pseudoduganella属和拟杆菌门下黄杆菌属 (Flavobacterium) 的相对丰度 (P<0.05) (图 3b);而显著降低了酸杆菌门 (Acidobacteria)、绿弯菌门 (Chloroflexi)和放线菌门 (Actinobacteria) 的相对丰度 (P<0.05)(图2b)。接种AM真菌显著提高拟杆菌门下噬胞菌属 (Cytophaga)、黄杆菌属 (Flavobacterium) 和黄色土源菌属 (Flavisolibacter) 及酸杆菌门下苔藓杆菌属(Bryobacter)、Subgroup 属的相对丰度 (P<0.05) (图 3b)。
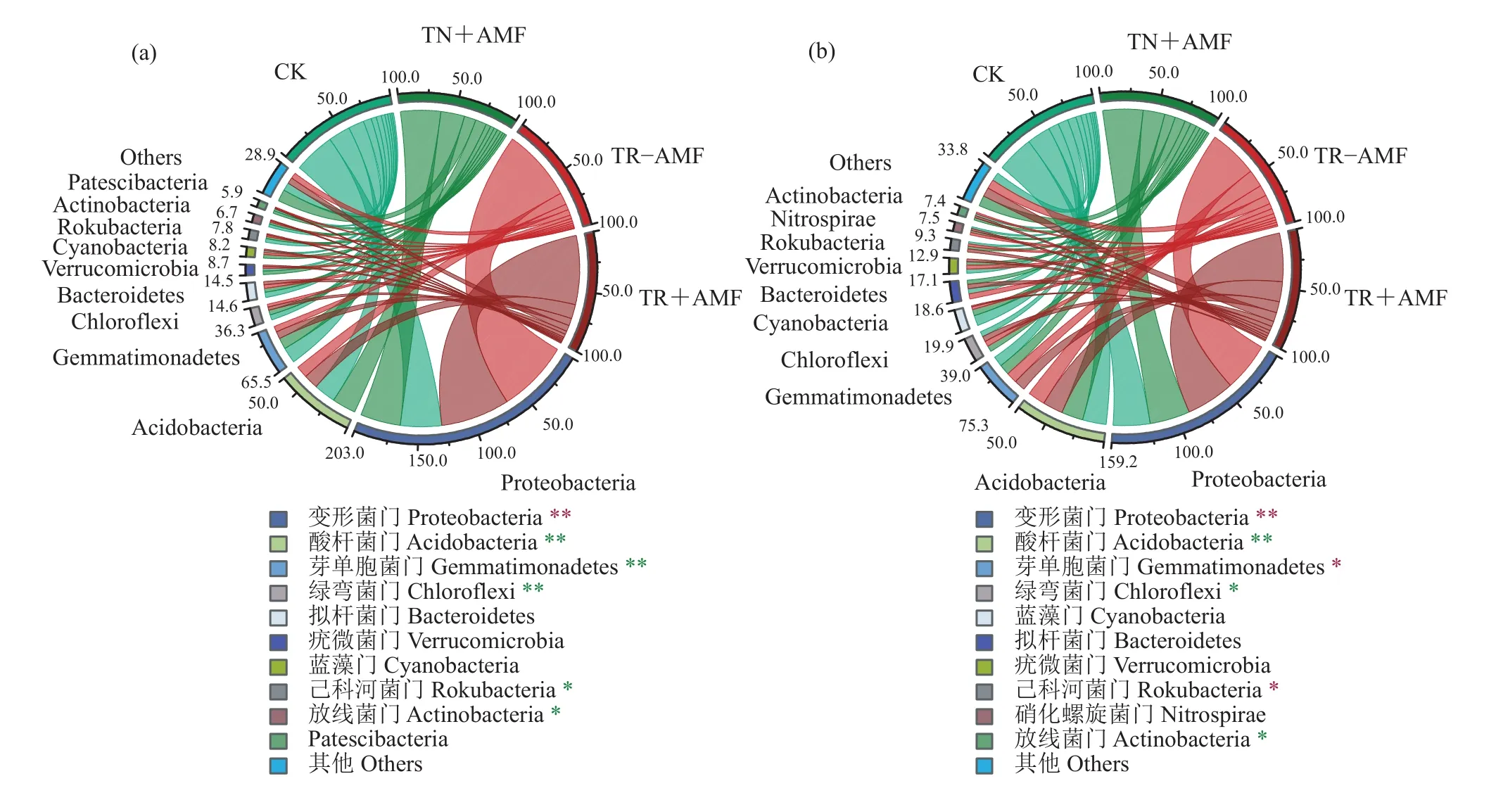
图2 接入病原菌第1天(a)和第14天(b)番茄根际的细菌门水平组成Fig. 2 Bacterial phylum level of tomato rhizosphere on 1 days (a) and 14 days (b) after inoculation of pathogen
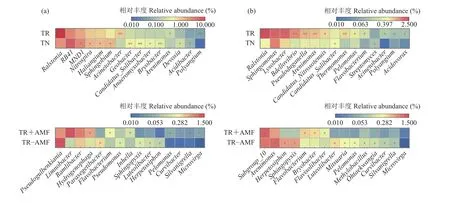
图3 接入病原菌第1天(a) 和第14天(b) 番茄根际细菌属水平的显著性比较Fig. 3 Significant comparison of bacterial genus levels of tomato rhizosphere at 1 days (a) and 14 days (b) after inoculation of pathogen
2.2.2 番茄根际土壤细菌多样性 接种青枯菌和AM真菌对根际土壤细菌的Alpha多样性产生显著影响 (表1)。在接入病原菌第1 天,接种青枯菌处理(TR–AMF和TR+AMF) 根际土壤细菌的Chao1指数、Shannon指数和Simpson指数显著降低 (P<0.05),表明接种青枯菌降低了番茄根际细菌的多样性与丰富度,而接种AM真菌未对细菌Alpha多样性产生显著影响。在接入病原菌第14 天,接种青枯菌处理 (TR–AMF 或 TR+AMF) 细菌的 Chao1 指数、Shannon指数和Simpson指数增加,与未接种青枯菌处理 (CK和TN+AMF) 处理之间无显著差异, 而接种青枯菌处理 (TR–AMF 和 TR+AMF) 的 Faith_pd指数显著低于未接种青枯菌处理 (CK和TN+AMF) ,表明青枯菌接种降低土壤细菌的物种丰富度。同时,方差分析表明接种AM真菌显著提高了番茄根际细菌的Chao1指数和Shannon指数 (P<0.05),由此推测AM真菌有利于提高根际土壤细菌的多样性与丰富度。

表1 接种病原菌后1和14天土壤细菌 OTU 水平上 Alpha 多样性 (均值±标准偏差)Table 1 Alpha diversity of soil bacteria at OTU level at the 1 and 14 days of inoculation of pathogens (mean ± STDEVP)
基于Bray-Curtis距离矩阵的NMDS分析结果表明,接入病原菌第1 天,接种青枯菌处理 (TR–AMF和TR+AMF) 与未接种青枯菌处理 (CK和TN+AMF)的根际土壤细菌群落在NMDs 1轴上分离且出现显著性 (r = 0.669,P<0.01) (图 4a),表明接种青枯菌显著影响了细菌群落结构;在接入病原菌后第14 天,接种青枯菌处理 (TR–AMF和TR+AMF) 与未接种青枯菌处理 (CK和TN+AMF) 的根际土壤细菌群落在NMDs 1轴上分离但无显著性 (图4b),接种AM真菌对番茄根际土壤细菌群落结构的影响不显著。
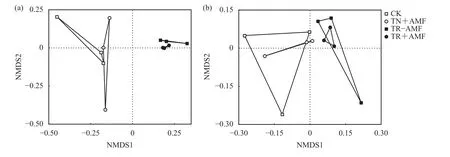
图4 接入病原菌第1天(a)和第14天(b)番茄根际细菌群落基于OTU水平的NMDS分析Fig. 4 NMDS analysis of soil bacterial community based on OTU level at 1 days (a) and 14 days (b)after inoculation of pathogen
2.2.3 番茄根际细菌共现网络分析 基于番茄根际细菌群落的共现网络变化,进一步探究接种青枯菌和AM真菌对番茄根际土壤细菌群落的影响 (图5)。在接入病原菌第1 天 ,TR处理的细菌共现网络相比于TN处理其节点数和连接数明显减少,模块化程度降低 (表2),表明接种青枯菌减少了细菌物种之间的相互作用,削弱了细菌群落结构的稳定性。而TR+AMF处理的细菌共现网络相比于TR–AMF处理显现出更多的节点数和连接数,更高的模块化程度和更低的聚类系数 (表3),表明在青枯菌入侵下AM真菌在一定程度上缓解由青枯菌接种引起的细菌群落稳定性的降低。在接入病原菌第14 天,与TN处理相比,TR处理的细菌共现网络的模块化程度提高,节点数和连接数增加 (表2),表明接种青枯菌的处理在试验后期其根际土壤中的细菌物种之间存在更频繁的相互作用,土壤细菌群落的稳定性提高。与第1天的结果一致,接入病原菌第14天共现网络表明TR+AMF处理比TR–AMF处理的细菌群落更加稳定,前者的共现网络中显现出更多的正相关连接,表明青枯菌入侵下AM真菌促进细菌物种间产生更多的良性互作。

表2 接种和未接种青枯菌的番茄细菌共生网络拓扑性质Table 2 Topological properties of bacterial co-occurrence network of tomato inoculated and not inoculated with R. solanacearum

表3 只接种青枯菌和同时接种青枯菌和AM真菌的番茄的细菌共生网络拓扑性质Table 3 Topological properties of bacterial co-occurrence network of tomato inoculated only with R. solanacearum(TR–AMF) and tomato inoculated with both R. solanacearum and AM fungus (TR+AMF)
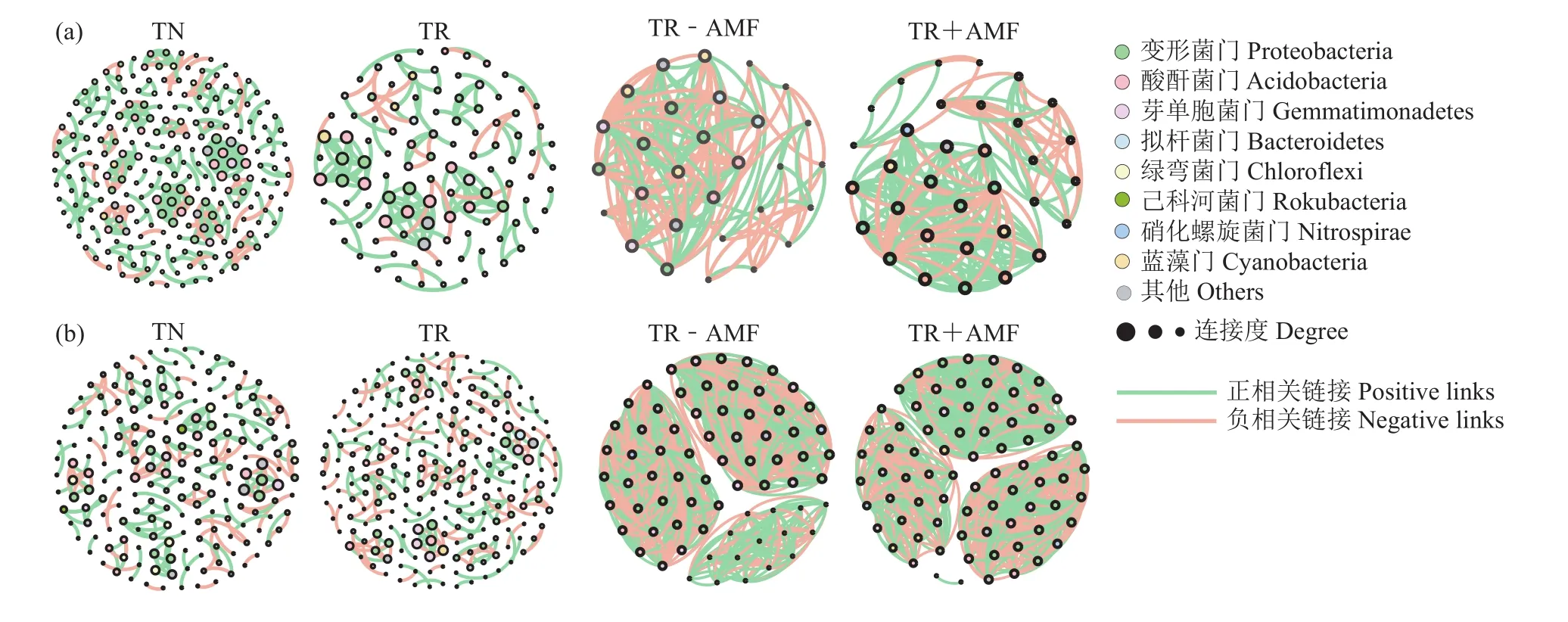
图5 接入病原菌第1天(a)和第14天(b)基于番茄根际细菌共现网络Fig. 5 Co-occurrence network of tomato rhizosphere bacteria at 1 days (a) and 14 days (b) after inoculation of pathogen
3 讨论
3.1 土壤细菌群落对接种青枯菌的响应
接种青枯菌显著提高了番茄根际土壤中的病原菌丰度 (P<0.05),进而诱导番茄青枯病的发生,表明病原菌丰度是引发青枯病的重要因素之一。除诱发青枯病外,接种青枯菌导致番茄根际土壤细菌群落组成和结构发生一系列改变。
土壤被认为是一个高度复杂和动态的生态系统,接种青枯菌通过改变土壤中病原菌的丰度进一步影响土壤微生物群落的动态平衡。接种青枯菌导致土壤细菌群落组成发生改变,可能是由病原菌入侵和免疫系统引起的植物根系分泌物的变化推动了对根际微生物的差异性招募[19–20]。番茄接种青枯菌后,在根际富集不动杆菌属 (Acinetobacter)、鞘氨醇单胞菌属 (Sphingomonas)、溶杆菌属 (Lysobacter)、假单胞菌属 (Pseudomonas) 等,其中,某些不动杆菌属可以促进植物生长从而提高植物对病原菌的抵抗能力[21–22];多数鞘氨醇单胞菌属、溶杆菌属和假单胞菌属可以分泌胞外酶和多种抗菌化合物拮抗病原微生物,减弱其毒性[22–25],由此推测宿主在青枯菌胁迫下招募上述菌属以提高其抗病性。大量研究同样表明,植物在病原菌胁迫下可以通过改变根系分泌物或释放挥发性有机物,在根际招募有益微生物以维持后代或邻近植物的生存[26–28]。
土著细菌作为土壤生命的重要组成部分,在青枯菌进入土壤时迅速对其作出响应。本研究发现,番茄根际细菌多样性指数在青枯菌接入土壤后显著下降,但随着青枯菌接入时间的增加,番茄根际土壤中的细菌群落多样性提高。试验前期细菌多样性的降低可能是由病原菌和土著细菌之间对生态位和资源存在竞争所导致[17,29],病原菌入侵导致宿主的根系分泌物的变化同样会导致番茄根际细菌群落多样性的降低[30–31];试验后期细菌群落多样性的提高可能因为宿主植物对病原菌的入侵产生免疫反应而在根际招募有益微生物[32–33]。
本研究通过共现网络将青枯菌和土壤细菌之间的关联性进行量化和可视化[34]。接种青枯菌在试验前期极大的降低了细菌共现网络的模块化和复杂程度,土壤细菌物种之间的相互作用减弱,进一步增加了青枯菌入侵的可能性,共现网络的简化与微生物多样性的降低和微生物组功能的削弱相关,这可能导致微生物抑病功能的丧失[17]。与细菌多样性的变化相似,番茄根际土壤细菌网络的复杂程度随着青枯菌接入时间的增加而提高,推测是宿主植物在青枯菌胁迫下选择性招募有益微生物,并促成更加紧密和频繁的相互作用,从而增强细菌群落的稳定性[35]。
3.2 AM真菌通过调控土壤细菌群落抑制青枯菌的生长
青枯菌丰度是导致番茄发病的重要因素,而接种AM真菌可以显著降低番茄根际土壤中青枯菌丰度 (P<0.05),在一定程度上抑制青枯菌的生长进而延缓了番茄青枯病的发展速度,降低其病情指数。接种AM真菌导致土壤中青枯菌数量的减少,推测AM真菌、青枯菌和土壤细菌群落之间存在复杂的互作关系,AM真菌可以通过调控土壤细菌群落抑制青枯菌的生长。
已有研究表明AM真菌通过改变宿主根系分泌物的组成,或通过菌丝为上述菌属提供了适宜的生态位以调控土壤微生物群落组成[15,36]。本研究发现,接种AM真菌提高了青枯菌胁迫下的番茄根际黄杆菌属 (Flavobacterium)、黄色土源菌属 (Flavisolibacter)、噬胞菌属 (Cytophaga) 和苔藓杆菌属 (Bryobacter)的相对丰度。马超等[37]的研究表明,存在一些特定的黄杆菌属通过减少青枯菌凝集素结合的糖供应抑制青枯菌数量,而某些黄杆菌属和黄色土源菌属可以调节植物的防御信号通路和抑制病原菌的生长和毒性[19,36];多数噬胞菌属和苔藓杆菌属通过分解有机质、利用碳源影响土壤碳循环,达到抑制病原菌生长的目的[19,38]。由此推测在青枯菌胁迫下因接种AM真菌而富集的上述菌属可能对降低土壤中青枯菌丰度起重要作用。
本研究还发现接种AM真菌在试验后期显著提高番茄根际细菌的Chao1指数和Shannon指数,表明AM真菌有利于提高细菌的多样性和丰富度。而Artursson等[15]的研究结果表明AM真菌会对土壤细菌群落产生影响,在提高宿主植物根际微生物的丰富度及其活性的同时,增加根际微生物的多样性[39],这与我们的研究结果一致,而细菌多样性的提高是抑制病原菌入侵的重要因素之一。
通过共现网络量化接种AM真菌对青枯菌和土壤细菌之间的关联性的影响。青枯菌入侵下AM真菌可以促进番茄根际细菌物种之间的良性互作,提高细菌网络的复杂程度,在一定程度上缓解由青枯菌导致的土壤细菌多样性的降低和稳定性的削弱。此外,接种AM真菌的番茄其细菌网络显现出更高的连通度和模块化程度,同样表明细菌物种之间存在稳定的共生关系,而高连接度和高模块化的共现网络,其微生物组可以更迅速的激活植物免疫系统,增强对病原菌的抵抗能力[19],由此推测AM真菌通过调控土壤细菌之间的相互作用以提高对青枯菌的抗性。上述由接种AM真菌所产生的网络拓扑性质差异,可能是由菌根共生过程中所产生的植物信号分子、激素和分泌物组成的变化造成的[40]。
4 结论
感染青枯菌的番茄根际会富集不动杆菌属(Acinetobacter)、鞘氨醇单胞菌属 (Sphingomonas)、溶杆菌属 (Lysobacter)、假单胞菌属 (Pseudomonas)等有益菌属以提高其抗病性,恢复细菌多样性和群落稳定性。接种AM真菌可显著降低番茄根际土壤中青枯菌的丰度,特别是提高侵染青枯菌后番茄根际的黄杆菌属 (Flavobacterium)、黄色土源菌属(Flavisolibacter) 、噬胞菌属 (Cytophaga) 和苔藓杆菌属 (Bryobacter)的相对丰度,因而抑制土壤中青枯菌的生长,并通过提高细菌的多样性和丰富度,促进番茄根际细菌物种之间的稳定共生和良性互作,从而提高细菌群落对青枯菌的抵抗能力。
