栀子黄色素的纯化、理化特性及稳定性评价
2023-02-21汤丽琴徐玉娟吴继军刘昊澄余元善林羡傅曼琴彭健温靖
汤丽琴,徐玉娟,吴继军,刘昊澄,余元善,林羡,傅曼琴,彭健,温靖*
1(江西农业大学 食品科学与工程学院,江西 南昌,330045)2(广东省农业科学院蚕业与农产品加工研究所 农业部功能食品重点实验室 广东省农产品加工重点实验室,广东 广州,510610)
颜色是食品品质的重要属性,影响消费者的接受度。食品工业常用合成着色剂来增强、均质和改变食品的色泽。近年来,天然色素逐渐引起人们的关注,研究者开始从植物原料中获取天然食用色素。栀子是天然色素的重要来源,属药食同源植物[1]。栀子果实的主要成分有环烯醚萜苷、奎宁酸衍生物和类胡萝卜素等[2]。栀子黄色素已被广泛用作食品着色剂,如糖果、饼干、果汁、面条等[3],其主要成分是西红花素-1(crocin-1),一种特殊的水溶性类胡萝卜素。近年已有研究结果显示西红花素-1具有抗肿瘤、抗氧化和抗抑郁等药理活性[4-5]。然而栀子黄色素粗提物由于京尼平苷杂质的存在,容易使食品出现褪色及绿变[6]。因此,建立高效的提取纯化工艺去除京尼平苷是栀子黄色素综合利用的关键。此外,纯化过程有望通过富集生物活性化合物来提高生物活性。目前已有研究采用膜分离法[7]、聚酰胺层析法[8]等对栀子黄色素进行分离制备,然而尚未发现使用X-5大孔树脂纯化栀子黄色素粗提液的报道。大孔树脂具有良好的理化稳定性、易回收和吸附选择性高等优点,已被广泛应用于生物活性物质的分离纯化,具有工业化生产的优势。此外,评估天然着色剂的稳定性对于确定食品保质期至关重要[9]。据报道,西红花素-1在光照、高温条件下较不稳定,限制了其在各领域的发展[10],不同来源西红花素-1的稳定性可能存在差异。本研究采用X-5大孔树脂对栀子果实中提取的栀子黄色素进行纯化工艺优化,并分析了纯化前后栀子黄色素的稳定性,以期为栀子黄色素的开发与应用以及保存方式提供理论依据。
1 材料与方法
1.1 材料与试剂
脱壳栀子果实采自江西吉安;X-5大孔树脂(比表面积500~600 m2/g;孔径29~30 nm;粒径0.315~1.25 nm;非极性),源叶生物科技有限公司;西红花素-1标准品(纯度>98%)、京尼平苷标准品(纯度>98%),上海阿拉丁生化科技股份有限公司;乙腈(色谱纯),德国Meker公司;无水乙醇、MgSO4、Fe2(SO4)3、NaOH(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
RLGY-600超高压设备,温州诺贝机械有限公司;BJ-200 多功能粉碎机,上海拜杰实业有限公司;UV-1900i型分光光度计,日本岛津公司;普通层析柱(1 cm×20 cm),上海夏美生化科技发展有限公司;FDU-2110冷冻干燥机,上海爱朗仪器有限公司。
1.3 试验方法
1.3.1 栀子黄色素粗提液的制备
原料预处理:将脱壳栀子果实在50 ℃烘箱中干燥至恒重,多功能粉碎机进行研磨,过60目筛,得干燥栀子果实粉末,置于4 ℃黑暗环境下备用。
参照ZHANG等[11]的方法进行栀子黄色素的提取。在前期实验的基础上,准确称取1.00 g栀子干粉,以料液比1∶18(g∶mL)加入50%(体积分数,下同)乙醇溶液,用真空封口机密封在聚乙烯真空袋中,于超高压设备中以100 MPa处理115 s。超高压处理后,收集提取液于离心管中,5 000 r/min离心10 min,收集上清液。将收集的上清液与石油醚于分液漏斗中等体积混合萃取2次,弃上层石油醚层,收集下层色素溶液。然后将下层色素溶液在40 ℃旋转蒸发仪中减压浓缩除去乙醇及石油醚,最终得到栀子黄色素粗提浓缩液。
1.3.2 栀子黄色素的制备
1.3.2.1 泄漏曲线的绘制
大孔树脂预处理:称取一定量的大孔树脂于烧杯中,加入5倍体积的乙醇浸泡过夜。
前期预实验已经对LX-17、XDA-1、ADS-7、ADS-21、AB-8、X-5、XDA-7、HP-20等大孔树脂进行了初步筛选,根据吸附及解吸量的比较,最终选择X-5大孔树脂进行动态吸附实验。准确称取干质量2.00 g的经预处理后的X-5大孔树脂,湿法装入层析柱中,并用超纯水洗涤至流出液无醇味。将1.0 mg/mL的栀子黄色素粗提液,以1 mL/min的上样流速上样,每10 mL流出液收集1管,在440 nm处测定吸光值。根据西红花素-1标准曲线(y=53.28x+0.06,R2=0.99)计算每管流出液中栀子黄色素的含量,绘制栀子黄色素泄漏曲线。
1.3.2.2 上样质量浓度的优化
准确称取干质量2.00 g的树脂,进行湿法装柱。配制上样质量浓度分别为1.50、2.00、2.50、3.00以及3.50 mg/mL的栀子黄色素粗提液,控制上样流速为2.00 mL/min。收集不同上样浓度色素流出液,测定栀子黄色素的含量,吸附率按照公式(1)计算。

(1)
式中:上样量,总的上样栀子黄色素含量,mg;泄漏量,总流出液中栀子黄色素的含量,mg。
1.3.2.3 上样流速的优化
栀子黄色素粗提液上样质量浓度为2.00 mg/mL,控制上样流速分别为1.00、1.50、2.00、2.50以及3.00 mL/min。收集不同上样流速色素流出液,测定栀子黄色素含量,吸附率按照公式(1)计算。
1.3.2.4 洗脱乙醇体积分数的优化
上样质量浓度2.00 mg/mL,上样流速1.50 mL/min,待栀子黄色素吸附完成,分别用250 mL体积分数50%、60%、70%、80%以及90%的乙醇溶液以3.00 mL/min的洗脱流速对栀子黄色素进行洗脱。收集不同体积分数乙醇洗脱液,测定栀子黄色素含量,洗脱率按照公式(2)计算。

(2)
式中:洗脱量,不同体积分数乙醇洗脱的栀子黄色素含量,mg;上样量与泄漏量同公式(1)。
1.3.2.5 洗脱流速的优化
上样质量浓度2.00 mg/mL,上样流速1.50 mL/min,洗脱乙醇体积分数为80%,控制洗脱流速分别为2.00、2.50、3.00、3.50以及4.00 mL/min。收集不同洗脱流速洗脱液,测定栀子黄色素含量,洗脱率按照公式(2)计算。
1.3.2.6 动态洗脱实验
在确定的优化工艺条件下进行栀子黄色素粗提液动态洗脱实验。参照CHEN等[12]的方法,首先采用500 mL的超纯水进行洗脱,再用20%乙醇溶液以2.5 mL/min的流速洗脱京尼平苷,每20 mL收集1管,绘制京尼平苷洗脱曲线。最后用80%乙醇溶液以3.00 mL/min的流速洗脱栀子黄色素,每6 mL收集1管,绘制栀子黄色素洗脱曲线。分别收集20%和80%乙醇洗脱液,在40 ℃下减压浓缩除去乙醇,并于冷冻干燥机中干燥成粉末,于-20 ℃贮藏备用。
1.3.3 色价的测定
参照GB 7912—2010《食品安全国家标准 食品添加剂 栀子黄》进行色价的测定。色价按公式(3)计算:
(3)

1.3.4 紫外-可见光谱分析
栀子黄色素粗提液、栀子黄色素纯化液、西红花素-1标准品以及京尼平苷标准品分别用蒸馏水溶解。然后在200~800 nm进行扫描,分析其光谱特征。
1.3.5 抗氧化能力的测定
1.3.5.1 DPPH自由基清除率的测定
1.3.5.2 铁离子还原能力(ferric reducing antioxidant power,FRAP)的测定
采用Fe3+还原法[14],样品的铁还原能力以Trolox当量(TE)表示,单位为 mg TE/ mL。
1.3.5.3 ABTS阳离子自由基清除率的测定
参考SHANG等[15]的方法进行测定,样品对ABTS阳离子自由基的清除能力以TE表示,单位为 mg TE/mL。
1.3.6 稳定性的测定
1.3.6.1 温度稳定性
将相同质量浓度的栀子黄色素粗提液及纯化液分装于50 mL离心管中,分别置于4、25、50以及75 ℃的环境下,测定在0、1、2、3、4以及5 h的栀子黄色素含量,栀子黄色素损失率按公式(4)计算。

(4)
式中:ODt0,0 h时栀子黄色素的吸光值;ODti,ih时栀子黄色素的吸光值。
1.3.6.2 光照稳定性
将相同质量浓度的栀子黄色素粗提液及纯化液分装于50 mL离心管中,分别置于灯光、紫外光(灯光:15 W,300 lx;紫外光:15 W,40 lx)以及黑暗的环境下,测定在0、1、2、3、4以及5 h的栀子黄色素含量,栀子黄色素损失率按公式(4)计算。
1.3.6.3 金属离子稳定性
栀子黄色素粗提液及纯化液分别用质量分数0.2%的Fe2(SO4)3、MgSO4、CuSO4、ZnSO4和MnSO45种不同溶液稀释至相同质量浓度,测定在0、1、2、3、4以及5 h的栀子黄色素含量,栀子黄色素损失率按公式(4)计算。
1.3.6.4 pH稳定性
栀子黄色素粗提液及纯化液分别用配制好的不同pH的缓冲液(3、5、7、9和11)稀释至相同质量浓度,然后测定在0、1、2、3、4以及5 h的栀子黄色素含量,栀子黄色素损失率按公式(4)计算。
1.4 数据处理与分析
采用SPSS 17.0软件进行统计学分析,P<0.05表示差异显著,所有实验均重复3次,用平均值±标准差表示。
2 结果与分析
2.1 栀子黄色素纯化工艺优化
2.1.1 X-5大孔树脂动态吸附泄漏曲线
泄漏曲线是决定吸附柱操作及动态响应的重要参数。通常,泄漏点(出口溶液的浓度达到进口溶液的大约5%)被认为是大孔树脂吸附达到平衡的点[16]。在泄漏点,树脂无法容纳吸附分子,溶质开始从树脂中泄漏。所以,有必要对大孔树脂进行泄漏曲线的测定,为大孔树脂的用量及栀子黄色素的上样量提供实验依据。如图1所示,栀子黄色素在流出液达到200 mL时开始出现泄漏,当到达600 mL时,流出液的浓度与原上样液中的栀子黄色素浓度接近,表明X-5树脂对栀子黄色素粗提液的吸附已经达到饱和。因此,可以确定栀子黄色素在该条件下的最大上样量不能超过600 mL。
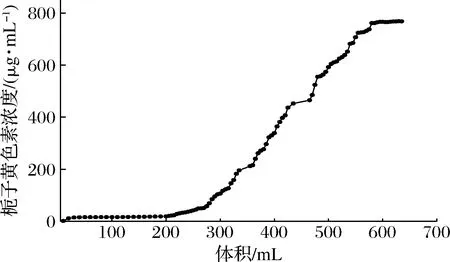
图1 X-5大孔树脂动态吸附泄漏曲线Fig.1 Dynamic adsorption leakage curve of X-5 macroporous resin
2.1.2 动态吸附及解吸条件的优化
为优化栀子黄色素的动态吸附与解吸过程,本研究对上样质量浓度、上样流速、乙醇质量分数和洗脱流速进行了评估。由图2-a可知,X-5大孔树脂对栀子黄色素的吸附率随栀子黄色素质量浓度的增加呈现先增大后减小的趋势。当上样质量浓度为2.00 mg/mL时,吸附率达最大为79.12%。这是因为当栀子黄色素质量浓度较低时,增大栀子黄色素的浓度会增加与西红花素相关活性位点数目,此外还能增加与大孔树脂的接触面积。然而,当栀子黄色素质量浓度进一步增大,会使更多的杂质吸附在X-5大孔树脂上以及导致大孔树脂吸附饱和的提前,因此吸附率会有所下降[17]。上样流速是影响栀子黄色素吸附率的另一个重要因素。由图2-b可以看出,随着上样流速的增大,吸附率逐渐减小。这是因为过高的上样流速导致栀子黄色素还未被大孔树脂吸附便已经泄漏,而较小的上样流速使得栀子黄色素有足够的时间与大孔树脂相互作用[18]。然而,在实际操作过程中,较小的上样流速导致实验周期延长。因此,本实验选择1.50 mL/min的上样流速进行后续的实验。由图2-c可以看出,栀子黄色素的解吸率随乙醇质量分数的增加先增大后减少。当乙醇质量分数为80%,栀子黄色素的解析率最高。随着乙醇质量分数的增大,洗脱剂的极性越弱,而栀子黄色素的极性较小更容易被弱极性的洗脱剂洗脱。如图2-d所示,解吸流速对解吸率有明显影响,在解吸流速为3.00 mL/min时,解吸率最高达97.24%。解吸流速过低会导致解吸时间过长,解吸的杂质增多。而过高的解吸流速会增加解吸溶液的量,增加了后续富集的工作量。

a-栀子黄色素质量浓度对吸附率的影响;b-上样流速对吸附率的影响;c-乙醇质量分数对解吸率的影响;d-洗脱流速对解吸率的影响图2 栀子黄色素动态吸附与解吸工艺优化Fig.2 Optimization of the dynamic adsorption and desorption process of gardenia yellow pigment
2.1.3 动态洗脱曲线
根据先前的实验结果对栀子黄色素进行分离制备,待栀子黄色素吸附平衡,首先用500 mL超纯水以2.00 mL/min的流速洗脱大孔树脂以除去栀子黄色素粗提液中的大部分糖、蛋白质以及其他大分子化合物。然后参考CHEN等[12]的方法,用20%的乙醇以2.50 mL/min的流速洗脱京尼平苷,最后用80%乙醇以3.00 mL/min的流速洗脱栀子黄色素。由图3可知,解吸曲线较尖锐,没有出现拖尾,适用于京尼平苷及栀子黄色素的洗脱。此外,洗脱体积分别为800和200 mL。分别收集20%和80%洗脱液,在40 ℃下旋蒸除去乙醇,再进行冷冻干燥即得到2种粉末产品(图3)。
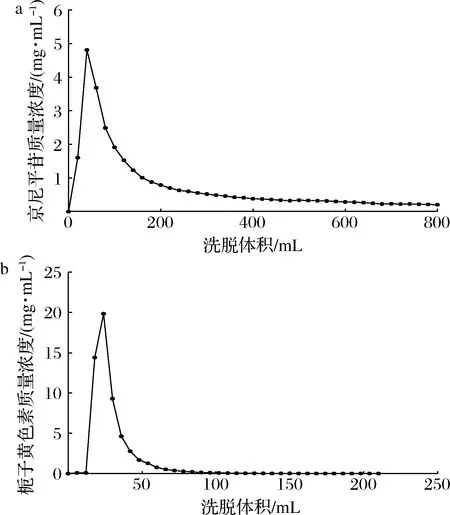
a-京尼平苷;b-西红花素-1图3 京尼平苷和西红花素-1的动态洗脱曲线Fig.3 Dynamic elution curve of geniposide and crocin-1
2.1.4 紫外-可见光谱分析
本研究通过对京尼平苷标准品、西红花素-1标准品以及栀子黄色素粗提物进行200~800 nm的全光谱扫描,确定了栀子黄色素粗提物的主要化合物类型。由图4-a~图4-c可以看出,栀子黄色素粗提物中含有京尼平苷(238 nm)、绿原酸(325 nm)、西红花素-1(440 nm)。由图4-d可以看出,经X-5大孔树脂纯化后,栀子黄色素纯化液中的京尼平苷的吸收峰几乎消失,西红花素-1的相对峰明显增加,结果表明,大部分的京尼平苷杂质被去除。

a-京尼平苷;b-西红花素-1;c-纯化前栀子黄色素;d-纯化后栀子黄色素图4 京尼平苷、西红花素-1、纯化前以及纯化后栀子黄色素的紫外吸收光谱图Fig.4 UV-VIS absorption spectra of geniposide, crocin-1, before purification and after purification of gardenia yellow pigment
2.2 纯化前后栀子黄色素理化特性评价
如表1所示,通过对纯化前后栀子黄色素各项理化指标进行测定发现,在相同质量浓度的栀子黄色素条件下,纯化后的栀子黄色素具有更高的DPPH、ABTS抗氧化能力以及FRAP还原力,这与邹立君[19]的研究结果一致。人体内自由基和生物分子之间的反应可能导致严重的组织损伤或细胞死亡,氧自由基及其衍生物可能通过破坏DNA和细胞膜而破坏细胞。因此,栀子黄色素可作为清除人体多余自由基的营养保健食品原料。纯化后的色价达243.43,较栀子黄色素粗提液提高了4.07倍,说明该纯化工艺对栀子黄色素的分离制备是有效的。

表1 纯化前后栀子黄色素理化指标测定Table 1 Determination of physical and chemical indexes of gardenia yellow pigment before and after purification
2.3 纯化前后栀子黄色素稳定性评价
2.3.1 温度稳定性评价
随着消费者健康意识的提高,植物原料提取的天然着色剂越来越受青睐。西红花素-1是栀子黄色素的主要成分之一,具有高度不饱和结构,这可能会在一定程度上影响其在食品中的加工应用。因此研究栀子黄色素的稳定性很有必要。由图5可知,纯化前与纯化后的栀子黄色素的损失率均随时间的延长及温度的升高而增大,且纯化后的栀子黄色素稳定性均高于未纯化栀子黄色素。纯化前及纯化后的栀子黄色素损失率在5 h,75 ℃条件下达到最高分别为12.31%,8.85%,这表明高温加速栀子黄色素降解。WEBER等[20]报告了类似的研究结果。此外,CARMONA等[21]研究表明在较高温度下,西红花素的糖苷键断裂,葡萄糖分子丢失。因此,栀子黄色素应保存在较低温度环境中,避免与高温接触。

a-纯化前;b-纯化后图5 温度对纯化前与纯化后栀子黄色素损失率的影响Fig.5 Effect of temperature on the loss rate of gardenia yellow pigment before purification and after purification
2.3.2 光照稳定性评价
如图6所示,纯化前与纯化后的栀子黄色素损失率均随光照时间的增加而增大。在相同光照条件下,纯化后栀子黄色素比未纯化栀子黄色素更稳定,这可能是因为栀子黄色素粗提物中的杂质会加速栀子黄色素的损失。此外,相较于灯光及黑暗环境,紫外光照射对栀子黄色素的稳定性影响较大,损失率达5.29%(纯化前)和3.27%(纯化后)。这与ALEHOSSEINI等[22]的研究结果一致。因此,栀子黄色素应避光保存。

a-纯化前;b-纯化后图6 光照对纯化前与纯化后栀子黄色素损失率的影响Fig.6 Effect of illumination on the loss rate of gardenia yellow pigment before purification and after purification
2.3.3 金属离子稳定性评价
从图7中可以看出,Fe3+对栀子黄色素稳定性影响最大,在前1 h内2种栀子黄色素的损失率均达到将近100%。这可能是因为栀子黄色素中的西红花素-1成分的共轭双键结构与Fe3+形成复合物,从而导致栀子黄色素的含量降低[23]。和对照组相比,除Fe3+以外的其他金属离子对栀子黄色素均呈现一定的保护作用,这可能与反应体系中电解质强度有关。因此,在栀子黄色素产品加工与运输过程中应避免与铁制品接触,可以使用安全的塑料制品进行包装。

a-纯化前;b-纯化后图7 金属离子对纯化前和纯化后栀子黄色素损失率的影响Fig.7 Effect of metal ions on the loss rate of gardenia yellow pigment before purification and after purification
2.3.4 pH稳定性评价
图8显示了不同pH处理对栀子黄色素损失率的影响。

a-纯化前;b-纯化后图8 pH对纯化前和纯化后栀子黄色素损失率的影响Fig.8 Effect of pH on the loss rate of gardenia yellow pigment before purification and after purification
栀子黄色素的损失率随处理时间的延长而增大,与纯化前栀子黄色素相比较,纯化后的栀子黄色素表现出更好的稳定性。由图8可以看出,2种栀子黄色素在pH 5~7的环境下,损失率较低,而在偏酸偏碱的环境下,损失率将近10%。酸性环境的损失可能是因为栀子黄色素中的西红花素-1易受亲电试剂H+作用而氧化为饱和烃,色素特征吸收峰向紫外区漂移,发生色移和褪色[24]。碱性环境的损失可能是因为栀子黄色素中西红花素类成分的羟基在碱性环境容易失去氢而导致结构发生改变。
3 结论
本研究采用X-5大孔树脂对栀子黄色素进行分离纯化,考察各因素对栀子黄色素吸附及解吸性能的影响,得到最佳工艺条件为:上样质量浓度2.00 mg/mL、上样流速1.50 mL/min、洗脱乙醇质量分数80%、洗脱流速3.00 mL/min。在此条件下分离纯化,栀子黄色素的色价由48.51提高到243.43。此外,纯化后栀子黄色素具有更高的抗氧化活性。稳定性实验结果表明纯化前后栀子黄色素受高温、紫外光、强酸强碱以及Fe3+的影响均会产生一定的损失。此外,纯化后栀子黄色素稳定性强于纯化前栀子黄色素。因此,栀子黄色素产品应存于低温、中性以及无Fe3+的环境中。后期有必要对栀子黄色素进行包埋研究,以提高该色素的稳定性,增加其应用价值。
