陆源DON亲水和疏水组分对米氏凯伦藻和中肋骨条藻生长及种间竞争的影响❋
2023-02-21马旭红张艳红李克强
马旭红,张艳红,李 敏,李克强
(中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
近年来,随着全球近岸海域富营养化程度的不断加剧,致使有害赤潮频发多发,严重危害海洋生态健康[1-4]。2002—2017年间,中国近海共发生赤潮1 177次, 其中东海区、南海区、渤海区和黄海区分别发生赤潮718、202、133和124次;涉及海域面积161 526 km2,其中东海区、渤海区、黄海区和南海区分别有103 776,34 729,13 302和9 719 km2海域受到影响[5]。近40年间渤海湾赤潮的肇事种主要有夜光藻(Noctilucascintillans)、中肋骨条藻(Skeletonemacostatum)、叉角藻(Ceratiumfurca)、球形棕囊藻(Phaeocystisglobosa)、米氏凯伦藻(Kareniamikimotoi)和红色中缢虫(MesodiniumRubrum)[6]。近20年间福建沿海赤潮主要发生在每年4-7月,高发期为5-6月,主要赤潮种为东海原甲藻(Prorocentrumdonghaiense)、夜光藻(Noctilucascintillans)、中肋骨条藻(S.costatum)、角毛藻(Chaetocerossp.)和米氏凯伦藻(K.mikimotoi),以甲藻类赤潮为主;甲藻类赤潮多为灾害性赤潮,造成直接经济损失最多的是米氏凯伦藻赤潮[7]。2012年在福建沿海发生了以米氏凯伦藻为优势藻种的有毒赤潮,致使大量养殖鲍死亡,直接经济损失累计超过20亿元,这是我国近海赤潮造成经济损失最严重的记录[8-9]。
大量研究表明,人类活动引起的氮、磷负荷增加是导致近海富营养化的主要原因[10-12]。近年来,近岸海域溶解有机氮浓度及其在总氮中的占比逐渐升高,对浮游植物的氮营养贡献愈来愈受到重视[13-16]。DON被认为是细菌、真菌以及浮游植物的潜在氮源[17-18]。传统上,DON被认为是一种难利用的有机氮源,对浮游植物的生物可利用性低,但有些浮游植物(如微小原甲藻、米氏凯伦藻等),在低无机氮环境中能利用DON,从而具有竞争优势[19-20]。有研究表明,约10%~72%的DON可作为浮游植物氮源,直接参与生物氮循环过程,并促进浮游植物生长[15,21-25]。然而由于DON的结构组成极为复杂,其对浮游植物生长影响作用的认知还十分有限[26]。DON的生物可利用性,包括易降解、半易降解和难降解组分,由DON化学结构决定,并受其来源、成分和分子大小的影响[27-29]。例如,一些亲水性低分子量的DON,如尿素、溶解态蛋白质、溶解结合态氨基酸(DCAAs)和溶解游离态氨基酸(DFAAs),可以被许多浮游植物利用,支撑淡水和海洋系统中的大部分浮游植物的生长[30-32],这些DON中基于蛋白质的亲水组分是易被浮游植物利用的氮源[23,33]。
DON的降解利用需要氨基酸氧化酶、亮氨酸氨肽酶、肽酶、胰蛋白酶和糜蛋白酶等多种酶的协作,其中,亮氨酸氨肽酶是研究最多的,它的酶活性可以用来指示DON的利用水平[33-35]。亮氨酸氨肽酶是一种肽链内切酶,可以水解多肽或蛋白质的肽键形成小分子的肽或氨基酸供浮游植物利用,主要以颗粒态而不是游离态或溶解态形式表达[37-39]。
目前,国内外大多数研究主要集中在无机氮或者小分子溶解有机氮(主要是氨基酸和尿素)与浮游植物生长之间的关系,而对于浮游植物与不同组分溶解有机氮之间关系的认知还十分有限,且存在颇多争议。为此,本研究选取我国近海主要赤潮肇事种米氏凯伦藻和中肋骨条藻,以畜禽养殖源有机质为DON氮源,通过单一藻和双藻混合室内受控加富培养实验,从动力学上初步探讨了两种藻对DON亲水和疏水组分的响应。研究结果有助于了解人为来源有机氮对赤潮藻生长及其种间竞争的影响,并可为赤潮的预测和防控提供科学依据。
1 材料与方法
1.1 样品的采集和处理
据第二次全国污染源普查公报,畜禽养殖源是近岸海域陆源污染的主要来源,占农业源总氮排放量约42%[40]。因此本文选择畜禽养殖源作为陆源DON,DON水样获取的具体操作步骤:取鸡粪10 g,溶于1 L的60℃的超纯水,摇动,放置24 h之后再离心15 min(7 000 r·min),之后用0.22 μm的聚碳酸酯滤膜过滤得到。水样中的DON浓度约为7 873 μmol·L-1、NH4-N浓度约为1 841 μmol·L-1、PO4-P 浓度约为452 μmol·L-1(见表1)。陆源DON亲水性和疏水性组分采用XAD-8树脂分离获取,DON回收率约为74%。具体操作步骤:(1)预处理:将300 g树脂用0.1 mol·L-1NaOH溶液浸泡24 h,倾倒上层液体和破碎颗粒,重复3次,然后将树脂用甲醛冲洗3次;(2)前处理:将树脂装入色谱柱中,依次用Milli-Q水,0.1 mol·L-1NaOH溶液和0.1 mol·L-1HCl溶液反复冲洗,这个过程重复到流出液的溶解有机碳浓度低于0.2 mg·L-1方可使用;(3)样品分离:将2 L畜禽养殖源水样用盐酸酸化至pH为2,以1 mL·min-1的流速通过装有XAD-8树脂的色谱柱,流出的水样继续用盐酸酸化至pH为2,接着以流速1 mL·min-1再次通过色谱柱,收集得到亲水组分,接着用2倍柱体积的0.01 mol·L-1HCl溶液冲洗色谱柱,最后用2倍柱体积的0.01 mol·L-1NaOH溶液以流速1 mL·min-1反冲洗色谱柱,收集得到疏水组分,经萃取和洗脱操作,疏水组分浓缩了3.3倍。分离结束后,重复前处理过程回收树脂。经处理后,DON亲水组分和疏水组分水样中的DON浓度分别约为3 848和1 983 μmol·L-1、NH4-N浓度分别约为1 268和181 μmol·L-1、PO4-P 浓度分别约为942和128 μmol·L-1(见表1)。

表1 畜禽养殖源水样各组分营养盐浓度
1.2 培养实验
培养实验所用米氏凯伦藻和中肋骨条藻接种于中国海洋大学海洋化学理论与工程技术教育部重点实验室藻种室,培养实验所用陈化海水取自黄海沙子口临近海域(36°06′N,120°30′E)。将培养实验所用陈化海水使用0.45 μm的醋酸纤维膜过滤除去颗粒物,在将过滤海水在121 ℃下高温高压灭菌30 min除去海水中细菌。
为探究DON的不同组分对米氏凯伦藻和中肋骨条藻生长的影响,分别设置了米氏凯伦藻单一藻培养组、中肋骨条藻单一藻培养组、米氏凯伦藻和中肋骨条藻混合藻培养组。每个培养组又进一步分别设置添加了DON原水组分、DON亲水组分和DON疏水组分,每组设置3个平行。实验采用5 L灭菌锥形瓶进行培养,向各培养体系中都先依次加入3.5 L灭菌海水,之后向各培养体系加入藻种,将100 mL米氏凯伦藻和100 mL中肋骨条藻分别加入相应培养体系,在混合藻培养体系分别加入50 mL米氏凯伦藻和50 mL中肋骨条藻藻种(藻个数比为1∶1)。加入畜禽养殖源相应组分的DON,其中DON原水组、DON亲水组、DON疏水组加入的DON源体积分别为25、50和30 mL。将与畜禽养殖源水样所含等量DIN(NO3-N和NH4-N;国药集团化学试剂有限公司)添加的培养体系作为对照组。此外本文添加了PO4-P(KH2PO4;国药集团化学试剂有限公司),维生素和微量元素(国药集团化学试剂有限公司)。各培养体系最终的培养条件见表2。将锥形瓶摇匀并置于培养箱中,设置光照强度191 μmol·m-2·s-1,光暗比为12 h∶12 h,温度为(20±1)℃。米氏凯伦藻的培养周期为22 d,中肋骨条藻的培养周期为10 d,双藻混合培养周期为10 d,取样频次为2天1次,取样前将培养体系摇匀。取300 mL藻液,将未经过滤的藻液,迅速装入10 mL棕色离心管,放入液氮中冷冻保存,用来测定亮氨酸氨肽酶活性。将剩余取出的藻液经0.7 μm的GF/F玻璃纤维膜(Whatman公司,450 ℃下灼烧4 h)过滤,滤膜用于测定叶绿素和PN,将滤液分别装入多个10 mL的离心管和30 mL棕色瓶中,并将样品置于-20 ℃的冰箱中,用于测定水体的TDN、DIN、TDP、DIP。

表2 培养实验条件
1.3 分析方法
TDN采用总碳/总氮自动分析仪(Multi N/C 3100; Analytik Jena AG, Jena, Germany)高温催化氧化法测定[41]。DIN(NH4-N,NO3-N和NO2-N)使用营养盐自动分析仪(AAⅢ; Bran+Luebe, Norderstedt, Germany)测定。TDN和DON差减得到DON(DON=TDN-DIN;总溶解磷(TDP)和颗粒氮(PN)采用《海洋调查规范》的碱性过硫酸钾氧化法测定。亮氨酸氨肽酶的测定是通过测定亮氨酸氨肽酶对底物L-亮氨酸-7-氨基-甲基香豆素盐酸盐(L-leucine-7-amido-4-methylcoumarin hydrochloride)的水解速率获得,将样品自然解冻,加底物L-亮氨酸-7-氨基-甲基香豆素盐酸盐(浓度为120 μmol·L-1)后放在35 ℃水浴下避光反应2 h,使用Fluorolog3-11荧光分光光度计(Jobin Yvon, France)测定,设定激发波长Ex为380 nm,发射波长Em为440 nm,测定荧光值[42]。叶绿素的含量采用90%的丙酮在低温4 ℃下萃取24 h,离心10 min后取上清液,然后用分光光度法测定吸光度[43]。
1.4 数据处理方法
1.4.1 浮游植物生长拟合方程 通过Origin软件(The Microcal Inc.)拟合浮游植物的生长曲线,选取Slogistic2生长模型拟合浮游植物的终止生物量和最大吸收速率,公式如下[44]:
(1)
式中:Bt为t时刻的生物量(Chla,μg·L-1);Bf为终止生物量(Chla,μg·L-1);B0为初始生物量(Chla,μg·L-1);4μmax/Bf为最大生长速率(d-1)。
1.4.2 浮游植物生长氮吸收拟合方程 浮游植物对氮吸收的动力学方程一般采用Monod方程[45],根据同时考虑浮游植物生长和衰亡过程和整个过程中N守恒,数学模型拟合时以PN代表计算浮游植物生物量,对数学模型方程进行修订[46]。
其中,针对在NO3和NH4条件下的非线性微分方程为:
(2)
(3)
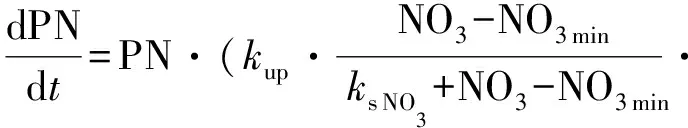

(4)
针对DON和DIN同时吸收条件下的非线性微分方程为:
(5)
(6)
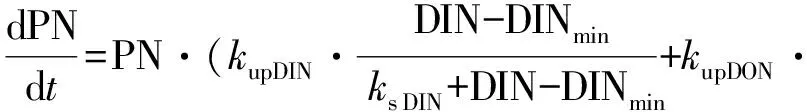

(7)
式中:NO3,NH4,DIN,和DON代表不同氮营养盐的浓度(μmol·L-1);PN:以氮衡量的浮游植物生物量(μmol·L-1);kup:营养盐吸收速率(h-1);ks NO3,ks NH4,ks DIN和ks DON:半饱和常数(μmol·L-1); NH4in:氨氮限制因子;DNmin(NO3min,NH4min,DINmin和 DONmin)为氮的最小浓度阈值(μmol·L-1);kG:浮游植物生长速率(h-1)。
非线性拟合程序应用MATLAB(R2016b,MathWorksR)软件开发,算法采用ode45函数,根据最小二乘法拟合动力学参数。
使用单因素分析法进行显著性检验,显著性水平设置为α=0.05。使用Windows19.0版本的IBM SPSS分析(IBM Corp., Armonk, NY, USA)。
2 结果与讨论
2.1 浮游植物生长
以Chla浓度表征浮游植物生物量,米氏凯伦藻和中肋骨条藻的生长均符合“S”型生长曲线,生长阶段符合Slogistic2生长模型。其中,米氏凯伦藻用了约12天由迟缓期进入指数生长期,约22天到达平台期;而中肋骨条藻仅用了1天就进入指数生长期,4天达到平台期,之后迅速进入死亡。米氏凯伦藻和中肋骨条藻混合藻培养实验中,中肋骨条藻在2天后成为优势种,其生长曲线与中肋骨条藻单一藻培养的生长曲线在趋势上基本一致(见图1)。在DON亲水性组分加富培养下,两种藻的生长曲线均快于DON疏水性组分加富培养,除米氏凯伦藻中DON疏水性加富组外,其他实验组的DON均能显著促进浮游植物生长(见图1)。

(红色线是添加DON亲水组分; 黑色线是添加DON原水组分; 蓝色线是添加DON疏水组分; 紫色线是对照组。Red lines are add to hydrophilic components; Black lines are add to terrestrial aquaculture source; Blue lines are add to hydrophobic components; Purple lines are control groups.)
本研究中中肋骨条藻(S.costatum)各实验组的终止生物量和最大生长速率均大于米氏凯伦藻(K.mikimotoi)各实验组的终止生物量和最大生长速率(见表3)。添加亲水DON实验组比添加疏水DON实验组更能促进浮游植物的生长,表现在米氏凯伦藻添加亲水DON实验组的终止生物量((115.38±11.09)μg·L-1)和最大生长速率((0.52±0.066)d-1)均大于添加疏水DON实验组的终止生物量((87.65±6.18)μg·L-1)和最大生长速率((0.50±0.023)d-1);中肋骨条藻添加亲水DON实验组的终止生物量((192.92±6.50)μg·L-1)和最大生长速率((2.34±0.18)d-1)均大于添加疏水DON实验组的终止生物量((149.08±5.36)μg·L-1)和最大生长速率((2.20±0.17)d-1)(见表3)。有研究表明,来自湖泊沉积物[47-49]和污水处理厂出水口DON[50-51]的亲水组分能被浮游植物吸收利用,刺激浮游植物的生长,而污水处理厂排放废水中的DON疏水性组分,即使在细菌存在的情况下,在数周内也不能被浮游植物利用[52]。但也有研究表明,并不是所有的DON疏水性组分都不能被利用,如来自农场及农田附近的DON疏水性组分有较高生物可利用性,可以被浮游植物吸收利用并促进浮游植物的生长[53]。

表3 DON不同组分加富培养下,米氏凯伦藻和中肋骨条藻的生长动力学参数
2.2 营养盐吸收过程
在浮游植物生长期间,米氏凯伦藻和中肋骨条藻各DON加富实验组的氮营养盐浓度都发生变化,其中NH4-N、NO3-N和DON的浓度下降,PN的浓度会随着浮游植物的生长逐渐积累增加,与叶绿素的变化趋势一致(见图2)。结果显示,中肋骨条藻单独培养下,NH4-N、NO3-N和DON浓度的消耗均快于米氏凯伦藻单独培养下的(见图2)。这与吸收动力学拟合结果一致,即中肋骨条藻对各形态氮的最大吸收速率均大于(p<0.05,α=0.05)米氏凯伦藻的,同时也显示中肋骨条藻对各形态氮吸收的最小浓度阈值和半饱和常数均低于(p<0.05,α=0.05)米氏凯伦藻的(见表4)。有研究表明中肋骨条藻对各种形态氮均有较好的吸收利用能力,包括硝氮、铵氨等无机态氮,尿素、丙氨酸等有机态氮,且在复合氮源条件下,中肋骨条藻的生长状况比单一氮源时更好,适合在高氮环境下生长,近岸海域丰富的有机氮以及较高的氮浓度可能是其爆发性生长引发赤潮的重要原因[54-55]。也有其他研究表明中肋骨条藻对DON有很高的亲和力而且能利用大部分的DON[56]。而米氏凯伦藻对有机氮的利用具有选择性,研究发现米氏凯伦藻能以尿素作为唯一氮源生长,并且米氏凯伦藻对尿素的吸收利用能力要优于对NH4-N和NO3-N的吸收利用[57-58]。Li等利用15N示踪技术进行的现场实验表明甘氨酸能被米氏凯伦藻吸收利用,但米氏凯伦藻对甘氨酸的亲和力要低于对尿素的亲和力[59]。也有一些实验室研究认为米氏凯伦藻不能利用游离氨基酸,如研究发现,米氏凯伦藻不能以甘氨酸、丙氨酸、苏氨酸、1,4-丁二胺盐酸盐这几种有机氮源生长[60-61],更有研究认为高浓度的氨基酸会抑制米氏凯伦藻的生长[57]。而且发现在低营养盐条件下,甲藻生长得比中肋骨条藻好,而在营养盐丰富的条件下,中肋骨条藻又会在竞争中处于优势地位[62-64]。这与本研究中混合藻培养中肋骨条藻能竞争成为优势种的结果一致。

表4 添加畜禽养殖源的不同组分溶解有机氮条件下米氏凯伦藻的氮吸收动力学参数
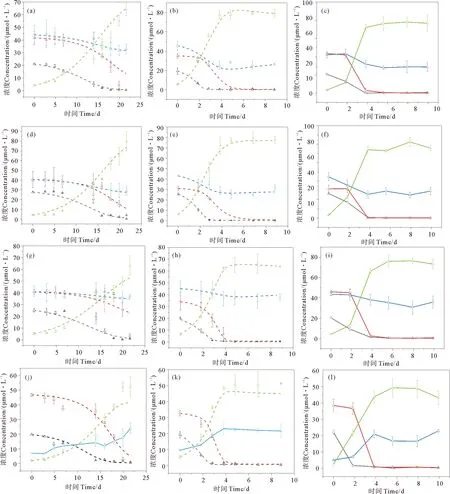
(红色线是硝氮,黑色线是氨氮,蓝色线是溶解有机氮,绿色线是颗粒氮。a、b、c是添加DON原水组分,d、e、f是添加DON亲水组分,g、h、i是添加DON疏水组分,j、k、l是对照组。Red lines are NO3-N;Black lines are NH4-N;Blue lines are DON;Green lines are PN.a、b、c are add to Terrestrial aquaculture source;d、e、f are add to Hydrophilic components;g、h、i are add to Hydrophobic components;j、k、l are Control groups.)
本研究结果显示中肋骨条藻和米氏凯伦藻对亲水DON的吸收都大于对疏水DON的吸收,表现在米氏凯伦藻亲水DON组、疏水DON组的DON浓度分别下降了27.19和21.08 μmol·L-1,中肋骨条藻亲水DON组、疏水DON组的DON浓度分别下降了30.2和22.02 μmol·L-1,吸收动力学结果显示(见表5),米氏凯伦藻和中肋骨条藻对亲水DON的吸收速率大于对疏水DON的吸收速率,对亲水DON吸收的半饱和常数也低于疏水DON的。本研究无法避免培养体系中DIN的存在,但是不影响不同组分DON对浮游植物生长影响的认识,疏水组分较亲水组分来说,利用率相对较低,但是疏水组分中的部分DON也可以促进浮游植物的生长。在自然系统中,疏水DON不能被浮游植物直接吸收快速利用,但可能在更长的时间尺度上对浮游植物的生长起作用,通过酶的降解,可保证DON在水生生态系统中的有效循环[64]。目前我国对DON的检测并未列入常规检测项目,对于DON中的重要组成部分的具有生物可利用性的尿素和氨基酸也未列入检测项目。有必要将DON做监控,以提高赤潮预警预报的准确性,其次,从根源上减少陆源DON的输入,从而减少赤潮的爆发。

表5 添加畜禽养殖源的不同组分溶解有机氮条件下中肋骨条藻的氮吸收动力学参数
2.3 亮氨酸氨肽酶(LAP)活性
虽然本实验浮游植物表面会存有细菌,但是在一些实地研究中发现,浮游植物而非细菌对LAP活性的贡献很大[65-66]。其中Stoecker D K等[67]研究了非无菌条件下几种甲藻的亮氨酸氨肽酶活性,发现60%~99%的LAP活性(亮氨酸氨肽酶活性)存在于>5 μm的部分,表明LAP活性与甲藻有关,而不是与细菌有关。同时,Ou等[68]的研究也表明大约60%~70%的LAP活性与大于5 μm的浮游植物有关。因此本文认为培养体系中的亮氨酸氨肽酶主要是浮游植物产生的。
图3为添加了陆源DON不同组分的各个培养体系中LAP酶活性实验结果。在米氏凯伦藻培养体系中,不同实验组的酶活性随着时间先升高后降低,各实验组的酶活性均在约第5天达到最大值,在培养实验后期,由于体系内无机氮盐的耗尽和米氏凯伦藻分泌的DON,酶活性在第15天开始升高,并且在18天左右达到最大值。在中肋骨条藻培养体系内,不同实验组酶活性随着时间先升高后降低,各实验组的酶活性均在约第4天达到最大值。在双藻混合培养体系内,不同实验组的酶活性随着时间先升高后降低,各实验组的酶活性均在约第2天达到最大值。比较酶活性显示,米氏凯伦藻组的酶活性大于(p<0.05,α=0.05)中肋骨条藻组见表6,说明米氏凯伦藻主要通过胞外酶来利用DON,其通过胞外酶降解DON的能力强于中肋骨条藻。但米氏凯伦藻生长速率低于中肋骨条藻,又说明在吸收DON或其降解产生的DON的能力上低于中肋骨条藻,这从其较低的吸收速率上可以看出。同样,添加疏水性DON培养组的酶活性均大于(p<0.05,α=0.05)添加亲水性DON组的见表6,说明浮游植物对疏水性DON的吸收利用需要通过胞外酶降解,而亲水性DON则可以直接被吸收利用,这与亲水性DON对浮游植物的促进作用大于疏水性DON的结果一致。此外,浮游植物在分泌胞外酶的过程中,也会消耗物质和能量,从而导致对生长供应的不足。而且,一旦浮游植物将酶释放到水体中,失去细胞的保护,在物理、化学等作用下更容易失活[64]。

(红色线是添加DON亲水组分,黑色线是添加DON原水组分,蓝色线添加DON疏水组分,绿色线是对照组。Red lines are add to Hydrophilic components; Black lines are add to Terrestrial aquaculture source; Blue lines are add to Hydrophobic components; Green lines are Control groups.)

表6 添加了畜禽养殖源不同组分条件下米氏凯伦藻和中肋骨条藻培养体系亮氨酸氨肽酶酶活性最大值
3 结论
本文采用一次性营养盐加富培养实验研究畜禽养殖源DON及其不同组分对中肋骨条藻和米氏凯伦藻生长的影响,主要结果如下:
(1)畜禽养殖源DON对中肋骨条藻生长的促进作用大于对米氏凯伦藻的,双藻混合培养时,中肋骨条藻会竞争成为优势种,体现在中肋骨条藻的最大生长速率、终止生物量和氮营养盐吸收速率常数均大于米氏凯伦藻,同时半饱和常数和亮氨酸氨肽酶活性小于米氏凯伦藻。
(2)畜禽养殖源DON的亲水组分比疏水组分更能促进浮游植物的生长,体现在中肋骨条藻和米氏凯伦藻亲水DON组的终止生物量和最大生长速率、最大吸收速率大于疏水DON组的,同时疏水DON组的酶活性大于亲水DON组的。
