CTCs和CTMs在局部晚期鼻咽癌预后判断中的临床应用
2023-02-20蒋婷婷李和沛王丹李燕雏
蒋婷婷 李和沛 王丹 李燕雏
(四川大学华西医院 1.液体活检和单细胞实验室;2.头颈肿瘤科;3.肿瘤放疗科,四川 成都 610041)
目前,临床常用的肿瘤标志物和影像学检查难以发现早期肿瘤,而且不能准确动态监测病情发展,可能导致患者错过最佳治疗时机。液体活检作为肿瘤早诊、随访及预后判断中的重要新型手段日渐成熟,当肿瘤细胞从实体肿瘤的原发灶或转移灶中脱落后进入外周循环系统后即可形成单个的循环肿瘤细胞(Circulating tumor cells,CTCs)或循环肿瘤癌栓(Circulating tumor microembolis,CTMs)。其中,循环肿瘤癌栓更有利于细胞之间的生物信息传递,更容易在血流剪切压力下存活,导致恶性肿瘤复发或远处转移的风险更高[1-2]。“CTCs和CTMs”作为液体活检最重要指标之一,其动态监测广泛应用于肿瘤的早期筛查、诊断分期、疗效评价、预后评估以及患者的个体化治疗等方面,已在乳腺癌、前列腺癌、胃癌、肺癌等多种实体肿瘤中得到证实[3-7]。临床研究发现,鼻咽癌患者外周血中的CTCs数目可提示鼻咽癌的病情进展程度,动态监测CTCs的变化可对化疗的疗效进行及时有效的评估,CTCs不同亚型与化疗敏感性和耐药性相关[8-9]。另外,研究[10]也发现CTCs数量与血浆EBV-DNA表达量呈正相关。但目前关于联合检测CTCs和CTMs在局部晚期鼻咽癌患者中的临床意义尚不清楚,本文探讨CTCs和CTMs在局部晚期鼻咽癌患者诊疗中的变化情况,为局部晚期鼻咽癌临床预后判断提供参考。
1 资料与方法
1.1 一般资料 纳入四川大学华西医院自2018年6月~2021年1月收治的38 例局部晚期鼻咽癌患者。其中男28 例,女10 例,中位年龄44.1岁,平均(48.56±0.51)岁。病理分期和TNM分期参照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版,其中纳入Ⅲ期患者11例,Ⅳ期患者27例。纳入标准:①经病理确诊为局部晚期鼻咽癌。②既往无肿瘤病史,且无放化疗治疗史。③无血管、严重心脏、肾脏等疾病。④血常规及血生化参数在正常参考值范围内。⑤ECOG评分0~1 分。本研究已获四川大学华西医院伦理委员会批准[伦理编号为:2015年审(141)号],且所有受试者均自愿签订知情同意书。
1.2 方法 38例局部晚期鼻咽癌患者,首先接受了0~4周期诱导化疗,具体方案为:吉西他滨+顺铂或多西紫杉醇+顺铂+氟尿嘧啶。随后进行适型调强放射治疗(Intensity Modulated Radiotherapy,IMRT),放疗期间根据患者个体差异情况给予同步化疗(Concurrent chemoradiotherapy,CRT),同步周期为0~3周期,使用单药顺铂或尼妥珠单抗进行同步治疗。
1.3 疗效评价 治疗效果评价标准根据实体瘤疗效评价标准RECIST 1.1(Response Evaluation Criteria in Solid Tumors,version 1.1)。完全缓解(Complete Response,CR):肿瘤病灶完全消失。部分缓解(Partial Response,PR):肿瘤病灶直径之和比基线水平减少30%以上。疾病进展(Progressive Disease,PD):肿瘤病灶直径之和相对增加20%以上,直径之和的绝对值增加5 mm以上,出现1 个或多个新病灶。疾病稳定(Stable Disease,SD):肿瘤病灶增加程度介于PR与PD两者之间。疾病控制(Disease Control,DC):治疗有效指疾病完全缓解、部分缓解和疾病稳定,即治疗有效为:CR+PR+SD。治疗无效为PD。CTCs疗效评价标准:治疗有效指治疗后外周血中CTCs数量下降≥1/5治疗前的CTCs数量,治疗无效指治疗后外周血中CTCs数量升高或不变>1/5治疗前的CTCs数量[11]。
1.4 外周血CTCs/CTMs检测方法 入组患者在治疗前、诱导化疗结束后1周和调强放射治疗结束1月及1年后四个时间点分别采集患者肘静脉血6 mL用于CTCs及CTMs检测,置于含有ACD的抗凝真空管中(Becton,Dickinson and Company,NJ,USA),避光低温保存,于24 h内检测,检测操作过程均严格按照试剂盒说明书进行。检测试剂盒购于赛特生物医药科技有限公司,其试剂盒具体包括SE-CTC试剂盒(Cytointelligen,SanDiego,CA,USA)和iFISH 试剂盒(Cytointelligen,SanDiego,CA,USA)。SE-CTC试剂盒用于分离富集外周血中的CTCs和CTMs,iFISH 试剂盒用于鉴定判别分类CTCs和CTMs。上述实验操作完成后在自动扫描平台上进行自动扫描。CTCs的判读标准:PD-L1+/CD31-/CD45-/DAPI+/CEP8≥2或者PD-L1-/ CD31-/CD45-/DAPI+/CEP8≥2;CTMs 的判读标准:单个循环肿瘤细胞数量≥2个的CTCs 聚集成的细胞团[8,12]。在CTCs和CTMs采血的各个时间点同时检测血浆 EBV-DNA 水平。
1.5 随访 截止2021年8月1日,入组患者在治疗结束后,门诊或电话定期随访,治疗结束后半年内每个月随访一次,1~3 年内每三个月随访一次,3~5 年内每半年随访一次,5年后每年随访一次。随访终点为疾病出现进展或死亡。
1.6 统计学分析 采用IBM SPSS 26.0版本对数据进行分析,计量资料采用最小值、最大值、中位数及均数进行描述,计数资料之间的相关分析采用卡方检验,等级资料采用Spearman相关系数分析,定量资料之间的比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 局部晚期鼻咽癌患者基线CTCs和CTMs数目与病理特征的关系 38例初治局部晚期鼻咽癌患者外周血中检出CTCs和CTMs细胞,见图1,CTCs和CTMs的计数基线与患者的临床病理特征的关系,见表1。基线分析可见,CTCs和CTMs的阳性检出率与鼻咽癌患者的性别、年龄、ECOG评分和TNM分期均无关(P>0.05)。病理分期为Ⅲ期和Ⅳ期患者的外周血中CTCs阳性检出率Ⅳ期比Ⅲ期患者高18.2%。患者外周血中血浆EBV-DNA水平范围为0.0~44700.0 copies/mL。采用Spearman相关系数分析CTCs和CTMs与EBV-DNA水平的相关性显示,局部晚期鼻咽癌患者与血浆EBV-DNA 表达水平均无相关性(P>0.05)。值得关注的是,纳入38例患者中,其中有5例患者EBV-DNA表达水平阴性,但这5例患者的外周血中均发现了CTCs,其中1 例患者外周血中还发现了CTMs,提示CTCs和CTMs可能在外周血中的检测灵敏度更高。
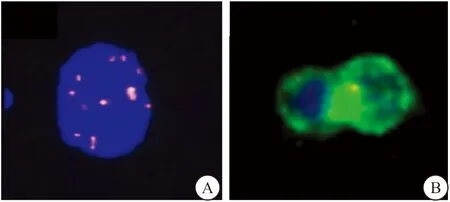
图1 CTCs和CTMs细胞Figure 1 CTCs and CTMs cells注:A.EpCAM-/CD45-/DAPI+/8号染色体≥5体的CTC;B.由两个EpCAM+的CTC组成的CTM
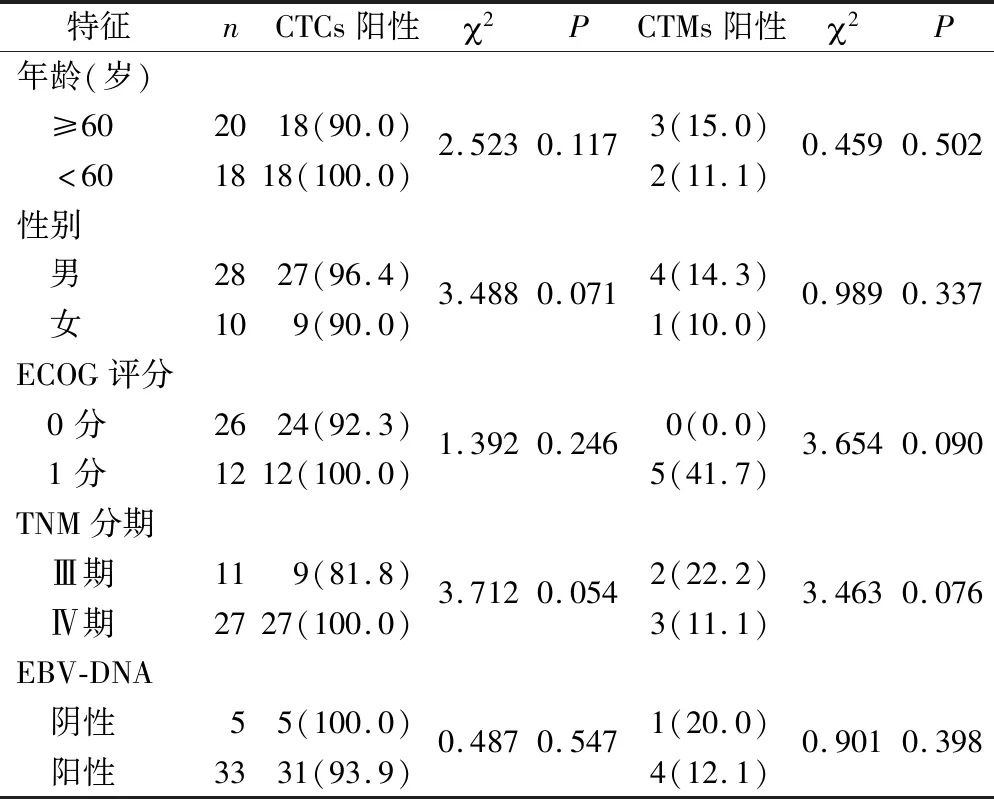
表1 局部晚期鼻咽癌患者基线CTCs和CTMs数目与临床病理特征的关系[n(×10-2)]Table 1 The relationship between the number of baseline CTCs/CTMs and clinicopathological characteristic in patients with locally advanced nasopharyngeal carcinoma
2.2 局部晚期鼻咽癌患者CTCs和CTMs基线数目与放疗靶区参数的相关性 纳入患者在治疗前CTCs基线数目检出的范围为0~21 个,治疗前CTMs基线数目检出的范围为0~4 个。36例CTCs阳性患者中,肿瘤原发灶靶区(GTVnx)范围为(52.07±30.14) cm3,淋巴结靶区(GTVnd)范围为(30.95±19.94) cm3,大体肿瘤体积(GTV)范围为(64.90±42.45) cm3;2例CTCs阳性患者中,GTVnx范围为(47.31±26.74) cm3,GTVnd范围为(13.82±8.16) cm3,GTV范围为(63.37±27.17) cm3。采用Spearman相关系数分析结果显示,入组患者治疗前CTCs数目与GTVnx、GTVnd及GTV均无相关性(P=0.478,P=0.647,P=0.077)。同样,CTMs与GTVnx、GTVnd及GTV均无相关性(P=0.254,P=0.687,P=0.082)。
2.3 局部晚期鼻咽癌患者外周血中CTCs和CTMs与治疗效果的关系 对在纳入患者中20例进行了治疗前、诱导化疗结束后1周和调强放射治疗结束1月及1年后进行了四个采血时间点的动态监测。分析20 例患者外周血中CTCs动态变化情况,按照CTCs评价标准判定,16 例有效,4 例无效。CTCs数目在四个时间点的数目分别为:(9.7±10.3)个、(5.40±6.4)个、(2.3±7.1)个和(1.5±3.4)个,经过治疗后CTCs总数较治疗前明显降低(P=0.0241)。进一步分析,CTMs数目四个时间点的数目分别为:(2.5±2.1) 个、(2.4±1.5)个、(0±3.1)个和(0±0.9)个,经过治疗后CTMs较治疗前降低(P=0.431)。②按照RECIST 1.1标准,上述20 例患者中,17 例患者治疗后DCR率为85.0%(17/20),PD率为15.0%(3/20)。CR、PR或SD患者CTCs数目在治疗前为(9.8±5.7)个,治疗后下降为(2.4±6.2)个;CTMs数目在治疗前为(2.9±1.2)个,治疗后下降至(1.4±0.2)个。另外,3例PD患者CTCs数目在治疗前为(14.2±3.9)个,治疗后降为(3.7±4.2)个;CTMs数目在治疗前为(2.9±1.2)个,治疗后下降至(1.4±2.2)个。结果提示,局部晚期鼻咽癌患者外周血中CTCs和CTMs数目的动态变化情况与治疗后的疗效密切相关,PD患者治疗后的CTCs和CTMs数目更高,治疗效果更差。③采用Fisher检验比较CTCs评价标准和RECIST 1.1评价标准,两种疗效评价方式差异无统计学意义(2=3.821,P=0.557)。局部晚期鼻咽癌患者CTCs数目与治疗效果的关系,见表2。
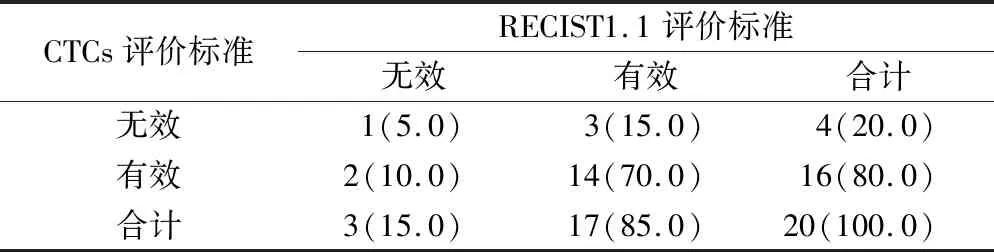
表2 局部晚期鼻咽癌患者基线CTCs数目与治疗效果的关系[n(×10-2)]Table 2 The relationship between baseline CTCs number and treatment effect in patients with locally advanced nasopharyngeal carcinoma
2.4 局部晚期鼻咽癌患者外周血中CTCs各亚型在治疗过程中的分布情况 分析动态监测的20例患者在治疗过程中CTCs各个亚型变化的情况(见图2)。三倍体CTCs四个时间点的检出百分比分别为:75.9%、59.3%、41.3%和5.7%;四倍体CTCs在四个时间点的检出百分比分别为:68.1%、30.3%、20.1%和18.6%;≥五倍体CTCs在四个时间点的检出百分比分别为:43.0%、37.0%、20.6%和20.5%。随访患者CTCs从治疗前到治疗后动态变化情况可见,三倍体、四倍体和≥五倍体CTCs分别下降了70.2%、49.5%和22.5%。经治患者中,三倍体CTCs对化疗或者放疗更为敏感,而≥五倍体的CTCs可能和耐药相关,具体机制需要进一步验证。
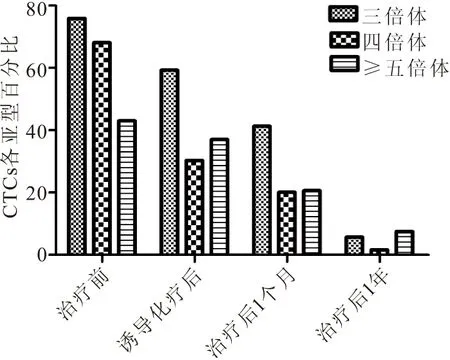
图2 患者外周血中CTCs亚型分布情况统计图(n=20)Figure 2 Distribution of CTCs subtypes in patients 注:CTCs各亚型百分比计算方式为:各亚型个数/CTCs总数×100%
进一步分析发现,2例患者在治疗前检出表达PD-L1阳性CTCs,且均为病情进展(PD)患者。对其分型发现,1例患者血液样本中,有一个三倍体CTC细胞表达PD-L1阳性;1 例患者有一个≥五倍体CTCs细胞表达PD-L1阳性。上述结果提示,外周血中出现表达PD-L1阳性CTCs提示预后不良。
3 讨论
鼻咽癌常见于中国南方和东南亚等地区,发病与环境、地理位置、遗传因素、EB病毒等因素有关[13-14]。据统计,仅不足1/3鼻咽癌患者可在早期确诊,约2/3患者确诊已是局部晚期。局部复发、局部未控和远处转移是导致鼻咽癌患者死亡的主要原因。目前,常规鼻咽癌的诊断及随访主要依赖于病理组织、血清肿瘤标志物和医学影像等检查。CTCs/CTMs作为一种新型、敏感监测指标有助肿瘤的早期诊断、实时动态检测、判断疗效和预后评估。
外周血中CTCs和CTMs是实体瘤的“液体活检”的重要组成,具有取材方便、多次反复取材和无创伤等优点[15-17]。既往循环肿瘤细胞在鼻咽癌的研究主要集中于外周血中CTCs 的阳性率与TNM分期间的相关性,Zhang等[8]报道,CTCs阳性检出率与TNM分期无显著相关性;He等[18]在纳入的33 例鼻咽癌研究中发现CTCs 计数与肿瘤负荷成正相关性。本研究发现,在入组的38 例局部晚期的鼻咽癌患者中,Ⅲ期和Ⅳ期患者CTCs阳性检出率分别高达81.8%以上,Ⅳ期患者比Ⅲ期患者CTCs阳性检出率高18.2%,提示肿瘤分期越晚,CTCs计数越高,肿瘤的负荷也越大。另外,本文进一步分析纳入的38 例治疗前局部晚期鼻咽癌患者CTCs阳性检出率与放疗靶区参数的相关性,发现入组患者治疗前CTCs和CTMs数目与GTVnx、GTVnd及GTV均无相关性。虽然以上述分析均为阴性结果,但CTCs阳性的局部晚期鼻咽癌患者治疗前勾画的GTV范围均比CTCs阴性的患者勾画的范围更广,提示临床医生可参考CTCs检出情况来进一步作出精准的范围选择。
Si等[19]研究发现,鼻咽癌患者治疗中CR或PR患者,外周血中的CTCs数目明显降低。本研究不仅分析20 例局部晚期鼻咽癌患者在治疗过程中外周血CTCs和CTMs数目的动态变化,更进一步分析了CTCs的各个亚型变化情况。患者经过治疗后,发现局部晚期鼻咽癌患者外周血中CTCs和CTMs数目的动态变化情况与治疗后的疗效密切相关,与CR、PR或SD组患者相比较,3 例PD患者治疗后的CTCs和CTMs检出率更高,治疗效果更差。上述结果提示,PD患者治疗后CTCs患者更容易产生耐药,治疗结束后更应该加强随访,防止肿瘤的复发和进一步转移。不同的亚型的CTCs具有不同的临床意义,不同亚型在不同肿瘤中具有明显异质性[20-24]。本研究发现,三倍体、四倍体及≥五倍体CTCs从治疗前到治疗后逐步下降,各亚型CTCs数目下降从高到低依次分别是三倍体CTCs、四倍体CTCs和≥五倍体CTCs。上述结果提示,≥五倍体的CTCs在治疗过程中可能存在耐药。进一步可见,本研究中表达PD-L1 CTCs的两例患者均出现病情进展,提示CTCs中表达PD-L1可能是预后不良因素之一。有研究显示,鼻咽癌病理组织中PD-L1阳性率高可95%,癌巢周围有大量的浸润性T淋巴细胞,因此,针对PD-L1靶点的PD-1抗体联合化疗治疗鼻咽癌的临床试验发现,卡瑞利珠单抗单药用于PD-L1表达阳性的鼻咽癌患者具有较高的抗肿瘤活性且安全性可控。提示局部晚期鼻咽癌联合应用PD-1单抗类抗肿瘤药物具有可期的疗效。
4 结论
CTCs和CTMs在局部晚期鼻咽癌病程及治疗过程中均有较高的检出率,并表现出显著差异,因此CTCs和CTMs可以用于局部晚期鼻咽癌动态监测、评估疗效及指导预后判断,将可根据检测结果制定精准化的治疗方案,及早采取对应的临床干预措施。
