建立“两步法”的化学平衡常数计算模型
2023-02-20张莹草
张莹草
(浙江省春晖中学 312300)
1 引言
人教版化学选修1《化学反应原理》中关于化学平衡的内容是高中化学学科内容中的核心概念之一,也是化学教学过程中最难的主题之一.化学平衡在宏观上是静态的,但是在微观上是动态的,它的概念较为抽象、复杂,给学生的认识和学习造成了很大的障碍.其中,化学平衡常数的计算更是难上加难,近几年在高考中融入以速率、平衡为中心的原理综合题中,使得较多学生对其望而却步,直接放弃计算.
同时,笔者发现考题中关于平衡常数的计算常有涉及Kc、Kp、K⊖等形式,而现行教材中却只介绍了较为简单的浓度平衡常数Kc的计算,致使学生在认识上产生盲区、在理解上产生偏差、在解题上产生恐惧.因此,本文对常见的三种化学平衡常数进行了分类介绍,以学习进阶的形式探究平衡常数的计算技巧,利用“两步法”建立计算模型,帮助学生理清思路、克服计算恐惧.
2 化学平衡常数的分类
2.1 浓度平衡常数Kc

2.2 压强平衡常数Kp
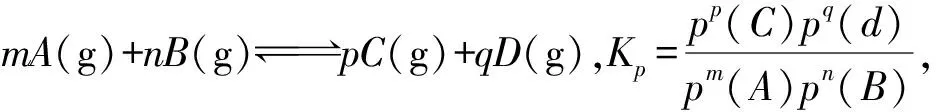
2.3 标准平衡常数K⊖
在化学平衡体系中,用各物质的相对浓度或相对分压替代浓度计算的平衡常数叫标准平衡常数,用K⊖表示.标准平衡常数是根据标准热力学函数计算得到的平衡常数,又称热力学平衡常数,在热力学中最为常用.根据反应体系中各物质存在形式的不同,可将化学反应分为溶液反应、气相反应和混合反应,对应标准平衡常数的表示方法也略有不同.
2.3.1 溶液反应中的标准平衡常数

2.3.2 气相反应中的标准平衡常数

2.3.3 混合反应中的标准平衡常数

3 化学平衡常数的计算
3.1 Kp的计算技巧
3.1.1 直接根据分压强计算压强平衡常数

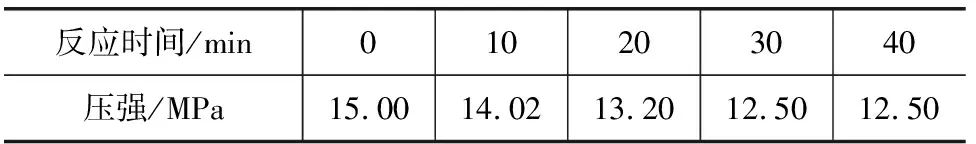
表1

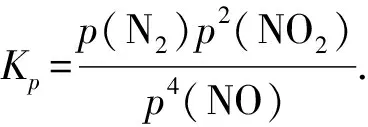
第一步:利用差量法求得,p(N2)=Δp=15.00MPa-12.50MPa=2.50 MPa,则p(NO2)=2p(N2)=5.00 MPa,p(NO)=15.00MPa-2.50MPa×4=5.00 MPa.
第二步:代入上式,求得Kp=0.1(MPa)-1.
3.1.2利用变式计算压强平衡常数

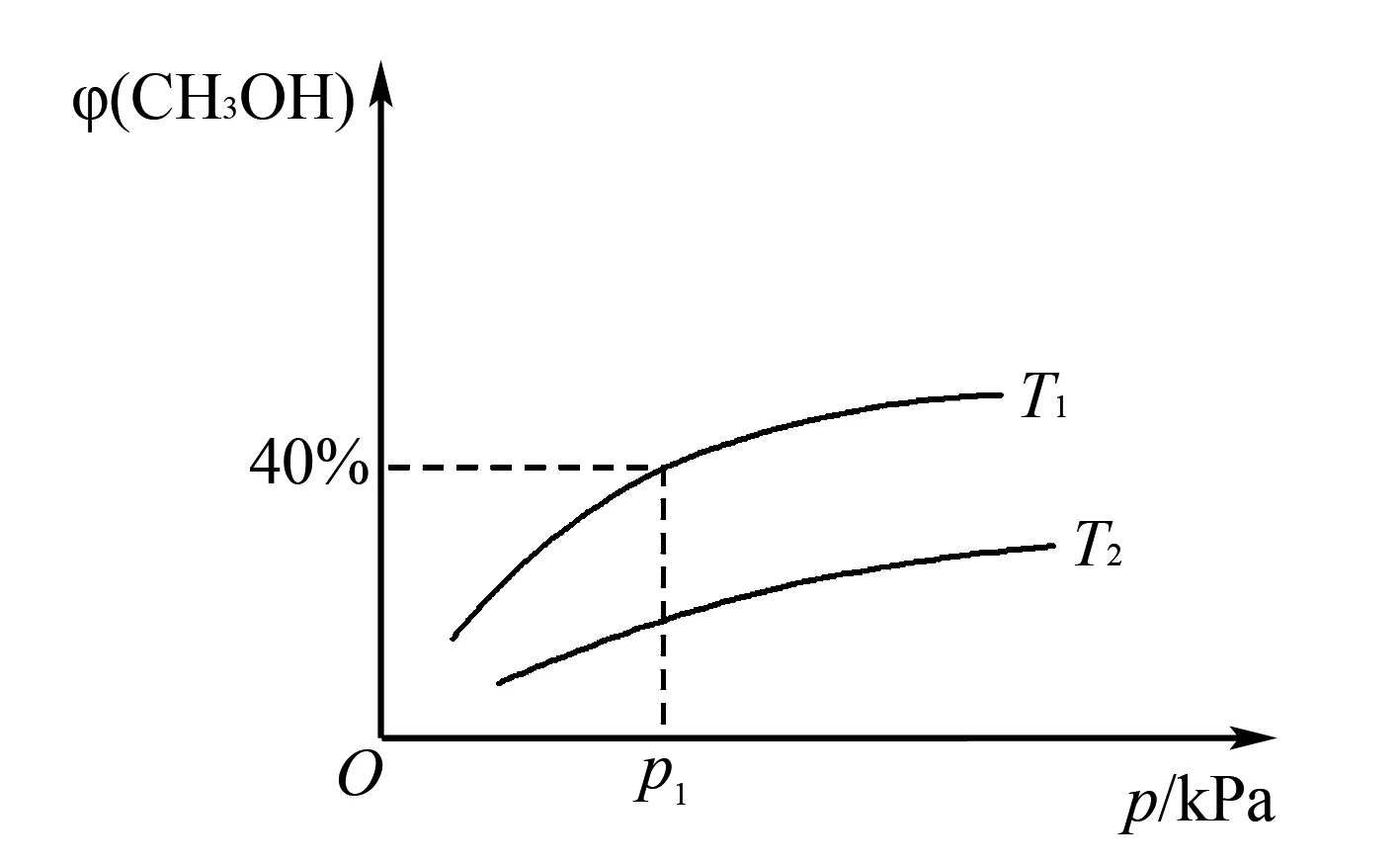
图1
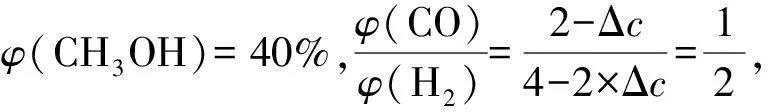
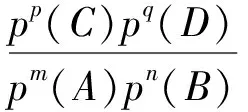

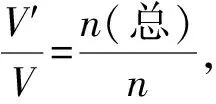
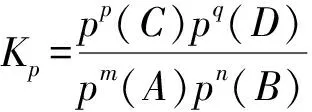
结论关于Kp的计算,首先分析题给信息,再选择以下三个计算式代入计算,有助于学生明晰计算思路,化简计算过程.
直接根据分压强计算压强平衡常数:
利用变式计算压强平衡常数:
①
②
3.2 Kc、K⊖的计算技巧
由Kp的计算得到提示,Kc、K⊖(气相)也可统一变式为关于n的计算式:
③
④
由此发现,Kc、Kp、K⊖的计算可简化为同一含n的模板,运用时仅需稍许的变动便能相互转化.该模板将三个计算难点串联了起来,大大减轻了学生的记忆量,避免学生出现记忆混乱,且以建模的方式将难题变成了简单题,体现了“证据推理与模型认知”的化学核心素养.
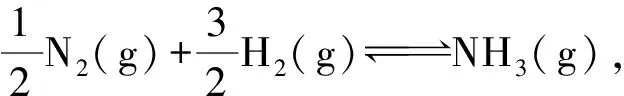
解析第一步:设N2和H2起始物质的量分别为n、3n,求得平衡时N2、H2、NH3的物质的量分别为(1-ω)n、3(1-ω)n、2ωn,n总=(4-2ω)n,p总=p⊖.
第二步:将数据代入变式④,可得
平衡常数的计算是高中化学教学的重难点,考察角度灵活,但也有规律技巧可以借鉴.本文以不同层次、不同难度的题目为学习进阶的载体,探究“两步法”计算模型,引导学生读懂数据、发现规律、处理数据,符合学生科学认知发展规律,有效提高学生迁移理解能力、定量分析能力,帮助学生攻克平衡常数计算难题.
