全营养素联合放化疗治疗局部晚期直肠癌的效果及其对免疫功能的影响
2023-02-19张莹陈名涛陈军梅
张莹,陈名涛,陈军梅
肠道所处的部位较特殊,肠道肿瘤患者常伴有不同程度的营养不良[1]。研究表明,对恶性肿瘤患者实施静脉营养支持,可能会促进肿瘤细胞的增殖[2]。但营养支持治疗是目前肿瘤患者的重要辅助治疗措施[3-4]。因此,如何实施合理的营养支持是临床亟需解决的问题。本研究旨在探讨全营养素联合放化疗治疗局部晚期直肠癌患者的效果及其对免疫功能的影响,现报道如下。
1 资料与方法
1.1 临床资料 选取2020年6—12月华润武钢总医院肿瘤科收治的66例局部晚期直肠癌患者作为研究对象,其中男40例,女26例;年龄(51.42±1.35)岁;病程(4.13±1.45)年。按照随机数字表法将患者分为观察组和对照组,各33例。2组性别、年龄、TNM分期、文化程度比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究已在华润武钢总医院伦理会备案,符合世界卫生组织《赫尔辛基宣言》中关于人体临床试验伦理学的相关要求。
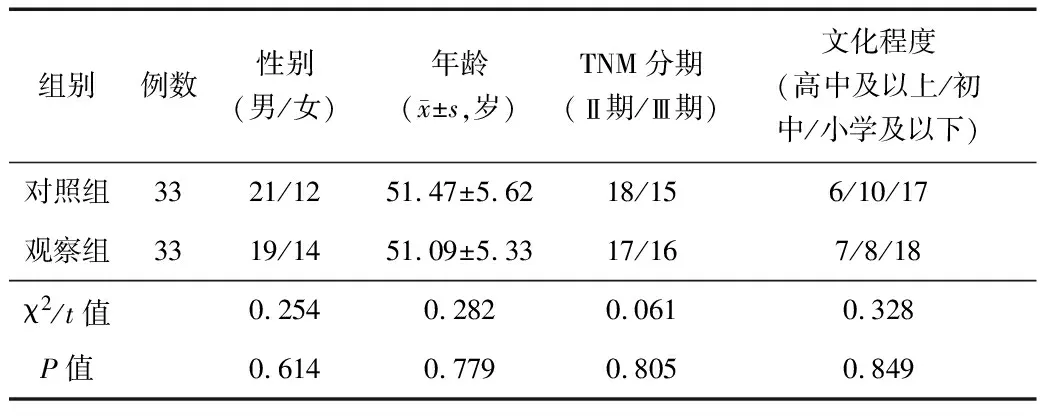
表1 2组临床资料比较
1.2 病例选择标准 纳入标准:(1)经胃肠镜取病理切片,确诊为局部晚期原发性直肠癌,无消化道梗阻;(2)择期手术后;(3)意识清楚、生命体征稳定;(4)签署知情同意书。排除标准:(1)入组前曾接受过其他化疗、放疗、免疫治疗等抗肿瘤治疗者;(2)合并内分泌疾病、代谢性疾病、免疫系统疾病等慢性疾病者;(3)长期应用激素或近3个月内有激素治疗史者;(4)合并严重的心、肺、肾等躯体性疾病或功能障碍者;(5)合并严重的精神疾病者。
1.3 治疗方法
1.3.1 对照组:对照组患者术后采用常规放化疗方案治疗,即予以5-氟尿嘧啶同步放化疗,并予以饮食管理,给予葡萄糖、水乐维他以维持水电解质平衡,保障机体内环境和生命体征稳定。
1.3.2 观察组:观察组患者在对照组基础上予以全营养素治疗,即术后待患者排气后,给予肠内营养制剂全营养素(商品名:能全素),每日分次冲服或鼻饲,持续治疗2周。
1.4 观察指标与方法 (1)营养状况:治疗2周后,叮嘱患者禁饮禁食12 h,而后穿病员服,应用RGZ-120型体重计称量体质量(kg)、身高(cm),每天在同一时间由专人测量(结果精度到0.1 cm)。通过身高换算标准体质量[标准体质量(kg)=身高(cm)-105],评估患者营养状况[5]。营养程度分级:标准体质量的90%以上为营养良好;标准体质量的85%~90%为轻度营养不良,75%~84%为中度营养不良,均视为营养不良;标准体质量的75%以下为营养低下。(2)免疫功能指标:分别于术前及术后1、2周采用APAAP桥联酶标法[6]测定患者T细胞亚群,包括CD3+、CD4+、CD4+/CD8+及自然杀伤细胞(NKC)分数,其中NKC分数是采用LDH释放法[7]测得。
2 结 果
2.1 营养状况比较 治疗后,观察组营养状况优于对照组(u=2.023,P=0.043),见表2。
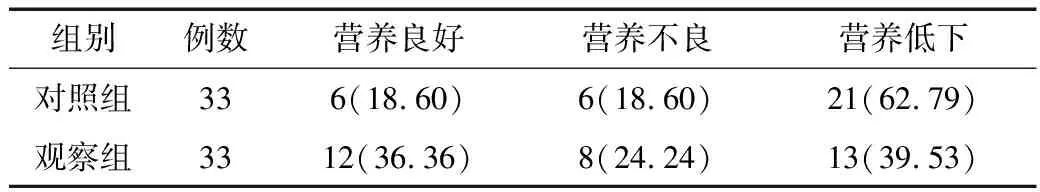
表2 2组营养状况 [例(%)]
2.2 免疫功能指标比较 术前,2组CD3+、CD4+、CD4+/CD8+及NKC分数比较,差异无统计学意义(P>0.05)。术后1周,观察组CD3+、NKC分数较其术前升高,对照组CD3+较术前降低(P<0.05);术后2周,观察组CD3+、CD4+、CD4+/CD8+及NKC分数均高于术前(P<0.05)。观察组术后1周CD3+、CD4+及NKC分数高于对照组,术后2周CD3+、CD4+、CD4+/CD8+及NKC分数均高于对照组(P<0.05),见表3。
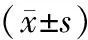
表3 2组免疫功能指标比较
3 讨 论
肠道恶性肿瘤是临床常见的消化系统肿瘤,近年来,局部晚期直肠癌的临床发病率呈逐年上升趋势,且患者趋于年轻化,部分肠道恶性肿瘤患者经手术治疗,会造成机体出现应激反应,引起机体蛋白质代谢加快、合成减慢,致使患者出现营养不良状况。营养疗法可一定程度上纠正体内蛋白质大量被消耗的临床问题,但其临床效果因人而异,目前尚未有确切效果的标准治疗方案。
目前,多个国家公共卫生系统的专家学者已达成共识,普遍认为肠道恶性肿瘤的发生与机体营养状况、免疫力等因素有关[8],发病机制错综复杂。对此,近年相关流行病学和临床专家学者们开始重点关注如何针对营养不良人群进行疾病诊断与评价、如何对其实施公共卫生干预和评价等问题,许多大型临床试验均在探讨营养素在疾病治疗中的应用价值。
研究表明,清除血液循环中的营养素可阻断肿瘤病原体繁殖所需的营养[9]。营养素是根据血液循环到达机体组织细胞,参与免疫应答,因此血液中的微量营养素水平低,并不意味着机体处于营养素缺乏。肠道恶性肿瘤患者的发病部位特殊,患者进食受限,消化与吸收功能受损,故导致其逐渐出现营养不良、机体免疫力低下,抗癌力亦随之下降。已有研究表明,恶性肿瘤患者多存在不同程度的营养不良,手术患者也需必要的营养支持治疗,以保障其生命安全和手术顺利进行[10]。一项动物实验对荷瘤体实验动物分别施行减少热氮量、提供标准全肠外营养(TPN)或特殊TPN的不同营养干预方式,结果显示:减少或控制氮摄入量可抑制肿瘤生长,但同时可导致宿主的蛋白质—热能供应不足,从而使机体免疫功能受损,如给予标准TPN,可改善荷瘤体实验动物的营养状况和免疫功能,但同时也促进了肿瘤细胞的生长、增殖[11]。因此,对于“营养支持是否有利于刺激肿瘤细胞生长”的论点尚存在争议,目前并无确凿的循证医学证据支持哪种观点。
恶性肿瘤可导致患者进食障碍,消化系统功能受损,久而久之造成机体肠道正常菌群失衡。研究发现,恶性肿瘤患者术后早期应用肠内营养(EN)有利于维护其肠道黏膜的完整性和屏障功能[12]。营养素疗法可发挥抗癌、抗炎、抗血栓、调节激素、刺激免疫系统和平衡肠道菌数等作用,目前营养素疗法在国内外应用广泛。
手术不能保证完全清除恶性肿瘤患者体内所有的肿瘤病灶,使其不再复发,甚至可能会造成有活性的肿瘤细胞进入血液循环或在腹腔内播散、种植。此外,肠道恶性肿瘤患者机体免疫功能不足,可能会影响手术效果,且应激性的手术创伤也可能会进一步抑制患者的免疫功能,上述均为肿瘤对机体造成损伤创造了机会。机体对抗肿瘤主要以自身免疫(细胞免疫功能)为主,细胞免疫由T淋巴细胞与NKC完成。因此,对于恶性肿瘤患者,外科手术是一种局部性治疗手段。提高患者自身的免疫功能对于保障患者完成手术及预后同等重要。营养支持对分化程度低的肠道恶性肿瘤患者有明显的肿瘤增殖促进作用[13]。化疗加营养支持可抑制肿瘤生长。基于此,本研究对择期手术后的局部晚期恶性直肠癌患者应用营养素疗法。全营养素的生物利用度较高,其可被机体完全吸收,且价格较低,其含有的矿物质、维生素和微量元素可为肠道恶性肿瘤患者补充因进食受限、吸收功能受损等而缺乏的营养成分。本研究结果显示,治疗后观察组营养状况优于对照组,可见同步化放疗联合全营养素可改善局部晚期直肠癌患者的营养状况。此外,术后1周,观察组CD3+、NKC分数较其术前升高,对照组CD3+较术前降低;术后2周,观察组CD3+、CD4+、CD4+/CD8+及NKC分数均高于术前,且观察组术后1周CD3+、CD4+及NKC分数高于对照组,术后2周CD3+、CD4+、CD4+/CD8+及NKC分数均高于对照组,表明对择期手术后接受化放疗的局部晚期直肠癌患者加用营养支持治疗十分有必要,既可有效地改善机体营养状况,还可提高机体免疫功能,抑制肿瘤生长。笔者认为,在局部晚期直肠癌患者的治疗中,保护、提高机体免疫功能与放化疗、手术同等重要,这也是延长患者寿命、改善预后的有效途径。但本研究随访时间有限,尚需进一步观察患者的远期预后。
综上所述,在局部晚期直肠癌患者术后同步放化疗期间加用全营养素可更有效地改善机体营养状况及免疫功能,更有利于抑制肿瘤细胞的增殖、生长。
利益冲突:所有作者声明无利益冲突。
