间充质干细胞外泌体对体外肝星状细胞增殖和活化的影响
2023-02-12孙东磊郭金波王丹丹罗雨欣牛国超杨双双张晓岚
孙东磊,郭金波,王丹丹,罗雨欣,牛国超,杨双双,张晓岚
肝纤维化以细胞外基质(extracellular matrix,ECM)在肝组织沉积为特点,是机体对各种慢性肝损伤后的一种修复反应,是慢性肝病进展为肝硬化的必经途径[1]。活化的肝星状细胞(hepatic stellate cells,HSCs)是ECM的主要来源,其持续增殖和活化是导致肝组织炎性损伤和纤维化的重要过程[2],而抑制HSCs增殖和活化是改善肝纤维化的重要途径[3]。外泌体(exosomes,Exo)是双层膜囊泡,约40~160 nm,介导细胞间的交流和旁分泌因子的运输[4]。据报道,Exo参与了许多不同的生物学过程,如脂肪组织再生、髓鞘膜生物生成、先天免疫、内皮细胞迁移、神经传递和抑制肿瘤生长等[5]。间充质干细胞(mesenchymal stem cells,MSCs)是产生Exo能力最强的细胞,其分泌的间充质干细胞外泌体(MSCs-Exo)对肝细胞坏死[6]、药物性肝损伤[7]、骨折愈合和软骨再生[8]、肢体缺血损伤[9]、糖尿病引起的认知障碍和炎症引起的早产脑损伤均有较好的治疗作用。然而,MSCs-Exo对肝纤维化的影响及其机制仍不清楚。本研究初步探究了MSCs-Exo对转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导的人肝星状细胞系LX-2细胞增殖和活化的影响,现报道如下。
1 材料与方法
1.1 细胞与试剂 LX-2细胞购于中国科学院上海细胞库;DMEM培养基和10%胎牛血清购自美国Gibco公司;青霉素和链霉素购自美国Gibco公司。MSCs-Exo成品购自山东省齐鲁细胞治疗工程技术有限公司;抗α-SMA和抗COL1A1购自Affinity Biosciences公司;抗β-actin购自美国Cell Signal Technology;抗CD9、抗CD63、抗GM130购自美国BD Biosciences;MTT检测试剂盒购自上海碧云天公司;逆转录试剂盒购自北京全式金公司;RT-PCR试剂盒购自日本Takara公司;细胞因子TGF-β1购自美国Sino Biological公司;引物由北京华科生物工程技术服务有限公司合成;Trizol试剂购自康为世纪公司。
1.2 细胞培养 取LX-2细胞,接种于T25培养瓶中,在含10% FBS、100 U/mL青霉素、100 μg/mL链霉素的完全DMEM高糖培养基,37℃、5% CO2饱和湿度孵箱中培养,隔日换液,待细胞生长至80%~90%密度时,传代。
1.3 外泌体鉴定 取出所购MSCs-Exo 10 μL,滴加于铜网上沉淀1 min,使用滤纸吸去浮液,滴加醋酸双氧铀10 μL于铜网上,沉淀1 min,使用滤纸吸去浮液。常温干燥数分钟后,使用透射电子显微镜(transmission electron microscope,TEM)在100 kv下对MSCs-Exo进行电镜成像检测,观察MSCs-Exo形态。取出MSCs-Exo 10 μL,用PBS稀释到30 μL,用聚苯乙烯微球对NanoFCM粒径分析仪性能进行测试校准。将MSCs-Exo吸进注射器后放到注射泵上,室温下以25 μL/s的流速注入MSCs-Exo,分析MSCs-Exo粒径分布。采用Western blot法检测MSCs-Exo阳性标志蛋白CD9、CD63和阴性标志蛋白GM130的表达。
1.4 细胞增殖检测 采用MTT法,消化对数生长期的细胞,用0.25%胰酶消化单层培养细胞,镜下计数,接种于96孔板1000个细胞/孔,周围加PBS 100 μL。用5 mL MTT溶剂溶解25 mg MTT,配制成5 mg/mL的MTT溶液,-20℃避光保存,每孔加入MTT溶液10 μL,在细胞培养箱内继续孵育4 h,每孔加入Formazan溶解液100 μL,适当混匀,继续孵育4 h,在572 nm下测定吸光度。
1.5 细胞mRNA水平检测 采用RT-PCR法检测细胞α-SMA和COL1A1 mRNA水平。应用TRIzol试剂提取细胞总RNA。使用cDNA反转录试剂盒将提取的RNA反转录为互补DNA(cDNA)。半定量PCR反应条件:94℃预变性5 min,94℃变性10 s,55℃退火30 s,72 ℃延伸1 min,循环38次,最后72℃延伸7 min。β-actin基因半定量循环30次。根据GenBank序列设计引物,所用引物的序列:β-actin: sense:5’-TGGACATCCGCAAAGACCTG-3’,antisense: 5’-CCGATCCACACGGAGTACTT-3’);α-SMA: sense: 5’-GTGCTGTCCCTCTATGCCTCTGG-3’,antisense: 5’-GGCACGTTGTGAGTCACACCATC-3’;COL1A1: sense:5’-CCTGCCTGCTTCGTGTAAA-3’,antisense: 5’-TTGAGTTTGGGTTGTTGGTCT-3’,实验重复3次。
1.6 细胞蛋白检测 采用Western blot法,使用RIPA裂解缓冲液、蛋白酶抑制剂10 μL 和磷酸化酶抑制剂10 μL,提取细胞总蛋白,行SDS凝胶电泳,分离并转移到PVDF膜上。用羊抗兔IgG孵育过夜,加荧光标记的二抗室温避光孵育60 min,用Odyssey对蛋白表达量进行分析,应用Image J分析各蛋白条带的灰度值。

2 结果
2.1 MSCs-Exo形态表现 在透射电镜下观察,MSCs-Exo呈圆形或椭圆形盘状囊泡样结构,有相对完整的膜结构,内含低密度物质(图1A)。使用超滤联合化学沉淀法分离出MSCs-Exo后,经粒径分析仪分析显示所提取的MSCs-Exo颗粒直径主要分布在30~200 nm之间,符合外泌体粒径分布特征(图1B)。
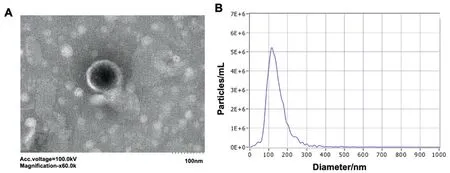
图1 外泌体超微结构形态和粒径分析A:外泌体形态(60.0K×);B:外泌体粒径分析
2.2 外泌体表面标志蛋白表达情况 经检测,提取的MSCs-Exo表面标志蛋白CD9和CD63阳性,而GM130阴性(图2)。
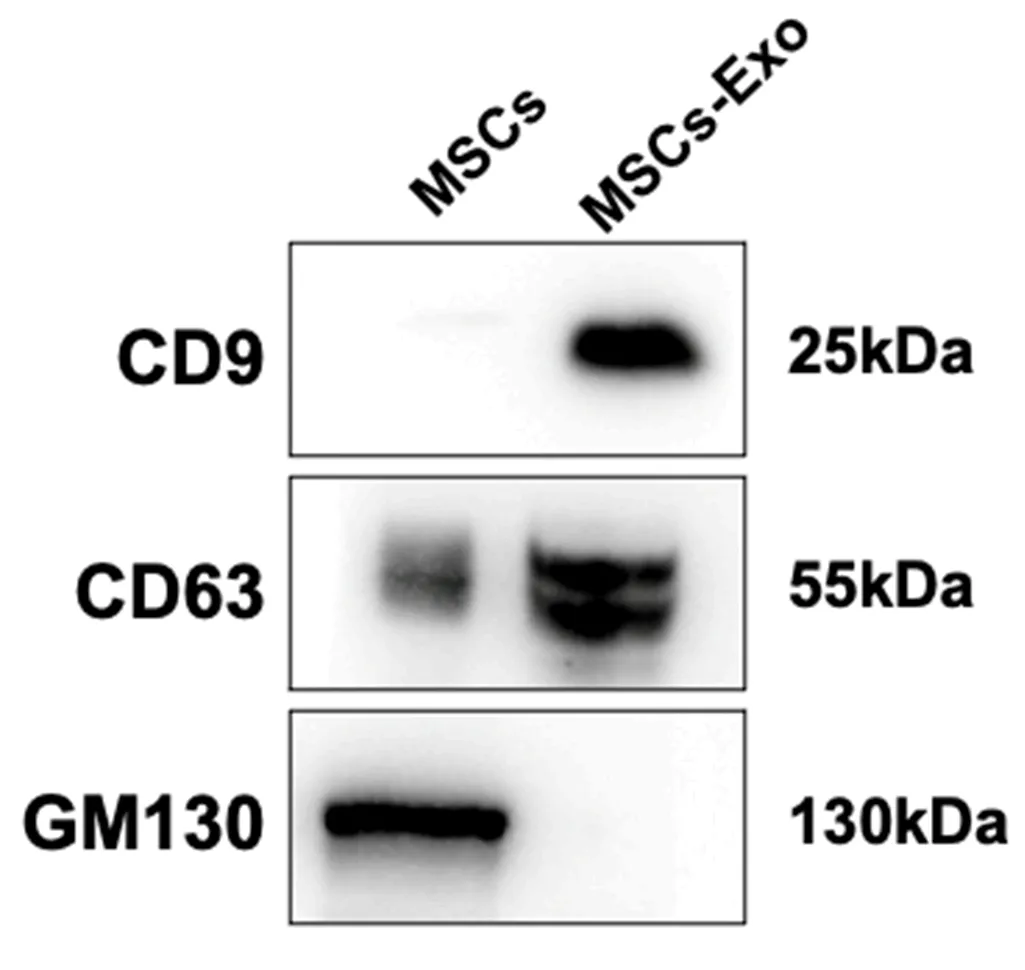
图2 外泌体标志蛋白表达(Western blot法)MSCs:间充质干细胞;MSCs-Exo:间充质干细胞外泌体
2.3 TGF-β1诱导LX-2细胞α-SMA和COL1A1基因和蛋白表达变化 以20 μg/L TGF-β1诱LX-2细胞12 h后,其α-SMA和COL1A1 mRNA(图3,左)和蛋白表达(图3,右)均显著升高,且随着TGF-β1浓度的升高而升高。

图3 TGF-β1诱导LX-2细胞活化左:RT-PCR法检测细胞α-SMA和COL1A1 mRNA水平;右:Western blot法检测细胞α-SMA和COL1A1蛋白表达
2.4 MSCs-Exo抑制LX-2细胞活化情况 三种浓度的MSCs-Exo(50 μg/mL,100 μg/mL,200 μg/mL)均可抑制TGF-β1诱导的活化的LX-2细胞α-SMA和COL1A1 mRNA及其蛋白的水平,且随着外泌体浓度的升高,活化标志蛋白α-SMA和COL1A1 mRNA和蛋白的水平明显降低,具有剂量依赖性(图4)。

图4 LX-2细胞活化标志蛋白表达变化A:RT-PCR检测α-SMA和COL1A1 mRNA水平;B:Western blot检测α-SMA和COL1A1蛋白水平
2.5 MSCs-Exo对LX-2细胞增殖活力的影响 MSCs-Exo-100和MSCs-Exo-200处理的LX-2细胞增殖活力较对照细胞显著降低(均P<0.0001,图5)。
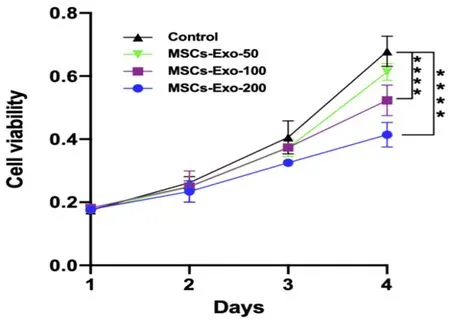
图5 MSCs-Exo对活化的LX-2细胞增殖的作用MSCs-Exo-100和MSCs-Exo-200处理LX-2细胞增殖活力较对照细胞显著降低
3 讨论
MSCs-Exo是MSCs分泌的纳米级细胞外囊泡,具有MSCs的大部分功能,但无恶性分化,且较MSCs免疫原性更低[10]。Exo内容物的成分复杂,主要包括蛋白质、核酸、脂质和代谢产物等。根据ExoCarta数据库(http://www.exocarta.org/)最新数据显示,已在Exo中检测出41860种蛋白、1116种脂质、3408种信使RNA(messenger RNA,mRNA)和2838种微小RNA(microRNA,miRNA),它们在健康和疾病的病理生理学过程中发挥重要作用,具有抑制纤维化和促进血管生成等重要的生物学功能,同时在细胞通讯、细胞迁移和肿瘤细胞增殖等方面发挥重要作用[11]。采用Exo提取试剂可在BMSCs培养上清液中收集到Exo沉淀,由于过滤器和超滤管的使用大大节省了实验成本,可获得较为纯化和更多的Exo,应用透射电镜、粒径检测、流式细胞技术和Western blot等多种方法对其进行有效鉴定。我们使用透射电镜、粒径检测、Western blot技术对本研究所用外泌体进行了有效鉴定,保证了后续实验的开展。
肝纤维化的早期是可逆的。一旦有假小叶形成,纤维化状态便不可逆[12]。研究发现,肝纤维化是肝脏反复受损后发生的愈合过程,及时有效的治疗可以逆转已经形成的纤维化。因此,有效控制肝纤维化已成为慢性肝病治疗的重要手段[13]。在肝纤维化进程中,HSCs从静息状态分化成产生更多的α-SMA和COL1Α1等ECM成分的肌成纤维细胞,导致ECM过度沉积,形成纤维性瘢痕。当到达持续阶段时,HSCs继而发生增殖、活化、纤维形成、细胞收缩、基质降解等变化,最终奠定了肝纤维化的病理学基础[14]。因此,HSCs的增殖和活化在肝纤维化形成过程中发挥关键的作用,抑制其增殖及活化被认为是治疗肝纤维化的关键[15]。LX-2细胞是应用最广泛的HSCs体外细胞模型之一,其保留着活化HSCs的关键特征,如细胞因子信号传导、神经元基因表达、维甲酸代谢和纤维形成等,广泛应用于肝炎及纤维化的体外研究,在成纤维细胞样表型转化方面也研究甚多[16]。LX-2细胞作为HSCs的体外细胞系,可以表达α-SMA和COL1Α1[17]。研究表明,TGF-β1等多种细胞因子与HSCs表面的特异受体结合可激活HSCs,促进HSCs增殖和活化[18]。
本研究应用MSCs-Exo干预TGF-β1诱导的人HSCs系LX-2细胞,探讨了MSCs-Exo对HSCs活化的影响。MTT细胞活性检测被广泛用于细胞增殖和细胞毒性检测实验[19]。本研究采用MTT法检测证实MSCs-Exo可以显著抑制LX-2的细胞活性,且其效应具有浓度依赖性。据此推测,MSCs-Exo可能通过影响活化HSCs的增殖活性,发挥抗纤维化的作用。α-SMA和COL1Α1作为HSCs活化的标志蛋白,其表达强度与HSCs增殖以及肝纤维化程度呈正相关,即肝纤维化程度越严重,α-SMA和COL1Α1表达越高[20]。经RT-PCR和Western blot检测结果显示,MSCs-Exo降低了LX-2细胞α-SMA和COL1A1 mRNA和蛋白表达水平,进一步证实MSCs-Exo通过抑制HSCs活化发挥抗纤维化作用,为抗肝纤维化研究提供了新线索。在未来的研究中,需要动物实验进行体内验证并深入探究MSCs-Exo的作用及其机制。
利益冲突声明 本研究不存在研究者、伦理委员会成员以及与公开研究成果有关的利益冲突。
作者贡献声明:孙东磊负责实验、实验方法的整理和论文撰写;郭金波、王丹丹负责实验思路指导,修改论文;罗雨欣、牛国超负责论文实验材料整理;杨双双负责资料统计学分析;张晓岚负责课题设计,拟定写作思路,修改论文。
