表观遗传学机制在糖尿病肾病发生发展中的作用
2023-02-11彭会巧郝晓晓吴亚靓缪鋆鋆
彭会巧 郝晓晓 吴亚靓 缪鋆鋆
糖尿病肾病(diabetic nephropathy,DN)是引起终末期肾病的原因之一,其也是糖尿病中最严重的微血管并发症。此外,大约50%DN 患者会发展成终末期肾病[1]。糖尿病患者中,DN 的发生率30%~40%[2]。除此以外,大约70%的有慢性肾脏病(CKD)临床表现的1、2 型糖尿病患者都将进展为DN[3]。DN 的病理特征是肾小球系膜增宽、分裂,出现K-W 结节[4]。DN 临床表现的早期特点主要是微量白蛋白尿(30~300 mg/L)直至大量蛋白尿(>300 mg/L)。其过程包括以下5 个步骤:初始高肾小球滤过率和肾肥大,运动后出现的微量白蛋白尿,持续性蛋白尿,肾功能减退,肾功能衰竭。DN 的发病是很难发现的,临床中一旦出现持续的显性蛋白尿,将不可逆转DN 病程的进展,其终末期肾病的进展率是其他肾脏疾病的14 倍左右。
在过去的几年中,糖尿病的患病率迅速增加,糖尿病引起的CKD 已经超过了肾小球肾炎引起的,成为中国城市患者CKD 的主要原因[5]。我国DN 患者数量众多,DN 引起的社会经济负担逐年加重。但由于DN 的发病机理相对其他疾病来说较为复杂,因此,临床及科研中将探索DN 的发病机理,以期能找到更有效的防治DN 的措施作为研究的重点。近年来,人们对DN 的发病机制有了新的发现。结合新的发展要求,从非遗传因素方面系统地回顾了DN 的发病机制,如免疫炎症、上皮间质转化、凋亡和线粒体损伤、表观遗传学、细胞-内皮通信等。本文就表观遗传学机制在DN 发生发展中的作用进行综述。
1 表观遗传的主要分子机制
1.1DNA 的甲基化 由S-腺苷甲硫氨酸(SAM)作为甲基供体,DNA 甲基化转移酶进一步作用在SAM 上,甲胞嘧啶最终转化成为5-甲基胞嘧啶,从而进行遗传基因的修饰却未改变DNA 的序列。许多动物、植物、真菌基因组都被DNA 胞嘧啶的甲基化所标记。通过掌握其位于基因组中的位置可以得知这个表观遗传标记的生物学作用。目前新技术使得大规模绘制 DNA 甲基化模式变得更加容易,不仅启动子甲基化在发育过程中经常是高度动态的,且许多生物体似乎也将DNA 甲基化特异性地靶向活性基因体[6]。DNA 甲基化的分子机制见图1。
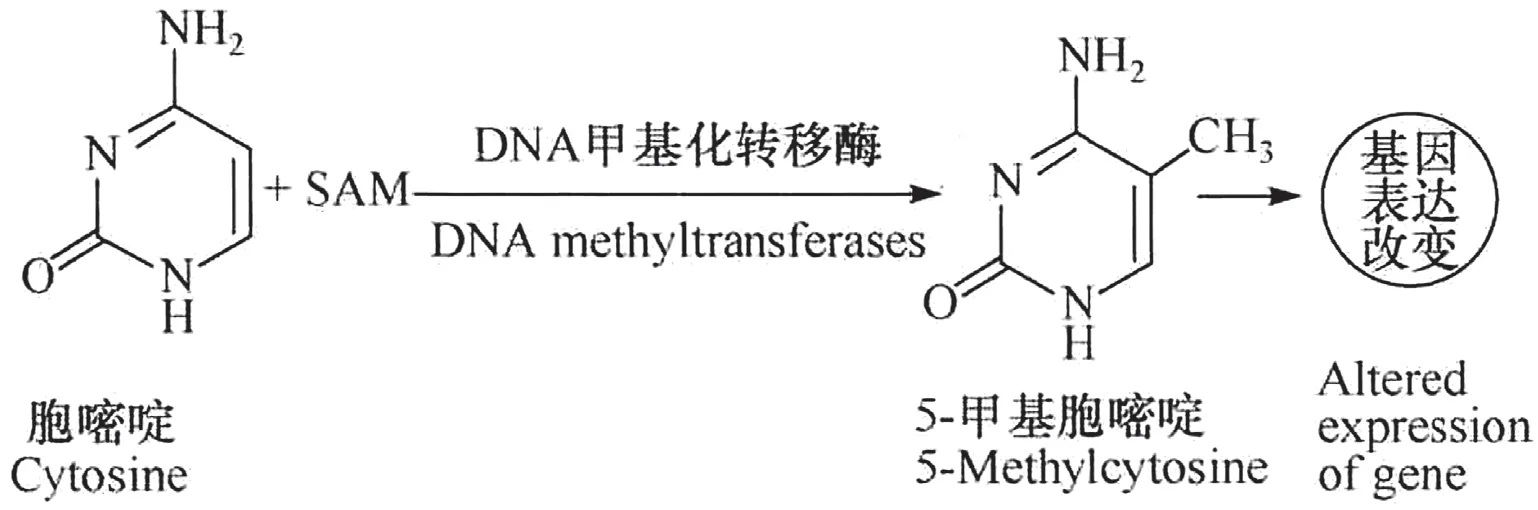
图1 DNA 甲基化的分子机制
1.2组蛋白修饰 组蛋白修饰是在相关酶的作用下,完成组蛋白甲基化、组蛋白的乙酰化以及形成去乙酰化组蛋白过程。组蛋白是参与DNA 包装和形成染色体的核心蛋白,染色体的基本结构是核小体,组成核小体的组蛋白八聚体的组蛋白H3和H4是蛋白酶修饰的主要位点,组蛋白尾部可被某些介质通过抑制组蛋白乙酰化来达到调节染色质重塑、染色质结构及基因表达的表观遗传机制失调[7,8],这些修饰作用大多是可逆的。组蛋白的代码见图2。

图2 组蛋白的代码
1.3非编码RNA 的调控 非编码RNA 的调控主要包括双链的小干扰RNA(siRNA)和微小RNA(miRNA)这两种常见的短链RNA,siRNA 是可以通过体外合成后转染进入细胞中,是RNA 干涉的中间产物,通过与信使RNA(mRNA)同源配对。miRNA 在植入前胚胎发育过程中是非必需的,它们的功能在卵母细胞减数分裂过程中受到抑制,糖尿病、肿瘤、代谢异常疾病也深受miRNA 的影响[9]。
2 表观遗传学——同样的基因,不同的结局
表观遗传修饰指的是通过专门的酶在基因以及周围敲入或敲出其他基因的动态变化,这些酶不改变DNA 核苷酸序列本身,而是改变DNA 被转录的过程。DNA 在真核细胞内并不是裸露的,而是被动态地包装成称为染色质的DNA-蛋白质复合物,这有助于将非常长的DNA 压缩包装在细胞核的紧密范围内。当需要基因产物时,染色质被选择性地解开并且被打开以允许获得转录因子(称为常染色质)。这潜在说明比DNA序列本身更重要的是,染色质的结构和可及性的变化显著影响基因表达的调节,无论是在不同的细胞之间,还是在单个细胞的一生中。这些变化部分取决于表观遗传学。这意味着相同的基因在不改变DNA 序列的情况下可以产生不同的表型。例如,身体中的每个细胞都是遗传上相同的,并且具有相同的胰岛素基因,但是只有胰腺β 细胞具有允许的表观遗传变化,允许打开的色素和胰岛素基因转录。除此之外,胰岛素表达被沉默地表观遗传变化导致染色质浓缩(称为异色素)。同样,即使基因相似性从未改变,通过累积表观遗传变化,遗传上相同的双胞胎也会逐渐变得更加不同。
3 表观遗传学机制在DN 发生发展中作用
3.1DNA 甲基化在DN 发生发展的作用 有几项研究将高血糖和DN 与表观遗传学联系起来。适当刺激人肾小球系膜细胞(HMC)或近端肾小管上皮细胞(PTC),结果表明HMC 和PTC 中存在特定的DNA 甲基化特征[10]。例如许多基因如胰岛素样生长因子结合蛋白1(IGFBP-1)的表达水平与改变的DNA 甲基化水平相关[11]。亚甲基四氢叶酸还原酶(MTHFR) 中基因C677T 的 TT 基因型以及T 等位基因可能是预测糖尿病发展成DN 风险的重要遗传分子标记[12]。
有一项研究使用无限大的人类甲基化DNA 甲基化阵列来研究原自带或不带有肾脏疾病的1 型糖尿病患者的外周血DNA 中全基因组启动子区内CpG 的甲基化情况[13]。该研究发现UNC13B 基因5'端高度甲基化,而该基因的基因变异被认为与糖尿病肾病的发生有关[14]。然而在高糖条件下,培养的鼠脑膜细胞的UNC13B 基因的表达并没有受到抑制,而是表达上调[15]。另一项研究用上述同样的方法,在从带或不带有晚期肾病的2 型糖尿病患者的唾液提取出的DNA 中发现了187 个具有不同特异性甲基化位点的基因[16]。最大规模的表观基因组关联研究在255 例CKD 患者(113 例由1 型糖尿病所致)和152 个对照个体(113 例有1 型糖尿病而无肾病)的血细胞中进一步发现了近50 万个特异性甲基化位点。在实验组和对照组中,23 个基因的DNA 甲基化有显著差异,其中6 个发现的候选基因已被认为与肾病有关,包括CUX1、ELMO1、FKBP5、INHBA-AS1、PTPRN2、PRKAG2。在这6 个基因中,带有CKD 的患者和对照者的外周血细胞中ELMO1 和PRKAG2 的mRNA 水平有轻微差异。另有研究通过总结肾小管上皮细胞中的DNA 甲基化情况,发现治疗组糖尿病肾病患者中共有1061 个基因的甲基化状态与对照组有明显差异。不同的甲基化位点主要位于增强子区和转录因子结合位点。在所有具有不同甲基化的基因中,大约40%是有调控相关性的。在上述研究中,DNA 甲基化不同的基因很少重叠,这表明在疾病条件下的异常DNA 甲基化情况比正常组织中观察到的更具有组织特异性。
肾脏疾病动物模型研究也揭示了DNA 甲基化的改变。据报道,在RASAL1 的启动子中观察到的DNA 高度甲基化,导致从纤维化和非纤维化肾脏分离的原发性成纤维细胞的RASAL1 转录水平下降[17]。RASAL1的表达减少增强了Ras 活性,导致肾纤维化。然而,RASAL1 并不是从人类样本中发现的异常甲基化基因。
DNA 甲基化已经显示出影响miRNA let-7a 下调泛素样含PHD 和环指域蛋白1(UHRF1),这是DNA 甲基转移酶1(Dnmt1)的重要相互作用蛋白[18]。高血糖导致啮齿类动物肾脏中没有类似肝脏中基因组DNA 低甲基化的现象[19]。DNA 去甲基化通过转化生长因子(TGF)-β1参与DN 系膜纤维化过程有助于DN 的进展。DNA 去甲基化和 mRNA 同时上调见于糖尿病小鼠肾脏的原代系膜细胞中[20]。此外,在7 年内转归为2 型糖尿病的糖尿病前期患者中已鉴别出差异甲基化的CpG[21]。这些基因参与碳水化合物和脂质代谢以及炎症反应包括SLC22A12、TRPM6、AQP9、HP、AGXT 和HYAL2等基因。DNA 甲基化与DN 的发病机制有关,其可调节基因表达影响疾病进展。
3.2组蛋白修饰对DN 发生发展中的影响 组蛋白尾部的修饰也是重要的表观遗传学现象,它可影响某些基因的转录和相应疾病的进展。高血糖的内环境导致内皮细胞中H3K4me1 水平升高,表明组蛋白甲基转移酶SET7 与DN 表观遗传学改变有关,这在其他条件下也得到验证[22]。锌依赖性组蛋白脱乙酰酶中,组蛋白去乙酰化酶(HDAC)2/4/5 在链脲佐菌素诱导的DN 大鼠、糖尿病db/db 小鼠和糖尿病患者肾脏活组织检查中上调,HDAC4 被证明有助于足细胞损伤,作用模式为足细胞损伤与体外通过 HDAC4-STAT1 信号传导抑制自噬和加剧炎症[23]。发现DN 发病机制肾小球硬化和肥大的关键是TGF-β1诱导的纤溶酶原激活物抑制剂-1(PAI-1)和p21 在肾小球系膜细胞(MCs)中的表达起主要作用[24],表明核因子E2 相关因子2(NRF2) 在丁酸钠(NaB)对 DN 的保护中起关键作用。其他研究结果表明,NaB 可能在转录水平激活 NRF2,可能是通过抑制 HDAC 活性[25]。此外,作为Polycomb 阻遏复合物2 的一部分zeste 同源物2(EZH2)的组蛋白甲基转移酶增强剂已经被证实在糖尿病条件下对足细胞和肾脏具有保护作用,通过减少TXNIP 和PAX6 表达抑制足细胞损伤和氧化应激[26]。
HDACs 在DN 中促纤维化基因的表达中也发挥作用,实验显示出姜黄素可以通过其抑制p300 和核因子-κB 来防止肾脏的氧化应激、系膜扩张和增加肾脏损伤[27]。
3.3miRNA 在DN 发生发展中的作用 除了DNA 甲基化和组蛋白修饰之外,非编码RNA,特别是miRNA,已经显示在DN 的发展中起主要调节作用。据报道,在DN(miR-192)背景下发现的第一个miRNA 是胶原形成的关键调节因子[28]。在来自糖尿病肾病患者的人肾活检中,TGF-β 介导的近端小管细胞中miR-192 的上调与纤维化和估计的肾小球滤过率降低有关[29]。肾脏miR-192 的抑制与糖尿病肾病小鼠模型中的肾纤维化减少和降低的尿蛋白有关[30]。研究表明TGF-β1导致E26 转录因子-1(Ets1)的乙酰化和从miR192 启动子解离。
有研究证实了miR-21 上调与人类DN 纤维化的严重程度以及肾功能下降的速度呈正相关[31]。尽管金丝桃苷是miR-21 的潜在拮抗剂,但血清miR-21也可能是DN 的生物标志物。由TGF-β 诱导的另一种miRNA 是miR-200b/c,其导致肾小球系膜肥大。而miR-200a 似乎参与TGF-β 的负反馈调节。抗炎作用也被归因于miR-146a,其在足细胞中的缺乏导致糖尿病性肾小球病的加速发展。类似地,miR-29a 可以预防小鼠中的DN 并降低高血糖条件下的足细胞功能障碍。相反,miR-29c 促进db/ db 小鼠肾小球纤维化和足细胞凋亡。miR-34c 上调可防止在高血糖条件下的足细胞凋亡,而miR-26a 的过表达阻止胶原蛋白的定位。两种miRNA 在DN 模型中均下调。此外,miR-126 的表达与患者中的DN 和白蛋白尿呈负相关,并且代表了DN 的潜在生物标志物。miR-130b 也显示出相同的结果。
然而,更多的miRNA 已经促进纤维化和凋亡,包括miR-195、miR-1207-5P、miR-135a、miR-218 和miR-34a。在健康人和DN 患者中miRNA 的检测和表征已经开启了鉴定miRNA(诸如miR-145 和miR-192)的尿生物标志物作为该标本中潜在标志物的潜力。为了找到DN 患者微量白蛋白尿的早期标志物,也对尿miRNA 进行了分析。因此,几种miRNA 在糖尿病状态下参与了肾纤维化和疾病进展的发展,并代表了治疗干预或疾病尿生物标志物的新型潜在靶标。
4 讨论
近些年来,经过大量的临床及实验研究,表观遗传学在各类临床疾病中的研究相继展开。结论是表观遗传学不仅揭示了许多疾病的病因和机理,而且也可以协助新型药物的研发、先进治疗方案制定等。单纯从理论分析考虑,运用表观遗传所研发的药物比传统治疗药物具有更高的疗效和更低的不良反应发生率。研究DN 的表观遗传调控将有助于DN 早期明确的诊断、更详细地诠释DN 的发病机制以及确定DN 未来的治疗方向。然而,尽管表观遗传调控有着其他研究没有的独特优势,鉴于医疗临床研究及疾病相应的治疗需要,只着重研究某些有价值的位点,有可能会忽视一部分重要的因素,表观遗传调控研究的片面性有待改进和解决。
