白羊草BiMYB52基因的克隆及转基因拟南芥抗旱性表达分析
2023-02-10李春艳杜利霞侯向阳
李春艳,钟 华,杜利霞,侯向阳*
(1.山西农业大学草业学院,山西 太谷 030801;2.农业农村部饲草高效生产模式创新重点实验室,山西 太谷 030801)
转录因子因其具有调控基因表达的作用,在过去被广泛应用于提高作物的农艺性能[1]。MYB蛋白是数量最多,功能多样化的转录因子之一[2],它广泛分布在真核生物中。MYB转录因子的结构特征是含有1-4个高度保守的DNA结合功能域“R”,根据R的数量将MYB转录因子家族分为四类1R-MYB,R2R3-MYB,3R-MYB和4R-MYB[3]。每个重复R约有51~52氨基酸,其中包含3个以17~19个氨基酸残基为间隔的色氨酸残基,形成3个α螺旋,其中第2和第3个形成一个螺旋-转角-螺旋(HTH)的结构,第3个螺旋能直接结合DNA被称为“识别螺旋”。R2R3-MYB在植物中数量最多,几乎占MYB家族的50%以上,同时大量研究证明这类蛋白参与了植物的生长发育和抗逆等多种生物过程[4]。如拟南芥(Arabidopsisthaliana)中编码R2R3-MYB类蛋白的GL1和WER基因,分别在其早期皮毛和根部特异性表达,突变体表现为皮毛和根毛缺失和减少,这说明这两个基因参与了拟南芥皮毛和根毛的形成[5-6]。拟南芥在干旱条件下,AtMYB2蛋白在ABA诱导下,与脱水应答基因RD22作用,促其表达增强,这说明AtMYB2蛋白在干旱胁迫下通过ABA途径诱导基因表达中发挥转录激活因子的作用[7]。将AtMYB44基因转入大豆中发现,转基因大豆对干旱和盐胁迫的耐受性显著增强[8]。
白羊草(Bothriochloaischaemum)为禾本科孔颖草属多年生植物。具有固土保水、生命力强,耐旱、高产耐牧等优点,是一种优质的乡土草资源[9]。但对其研究主要集中在生产性能[10]、营养价值[11]、生理生态[12]及遗传多样性上[13]等方面,尚缺乏对其抗逆优良性状关键调控基因的挖掘与利用。因前期对干旱胁迫条件下白羊草转录组测序的研究表明,转录因子MYB在白羊草响应干旱胁迫的过程中具有重要的作用[14],因此,本研究从前期白羊草转录组测序中筛选出的一段对干旱胁迫响应表达量变化显著的MYB序列为基础[15],克隆得到其全长,并命名为BiMYB52,为了更好地研究BiMYB52基因在抗逆中的作用,采用染色体步移技术从白羊草中扩增出了BiMYB52启动子序列,根据启动子顺式作用元件分析结果对白羊草进行了相应逆境胁迫,以期了解在不同逆境胁迫下的表达特性,为深入研究BiMYB52抗逆机制提供基础。
1 材料与方法
1.1 材料的种植与处理
将采集于山西省太谷县(采集地海拔978 m,经纬度分别为112°34′E,37°21′N)的白羊草种子,经过酒精浸泡30 s,0.1%升汞处理15 min消毒后,播种于蛭石和珍珠岩比例为3∶1的营养钵中,出苗后培养约30 d,选取长势一致幼苗进行不同的处理:放入4℃培养箱进行低温培养;将白羊草幼苗根部分别置于250 mmol·L-1的氯化钠(NaCl)、20% 聚乙二醇(PEG)和100 μmol·L-1脱落酸(Abscisic acid,ABA)的1/2 MS营养液中培养;分别用200 μmol·L-1水杨酸(salicylic acid,SA)和100 μmol·L-1茉莉酸甲酯(Methyl jasmonate MeJA)喷幼苗叶片至饱和后套袋密封培养;每个处理5株,重复3次,分别取处理0,2,4,8,12和24 h的叶片,-80℃保存待用。
1.2 白羊草BiMYB52基因的克隆与生物信息学分析
用Trizol法提取白羊草幼叶总RNA后,采用RevertAidTM反转录试剂盒将RNA反转录合成cDNA第一链,根据转录组测序得到的类MYB序列,设计引物BiMYB52-F和BiMYB52-R(见表1),以cDNA为模板,根据TA/Blunt-Zero Cloning Kit基于拓扑异构酶的超快速克隆试剂盒说明书进行PCR扩增,反应体系为20 μL:cDNA模板 1 μL(<200 ng),2×Pfu Master Mix 10 μL,引物BiMYB52-F和BiMYB52-R各0.5 μL,ddH2O补充至20 μL。反应程序:95℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s·kb-1,30 cycles;72℃ 10 min。反应结束后,将PCR产物置于1% 琼脂糖凝胶中进行电泳,按照百泰克凝胶回收试剂盒的说明书,进行目的片段的回收,然后将目的片段与T载体连接,紧接着将反应液转化到DH5α感受态细胞中,用含卡纳抗生素进行筛选,挑选阳性克隆进行鉴定。
用DNAstar 7.0分析BiMYB52基因的核酸及氨基酸序列,用ScanProsite对氨基酸序列的保守结构域进行分析。从NCBI上下载同源性较高的其他植物R2R3-MYB蛋白序列,用DNAMAN6.0对同源物种的氨基酸序列进行比对;利用MEGA5.0 软件邻位归并发法构建系统进化树。
1.3 BiMYB52启动子克隆与分析
根据已经克隆到的白羊草BiMYB52基因序列,分别设计SP1,SP2,SP3引物(见表1),以白羊草DNA为模板,采用染色步移法进行BiMYB52 基因启动子序列的扩增。根据Genome Walking Kit的说明进行3步扩增,产物进行电泳检测后与T载体链接,然后转化大肠杆菌,挑选阳性克隆送上海英俊公司测序。
利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)对克隆得到的BiMYB52基因启动子序列进行分析。
1.4 不同逆境胁迫下白羊草BiMYB52基因的表达特异性
用Trizol提取上述(1.1)各处理的RNA,根据反转录Thermo Fisher公司cDNA Synthesis Kit说明书将RNA反转成cDNA,以白羊草BiMYB52的序列设计定量引物P1和P2(见表1),以cDNA为模板,参照Thermo Fisher公司的SYBRTMGreen PCR试剂盒说明书,进行实时荧光定量PCR扩增,扩增体系为20 μL:2 μL cDNA模板,0.8 μL引物P1和0.8 μL P2,10 μL SYBR Green Realtime PCR Master Mix,0.4 μL ROX Reference Dye Ⅱ(50×),ddH2O补足至20 μL。反应程序为:95℃ 3 min;95℃ 5 s、60℃ 20 s,35~40个循环。每个样品3个重复,以18S rRNA为内参基因[16],利用2-ΔΔCt法[17]计算BiMYB52基因在不同处理下的表达量。
1.5 植物表达载体构建及拟南芥转化
设计含有Nco I和Xba I酶切位点的引物P5和P6(表1),扩增BiMYB52的启动子序列,得到带有酶切位点的目的基因片段;用Nco I和Xba I双酶切该基因片段和pCAMBIA1301质粒载体,经T4 DNA连接酶连接,得到插入目的基因的pCAMBIA1301-BiMYB52植物表达载体。将构建pCAMBIA1301-BiMYB52表达载体转化大肠杆菌DH5α,经PCR验证,挑选阳性克隆送生物公司测序,将测序正确的pCAMBIA1301重组质粒转化农杆菌感受态GV3101。用花序侵染法转化野生型拟南芥,在含有潮霉素的培养基筛选转基因抗性植株,采用引物HPT-F和HPT-R通过RT-PCR法鉴定转基因植株阳性苗。再经过自交和筛选后得到T3代转基因拟南芥,用于后续试验。

表1 实验中的引物序列
1.6 转基因拟南芥的抗旱性分析
将野生型拟南芥种子和已鉴定出的BiMYB52-1,BiMYB52-2和BiMYB52-3转基因拟南芥种子,用75%的酒精消毒1 min,再用9%的次氯酸钠消毒10 min,最后用灭菌的双蒸水清洗,然后置于1/2MS固体培养基上。4℃冰箱中放置48 h进行春化,之后放置于光照培养箱中,温度22℃,光强10 000 Lx,相对湿度50%~60%,光照16 h和黑暗8 h交替进行培养,培养7 d幼苗,选择长势一致的幼苗转至装有蛭石的花盆中培养。将生长至30 d的幼苗进行干旱处理。干旱处理采用不浇水处理14 d,恢复处理采用与对照相同的培养方式进行复水,复水5 d后计算存活率。每个处理设置3个生物学重复。生理指标的检测采用南京建成公司的试剂盒测定,丙二醛MDA含量的测定采用试剂盒A003-1,脯氨酸Pro含量的测定采用试剂盒A107。
1.7 数据梳理
采用SPSS25.0软件进行双因素方差分析,Duncan’s法对平均值进行比较和Excel软件进行分析和作图。
2 结果与分析
2.1 白羊草BiMYB52基因的克隆
根据转录组测序得到的435 bp MYB转录因子片段,利用TA/Blunt-Zero Cloning Kit技术,扩增得到1个长度为1 149 bp的序列(图2A),其阳性克隆菌落鉴定图为2B。Blast比对结果显示该序列与高粱(Sorghumbicolor)、玉米(Zeamays)、糜子(Panicumhallii)等物种的MYB基因高度同源,初步认为获得的序列是一个MYB类蛋白序列。
2.2 白羊草BiMYB52基因的生物信息学分析
BiMYB52基因含有一长度为714 bp的ORF(开放阅读框),编码237个氨基酸,其蛋白分子量为26.98 kDa,理论等电点为7.09。该蛋白的N端含有两个保守的结构域R2和R3(图2),R2和R3 N端保守基序分别为[W]-x(19)-[W]-x(19)-[W]和[W]-x(18)-[W],说明这次克隆的蛋白属于MYB家族的R2R3亚族。利用GenBank上的BlastP搜索到不同物种的9个R2R3-MYB蛋白序列,并进行了比对分析,由图3可见,该基因N端存在两个保守的结构域,与其他R2R3-MYB转录因子的同源区都集中在这一区域,C端同源性极低。
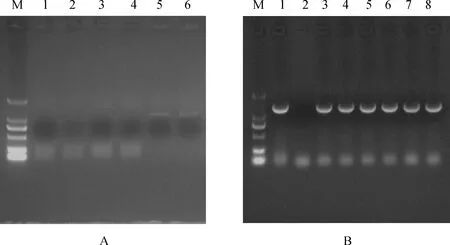
图1 白羊草BiMYB52基因的克隆及阳性菌落鉴定结果
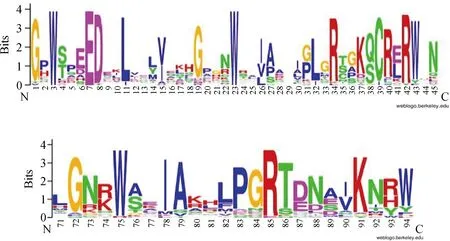
图2 R2R3-MYB蛋白N-端DNA-binding结构域

图3 BiMYB52氨基酸序列与其他植物R2R3-MYB蛋白的多序列比对
该基因编码蛋白与其他物种的R2R3-MYB蛋白的同源性相对较高,与高粱同源性达到94.56%,与芒草(Miscanthuslutarioriparius)同源性达到93.7%、与谷子(Setariaitalica)、糜子、玉米、柳枝稷(Panicumvirgatum)等同源性达88.33%~92.86%。
系统进化树分析表明,BiMYB52与高粱SbMYB52聚为一类,与玉米ZmMYB52,芒草MlMYB52的亲缘关系较近,与野生型二粒小麦(Triticumdicoccoides)TdMYB52、二穗短柄草(Brachypodiumdistachyon)BdMYB52、水稻(Oryzasativa)OsMYB52、谷子SiMYB52等也聚为一类,但亲缘关系较远(图4)。由于该系统树上,功能相关的MYB大都聚到一起,故将其命名为BiMYB52。
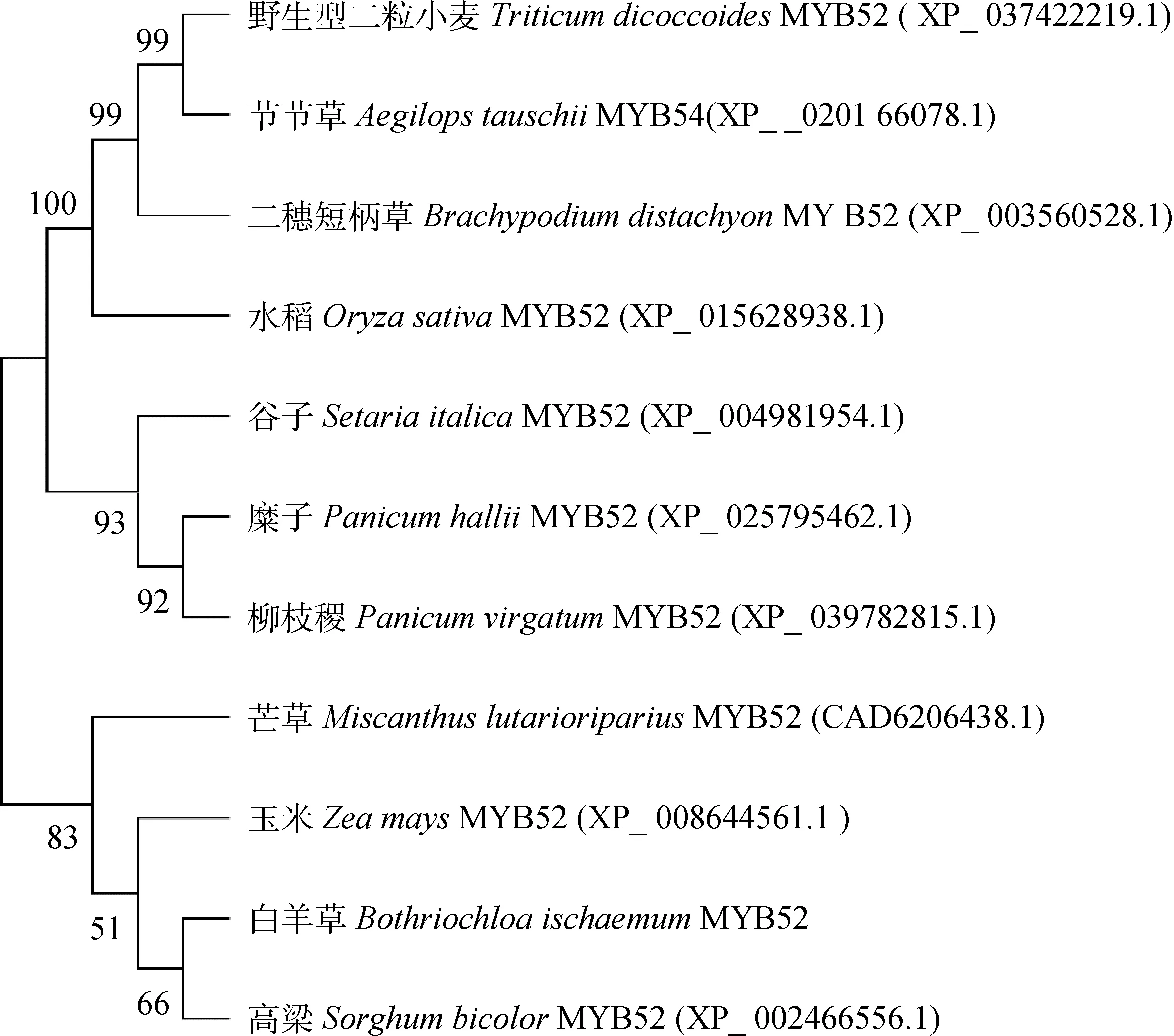
图4 基于氨基酸序列构建的BiMYB52系统进化树
2.3 BiMYB52启动子的克隆与序列分析
以白羊草DNA为模板,根据白羊草中克隆到的BiMYB52基因开放阅读框序列,设计特异性引物SP1,SP2,SP3(表1),采用步移法得到2 127 bp启动子序列(图5)。利用Plant-CARE对克隆得到的BiMYB52基因启子序列进行分析。结果显示,序列中除含有TATA-box(17个)和CAAT-box(7个)一般启动子所具有的特征元件[18],还含有能响应ABA调控的5个顺式作用元件ABRE,2个与胁迫和水杨酸SA响应的顺式作用元件W-box,5个与缺水、抗脱落酸、抗冻均有响应的结构MBS,1个与干旱、高盐、低温诱导相关的结构DRE,1个参与脱落酸应答的元件DPBFCOREDCDC3,1个与胚乳表达相关的结构Skn-1-motif,10个光响应元件ATCT-motif,5个与SA响应相关的元件GCCCORE,1个与光响应和MeJA响应相关的G-box。具体结构和数量见表2。
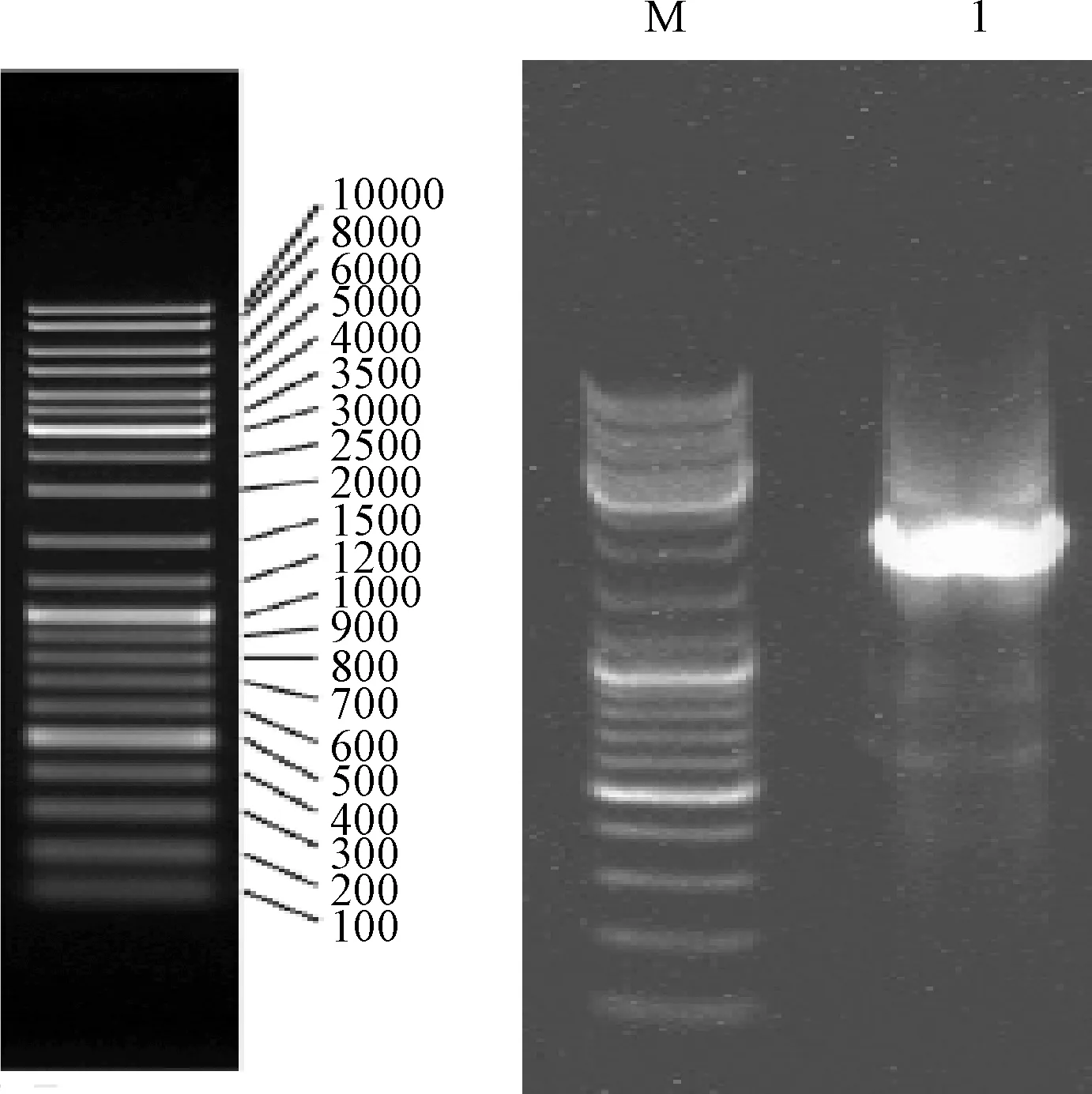
图5 白羊草BiMYB52启动子PCR扩增产物

表2 BiMYB52基因启动子顺式作用元件种类和数量及功能分析
2.4 逆境胁迫下白羊草BiMYB52基因的表达分析
利用RT-qPCR对白羊草BiMYB52基因在非生物逆境胁迫下的表达量进行检测,结果表明,多种逆境胁迫均能诱导白羊草BiMYB52基因的增强表达。在20% PEG胁迫诱导下,BiMYB52的表达量随时间上调,8 h表达量达到高峰,为对照的26倍,然后又下降(图6A);NaCl胁迫下BiMYB52的表达量在8 h之前无明显变化,8 h开始增加,12 h达到最大,此时表达量增加为对照的9倍,而后又迅速下降(图6B);冷胁迫下(4℃)BiMYB52的表达量呈现先升高12 h达到峰值,后降低的趋势(图6C);外源ABA也能明显诱导BiMYB52的表达,也呈现出先升高后降低的趋势,8 h时表达量最大,是对照的4倍(图6D);SA处理后,4 h出现第一高峰,随后迅速下降(图6E);MeJA处理后2 h就出现第一次高峰,而后第二次高峰出现在12 h,此时诱导的转录水平低于2 h(图6F);这些结果表明,BiMYB52的表达受多种胁迫和激素影响。
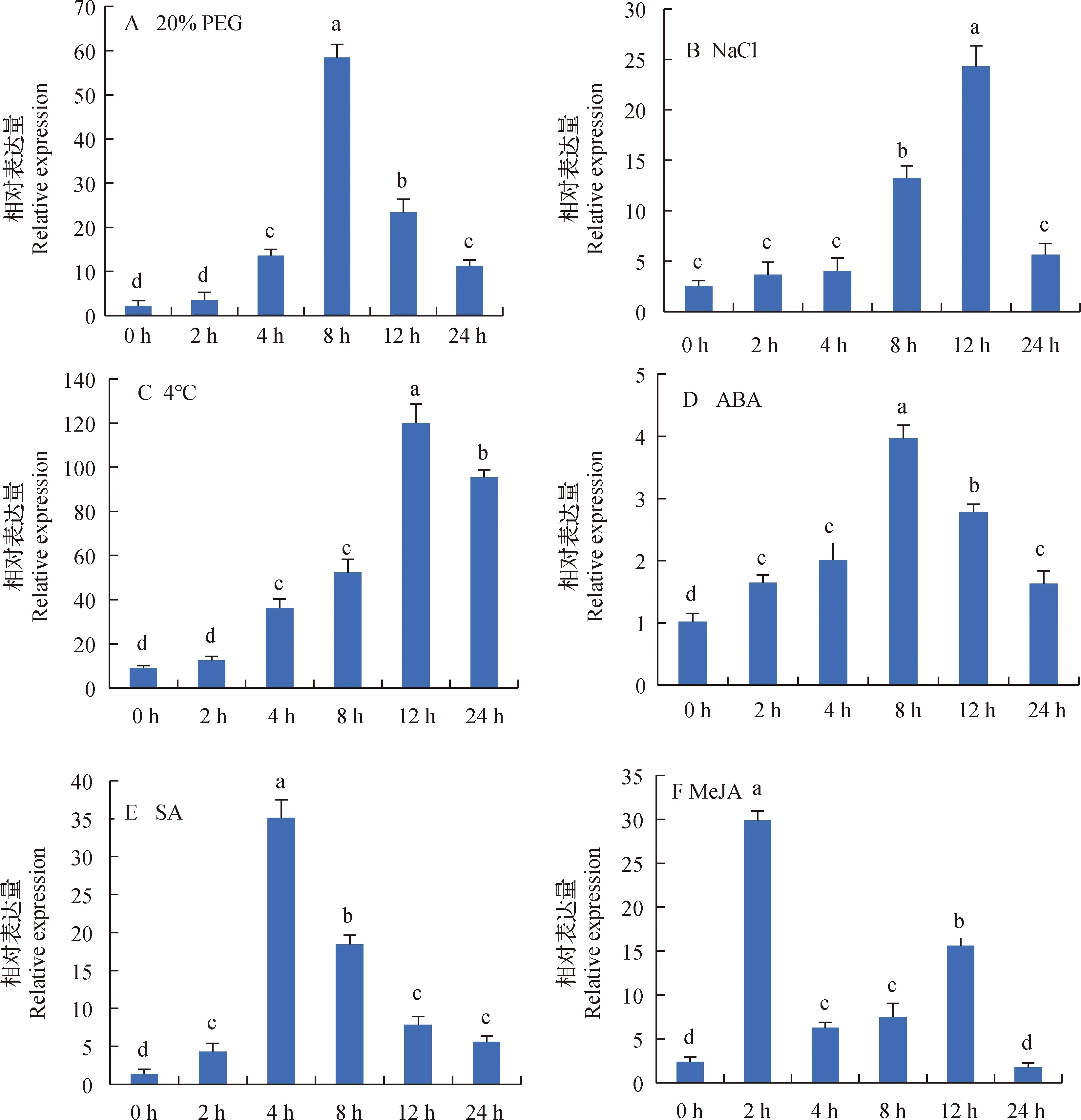
图6 BiMYB52在不同胁迫诱导下的表达量变化分析
2.5 表达载体构建及遗传转化
采用PCR法扩增带有Nco I和Xba I酶切位点的BiMYB52启动子基因序列(图7A),获得大小约为2 167 bp目的片段,将该目的片段与经过Nco I和Xba I双酶切的pCAMBIA1301载体进行连接转化大肠杆菌DH5α,经PCR验证,挑选阳性克隆测序,将测序正确的质粒转化到农杆菌GV3101感受态细胞中进行菌落PCR鉴定(图7B),得到与预期大小一致的片段,证明含有目的基因的pCAMBIA1301-BiMYB52植物表达载体已经构建完成。用花序侵染法转化野生型拟南芥,在含有潮霉素的培养基筛选得到5个株系(图8),以得到的转基因拟南芥DNA为模板,采用引物HPT-F和HPT-R(表1)进行转基因拟南芥PCR检测,获得与预期598 bp大小一致的片段(图8)。选取BiMYB52-1,BiMYB52-2和BiMYB52-3转基因株系进行干旱胁迫分析。
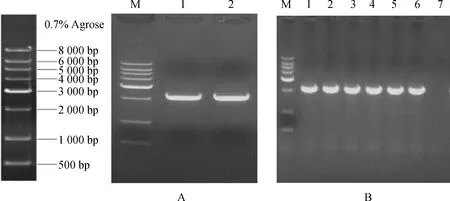
图7 带酶切位点BiMYB52启动子的扩增和表达载体pCAMBIA1301-BiMYB52的PCR鉴定
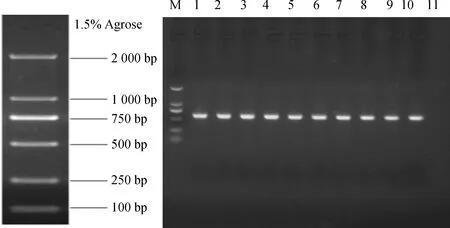
图8 转BiMYB52基因拟南芥T1代株系PCR鉴定
2.6 转基因拟南芥抗旱性分析
为方便我们把BiMYB52-1,BiMYB52-2和BiMYB52-3转基因株系分别命名为OE1,OE2和OE3。由图9所示,野生型和转基因BiMYB52拟南芥在干旱胁迫前后的存活率无明显差异,干旱胁迫复水后,转基因拟南芥OE1,OE2和OE3存活率较高,分别为80.4%,86.5%和71.3%,而野生型拟南芥的存活率仅为31.3%。图10和11表明,正常供水条件下,转基因拟南芥与野生型拟南芥丙二醛MDA和脯氨酸Pro含量无显著差异,干旱胁迫条件下,转基因拟南芥OE1,OE2和OE3丙二醛MDA含量均显著低于野生型(P<0.05),而脯氨酸Pro含量均显著高于野生型(P<0.05),说明转基因拟南芥在干旱胁迫条件下积累的丙二醛MDA较少,但脯氨酸Pro含量较多。
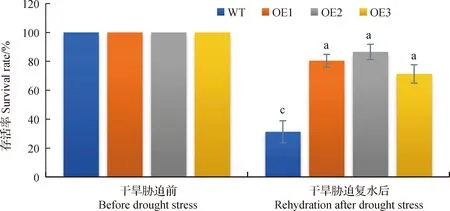
图9 干旱胁迫复水后的存活率
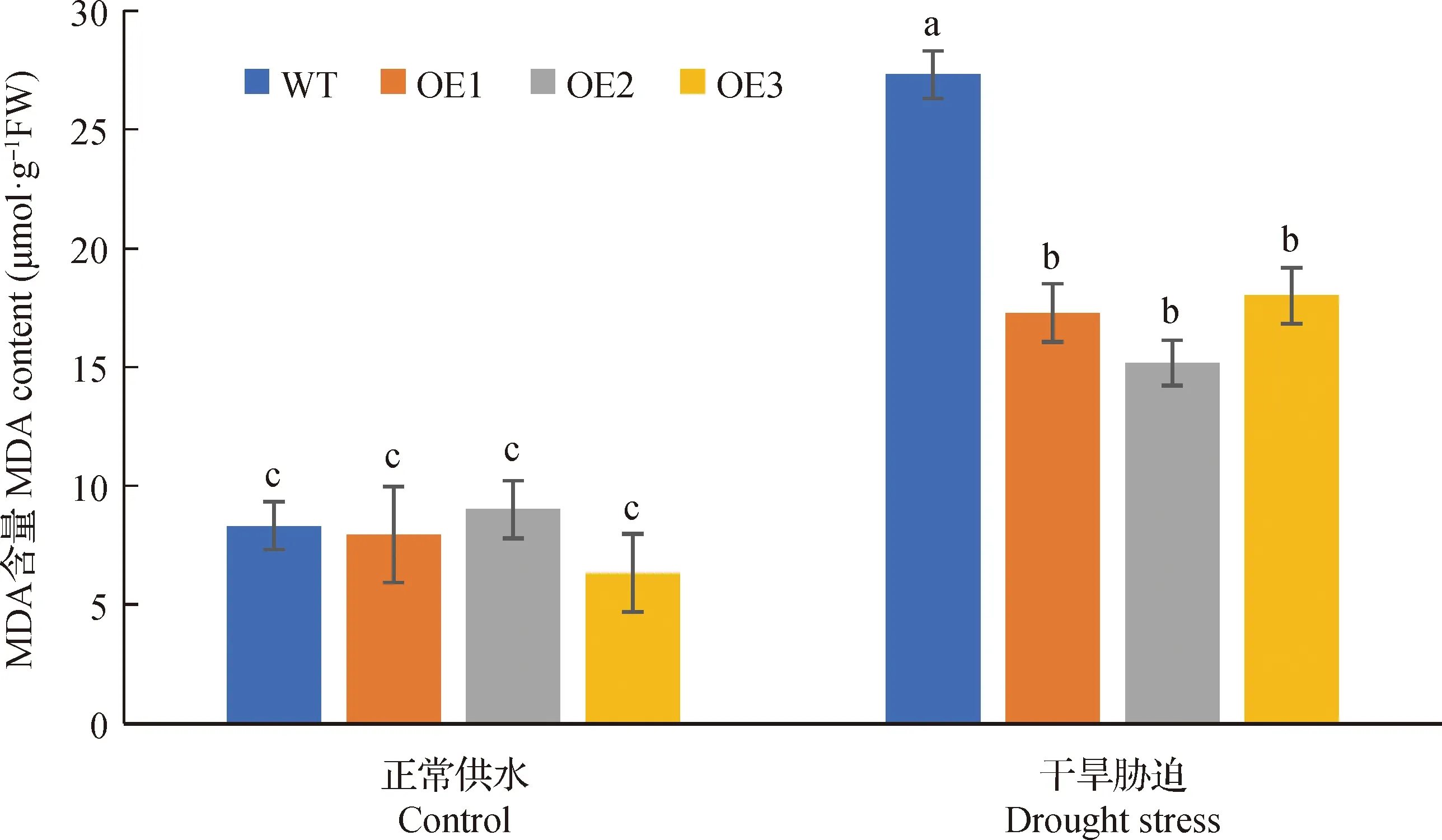
图10 正常和干旱胁迫条件下野生型和转基因拟南芥叶片的丙二醛(MDA)含量
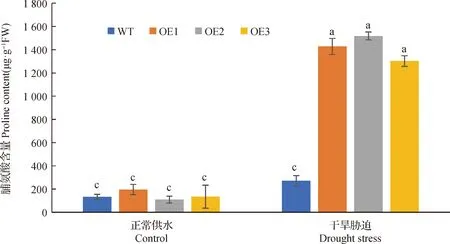
图11 正常和干旱胁迫条件下野生型和转基因拟南芥叶片的脯氨酸含量
3 讨论
植物中MYB蛋白首次发现是在玉米蛋白微粒中分离出的参与花青素合成ZmMYB基因[19],后来随着拟南芥MYB家族基因被逐渐鉴定出来,许多功能异同的MYB蛋白在多种植物中被分离和鉴定出来[20]。本研究利用前期转录组测序得到的一段MYB序列,从白羊草中克隆出1个BiMYB52基因,其cDNA全长1 149 bp,含714 bp的ORF,编码237个氨基酸,其N端构成了R2,R3两个典型的DNA结合结构域,形成2个HTH(螺旋转角螺旋)结构[3],这种结构有助于与DNA分子结合进而发挥功能[21-22]。氨基酸序列比对结果显示,BiMYB52与高粱SbMYB52(XP_002466556.1)的同源性最高,达到94.44%。
R2R3-MYB蛋白已经被证明对非生物胁迫的反应至关重要。过去的许多研究已经报道了一些R2R3-MYB蛋白与植物抗逆性相关的功能。例如,拟南芥AtMYB60是气孔运动调节因子,受干旱胁迫的影响,过表达该基因会抑制对水分的敏感性[23],AtMYB96,AtMYB15和AtMYB2在干旱胁迫的诱导下,通过激活脱水应答基因(如RD22)的转录来充当耐旱的正调控因子[7,24],除拟南芥外,还在苹果[25]、水稻[26]、小麦[27]等植物中发现了R2R3-MYB基因在其对干旱响应中起着重要作用。AtMYB20通过抑制PP2Cs表达来增强抗盐性[28],TaMYB56-B和LcMYB1在转基因拟南芥中能够正调节应激反应和盐反应[29]。不同物种中的MYB蛋白能够响应冷、盐和干旱胁迫响应。如GmMYB92[30]和TaMYB56-B控制盐和冷反应,OsMYB4 调节干旱和寒冷反应[31]。因此,MYB蛋白质可能是植物对多种非生物胁迫反应的关键调控节点。众所周知,ABA作为一种信号分子,在植物逆境胁迫响应过程中发挥着重要的作用。研究证明,拟南芥AtMYB60和AtMYB96参与调控依赖ABA的干旱胁迫反应,通过调节气孔运动来提高植物抗旱能力[32-33],Ding等报道了拟南芥基因AtMYB15的过量表达可以调高拟南芥对ABA的敏感性,并提高了植物的抗旱性[34]。本研究发现在外源激素ABA,SA,MeJA和干旱、高盐、低温等逆境胁迫,均能诱导mRNA的积累,对转基因BiMYB52拟南芥抗旱性的研究表明,干旱胁迫复水后,转基因拟南芥存活率远远大于野生拟南芥;干旱胁迫条件下,转基因拟南芥MDA含量的减少,说明干旱胁迫条件下转基因拟南芥细胞膜透性减弱,这可以减缓干旱胁迫的植物伤害,脯氨酸含量的增加可提高植物的渗透调节能力,从而增加植物的耐旱性。说明BiMYB52基因可能通过体内ABA,SA和MeJA多种激素信号途径来参与白羊草抗旱性调控。这是因为BiMYB52基因的启动子区域上含有ABREs元件(ACGT),W-box,G-box和一些与干旱、盐胁迫和低温胁迫相关的顺式作用元件。
4 结论
本研究以前期白羊草干旱胁迫条件下转录组测序中所获得一段类MYB序列,利用基于拓扑异构酶快速扩增法从白羊草中克隆到R2R3-MYB型的基因BiMYB52,经生物信息学分析发现其N端具有较高的保守性。利用染色体步移技术获得该基因的启动子,通过对启动子的分析对其进行了相应的胁迫处理,发现BiMYB52不仅受低温、干旱和高盐胁迫的诱导,同时外源激素ABA,SA和MeJA也能诱导其表达量增加。通过对转基因拟南芥进行干旱胁迫,对转基因植株干旱胁迫复水后存活率、丙二醛MDA和脯氨酸含量的测定表明转基因拟南芥的抗旱性明显优于野生拟南芥。这位进一步揭示白羊草BiMYB52基因在非生物胁迫中的调控作用奠定了基础。
