天然糯玉米淀粉的提取工艺优化
2023-02-07娄海伟王媛牛永武孙艺铭皇甫新燕赵仁勇
娄海伟,王媛,牛永武,孙艺铭,皇甫新燕,赵仁勇
(河南工业大学粮油食品学院,河南 郑州 450001)
糯玉米是由普通玉米经自然突变而形成的优质谷物,其支链淀粉含量占总淀粉的95%以上[1]。糯玉米淀粉具有糊化温度低[2]、峰值黏度高[3]、抗老化能力强[4]及透明度高[5]等优质特性,拥有较高的商业价值和较好的发展前景[6-7]。但对糯玉米进行干燥时,胚乳结构会收缩聚集,淀粉与蛋白质的结合更加紧密,导致糯玉米淀粉的提取较为困难。为了实现糯玉米淀粉的高效提取,需要破坏或削弱蛋白质和淀粉之间的结合力[8],因此选择适合的糯玉米深加工工艺来分离淀粉与蛋白质尤为重要。
玉米的深加工主要分为干磨法和湿磨法两种[9],其中干磨法加工是通过脱胚、研磨、风选、筛分等方式将玉米中的各组分分离,该方法主要用于制备玉米粗粉、玉米糁等;湿磨法加工是通过浸泡的方式膨化玉米的内部组分,具有还原性的浸泡液可以还原蛋白质的二硫键,在研磨的过程中,使玉米中的各组分得到更好的分离,获得纯正的玉米淀粉及其他副产物。目前工业提取玉米淀粉的方法主要为湿磨法,所使用的浸泡液有亚硫酸[10]、乳酸[11]、L-半胱氨酸[12]、酸浆[13]、氢氧化钠[14]、蛋白酶[15]等,通常需要在浸泡液中浸泡玉米籽粒36 h~60 h[16]后进行提取。浸泡玉米籽粒的过程十分耗时,且提取过程较为繁琐,进而有学者采用超声波[17]、挤压[18]等方式辅助提取玉米淀粉,以期缩短提取时间、提高淀粉产量,但辅助提取法既耗能又耗材,尚未应用于实际生产中。有关玉米淀粉的提取主要以普通玉米为原料,从糯玉米中提取糯玉米淀粉的报道较少。
基于此,为了提高糯玉米淀粉的提取率和提取效率,本研究以糯玉米碴为原料,采用湿磨法提取糯玉米淀粉,研究浸泡液种类和浓度、浸泡时间和浸泡温度对糯玉米淀粉提取率的影响,探究不同浸泡条件下糯玉米胚乳中淀粉与蛋白质的分离情况,优化并确定糯玉米淀粉的最适提取工艺参数,为糯玉米淀粉的工业化生产提供理论参考。
1 材料与方法
1.1 材料与试剂
糯玉米碴(淀粉84.53%、蛋白质9.64%、灰分0.50%、粗脂肪1.82%、直链淀粉占总淀粉含量的1.49%):产于河南省安阳市滑县。
乳酸、可溶性淀粉、乙酸镁:天津市科密欧化学试剂有限公司;L-半胱氨酸:天津光复科技发展有限公司;牛血清白蛋白:北京索莱宝科技有限公司;直链淀粉检测试剂盒(K-AMYL):爱尔兰Megazyme公司;亚硫酸、硝酸钙:天津市大茂化学试剂厂;碘化钾、葡萄糖:国药集团化学试剂有限公司;碘:天津市永大化学试剂有限公司;冰乙酸、石油醚、无水乙醇:天津市天力化学试剂有限公司;硫酸(色谱纯):洛阳市化学试剂厂;硫酸铜:天津市瑞金特化学品有限公司;硫酸钾、盐酸:天津市恒兴化学试剂制造有限公司;磷酸:洛阳昊华化学试剂有限公司。除已标明纯级的试剂外,以上其他试剂均为分析纯。
1.2 仪器与设备
3100锤式旋风磨:瑞典Perten公司;UV-2550紫外可见光分光光度计:日本岛津公司;5810R离心机:德国艾本德股份公司;Freezone 6L真空冷冻干燥机:美国Labconco公司;Kjeltec8400凯氏定氮仪:丹麦FOSS公司;SHB-IV循环真空泵:郑州长城科工贸有限公司;Innova 40气浴恒温摇床:美国New Brunswick Scientific公司;Waters 2707高效液相色谱仪:美国Waters公司;SX2-5-12电阻炉:天津市中环实验电炉有限公司;SUS304食品级粉碎机:永康市艾泽拉电器有限公司。
1.3 方法
1.3.1 糯玉米基础理化指标的测定
参照叶俊芳等[19]的方法测定糯玉米碴中淀粉的含量;参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》中的方法测定灰分含量;参照GB5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的方法测定蛋白质含量;参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的方法测定脂肪含量;参照直链淀粉检测试剂盒(K-AMYL)说明书测定总淀粉中直链淀粉含量。
1.3.2 糯玉米淀粉的制备
糯玉米淀粉的提取参照王亚丹[20]的方法并适当修改,具体方法如下:称取19 g~21 g糯玉米碴样品,在料液比1∶3(g/mL)的浸泡液中浸泡。使用食品级粉碎机将糯玉米碴打碎成浆液,浆液先过50目筛网,后过200目筛网,用蒸馏水冲洗筛上物,直至滤网滤下液体呈澄清透明状,对上述滤液进行抽滤,获得粗淀粉(即滤饼),加水洗涤,经多次离心(8 000 r/min,10 min)清洗后进行真空冷冻干燥,过100目筛后即为糯玉米淀粉。
1.3.3 淀粉提取率的计算
参照叶俊芳等[19]的方法测定所提取的糯玉米淀粉的干基含量。使用李晓娜等[21]的方式计算糯玉米淀粉的提取率,具体公式如下。
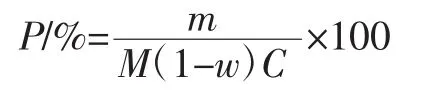
式中:P为糯玉米淀粉提取率,%;m为提取样品中的糯玉米淀粉质量,g;M为糯玉米碴质量,g;w为糯玉米碴含水量,%;C为糯玉米碴中淀粉的干基含量,%。
1.3.4 游离淀粉含量的测定
参照闫荣[22]的方法并稍作修改,称取1.00 g玉米碴样品,在不同的浸泡条件下使用碘显色法测定游离淀粉的含量。
1.3.5 可溶性蛋白的测定
参照闫荣[22]的方法测定浸泡液中的可溶性蛋白含量,使用邓丽莉等[23]的方法建立标准曲线(Y=6.169 1X+0.004 7,R2=0.999 6;X 为蛋白质浓度,mg/mL;Y 为吸光度)。
1.3.6 单因素试验
以糯玉米淀粉提取率、游离淀粉含量及可溶性蛋白含量为指标,探究乳酸浓度(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%)、亚硫酸浓度(0.1%、0.2%、0.3%、0.4%、0.5%)、L-半胱氨酸浓度(0.2%、0.4%、0.6%、0.7%、0.8%、0.9%、1.0%)、浸泡时间(2、4、6、8、10 h)及浸泡温度(46、48、50、52、54、56、58、60 ℃)对糯玉米淀粉提取率、游离淀粉含量和可溶性蛋白含量的影响。
1.3.7 最佳提取工艺参数的优化试验
根据单因素试验结果,选取亚硫酸浓度、浸泡时间、浸泡温度3个因素进行响应面Box-Behnken试验设计,以糯玉米淀粉提取率作为评价指标,因素水平设计见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experimental design
1.3.8 数据处理与分析
所有数据均为3次试验结果的平均值,P<0.05表示数据间具有显著差异。使用软件SPSS 25分析数据的差异显著性,软件Origin 8.5进行图形的绘制,软件Design-Expert 11进行Box-Behnken试验设计及分析。
2 结果与分析
2.1 浸泡液对糯玉米淀粉提取的影响
2.1.1 乳酸浓度对糯玉米淀粉提取的影响
乳酸浓度的变化对糯玉米淀粉提取的影响见图1。
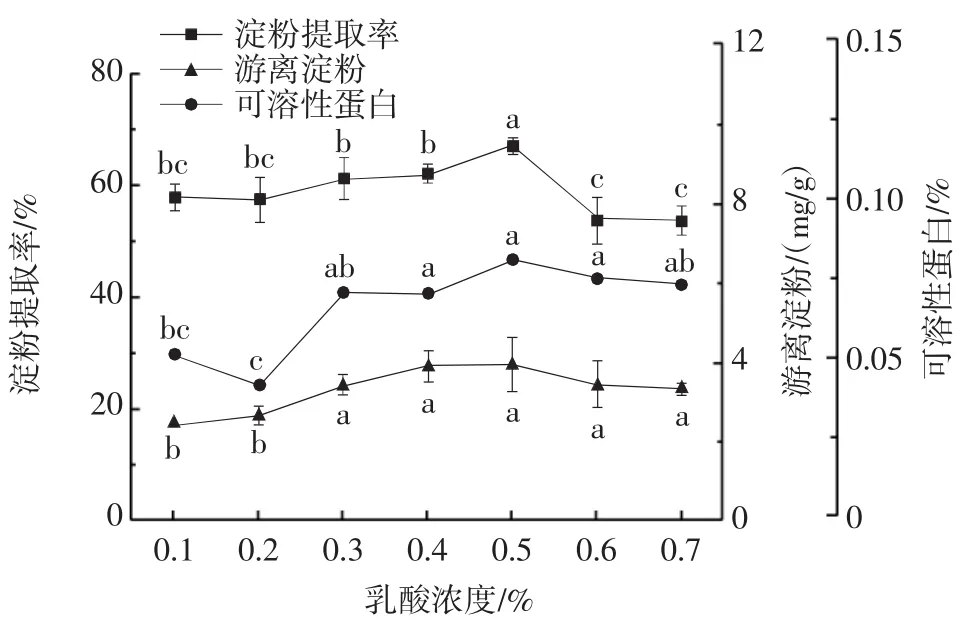
图1 乳酸浓度对糯玉米淀粉提取的影响Fig.1 The effect of lactic acid concentration on the extraction rate of waxy corn starch
由图1可知,乳酸浓度从0.1%升高到0.5%时,糯玉米淀粉提取率逐渐增大,当乳酸浓度为0.2%~0.3%时浸泡溶液中可溶性蛋白的含量显著升高(P<0.05);乳酸浓度为0.5%时,淀粉提取率达到最大值(66.12%),随着乳酸浓度继续增加,糯玉米淀粉的提取率呈下降趋势,游离淀粉与可溶性蛋白含量变化趋于稳定,这可能是由于淀粉被蛋白质紧密地包裹,而乳酸可以使玉米蛋白质软化并加快糯玉米的膨胀速率,适量的乳酸浓度促进了蛋白质的溶解,有效地削弱了蛋白质网络结构的强度,使糯玉米碴中淀粉与蛋白质的结合力下降,淀粉游离出来的“通道”被扩宽,因此糯玉米淀粉更容易从结构中脱离,但乳酸浓度过高时会导致蛋白质变性,使糯玉米淀粉与蛋白质的分离难度增加,进而降低了糯玉米淀粉的提取率,这同Roushdi等[24]的结论一致。因此,乳酸浓度0.5%时适合糯玉米淀粉的提取。
2.1.2 亚硫酸浓度对糯玉米淀粉提取的影响
亚硫酸浓度的变化对糯玉米淀粉提取的影响见图2。

图2 亚硫酸浓度对糯玉米淀粉提取的影响Fig.2 The effect of sulfurous acid concentration on the extraction rate of waxy corn starch
由图2可知,亚硫酸浓度对糯玉米淀粉提取率的影响呈先上升后下降的趋势。当亚硫酸浓度为0.1%~0.3%时,随着亚硫酸浓度的升高,淀粉提取率、游离淀粉和可溶性蛋白的含量均逐渐上升,当亚硫酸浓度升至0.3%时,淀粉提取率最高(73.83%),这是由于亚硫酸具有还原性,可以还原蛋白质中的二硫键,破坏束缚淀粉的蛋白质网络结构[25],使淀粉更容易与蛋白质脱离,从而提高了糯玉米的淀粉提取率。当亚硫酸浓度大于0.3%时,淀粉提取率及游离淀粉的含量降低,这可能是在浸泡过程中,部分玉米蛋白质溶解于浸泡液中,所形成的小分子多肽等物质会将淀粉颗粒包裹[26],同时,亚硫酸浓度增大会使浸泡体系的pH值降低,导致部分蛋白质变性,这也会阻碍蛋白质和淀粉的分离,进而降低糯玉米淀粉的提取率及游离淀粉的含量。因此,亚硫酸浓度0.3%适于糯玉米淀粉的提取。
2.1.3 L-半胱氨酸浓度对糯玉米淀粉提取的影响
L-半胱氨酸浓度的变化对糯玉米淀粉提取的影响见图3。

图3 L-半胱氨酸浓度对糯玉米淀粉提取的影响Fig.3 The effect of L-cysteine concentration on the extraction rate of waxy corn starch
由图3可知,当L-半胱氨酸浓度为0.2%~0.6%时,对糯玉米淀粉提取率的影响不显著(P>0.05),当L-半胱氨酸浓度为0.6%~0.8%时,糯玉米淀粉的提取率及可溶性蛋白的含量逐渐升高,这可能是由于L-半胱氨酸的活性巯基基团具有还原蛋白质中二硫键的能力[27],削弱了淀粉与蛋白质间的结合力,促进了糯玉米淀粉的分离,因此,提高了糯玉米淀粉的提取率和可溶性蛋白的含量。当L-半胱氨酸浓度为0.8%时,糯玉米淀粉的提取率达到最大值(73.69%)。当L-半胱氨酸浓度大于0.8%时,糯玉米淀粉提取率、游离淀粉及可溶性蛋白的含量均逐渐降低,这主要是由于L-半胱氨酸浓度增大,浸泡体系的pH值降低,同时,玉米碴浸泡过程中存在乳酸菌的生长繁殖和乳酸的合成[28],进一步使pH值降低,从而导致部分蛋白质的变性,造成淀粉提取率的下降。因此,L-半胱氨酸浓度0.8%时适宜糯玉米淀粉的提取。
综上所述,采用乳酸浸泡液提取糯玉米淀粉的提取率较低;采用亚硫酸浸泡液或L-半胱氨酸浸泡液提取糯玉米淀粉的提取率较高且差别不大,基于成本因素,选取亚硫酸作为提取糯玉米淀粉的最适浸泡液并进行后续试验。
2.2 浸泡时间对糯玉米淀粉提取的影响
浸泡时间对糯玉米淀粉提取的影响见图4。
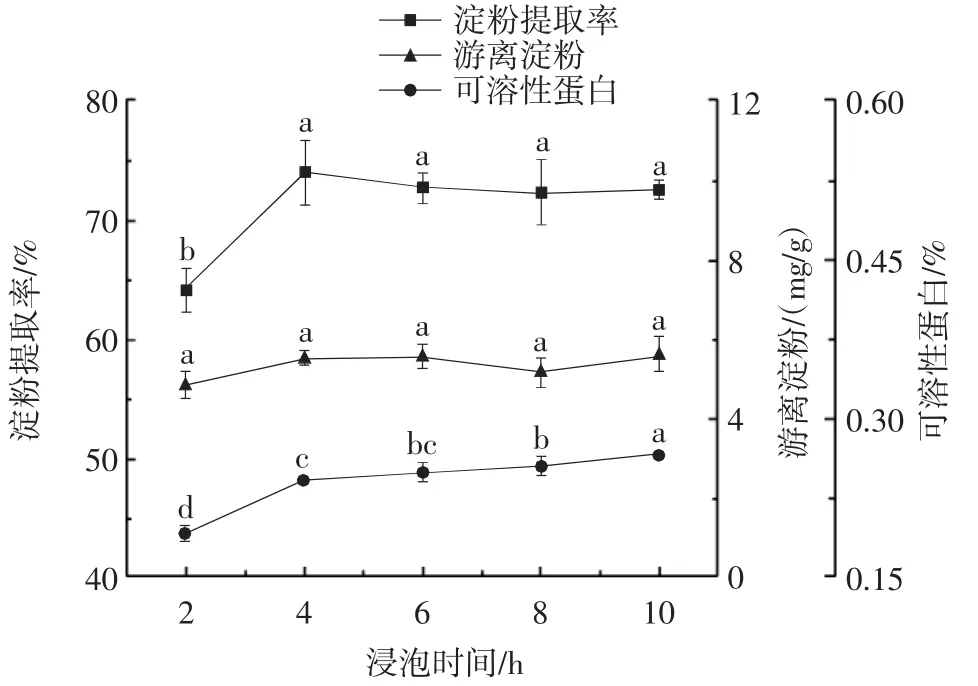
图4 浸泡时间对糯玉米淀粉提取的影响Fig.4 The effect of soaking time on the extraction rate of waxy corn starch
由图4可知,在浸泡2 h~4 h时糯玉米淀粉的提取率显著上升(P<0.05),延长浸泡时间发现糯玉米淀粉的提取率与4 h时的淀粉提取率无显著差异(P>0.05)。在浸泡时间2 h~10 h内,游离淀粉的含量无显著差异(P>0.05);可溶性蛋白的含量在浸泡2 h~4 h时快速升高,浸泡4 h~10 h时上升缓慢。这说明亚硫酸浸泡液在前4 h已经浸透糯玉米碴,浸泡4 h~10 h时糯玉米淀粉提取率无显著差异(P>0.05)。这与玉米粒浸泡36 h~60 h相比,明显缩短了糯玉米淀粉提取所需要的浸泡时间,有效提高生产效率。
2.3 浸泡温度对糯玉米淀粉提取的影响
浸泡温度对糯玉米淀粉提取的影响见图5。

图5 浸泡温度对糯玉米淀粉提取的影响Fig.5 The effect of soaking temperature on the extraction rate of waxy corn starch
由图5可知,当浸泡温度为46℃~52℃时,随着浸泡温度的升高,糯玉米淀粉的提取率逐渐升高,当浸泡温度为52℃时,糯玉米淀粉的提取率最高。但浸泡温度大于54℃时,糯玉米淀粉的提取率变化不显著(P>0.05);可溶性蛋白的含量在浸泡温度54℃~56℃时显著增加(P<0.05),说明此温度条件适宜玉米蛋白质的溶解,而在58℃~60℃时可溶性蛋白的含量显著下降(P<0.05),这可能是由于较高的温度使蛋白质发生了变性,可溶性蛋白的含量逐渐降低,这与陈龙凤[29]的研究结论相似。游离淀粉含量在54℃~60℃时呈显著升高的趋势(P<0.05),这是由于糯玉米淀粉易糊化,导致部分淀粉吸水膨胀并溶解于水中,使糯玉米淀粉的提取率下降。因此,提取糯玉米淀粉的浸泡温度不宜过高,较适宜的浸泡温度为50℃~54℃。
2.4 响应面试验优化糯玉米淀粉提取工艺参数
对比不同浸泡条件对糯玉米淀粉提取率、游离淀粉及可溶性蛋白含量的影响,选取影响效果显著的亚硫酸浸泡液、浸泡时间和浸泡温度进行响应面试验设计,以糯玉米淀粉提取率作为评价指标,响应面试验设计及结果见表2。

表2 响应面试验设计和结果Table 2 Design and results of response surface experiment
利用Design Expert拟合得到淀粉提取率(Y)与各因素的二次回归模型:Y=75.17+1.82X1+1.83X2-1.39X3-2.73X1X2+0.491 2X1X3+0.174 5X2X3-4.08X12-2.59X22-1.93X32。回归模型的方差分析结果见表3。

表3 回归模型的方差分析Table 3 The variance analysis of the regression model

续表3 回归模型的方差分析Continue table 3 The variance analysis of the regression model
由表3可知,通过响应面建立的回归模型P<0.01,失拟项P>0.05,表明建立的回归模型显著性及拟合性强,其中 R2=0.973 8,R2Adj=0.940 1,信噪比大于 4,表明回归方程可以模拟并分析糯玉米淀粉的提取率。3个因素(亚硫酸浓度、浸泡时间和浸泡温度)的一次项和二次项均极显著影响糯玉米淀粉的提取率(P<0.01)。根据F值大小可判断各因素对糯玉米淀粉提取率的影响大小,由大到小依次为浸泡时间、亚硫酸浓度、浸泡温度。某些因素间的交互作用对响应值也很重要[30-31],亚硫酸浓度与浸泡时间的交互作用极显著影响糯玉米淀粉的提取率(P<0.01),而亚硫酸浓度和浸泡温度间的交互作用、浸泡时间和浸泡温度间的交互作用对糯玉米淀粉提取率的影响不显著(P>0.05)。
为了进一步研究各因素之间的交互作用对糯玉米淀粉提取率的影响效果,通过Design-Expert绘制的3D响应曲面及2D等高线见图6。

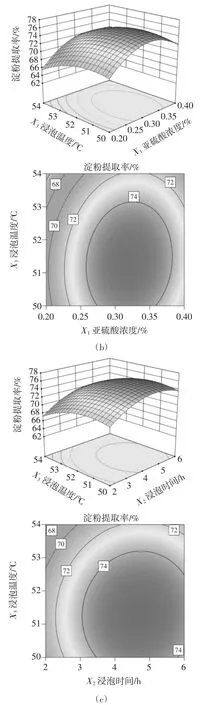
图6 因素之间的交互作用对糯玉米淀粉提取率的影响Fig.6 The effect of the interaction between factors on the extraction rate of waxy corn starch
由图6(a)可知,亚硫酸浓度与浸泡时间之间存在极显著的交互作用(P<0.01)。在浸泡 2 h~4 h时,随着亚硫酸浓度的增加,淀粉提取率呈先升高后降低的趋势;亚硫酸浓度在0.30%~0.35%时,随着浸泡时间的延长,淀粉提取率出现最高值。
根据上述回归模型,采用响应面试验优化得到糯玉米淀粉最适的提取工艺参数:亚硫酸浓度0.31%、浸泡时间4.45 h、浸泡温度51.4℃,模型预测糯玉米淀粉的提取率为75.74%。该优化条件下糯玉米淀粉的实际提取率为76.36%,与糯玉米淀粉的预测值无显著性差异(P>0.05),优化后的糯玉米淀粉提取工艺明显缩短了浸泡时间,不仅能够降低能耗,还能够有效提高生产效率。
根据最适工艺参数提取的糯玉米淀粉,其基础理化指标:淀粉含量99.40%、蛋白质含量0.23%、灰分含量0.03%、粗脂肪含量0.19%,符合国家标准GB/T 8885—2017《食用玉米淀粉》。
3 结论
以糯玉米碴为原料,采用单因素试验研究浸泡液种类、浸泡液浓度、浸泡时间、浸泡温度对糯玉米淀粉提取率的影响,确定了亚硫酸溶液为提取糯玉米淀粉的最适浸泡液。在单因素试验基础上,采用响应面试验优化确定了糯玉米淀粉的最适提取工艺参数(亚硫酸浓度0.31%、浸泡时间4.45h、浸泡温度51.4℃)。在该优化条件下,糯玉米淀粉的实际提取率可达76.36%,提取的糯玉米淀粉基础理化指标:淀粉含量99.40%、蛋白质含量0.23%、灰分含量0.03%、粗脂肪含量0.19%。该优化条件缩短了糯玉米淀粉的提取时间,还降低了能耗,可有效提高生产效率,而且提取的天然糯玉米淀粉的纯度较高,在食品工业具有较大的应用潜力。
