基于HIF-1α/ERK通路探讨异丙酚对缺氧大鼠海马神经元线粒体损伤的影响*
2023-02-04妙永惠阎文军
妙永惠,阎文军
(1.临夏州人民医院 麻醉科,甘肃 临夏 731100;2.甘肃省人民医院 麻醉科,甘肃 兰州 730000)
脑缺血性疾病属于发病率、致死率和致残率高的临床常见疾病,严重威胁患者生命安全[1]。海马神经元对缺氧反应十分敏感,线粒体损伤是神经元缺氧损伤的关键环节,探讨海马神经元缺氧损伤机制有重要的临床意义[2]。近年来,麻醉药的脑保护作用逐渐成为研究热点。异丙酚对脏器保护及缺血再灌注损伤影响的研究已有报道[3-4]。既往研究显示[5],异丙酚具有减轻脑缺血再灌注损伤的保护作用,但其对线粒体损伤的影响及具体机制尚无定论。本研究通过体外培养大鼠原代海马神经元,并应用糖氧剥夺法复制海马神经元缺氧损伤模型,旨在观察不同剂量异丙酚对缺氧海马神经元线粒体损伤的作用,并探讨其可能的调控机制。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级新生SD 大鼠(24 h 内)2 只,性别不限,体重(8±2)g,健康(皮肤黏膜红润,运动正常),购自浙江维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(浙)2019-0001,实验动物使用许可证号:SYXK(甘)2018-005]。
1.2 主要试剂与仪器
异丙酚(英国阿斯利康制药有限公司,批准文号:H20130535),缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)/细胞外调节激酶(extracellular signal-regulated kinase,ERK)特异性抑制剂U0126(武汉艾美捷科技有限公司),DMEM-F12培养液、Neurobasal-A 培养液(美国HyClone 公司),多聚赖氨酸(美国Sigma 公司),钙调神经磷酸酶(Calcineurin,GaN)检测试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(南京建成生物工程研究所),钙离子荧光探针(FLuo-AM)、聚乳酸聚合物(Pluronic F127)(海门市碧云天生物技术研究所),2,7-二氯荧光素二乙酸酯探针(2,7-Dichlorofluorescein diacetate,DCFH-DA)(北京百奥莱博科技有限公司),兔抗大鼠HIF-1α、ERK1/2、磷酸化ERK1/2(p-ERK1/2)、天冬氨酸特异性半胱氨酸蛋白酶3(cysteine-containing aspartate-specific proteases 3,Caspase-3)多抗(一抗)及辣根或氧化物酶标记的山羊抗兔IgG 单抗(二抗)(美国Abcam 公司)。QP-80 型三气培养箱(美国Thermo 公司),CKX53 型倒置光学显微镜、FV3000 型激光共聚焦显微镜(日本奥林巴斯株式会社),Infinite F50 型酶标仪(瑞士TECAN 公司),Mini-PROTEAN Tetra 型电泳仪(美国Bio-Rad 公司)。
1.3 方法
1.3.1 原代海马神经元分离和培养 新生SD 大鼠断头处死,无菌取海马组织,置于DMEM-F12 培养液(20%胎牛血清),更换0.25%胰蛋白酶消化处理25 min,吸管吹打均匀,加入DMEM-F12 培养液终止消化,消化液过200 目滤网,滤液经1 000 r/min 离心5 min,取沉淀,DMEM-F12 培养液重悬。调整细胞密度为5×105个/mL,培养于多聚赖氨酸包被的培养皿中,95% O2、5% CO2、37℃及饱和湿度条件下,培养24 h 后替换Neurabasal-A 培养液(2% B27+1% L-谷氨酰胺+1%丙酮酸钠),倒置显微镜下观察细胞生长情况,培养至第3 天加入4 mg/L 的阿糖胞苷抑制非神经细胞过度增殖,每3 天半量换液1 次,倒置显微镜观察细胞形态,培养至第8 天采用免疫细胞化学染色法观察神经元特异性烯醇化酶表达,细胞浆和突起棕褐色阳性染色细胞即为海马神经元细胞,阳性细胞占总细胞数92%以上即可用于后续实验[6]。
1.3.2 分组及干预方法 培养至第8 天原代海马神经元细胞分为6 组,每组3 个复孔。对照组:用高糖DMEM 培养液替换Neurabasal-A 培养液;缺氧组:用低糖DMEM 培养液替换Neurabasal-A 培养液;低剂量异丙酚组(LP 组)、中剂量异丙酚组(MP 组)和高剂量异丙酚组(HP 组):用含终浓度分别为3 mg/L、6 mg/L、12 mg/L 异丙酚的低糖DMEM 培养液替换Neurabasal-A 培养液;U0126 组:用含终浓度12 mg/L异丙酚+50 μmol/L U0126 的低糖DMEM 培养液替换Neurabasal-A 培养液。对照组细胞于95% O2、5%CO2、37℃及饱和湿度条件培养24 h;缺氧组、LP 组、MP 组、HP 组和U0126 组细胞于95% N2、5% CO2、37℃及饱和湿度条件培养24 h。
1.3.3 透射电镜观察海马神经元细胞形态 收集干预24 h 后的各组细胞,PBS 吹洗3 次后,加入胰蛋白酶消化获得细胞沉淀,加入20 倍沉淀体积的固定液于4℃固定48 h,磷酸盐缓冲液(PBS)洗涤3 次后,参照文献[7]制作厚度为50 nm 超薄切片,经醋酸双氧铀双面染色后,于透射电镜下观察细胞超微结构,并拍摄照片。
1.3.4 MTT 法检测细胞存活率 收集干预24 h 后的各组细胞,分别加入0.5 g/L MTT溶液,继续培养3 h,加入20%的十二烷基磺酸钠溶液,充分混匀溶解结晶,应用酶标仪测定490 nm 波长处的吸光度值。计算细胞存活率=各干预组吸光度值/对照组吸光度值×100%。
1.3.5 激光共聚焦显微镜检测Ca2+、活性氧(ROS)的荧光强度 原代海马神经元细胞培养于加有载玻片的24 孔板,按照上述缺氧和干预方法处理24 h,Hank's 液洗涤3 次。每孔加入5 μmol/L FLuo-AM 和质量浓度0.05% Pluronic F127 混合液(Ca2+荧光强度检测),或每孔加入10 μmol/L DCFH-DA 探针(ROS荧光强度检测)。37℃避光孵育30 min,Hank's 液洗涤3 次,并用Hank's 液继续避光孵育30 min,然后用4%多聚甲醛固定、封片,激光共聚焦显微镜(激发波488 nm、发射波525 nm)观察拍照,应用Image J 图像分析软件分析荧光强度。
1.3.6 酶联免疫吸附试验检测细胞GaN 活性 收集干预24 h 后的各组细胞,PBS 洗涤并重悬细胞,加入细胞裂解液于冰上裂解20 min,12 000 r/min 离心15 min(离心半径12 cm),取上清液,BCA 法检测蛋白浓度,按照GaN 检测试剂盒说明书步骤操作,检测细胞GaN 活性。
1.3.7 Western blotting检测细胞的HIF-1α、ERK1/2、p-ERK1/2、Caspase-3 蛋白相对表达量 收集干预24 h 后的各组细胞,PBS 洗涤并重悬细胞,加入细胞裂解液于冰上裂解20 min,12 000 r/min 离心15 min(离心半径12 cm),取上清液,于沸水水浴10 min 变性,再次离心取上清液,BCA 法检测蛋白浓度。取50 μg 待测蛋白进行恒定电流的十二烷基硫酸钠聚丙烯酰胺凝胶电泳约1.5 h,分离胶电转至硝酸纤维素膜,5%脱脂奶粉封闭2 h,加入稀释一抗HIF-1α(1∶400)、ERK1/2、p-ERK1/2、Caspase-3(1∶500),4℃过夜,含Tris-Hcl 的吐温20 缓冲液(TBST)洗涤3 次,每次10 min,加入稀释二抗(1∶5 000)室温孵育2 h,TBST 再次洗涤,加入电化学发光液显色,以β-actin为内参,蛋白条带应用Image J 图像分析软件分析目的蛋白相对表达量。
1.4 统计学方法
数据处理采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用方差分析,进一步两两比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组海马神经元形态改变
对照组线粒体膜和嵴结构完整清晰,数量多;缺氧组线粒体数量少且肿胀,嵴完整性和连续性破坏,空泡化严重;LP 组、MP 组和HP 组线粒体上述损伤均有所减轻,其中HP 组减轻最为明显;U0126 组线粒体损伤较HP 组严重。见图1。
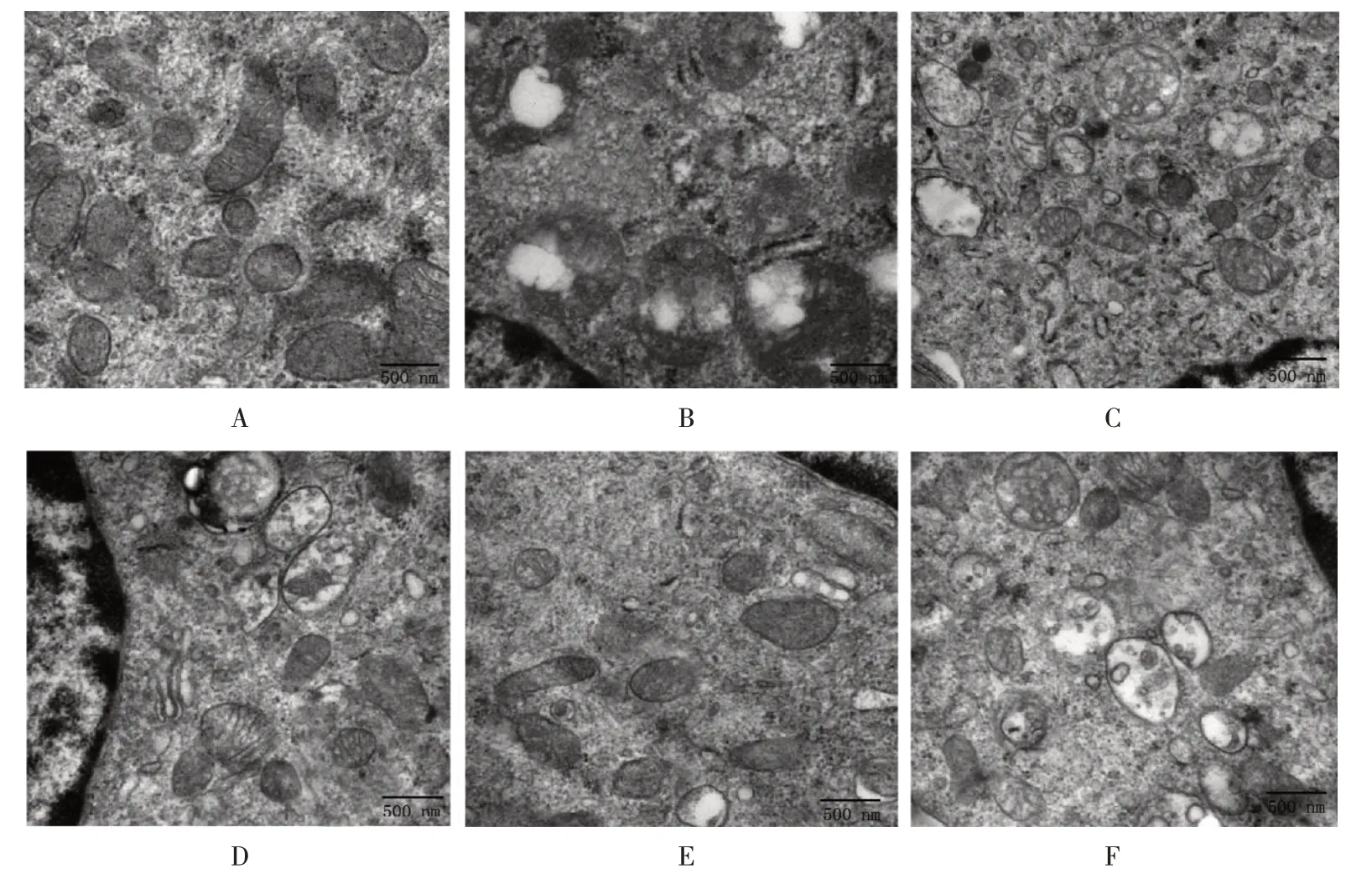
图1 各组海马神经元线粒体超微结构(透射电镜×15 000)
2.2 各组海马神经元细胞存活率的比较
各组海马神经元细胞存活率分别为:对照组(95.65±4.20)%、缺氧组(42.30±3.64)%、LP 组(45.41±4.22)%、MP 组(59.54±5.19)%、HP 组(70.81±6.47)%、U0126 组(53.08±5.61)%,各组比较,经方差分析,差异有统计学意义(F=174.790,P=0.000);进一步两两比较,结果:与对照组比较,缺氧组海马神经元细胞存活率降低(P<0.05);与缺氧组比较,MP 组、HP 组及U0126 组海马神经元细胞存活率升高,且HP 组高于MP 组和U0126 组(P<0.05);缺氧组与LP 组比较,差异无统计学意义(P>0.05)。
2.3 各组海马神经元Ca2+、ROS荧光强度的比较
各组海马神经元Ca2+、ROS 荧光强度比较,经方差分析,差异有统计学意义(F=155.230 和224.164,均P=0.000);进一步两两比较,与对照组比较,缺氧组海马神经元Ca2+、ROS 荧光强度均升高(P<0.05);与缺氧组比较,LP 组ROS 荧光强度降低(P<0.05),Ca2+荧光强度差异无统计学意义(P>0.05);与缺氧组比较,MP 组、HP 组及U0126 组海马神经元Ca2+、ROS 荧光强度均降低,且HP 组低于MP 组和U0126 组(P<0.05)。见表1。
表1 各组海马神经元细胞Ca2+、ROS荧光强度的比较(±s)
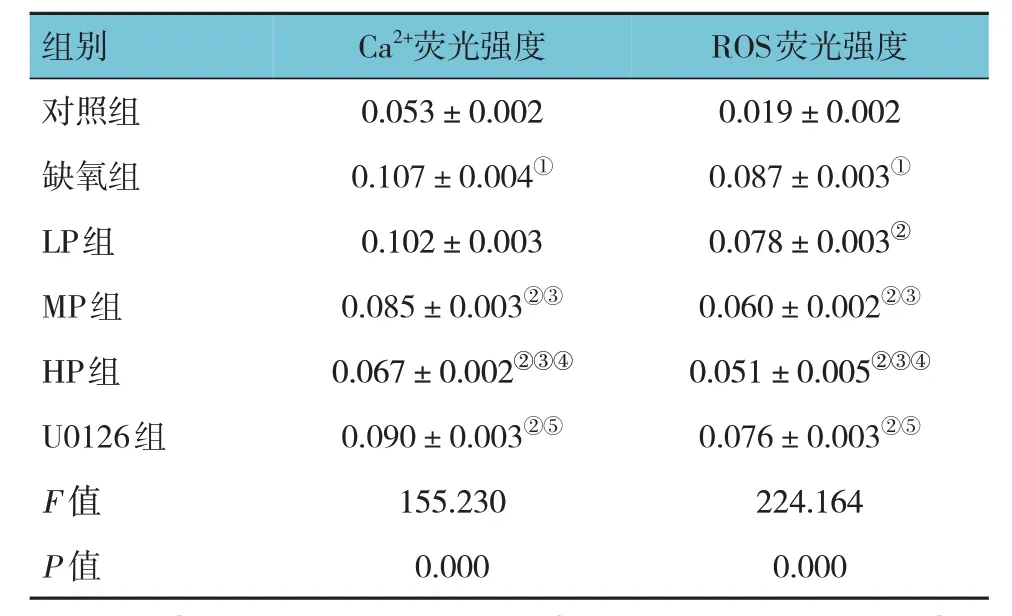
表1 各组海马神经元细胞Ca2+、ROS荧光强度的比较(±s)
注:①与对照组比较,P <0.05;②与缺氧组比较,P <0.05;③与LP 组比较,P <0.05;④与MP 组比较,P <0.05;⑤与HP 组比较,P <0.05。
2.4 各组海马神经元细胞GaN活性的比较
各组海马神经元细胞GaN 活性分别为:对照组(0.23±0.02)u/mg、缺氧组(0.61±0.05)u/mg、LP 组(0.59±0.06)u/mg、MP 组(0.50±0.05)u/mg、HP 组(0.37±0.04)u/mg、U0126 组(0.54±0.04)u/mg,各组海马神经元细胞GaN 活性比较,经方差分析,差异有统计学意义(F=123.120,P=0.000);进一步两两比较,与对照组比较,缺氧组海马神经元GaN 活性升高(P<0.05);与缺氧组比较,MP 组、HP 组及U0126 组海马神经元GaN 活性降低,且HP 组低于MP 组和U0126 组(P<0.05);缺氧组与LP 组比较,差异无统计学意义(P>0.05)。
2.5 各组海马神经元细胞HIF-1 α、ERK1/2、p-ERK1/2、Caspase-3 蛋白相对表达量比较
各组海马神经元细胞HIF-1α、p-ERK1/2、Caspase-3 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),各组ERK1/2 蛋白相对表达量比较,经方差分析,差异无统计学意义(P>0.05);进一步两两比较,与对照组比较,缺氧组HIF-1α、p-ERK1/2、Caspase-3 蛋白相对表达量升高(P<0.05);与缺氧组比较,LP 组、MP 组、HP 组及U0126 组HIF-1α、p-ERK1/2 蛋白相对表达量升高,且HP 组高于LP 组、MP 组和U0126 组(P<0.05);与缺氧组比较,LP 组、MP 组、HP 组 及U0126 组Caspase-3 蛋白相对表达量降低,且HP 组低于LP组、MP 组和U0126 组(P<0.05);缺氧组与LP 组比较,差异无统计学意义(P>0.05)。见图2 和表2。
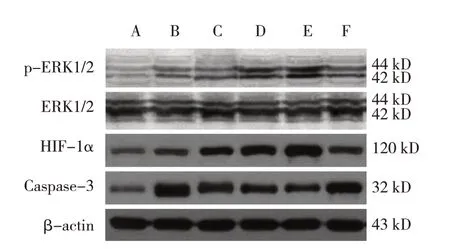
图2 各组海马神经元细胞HIF-1α、ERK1/2、p-ERK1/2、Caspase-3蛋白表达
表2 各组海马神经元细胞HIF-1α、ERK1/2、p-ERK1/2、Caspase-3蛋白相对表达量的比较(±s)
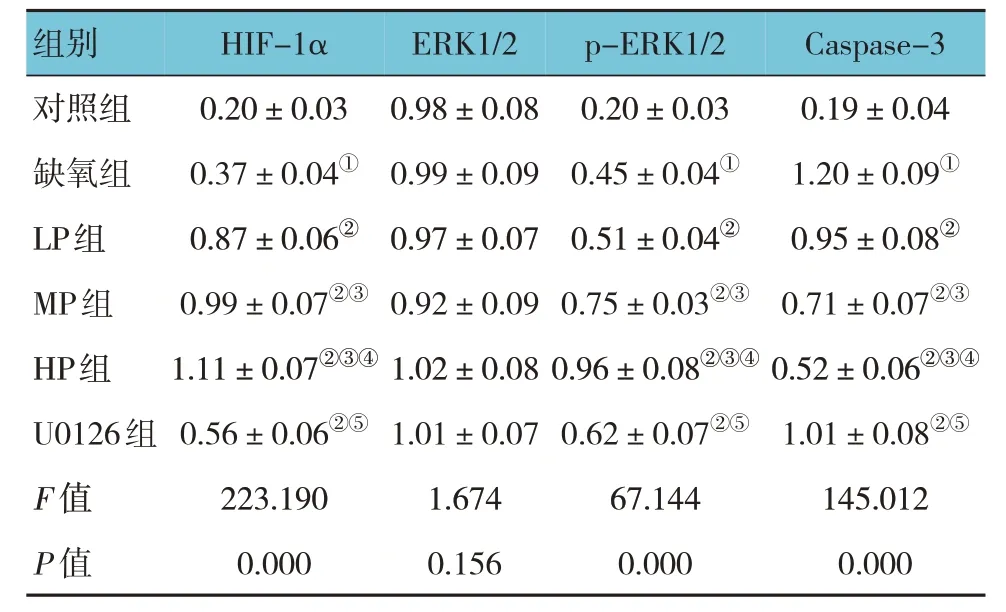
表2 各组海马神经元细胞HIF-1α、ERK1/2、p-ERK1/2、Caspase-3蛋白相对表达量的比较(±s)
注:①与对照组比较,P <0.05;②与缺氧组比较,P <0.05;③与LP 组比较,P <0.05;④与MP 组比较,P <0.05;⑤与HP 组比较,P <0.05。
3 讨论
脑组织对缺氧十分敏感,尤其是海马神经元,短时间的缺氧即可造成不可逆损伤,其机制十分复杂,目前仍未完全阐明[8-9]。研究认为,氧化应激、胞内钙超载是神经元缺氧损伤的重要机制,脑组织缺氧后,突触过度激活引起Ga2+通道开放,细胞外Ga2+大量内流,同时自由基大量生成,导致线粒体膜去极化发生结构改变[10]。进一步促使Ga2+通道开放,胞内钙超载,加重神经元损伤。胞内钙超载导致的线粒体损伤可加速神经元凋亡,目前该机制已成为研究的热点领域[11-13]。目前关于异丙酚对缺氧海马神经元线粒体损伤的影响及具体机制仍需深入研究,为其临床应用提供理论支持。
本研究结果显示,缺氧组海马神经元存活率低于对照组,细胞内线粒体超微结构损伤严重,Ca2+、ROS 荧光强度、GaN 活性高于对照组,说明缺氧可导致细胞外Ga2+大量内流,造成海马神经元线粒体损伤,最终引起海马神经元死亡。本研究进一步应用不同浓度异丙酚作用于体外培养海马神经元,结果发现,MP 组、HP 组线粒体损伤减轻,且细胞存活率高于缺氧组,Ca2+、ROS 荧光强度、GaN 活性均低于缺氧组,提示异丙酚具有减少海马神经元钙超载,清除自由基,缓解胞内线粒体损伤的作用。研究表明,异丙酚可激活γ-氨基丁酸A 型(GABAA)受体,可以选择性地让Cl-通过,引起细胞膜超极化,Ga2+内流[14]。另有研究表明,异丙酚可通过抑制N-甲基-D-天冬氨酸受体毒性,变构调节门控通道,发挥细胞保护作用[15]。动物实验研究显示[16],丙泊酚可有效缓解七氟烷诱导的大鼠海马神经细胞损伤,抑制炎症反应和神经元凋亡,从而发挥认知损伤保护作用。XU 等[17]的研究显示,低浓度丙泊酚可增强海马神经元活力,抑制其凋亡,与本研究结果相似,但在其研究中高浓度丙泊酚可降低海马神经元活力,促进其凋亡,可能与p38 丝裂原活化蛋白激酶磷酸化水平有关,这与本研究结果不一致,其原因可能为本研究选用的细胞糖氧剥夺模型而使研究结果差异。
本研究发现,缺氧组HIF-1α、p-ERK1/2、Caspase-3 蛋白相对表达量均高于对照组,不同浓度异丙酚干预后上述蛋白表达量降低,提示丙泊酚抑制细胞内线粒体损伤的作用可能与抑制HIF-1α/ERK 信号通路激活有关。HIF-1α/ERK 是细胞缺氧损伤相关的关键信号通路之一。HIF-1α 属于细胞内具有转录活性的核蛋白,缺氧条件下大量表达调控多种基因转录和翻译,以适应缺氧环境[18]。ERK1/2 磷酸化水平与缺氧及细胞凋亡关系密切,可直接影响HIF-1α 转录活性,同时可调控下游凋亡关键蛋白酶Caspase-3 的表达[19-20]。本研究在高剂量异丙酚基础上应用HIF-1α/ERK 信号通路抑制剂U0126 干预,结果显示,与HP 组比较,U0126 组线粒体损伤程度较重,细胞存活率降低,Ca2+、ROS荧光强度及GaN 活性升高,且HIF-1α、p-ERK1/2 蛋白相对表达量降低,Caspase-3 蛋白表达量升高,进一步说明异丙酚可通过激活HIF-1α/ERK 信号通路发挥减轻大鼠海马神经元线粒体损伤的作用。
综上所述,不同浓度异丙酚作用于体外培养海马神经元可减少细胞内Ca2+、ROS 荧光强度,抑制GaN 活性,减轻缺氧大鼠海马神经元线粒体损伤,其调控机制可能与HIF-1α/ERK 信号通路有关。海马神经元糖氧剥夺损伤是多种分子机制共同作用的结果,线粒体损伤导致的能量代谢异常是导致细胞凋亡的主要原因之一,其机制也存在复杂性。本研究仅从HIF-1α/ERK 信号通路分析了异丙酚对线粒体损伤影响的机制,后续研究重点将探讨异丙酚能否通过其他途径影响神经元线粒体损伤,为临床提供更多的理论依据。
