水稻内生成团泛菌YS19与菠萝泛菌YJ76共培养提高环境胁迫生存适应性
2023-02-02孙远浩周心怡何新宇杨逸轩冯永君
孙远浩, 周心怡, 何新宇, 杨逸轩, 冯永君,2*
(1. 北京理工大学 生命学院,北京 100081;2. 岭南现代农业科学与技术广东省实验室深圳分中心农业部农业基因数据分析重点实验室 中国农业科学院农业基因组研究所,广东 深圳 518120)
植物内生菌是指能定殖在健康植物组织内并与植物建立了和谐联合关系的一类微生物[1]。它们可以主动侵染定殖在健康植物组织中,大部分菌体的定殖都能使内生菌和植物彼此受益[2-3]。成团泛菌(Pantoeaagglomerans)是一种重要的环境微生物,广泛分布于植物、动物、空气、土壤、水等各种环境中[4]。成团泛菌YS19是从水稻“越富”品种中分离出的一种优势内生菌,其在植株的各个生长阶段的各个器官中大量分布[5]。YS19表现出很强的固氮活性,分泌各类植物激素,调节光合产物由茎、叶向穗的转移,具有促进水稻增产的潜力[6]。前期相关的研究表明,YS19生长到一定阶段或感受逆境时会形成菌体聚集的共质体结构[7-8],该结构并非源自细胞分裂产生的单克隆体系,而是由分散的细菌细胞主动聚集形成的[6,9],形成共质体可以减弱环境中逆境因素的侵害[10-12]。 菠萝泛菌(Pantoeaananatis)YJ76是从同一水稻品种中分离得到的一种优势内生菌,其与YS19合计占到在该宿主分离菌总丰度的90%以上,尽管两个菌株都非常有优势,但YS19依然占据了统治性的地位。YJ76同样能分泌多种植物激素,具有很强的固氮活性,与宿主互作时增加水稻苗的生物量[13]。YJ76能大量产生吲哚信号[14],而吲哚是近年来备受关注的一种信号分子,被认为在细菌种内和种间发挥重要调控作用[15]。共质体结构最早由Achouak等[16]报道,细菌聚集形成共质体结构后,在抵抗损伤、增强代谢、适应环境等方面,会产生分散细胞所不具备的一些优势[17]。当细菌处于逆境,如强酸、强碱、抗生素、紫外线、干燥等环境下,形成共质体的菌体能够表达特定应激蛋白以及启动新的代谢模式;另外,大量细菌聚集成团受特定的信号分子调节,具有群体优势,这种优势在菌体定殖、环境栖息中具有重要意义[18-21]。本研究探索了微生态菌体栖息环境下YS19与YJ76的相互作用对共质体形成和抗逆作用的影响,相关研究增加了对植物内生菌间互作关系的认识,为开发新型多菌种协同的生物菌剂并应用到水稻生产实践提供了可借鉴的思路。
1 材料与方法
1.1 材料
1.1.1 供试菌种 成团泛菌(Pantoeaagglomerans)YS19(NCBI 16S rDNA AB033602)和菠萝泛菌(Pantoeaananatis)YJ76(NCBI 全基因组序列号 CP022427)均为北京理工大学生命学院植物与微生物相互作用实验室(本实验室)从水稻“越富”品种中分离得到的植物内生菌。YJ76突变株Δzwf采用Tn5插入突变法筛选获得,突变基因编码葡萄糖-6-磷酸脱氢酶,经测定该基因突变后对菌体的生长没有实质性影响,但吲哚产量相比野生株减少38.59%[22],带有氨苄青霉素、利福平(Amp,Rp)抗性。大肠埃希菌(Escherichiacoli)DH5α,含有pBBR1-MCS-2-GFP质粒,能够表达绿色荧光蛋白(GFP),具有卡那霉素(Kan)抗性,由中国农业科学院农业资源与农业区划研究所魏海雷研究员友好提供。
1.1.2 培养基 LB培养基(g/L):NaCl 10,胰蛋白胨 10,酵母浸提物 5,121 ℃灭菌20 min,配制固体培养基时,琼脂加入量为1.5%(质量分数)。
1.1.3 主要试剂与仪器设备 磷酸缓冲液(PBS,g/L):NaCl 8.0,KCl 0.2,Na2HPO4·12H2O 2.9,KH2PO40.2;ZnSO4、NaCl、Na2HPO4·12H2O、KH2PO4、抗生素、番红等均购自北京索莱宝科技有限公司;质粒小提试剂盒购自赛默飞世尔科技公司。电子天平(JY1002,上海良平仪器仪表有限公司);恒温震荡摇床(TH2-C,苏州培英实验设备有限公司);小型台式高速离心机(I-14,德国Sigma公司);光学显微镜(SK-FL,重庆奥特光学仪器有限公司);激光扫描共聚焦荧光显微镜(CLSM,ZEISS LSM510 META,蔡司集团)。
1.2 方法
1.2.1 培养方法 将甘油保存的两种菌株分别于LB固体培养基上划线,30 ℃倒置培养24 h后,挑取单菌落接种至20 mL LB液体培养基中,培养12 h制备种子液,然后将细胞转接到装有150 mL LB液体培养基的500 mL摇瓶中,培养16 h后备用[12]。本研究中有关细菌的实验,如无特殊说明均以1%(体积分数)接种至培养基中,30 ℃、180 r/min培养。
1.2.2 YJ76-GFP菌株的构建 将含有pBBR1-MCS-2-GFP质粒的E.coliDH5α接种至LB液体培养基中,37 ℃、220 r/min培养12 h,然后使用质粒小提试剂盒提取质粒pBBR1-MCS-2-GFP。制备YJ76感受态细胞并以质粒pBBR1-MCS-2-GFP为材料电击转化[23],转化完成后涂布于LB平板培养至出现单菌落,挑取单菌落接种至LB液体培养基中扩大培养获得能够表达绿色荧光蛋白(GFP)的YJ76-GFP菌株。
1.2.3 YJ76与YS19的共培养及共质体形成 YS19和YJ76共培养时,将培养至指数期的YS19与YJ76均调整到A600=0.6,分别按(10∶0)~(10∶10)的接种量比例转接至LB液体培养基中,但接种时总接种量保持一致(1%,体积分数),培养48 h后,取样测定A600。同时,将菌液滴加于血细胞计数板(1 mm×1 mm),番红染色后在光学显微镜下观察共质体成团平均尺寸,并通过显微计数法测定共质体的成团率(参与成团的菌体细胞占总细胞数的比例)[24]。此外,将YS19和YJ76-GFP按10∶3接种量比例接种培养48 h后,取样用激光扫描共聚焦荧光显微镜观察共质体结构的形成。
1.2.4 抗逆性检测 将YS19、YJ76以及共培养(YS19和YJ76菌株的接种量比例为10∶3)分别独立接种到LB液体培养基中,培养48 h后,取样分别进行重金属、抗生素、紫外线和干燥处理。检测菌体对重金属、抗生素的抗性时,培养基中分别加入化学品(终浓度为1.5 mmol/L ZnSO4;终浓度为40 μg/mL 四环素),培养4 h。将A600调节至0.6的菌液用PBS稀释100倍,转移到培养皿中,在距离15 W紫外灯(波长254 nm)45 cm处,均匀照射30、60、90 s,检测菌体对抗紫外照射能力,在10 mm×10 mm无菌滤纸片上分别滴加50 μL菌液,无菌环境下干燥处理1、2、3 h,干燥结束后用PBS收集菌体,检测菌体抗干燥能力。将处理完成的菌液用PBS稀释并在LB平板上涂布培养,培养完成后进行菌落计数,存活率定义为处理后的菌落形成单位(CFU)数量除以处理前的CFU数量[6],所有实验三个平行。
2 结果与分析
2.1 YS19和YJ76不同接种量比例对协同生长特征的影响
首先观察了YS19单独培养时(YS19∶YJ76=10∶0)共质体形成的状况,发现在LB培养基中培养48 h后,YS19形成了大量共质体结构(图1,YS19),成团率为67.2%,成团的平均尺寸为2.6 μm,菌液A600为1.87。相比之下,培养体系中存在一定量的YJ76可以显著促进共质体的形成(图1,(10∶1)~(10∶3))。显微观察发现,当YS19和YJ76两个菌株接种量比例为10∶3时,对共质体形成促进效果最显著(图1),统计学分析表明,在该接种量比例下共质体成团平均尺寸、成团率均达到最高(图2),与其他接种比例之间存在显著性差异(P<0.05)。此时成团率最大为79.2%,相较YS19单独培养时增幅17.8%;成团平均尺寸为4.7 μm,增幅80.7%;A600为2.38时,增幅27.3%。随着YJ76添加比例的增加,对共质体形成的促进作用逐步弱化(图1,(10∶4)~(10∶6),图2),最后表现为抑制作用(图1,(10∶7)~(10∶10),图2)。当两个菌株接种量比例达到10∶9时,成团率为42.6%,相较YS19单独培养时降低36.6%;成团平均尺寸为1.6 μm,降低38.4%;A600为1.7,降低9.0%。
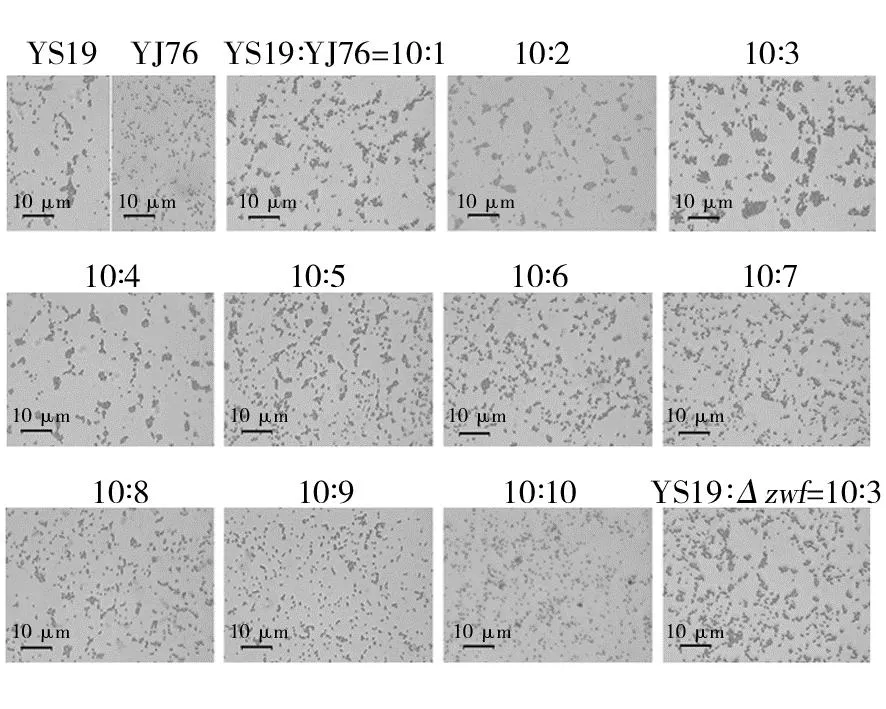
图1 显微观察YS19与YJ76不同接种量比例共培养对共质体形成的影响Fig.1 Micrographic observation on the effect of co-cultivation with different inoculation ratios between YS19 and YJ76 on symplasmata formationYS19∶Δzwf=10∶3表示YS19与YJ76突变株Δzwf的接种量比例为10∶3YS19∶Δzwf=10∶3 indicates that the inoculation ratio of YS19 and YJ76 mutant Δzwf is 10∶3
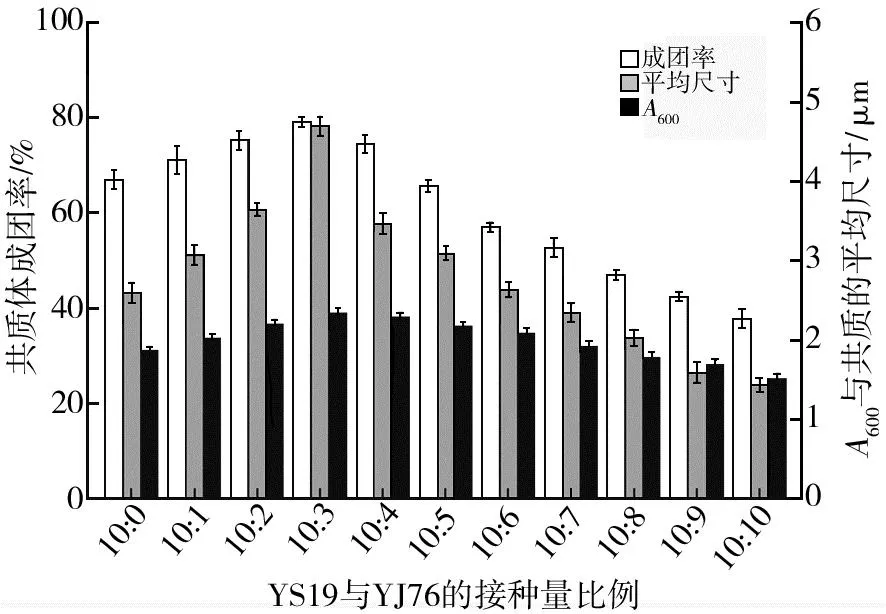
图2 YS19与YJ76不同接种量比例对共质体成团率、平均尺寸和A600的影响Fig.2 The effects of different inoculation ratio of YS19 and YJ76 on the symplasmata formation ratio, average size and A600 标准差用图中的误差线表示(n=3, P<0.05),下图同The standard deviation is represented by the error bars in the figure (n=3,P<0.05), the same as in the figure below
2.2 吲哚产量减少的YJ76突变体Δzwf对共培养促进作用的影响
考虑到前期研究中发现吲哚对于YS19共质体形成有显著促进作用[25-26],本研究利用吲哚产量显著下降的YJ76突变株Δzwf进行了相同的分析(图1,YS19∶Δzwf=10∶3;表1),以探究吲哚的产生在两个菌株共培养时对共质体形成发挥的作用。将YS19与YJ76突变株Δzwf以10∶3的接种量比例共培养48 h后,发现YS19的成团率为63.7%,相较于YJ76野生株共培养时减幅19.6%;成团平均尺寸为3.2 μm,减幅31.9%;A600为1.93,减幅17.9%,表明由Δzwf基因突变造成吲哚产量下降,相比YJ76野生株两个菌株共培养时促进YS19共质体形成的效果,受到了显著抑制。
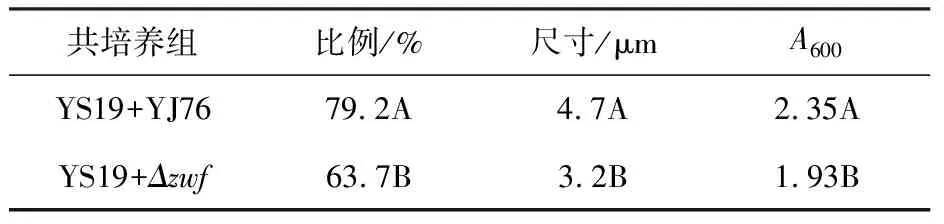
表1 YS19与YJ76突变株Δzwf共培养对共质体成团率、平均尺寸和细菌生长的影响Table 1 Effect of co-cultivation of YS19 and YJ76 mutant Δzwf on symplasmata formation rate, average size and bacterial growth
2.3 YJ76参与YS19共质体的形成
将YS19和YJ76-GFP两个菌株共培养后,使用LSCM明场观察发现菌体形成了大量的共质体结构(图3A),而在暗场观察发现许多GFP荧光标记的YJ76菌体细胞(图3B)。明场和荧光暗场重叠的结果显示,共质体并非仅由单一菌株形成,而是YJ76显著参与到YS19的共质体中,两个菌株的菌体细胞相互交织在一起(图3C),表明这两种植物内生菌在共同的栖息环境中,产生了实质性相互作用,从而形成了杂合共质体。
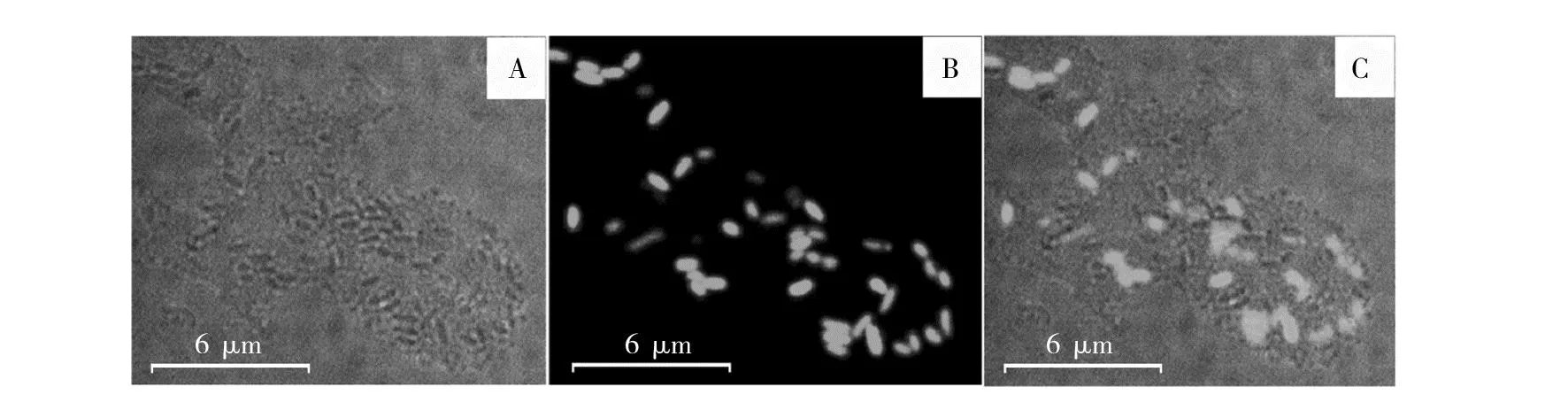
图3 CLSM观察YS19与YJ76-GFP形成的杂合共质体Fig.3 CLSM observation of hybrid symplasmata formed by YS19 and YJ76-GFP明场(A)、暗场(B)与两场重叠(C)下的共质体进行比较;YJ76-GFP显绿色荧光Hybrid symplasmata in the bright field channel (A) and fluorescent field channel (B) were compared with that in overlapping of the two field (C);YJ76-GFP showed green fluorescence
2.4 YS19和YJ76共培养对菌体抗逆能力影响
为了探究YS19和YJ76共培养促进共质体形成对菌体抗逆境生存能力的影响,本研究选用了四种逆境处理方式:重金属、四环素、紫外线和干燥。研究发现,共培养相较YS19单独培养抵抗重金属Zn2+、四环素逆境胁迫的能力分别提高了63.9%、56.0%;相较YJ76单独培养抵抗重金属Zn2+、四环素逆境胁迫的能力分别提高了147.9%、172.7%(图4A)。相同的促进效果同样发现在紫外线照射研究中,处理90 s时检测,两个菌株共培养存活率较YS19单独培养提高了57.4%,而两个菌株共培养较YJ76单独培养提高了266.3%(图4B)。同样,对于干燥处理,两个菌株共培养也能显著促进菌体的存活率,处理3 h后检测,两个菌株共培养存活率较YS19单独培养提高了72.0%,而两个菌株共培养较YJ76单独培养提高348.6%(图4C)。
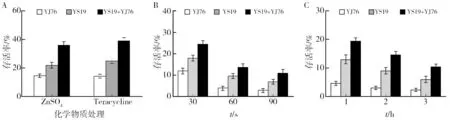
图4 YS19、YJ76和共培养菌经过化学物质(A)、紫外线(B)和干燥(C)处理后的存活率Fig.4 Survival rate of YS19, YJ76 and co-culture solution after chemical (A),ultraviolet (B) and drying (C) treatments
3 讨 论
在自然生长环境或培养基中,成团泛菌能够主动聚集成团形成独特的共质体结构[6],这一结构的形成能显著提高菌体在逆境中的生存能力,本实验室以及其他学者的研究都发现成团泛菌在植物体内定殖时,几乎全部以共质体形式存在[11-12,27-28]。本研究从菌体共培养(模拟栖息)和共质体结构形成两个角度探究了两菌互作对抗逆的影响。
首先证实了P.ananatisYJ76参与P.agglomeransYS19共质体的形成,正如前期本实验室研究发现,YS19在形成共质体时并非由单个细胞发育而来(即所谓单克隆体系),而是多个单细胞主动聚集的结果,本研究观察到的现象进一步印证了上述结果,因为如果共质体的形成起源于单克隆体系,则在YS19共质体中不可能观察到YJ76细胞。另外,适量的YJ76能够促进YS19共质体的形成,本研究又通过YJ76吲哚产量大幅减少的突变株Δzwf与YS19共培养,发现共质体的成团率以及尺寸有不同幅度的缩减。相关研究表明,吲哚信号能够促进YS19释放eDNA和胞外多糖,而这两种物质存在于共质体内并在促进共质体稳定性中发挥了重要作用[29-30],结合本研究的结果,可以推定YJ76对YS19共质体形成的促进作用是由于YJ76产生的吲哚信号造成的。而在较高的YJ76接种量比例下,共质体的形成受到了抑制,这是由于过多的YJ76接种量使YS19的绝对量减少造成的。
本研究还发现YS19、YJ76共培养能显著提高两个菌株对逆境(重金属Zn2+、四环素、紫外线以及干燥)的抵抗能力。在宿主水稻体内复杂的微生态系统中,YS19与YJ76两个菌株占有菌体数量上的绝对优势,本研究结果表明在合适的共培养条件下两个菌株能够产生协同作用,提升了菌体抵御逆境的能力。这种协同效应很可能是源自于两个菌株具有的互补效应[31]以及吲哚这一能够发挥重要作用的种间信号分子的调控作用。也就是说,面对复杂多变的自然环境,两个菌株甚至多个菌株的微生态体系具有更强的适应性。从本研究结果来看,对同一植物分离的内生菌的微生态体系开展多菌的联合培养研究对于探索内生菌的相互作用乃至菌肥开发和利用具有科学意义。
