高尿酸血症小鼠肠渗透性增加的差异表达基因分析
2023-01-30邹通孟瑾宋淼龚雪琳邢士超王笑峰
邹通,孟瑾,宋淼,龚雪琳,邢士超,王笑峰
(青岛大学基础医学院病原生物学系,山东 青岛 266071)
近年来,高尿酸血症(HUA)的发病率逐渐上升,全球HUA的患病率为5%~25%[1]。除引起痛风外,HUA并发的多种代谢性疾病严重影响病人的生活质量,但引起HUA并发症的机制目前尚不清楚。研究表明,肠黏膜屏障功能失调、肠通透性增加是引起各种代谢性疾病的重要风险因素。我们之前的研究表明,HUA小鼠肠渗透性显著增加,肠渗透性增加可能是导致HUA并发多种代谢性疾病的因素[2]。但是,导致HUA小鼠肠渗透性增加的机制尚不清楚,而明确其机制对治疗HUA并发代谢性疾病具有重要意义。本研究通过转录组测序(RNA-seq)技术和生物信息学分析探究引起HUA小鼠肠通透性增加的相关基因,从而为HUA导致肠通透性增加的机制研究提供新的思路。现将结果报告如下。
1 材料与方法
1.1 实验动物
HY组实验动物为由上海模型生物中心利用聚类规则间隔短回文重复序列(CRISPR)/CRISPR相关内切酶Cas9(Cas9)基因编辑技术敲除尿酸氧化酶基因(Uox-/-)建立的小鼠HUA模型,以同笼繁殖的野生型小鼠作为对照(WT组),每组5只。所有小鼠均饲养在12 h光照-12 h黑暗昼夜节律循环的环境中,可以自由饮食和饮水。15周后安乐死处死小鼠,收集血清及肠组织,保存于-80 ℃。所有小鼠实验均符合青岛大学附属医院动物研究伦理委员会的要求。
1.2 小鼠肠渗透性测定
应用异硫氰酸荧光素(FITC)标记的右旋糖酐(FD4,Sigma-Aldrich)测定小鼠的肠通透性。小鼠禁水4 h后,灌胃FD4,剂量为400 mg/kg。4 h后内眦取血,离心取血清,利用多功能酶标仪在激发波长为485 nm、发射波长为528 nm处检测FD4的荧光水平。
1.3 肠组织RNA的提取
加入Trizol,将空肠、回肠和结肠研磨成匀浆液,加入氯仿混匀,离心取上层液,加入异丙醇,离心,弃上清液,用体积分数为0.75的乙醇洗涤3次,沉淀即为总RNA。使用QuickDrop超微量紫外可见分光光度仪测RNA浓度及纯度。
1.4 RNA-seq
使用Agilent 2100 Bioanalyzer(Agilent RNA 6000 Nano Kit)检测组织总RNA的浓度。使用BGISEQ-500平台检测样品,数据分析之前去除低质量、接头污染以及未知碱基N含量过高的reads,得到clean reads,使用 HISAT将clean reads比对到参考基因组序列。使用 Bowtie2 将clean reads比对到参考序列以统计基因比对率,使用RSEM计算基因和转录本的表达水平。采用R软件中ggplot2包进行图形的绘制。使用DEGseq和PossionDis进行差异表达分析。RNA测序原始数据均已上传到NCBI的GEO数据库,ID为GSE143342。
1.5 GO富集和KEGG通路富集
根据GO注释结果以及官方分类,将差异表达基因(DEG)进行功能分类,同时使用R软件中的phyper函数进行富集分析。根据KEGG注释结果以及官方分类,将DEG进行生物通路分类,同时使用R软件中的phyper函数进行富集分析。
1.6 实时荧光定量PCR(RT-qPCR)验证
反转录体系:All-In-One 5×RT MasterMix 4 μL,总RNA 5 μL,无核酶水11 μL。以上反应体系混合均匀,于37 ℃ 15 min、60 ℃ 10 min、95 ℃ 3 min条件下反应,反转录产物即为cDNA。RT-qPCR反应体系:BlasTaq 2×qPCR MM 10.0 μL,上、下游引物各0.5 μL,cDNA 2.0 μL,无核酶水7.0 μL。反应条件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。所用引物序列见表1。

表1 RT-qPCR所用引物序列(5′→3′)
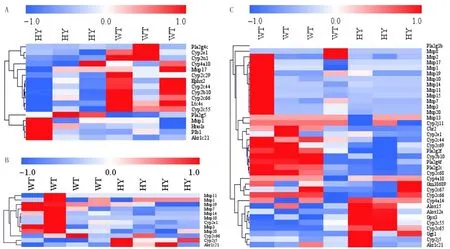
1.7 统计学分析
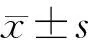
2 结 果
2.1 两组小鼠血尿酸水平和肠渗透性比较
HY组小鼠血尿酸水平显著高于WT组(t=7.376,P<0.01);与WT组相比,HY组小鼠肠渗透性显著增加(t=7.326,P<0.01)。见表2。

表2 两组小鼠血清尿酸水平和肠渗透性比较
2.2 小鼠肠组织RNA测序
与WT组小鼠相比,HY组小鼠结肠的DEG共有1 006个,其中554个表达上调,452个表达下调(图1A);回肠的DEG共有347个,其中221个表达上调,126个表达下调(图1B);空肠的DEG共有398个,其中169个DEG表达上调,229个DEG表达下调(图1C)。

A:结肠DEG火山图;B:回肠DEG火山图;C:空肠DEG火山图。横轴数值为log2转换后的差异倍数值,纵轴数值为-log10转换后的显著性值。红色代表上调的DEG,蓝色代表下调的DEG,灰色代表非DEG。图1 HUA小鼠肠组织DEG火山图
2.3 DEG功能分析
GO富集分析显示,结肠中的DEG主要富集于细胞内区域、细胞脂质代谢过程、胰岛素激活受体活性和花生四烯酸代谢过程等,回肠中的DEG主要富集于脂代谢正向调控、蛋白激酶B信号转导的调节及糖异生的负调控过程,空肠中的DEG主要富集于谷胱甘肽转移酶活性、脂质代谢过程和辅因子结合等过程。KEGG通路富集分析显示,结肠、回肠、空肠的DEG主要富集于花生四烯酸代谢、丙酮酸代谢、柠檬酸循环、细胞色素P450(CYP450)对异源性物质的代谢、CYP450对药物的代谢、化学致癌作用等通路,其中花生四烯酸代谢信号通路在结肠、回肠和空肠中同时被富集。见图2、3。

A:结肠DEG的GO分类及富集;B:回肠DEG的GO分类及富集;C:空肠DEG的GO分类及富集。横轴代表DEG数目,纵轴代表GO功能分类。图2 HUA小鼠肠组织DEG的GO富集分析
A:结肠DEG的KEGG通路分类及富集;B:回肠DEG的KEGG通路分类及富集;C:空肠DEG的KEGG通路分类及富集。横轴代表基因所占的比例,纵轴代表KEGG功能分类。图3 HUA小鼠肠组织DEG的KEGG通路富集分析
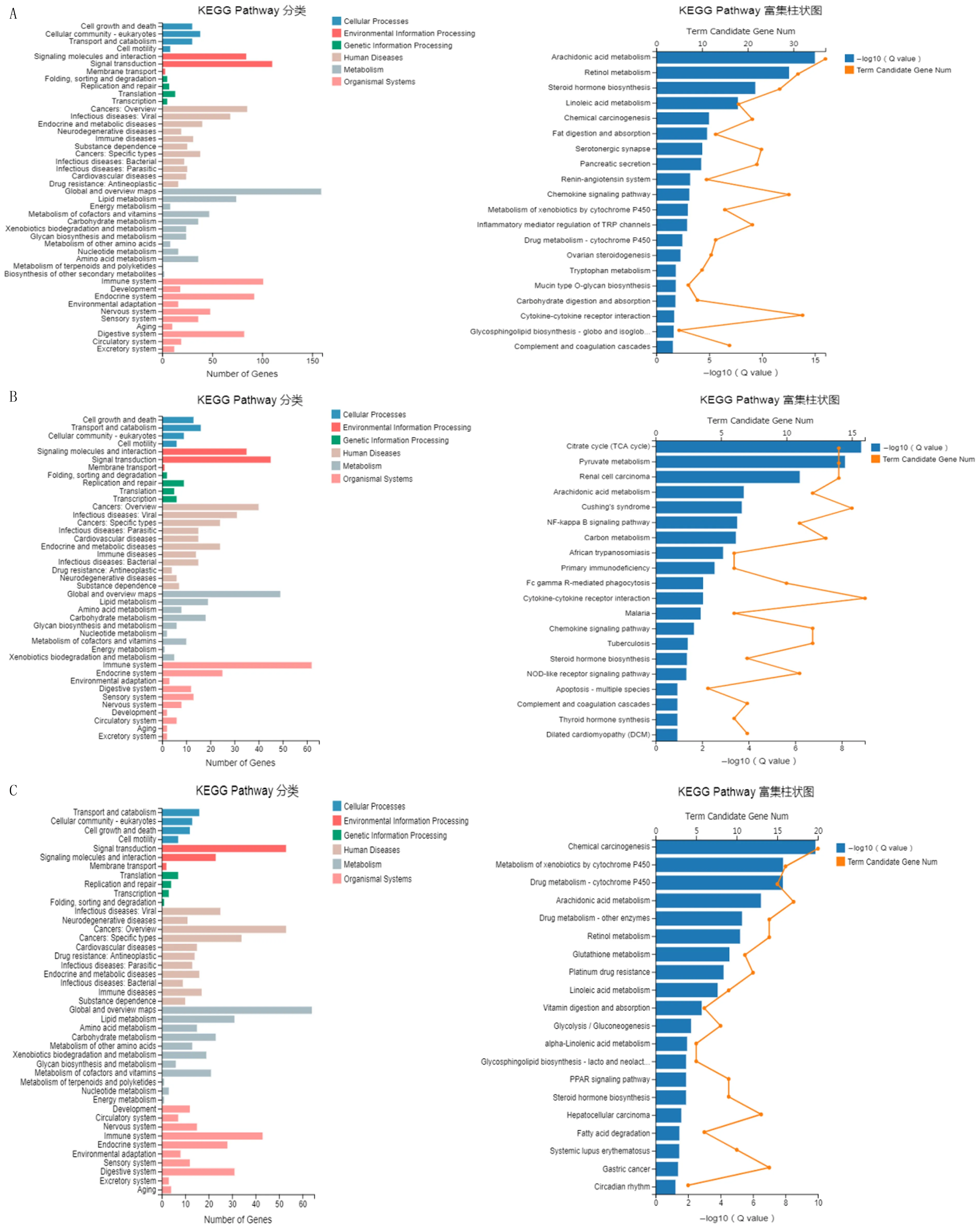
2.4 与花生四烯酸代谢通路相关的DEG表达分析
进一步将与花生四烯酸代谢通路相关的基因绘制成热图,结果显示,两组小鼠相比, CYP450系列的几个关键基因如CYP2C55、CYP2E1、CYP2C66、CYP2C29在空肠和结肠中的表达差异有显著性,而CYP450系列DEG在回肠中表达比较少。见图4。
A:空肠中与花生四烯酸代谢通路相关的DEG热谱图;B:回肠中与花生四烯酸代谢通路相关的DEG热谱图;C:结肠中与花生四烯酸代谢通路相关的DEG热谱图。每组3~4只小鼠,横轴代表聚类分析的样品,纵轴代表DEG。红色代表上调的DEG,蓝色代表下调的DEG,颜色越深表示表达量越高,颜色越浅表示表达量越低。图4 小鼠肠组织中与花生四烯酸代谢通路相关的DEG热图
2.5 肠组织中CYP450相关基因表达的验证
RT-qPCR检测结果显示,与WT组小鼠相比,HY组小鼠空肠和结肠中的CYP2E1基因的表达显著升高(t=4.717、9.986,P<0.05),CYP2C55基因表达显著降低(t=3.682、4.047,P<0.05);空肠中CYP2C29、CYP2C66基因的表达水平显著降低(t=5.099、4.572,P<0.01),CYP2C23、CYP4a10基因的表达水平差异无统计学意义(P>0.05);在结肠中CYP2C23、CYP2J11、CYP2J5、CYP2C66、CYP2C67、CYP2C68、CYP2C69、Ephx2基因的表达差异无显著性(P>0.05)。见表3、4。
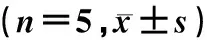
表3 两组小鼠空肠中CYP450相关基因表达的比较
表4 两组小鼠结肠中CYP450相关基因表达的比较
3 讨 论
本研究通过对HUA小鼠肠组织进行RNA测序以及生物信息学分析发现,花生四烯酸代谢信号通路相关基因,特别是CYP450系列相关基因参与HUA肠渗透性的调节。两组小鼠相比,CYP2C29、CYP2C66、CYP2E1和CYP2C55基因在空肠中的表达差异具有显著性,CYP2C55和CYP2E1基因在结肠中的表达差异具有显著性,其中CYP2E1和CYP2C55基因在空肠和结肠中均差异表达,提示HUA的肠渗透性增加可能与这些基因有关。
肠屏障对防止肠腔内的有害物质进入体循环有重要的作用[3-4]。肠屏障被破坏、肠渗透性增加,将会导致脂多糖(LPS)、细菌及相关代谢产物进入循环系统,激起一系列的炎症反应,以上变化不仅涉及包括肠易激综合征等在内的肠道疾病[5-7],还涉及糖尿病、代谢性疾病、非乙醇性脂肪肝病等各种系统性疾病[8-9],因此肠道通透性增加是引发各种代谢病的关键因素。我们之前的研究表明,HUA小鼠肠渗透性增加可能与CYP450有关[2]。CYP450是存在于不同组织中的重要代谢酶。这些酶主要存在于肠道和肝脏组织中,在细胞代谢中起着核心作用,其主要功能是异源物质代谢和生物活性分子合成[10]。研究表明,CYP酶除了与癌症的发展相关外,也与炎症的发生有关,尤其是来自CYP1、CYP2、CYP3和CYP4家族的相关酶[11]。影响肠通透性的因素有很多,其中肠道微生物及病原体相关分子均可以通过肠黏膜免疫细胞表面的Toll样受体(TLRs)引起免疫应答,产生炎症因子和干扰素,诱导肠炎症,进而导致肠渗透性增加[12-13]。大量的研究均表明,炎症是导致肠渗透性增加的一个重要因素。本文研究结果显示,在HUA小鼠的空肠和回肠中有多个CYP2家族的基因发生显著变化,特别是CYP2E1在空肠和结肠中的表达显著升高,CYP2C55的表达显著降低。CYP2E1是CYP450的乙醇诱导形式,参与乙醇代谢,在非乙醇脱氢酶氧化途径中起重要作用,参与了乙醇性肝病的发生过程[14]。有研究表明,CYP2E1可以通过模式识别受体激活先天性免疫系统,促进炎症反应,增加氧化应激反应[15-16]。另有研究表明,在乙醇喂养小鼠中CYP2E1表达增加,引起了体内氧化应激,上调了肠道内的CLOCK以及PER2蛋白的表达,促进了肠道通透性的增加,而CYP2E1基因敲降小鼠与接受CYP2E1抑制剂治疗小鼠的肠渗透性增加则有所缓解[17-18]。CHO等[19]研究表明,CYP2E1的增高会引起肠渗透性的变化,表明CYP2E1参与了肠渗透性的调控。在本研究中,HUA小鼠空肠和结肠中的CYP2E1表达显著增高,表明CYP2E1也参与了HUA肠渗透性的调控。我们推测,HUA小鼠中异常的菌群及代谢产物导致肠道内CYP2E1水平上调,进而通过引起肠道的氧化应激及炎症反应,损伤肠上皮细胞,影响肠渗透性。我们之前的研究也表明,在HUA小鼠的空肠和结肠中,模式识别受体TLRs以及炎症因子如肿瘤坏死因子-α、白细胞介素-1β等水平增高,先天性免疫应答反应被激活[2]。CYP2C55是一种可以催化花生四烯酸代谢产物合成的酶,而这些代谢产物具有调节肾血管张力和离子转运等重要的生理功能。既往有文献报道,LPS诱导的炎症反应使CYP2C55mRNA水平降低,表明CYP2C55也在炎症反应中发挥着重要作用,CYP2C55的下调会激活肠道的氧化应激和炎症反应[20]。因此我们推测,HUA通过上调CYP2E1和下调CYP2C55引起氧化应激及炎症反应,损伤肠黏膜屏障,进而导致肠渗透性增加。CYP2E1和CYP2C55在HUA肠渗透性增加的分子机制中起着重要的作用。
综上,在HUA小鼠中,CYP450相关基因的改变影响了肠渗透性,特别是CYP2E1和CYP2C55在其中起着关键作用。本研究结果为HUA并发症的治疗提供了一个新的方向,但其具体机制有待进一步研究。
