颗石藻Emiliania huxleyi对升温和温度波动响应的株间效应*
2023-01-17王雅婻冯媛媛李童童白有成
王雅婻 冯媛媛 李童童 蔡 婷 白有成
颗石藻对升温和温度波动响应的株间效应*
王雅婻1, 2冯媛媛2, 3①李童童1蔡 婷4白有成4
(1. 天津科技大学海洋与环境学院 天津 300457; 2. 上海交通大学海洋学院 上海 200030; 3. 上海市极地前沿科学研究基地 上海 2000303; 4. 自然资源部第二海洋研究所 浙江杭州 310012)
在全球气候变化的背景下, 极端天气频发, 海洋生物也将受到环境异质性的影响, 即环境条件基于平均水平的震荡变化。为研究温度波动变化对海洋碳循环中的重要种群颗石藻的影响, 采用半连续培养的方式对海洋颗石藻优势种赫氏颗石藻()的非钙化株系与钙化株系分别进行模拟培养实验, 探究颗石藻在低(20 °C)和高(25 °C)平均温度下对升温及温度波动变化的响应。结果表明, 升温与温度波动对两株的生长均起到了抑制作用, 而升温和温度波动变化对两株.的生长速率以及胞内碳水化合物含量、非钙化株系的颗粒有机碳含量及钙化株系的蛋白质和颗粒物无机碳含量、碳氮比及沉降速率产生了显著的交互效应, 温度的波动变化在一定程度上增强了颗石藻应对升温的适应性。通过对两株系的生理响应结果进行对比分析, 发现非钙化株系各生理参数对升温和温度波动变化更为敏感, 表明颗石藻的钙化作用可能对其应对环境波动下的极端环境条件起缓冲保护作用。升温和温度波动变化显著削弱了颗石藻的沉降速率, 可能会对颗石藻相关的海洋碳沉降与输出产生显著的削弱效应。因此, 为了更准确地预测海洋颗石藻对气候变化的响应, 未来相关研究需要考虑叠加在升温基础上的温度波动变化对颗石藻的生理生态学效应。
颗石藻; 海洋变暖; 温度波动; 钙化作用; 株间效应
化石燃料的燃烧、热带森林的砍伐以及土地利用的改变等人类活动使大气中的二氧化碳(CO2)浓度持续升高, 由于二氧化碳的温室效应, 全球平均气温也随之上升并导致海洋升温(IPCC, 2022)。在过去的一个世纪内, 全球平均海面温度(sea surface temperature, SST)升高了约1 °C (Fischetti, 2013), 预计到2100年, 全球海洋表层水温将持续上升1~4 °C (IPCC, 2022)。海水升温也使海洋异常增暖事件和海洋热浪等生态灾难频发, 对海洋生物多样性产生影响(Hobday, 2016; IUCN, 2016), 如北极水域的融化可能会增加物种在太平洋和大西洋之间跨北极迁徙的可能性(Parmesan, 2003; 郭世安等, 2022)。生活在真光层内的浮游植物与其他生物相比粒径更小生长较快, 因而对温度变化的响应更加明显。温度是影响生物代谢途径中酶活性的重要环境因子, 对调节浮游植物的生长和生理过程起到关键作用(Eppley, 1972; Raven, 1988), 在适温范围内浮游植物在不同温度下的生长速率通常随着温度的升高而逐渐升高, 达到最适温度后则随升温迅速降低(Norberg, 2004), 进而影响藻类基因型和表型变异及胞内化学转化、存储和营养盐输运等过程(Raven, 1988)。
在全球平均气候变化的基础上, 海洋浮游植物还将受到不同时空尺度的环境条件震荡变化的影响(Cabrerizo, 2021)。温度可在不同的时间尺度上波动, 如随天气变化、昼夜循环、垂直和水平平流、季节变化等产生震荡变化(Leinweber, 2009; Doblin, 2016)。而且随气候变化的加速, 这种环境波动变化频率和幅度也会随之变化(Salinger, 2005; Williams, 2014; Perkins-Kirkpatrick, 2020)。由于浮游植物的热性能曲线在超过其最佳生长温度后迅速下降, 在较高温度下的波动可能意味着浮游植物会周期性地经历不利于生长的温度条件(Vasseur, 2014), 从而对海洋生物从有机体水平上(资源获取及分配)到种群水平上(繁殖及演替)产生不可忽视的影响(Bernhardt, 2020)。例如, 温度波动显著降低了海洋甲藻和sp.的生长速率, 其热休克蛋白在温度波动的高温阶段呈现出了显著的上调(Fu, 2022)。同样地, 温度波动也延缓了近岸硅藻威氏海链藻()的生长, 随机温度波动降低了其胞内碳氮含量, 但恒定波动则对其胞内化学元素含量影响不显著(王鑫威, 2019)。在平均温度相同的条件下, 赫氏颗石藻()的生长速率在较高频率的温度波动变化下降幅较低, 说明温度波动对其生理过程受高温抑制的现象有所缓解(Wang, 2019)。与稳定温度条件相比, 温度波动可升高淡水浮游动物的物种多样性(Shurin, 2010), 而对湖泊浮游植物群落的研究则发现升温和温度波动的共同作用导致了浮游植物种群物种多样性的显著降低(Rasconi, 2017)。
颗石藻是一类具有多种生态型(Hagino, 2005; Cubillos, 2007)并在海洋中分布广泛的单细胞藻类(McIntyre, 1967; Brown, 1995), 可通过光合作用生产颗粒有机碳(particulate organic carbon, POC), 并通过钙化生产颗粒无机碳(particulate inorganic carbon, PIC)(Rost, 2004)。在亚热带海域, 颗石藻贡献了20%以上总有机碳生产(Poulton, 2007)及约50%亚热带和高纬度碳酸钙(CaCO3)的沉积(Tyrrell, 2004), 在海洋碳循环中有重要作用。赫氏颗石藻()是分布最广泛的颗石藻优势物种, 尤其在温带和靠近北极的海域可发生大面积季节性水华(Hobday, 2016)。对海水碳酸盐体系的变化很敏感, 海洋酸化对.的生长和钙化都产生了负面影响(冯媛媛等, 2020)。然而, 除海洋酸化外, 颗石藻的生理学过程还受到许多变化的环境因素影响, 如紫外线辐射、温度和营养盐浓度等。其中, 温度可能是调节颗石藻生理机能最重要的因素之一(Boyd, 2010; Sett, 2014; Gao, 2019)。自20世纪50年代以来, 海水变暖使包括颗石藻在内的北大西洋浮游植物的分布每10年向极地方向移动数百公里, 水华的季节时间提前了4~5周(IUCN, 2016), 生物量也随之增加(Winter, 2014)。研究发现, 在低光条件下升温可以提高的生长速率(Feng, 2008), 此外, 温度也是控制细胞POC和PIC含量的重要因子(Feng, 2018)。同时, 由于颗石藻在自然环境中存在着形态及基因型上的多样性, 不同物种及同一物种的不同株系应对温度异质性变化的响应机制也可能存在显著差异(Westbroek, 1993)。综上, 如果不考虑温度波动的影响, 就无法准确理解和预测海洋颗石藻对海洋环境快速变化的响应, 但针对颗石藻应对升温和温度波动度的交互作用的生理响应的相关研究还在起步阶段。此外, 颗石藻的不同株系应对温度波动响应的株间效应也尚未可知。
因此, 在前期研究基础上, 本研究通过对颗石藻的钙化株系和非钙化株系分别在恒温及温度波动条件下进行室内受控半连续培养实验, 以期获取颗石藻对升温和温度波动交互作用的生理响应; 并通过对比分析颗石藻钙化与非钙化株系对升温及温度波动变化生理响应的株间效应, 以期进一步探究颗石藻钙化作用对其应对温度变化的调节机制。
1 材料与方法
1.1 藻种选择
实验采用的赫氏颗石藻钙化株系RCC1266分离自爱尔兰周围的大陆架水域(49°30′N, 10°30′W), 赫氏颗石藻非钙化株系PMLB分离自欧洲北海。藻种在实验室用无硅的f/20培养基, 即f/2水平稀释10倍(Guillard, 1962), 保种于恒温光照培养箱(GXZ-280D, 宁波), 培养温度为15 °C、光照强度为120~150 μmol/(m2·s)、光暗周期比为12 h︰12 h。
1.2 实验设置
取指数生长期的藻种接种至500 mL Nalgene培养瓶中, 初始细胞丰度为1.0×104cells/mL, 光强为150~180 μmol/(m2·s)、光暗周期比为12 h︰12 h, 培养基由过滤并高压灭菌后的黄渤海海水配置, 氮、磷营养盐、维生素及微量元素添加至f/20水平, 在由加热棒及冷暖水机(HC-1000BH, 海利, 中国)控温的恒温(20和25 °C)及波动[(20±4)和(25±4) °C]水槽中进行培养, 其中温度波动频率为每24 h一个波动周期(图1), 实验采用的波动频率与幅度采取温带近岸海域常见平均水平(Leinweber, 2009)。共设置四个处理组: (1) 对照: 20 °C恒温; (2) 波动: (20±4) °C; (3) 升温: 25 °C恒温; (4) 升温+波动: (25±4) °C, 每个处理设置3个平行样。每天用荧光仪(Trilogy, Turner Designs, 美国)测量活体荧光值后采用新鲜配置的培养基进行稀释, 使藻液的丰度维持在1.0×104cells/mL, 至生长速率连续5~7个稀释周期中保持相对稳定时(变化<15%)进行最终采样(Feng, 2008)。各处理组总培养时间为15~21天。
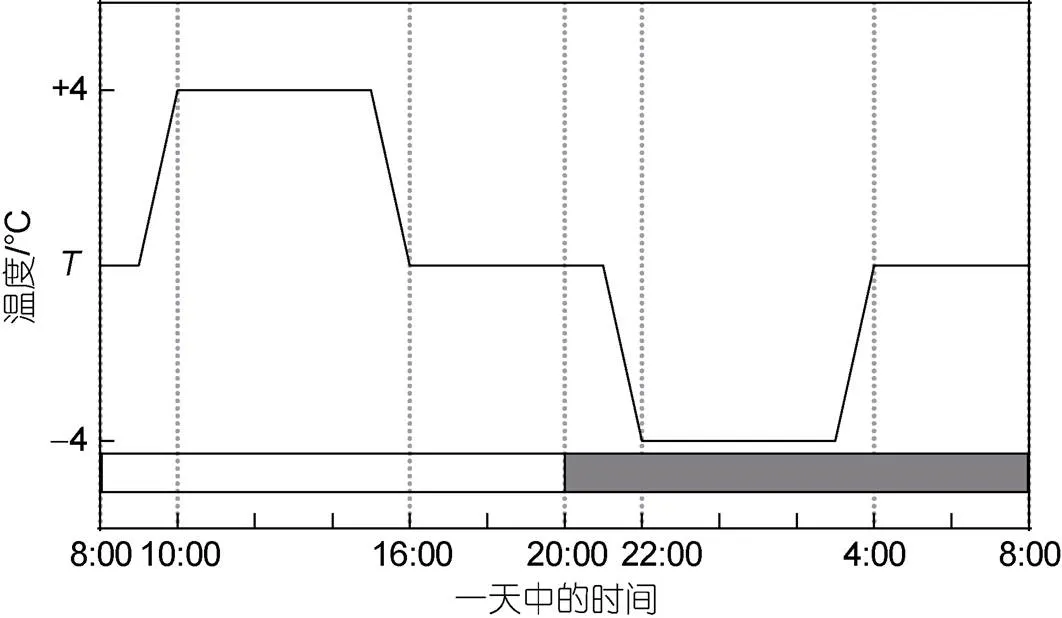
图1 室内培养温度波动模式简易图
注: 灰白条代表光照周期, L︰D = 12 h︰12 h;代表平均温度
1.3 样品分析
1.3.1 藻细胞计数、叶绿素及生长速率 取1 mL混匀藻液用6 μL碱性鲁格试剂固定, 通过微藻计数框在光学显微镜(CH20BIMF200, Olympus, 日本)下计数, 计算培养结束时的细胞丰度。实验结束时取20 mL藻液过滤在GF/F滤膜(25 mm, Whatman, 美国)上, 于-20 °C冰箱中避光保存。测定时在避光-20°C条件下用5 mL 90%丙酮萃取24 h, 然后用酸化法荧光仪(Turner Designs, 美国)测定叶绿素(chl)含量(Welschmeyer, 1994)。
生长速率(单位: /d)用下列公式计算:
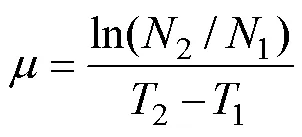
式中,T和T分别为取样时间,1和2分别为在1和2时采用荧光仪(Turner Designs, 美国)测定的活体叶绿素荧光值。
1.3.2 蛋白质和碳水化合物含量测定 将两份100 mL藻液过滤到0.4 μm聚碳酸酯滤膜(PALL, 美国)上, 在-80 °C冰箱中保存, 用于蛋白质和碳水化合物含量的测定。蛋白质的测定采用考马斯亮蓝G-250法(Bradford, 1976)。用1 mL Milli-Q水将滤膜上的藻液洗脱, 随后加入4 mL考马斯亮蓝溶液, 混合充分后放置5 min显色, 用紫外可见分光光度计(UV-2550, Shimadzu, 日本)测量595 nm下的吸光度。碳水化合物的测定采用硫酸-苯酚显色法(Dubois, 1956), 取出滤膜, 加入5 mL 0.05 mol/L H2SO4溶液, 置于60 °C水浴加热10 min后冷却至室温, 取样品2 mL加0.05 mL 80%苯酚溶液和5 mL浓硫酸试剂, 静置30 min显色, 然后用紫外可见分光光度计(UV-2550, Shimadzu, 日本)测量485 nm下的吸光度。
1.3.3 元素组成分析 细胞颗粒有机磷(particulate organic phosphorus, POP)含量采用磷钼蓝显色法测定(Solórzano, 1980)。取50 mL藻液过滤到经马弗炉(450 °C, 4 h)灼烧过的GF/F滤膜上, 藻液过滤完成后加入2 mL 0.17 mol/L的Na2SO4溶液润洗, 而后转移至瓶玻璃瓶内(已灼烧), 加入2 mL 0.017 mol/L的MgSO4溶液使GF/F滤膜完全浸没, 然后封口置于60 °C烘箱中烘干后待测定。测试时采用HCl将有机磷转化为无机磷酸盐后加入显色剂, 显色后用紫外可见分光光度计(UV-2550, Shimadzu, 日本)测量855 nm下的吸光度。
总颗粒碳(Particulate total carbon, PTC)、POC和颗粒态有机氮(particulate organic nitrogen, PON)的含量用CHN元素分析仪(Costech, 意大利)进行分析(Hutchins, 1998)。取2份100 mL藻液, 分别过滤到2张GF/F滤膜上(已灼烧), 过滤完成后取一份直接放入铝箔纸袋(已灼烧)在60 °C烘箱内烘干, 用于测定PTC的含量; 另一份用浓盐酸熏蒸3 h (以去除无机碳)后放入60 °C烘箱内烘干(Zondervan, 2002), 用于测定POC和PON, PTC与POC之差为PIC (Feng, 2008), 即
PIC=PTC–POC, (2)
式中,PIC、PTC、POC分别代表PIC、PTC、POC的含量(单位: pg/cell), 将细胞POC与PIC含量与相乘得出POC与PIC的生产率POC、PIC[单位: pg/(cell·d)]:
POC=×POC, (3)
PIC=×PIC. (4)
1.3.4 沉降速率和细胞大小的测定 浮游植物沉降速率的测定采用赛特科尔沉降法(SETCOL法) (Bienfang, 1981)。将混合均匀的藻液倒入垂直放置、
出水口已封闭的沉降柱, 盖好盖子使沉降柱内几乎没有气泡, 在静止桌面上避光放置3 h。完成沉降后依次从上、中、下三个出水口取样, 记录取样的时间和各层藻液体积, 然后量取适量藻液过滤至GF/F滤膜上, 用于对叶绿素含量的测定。最终结果用Bienfang沉降速率公式进行计算(单位: m/d):
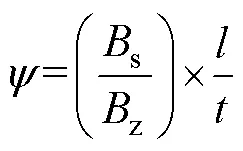
其中,z为沉降柱内总生物量(单位: μg/L);s为沉降柱最下层生物量(单位: μg/L);为沉降柱高度(单位: cm);为沉降时间(单位: h)。
细胞大小采用Beckman激光粒度仪测定(LS 13320, 美国)。
1.4 数据分析
显著性分析及交互效应采用双因素方差分析方法(Two-way ANOVA)分析,<0.05表示有显著性差异。采用Graphpad Prism 8绘图。
计算环境因子的交互效应依据Flot等方法(Piggott, 2015)。OE (observed effect)为单一环境因子或两种及以上环境因子共同变化对浮游植物某一生理参数的表观影响, 通过计算处理组相比于对照组变化的百分比获得, 如单一环境因子的表观影响计算如下:
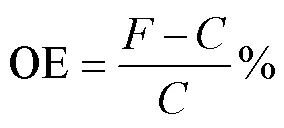
其中OE为波动对浮游植物生理参数的表观影响;为波动组数值;为对照组数值; 结果是正值为升高效应, 结果是负值为降低效应。
ME (multiplicative effect)为两种环境因子的交互效应, 如升温和波动的交互效应计算如下:

其中, ME1+2为升温和波动的交互效应; OE1和OE2分别为升温和波动对浮游植物生理参数的表观影响。当OE1与OE2正负结果一致时, |OE1+2| > |ME1+2|, 两种环境因子为协同性交互效应, 反之则为拮抗性交互效应。
2 结果
2.1 生长速率
在20和25 °C条件下, 温度波动变化均显著降低了两个株系的生长速率(图2,<0.05)。在恒温及温度波动条件下, 升温显著降低了非钙化株系PMLB的生长速率, 在升温(25 °C恒温)及升温波动组[(25±4) °C]均显著低于对照(20 °C恒温)及波动[(20±4) °C]组(<0.05), 分别降低了13.06%和28.21% (图2a)。而对钙化株系RCC1266而言, 升温组与对照组的生长速率无显著差异, 仅在波动条件下, 升温波动组的生长速率显著低于波动组(图2b,<0.05)。两株系的最高生长速率均出现在对照组[非钙化株系: (0.87±0.04) /d; 钙化株系: (1.01±0.01) /d], 最低生长速率则在升温波动组[非钙化株系: (0.66±0.02) /d; 钙化株系: (0.56±0.04) /d]。双因素方差分析表明, 升温和温度波动对两株系的生长速率有显著交互效应(<0.05)。

图2 不同温度条件下Emiliania huxleyi PMLB (a)与Emiliania huxleyi RCC1266 (b)的生长速率
注: 误差棒表示标准偏差,=3; 字母表示处理组间的显著性差异,<0.05, 余图同
2.2 胞内叶绿素a、蛋白质及碳水化合物含量
在四个温度温度组中, 非钙化株系PMLB的胞内chl、蛋白质及碳水化合物含量均在波动组最高、在升温组为最低(图3a, 3c, 3e)。对非钙化株系PMLB而言, 温度恒定时, 升温使胞内chl、碳水化合物含量分别比对照组显著降低了81.88%和83.38% (<0.05); 而在温度波动下, 高温波动与波动组相比, 胞内chl含量显著降低了54.51% (<0.05), 而其他参数虽有下降的趋势, 但无显著性差异(>0.05)。在同样的平均温度条件下, 温度波动使胞内各参数含量都有所升高, 高温波动下胞内chl含量较高温组显著上升了354.66% (<0.05),

图3 不同温度条件下Emiliania huxleyi PMLB (a, c, e)和Emiliania huxleyi RCC1266 (b, d, f)胞内叶绿素a、蛋白质和碳水化合物质量浓度
胞内蛋白质含量在波动组及高温波动组也分别较对照组及高温组升高209.61% (<0.05)及336.82%, 胞内碳水化合物含量在高温波动组也较高温组升高了220.23%。与非钙化株系相似, 钙化株系RCC1266的胞内chl、蛋白质及碳水化合物含量最高值也出现在(20±4) °C (图3b, 3d, 3f)。与非钙化株系不同的是, 温度恒定时, 升温显著提高了钙化株系RCC1266的胞内蛋白质及碳水化合物含量(<0.05); 而在温度波动条件下, 胞内chl含量在升温波动组较波动组降低了54.51% (<0.05)。温度波动仅在低温(20 °C)条件下显著升高了胞内chl、蛋白质及碳水化合物含量(<0.05), 在平均温度为25 °C下, 各参数在高温波动组与高温组间无显著差异(>0.05)。双因素方差分析表明, 升温和温度波动仅对PMLB的胞内碳水化合物含量有显著交互效应(<0.05), 对RCC1266的胞内蛋白质和碳水化合物含量均有显著交互效应(<0.05)。
2.3 胞内元素组成及颗粒碳生产速率
在四个温度处理组中, 非钙化株系PMLB的胞内POP、POC和PON含量在波动组最高、在升温组最低(图4a, 4c, 4e), 这与其胞内的chl和生物大分子含量的变化一致。对非钙化株系PMLB而言, 温度恒定时, 升温使胞内POP、POC和PON含量分别比对照组显著降低了76.64%、77.23%和77.47% (<0.05); 而在温度波动下, 高温波动与波动组相比, 胞内PON含量显著降低了48.41% (<0.05), 而胞内POP与POC含量虽然也出现了下降趋势, 但无显著性差异(>0.05)。在同样的平均温度条件下, 温度波动使胞内各参数含量都有所升高, 波动相比于对照组无显著性差异(>0.05), 而高温波动下胞内POP、POC和PON含量分别较高温组显著升高了397.75%、508.02%和353.12% (<0.05)。
与非钙化株系相似, 钙化株系RCC1266的胞内POP、POC与PON含量最高值也出现在波动组(图4b, 4d, 4f), 与非钙化株系不同的是, 最低值出现在高温波动组。温度恒定时, 升温对钙化株系RCC1266胞内各参数的含量无显著影响(>0.05); 而在温度波动下, 高温波动与波动组相比, 胞内POP与PON含量显著降低了14.31%和41.02% (<0.05), 胞内POC含量虽也出现了下降趋势, 但无显著性差异(>0.05)。温度波动在低温(20 °C)条件下显著升高了胞内POP和POC含量(<0.05), 在高温(25 °C)条件下显著降低了胞内PON含量(<0.05)。双因素方差分析表明, 升温和温度波动仅对PMLB的胞内POC含量有显著交互效应(<0.05), 对RCC1266的胞内POP、POC和PON含量均无显著交互效应(>0.05)。
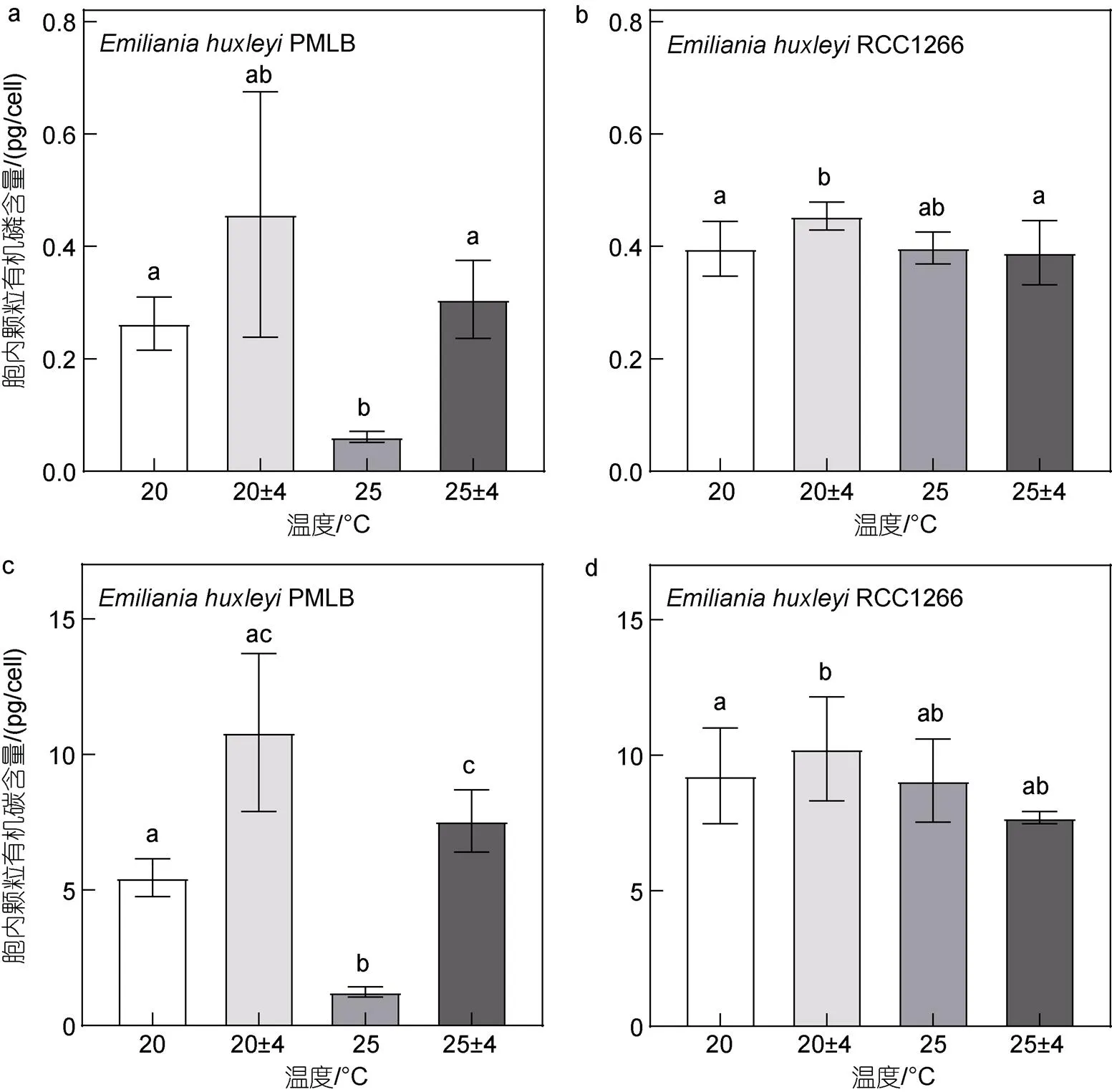
非钙化株系PMLB的胞内元素摩尔比在四个温度处理组中均无显著性差异(表1,>0.05)。钙化株系RCC1266的C/N在高温波动组最高, 在对照组最低。在温度波动下, 升温使碳氮比值(C/N)比波动组显著升高了18.85% (<0.05); 在平均温度为25 °C下, 温度波动使C/N比高温组显著升高了16.58% (<0.05)。与C/N相反, 钙化株系RCC1266的N/P在对照组最高, 在高温波动组最低。温度恒定时, 升温使N/P显著降低了4.08% (<0.05)。双因素方差分析表明, 升温和温度波动仅对RCC1266的C/N有显著交互效应(<0.05)。
在25 °C条件下, 温度波动变化显著降低了钙化株系RCC1266的胞内PIC含量与PIC/POC (图5,<0.05)。在恒温及温度波动条件下, 升温使胞内PIC含量有降低趋势, 但组间无显著性差异(>0.05), 而温度波动仅在高温条件下显著降低了胞内PIC含量。与胞内PIC含量变化相似, 升温波动组的PIC/POC也显著低于高温组, 而其他处理组的PIC/POC变化均无显著性差异(>0.05)。双因素方差分析结果表明, 升温和温度波动对胞内PIC含量有显著交互效应(<0.05), 使其比对照组显著降低了69.84%, 对PIC/POC则无显著交互效应(>0.05)。
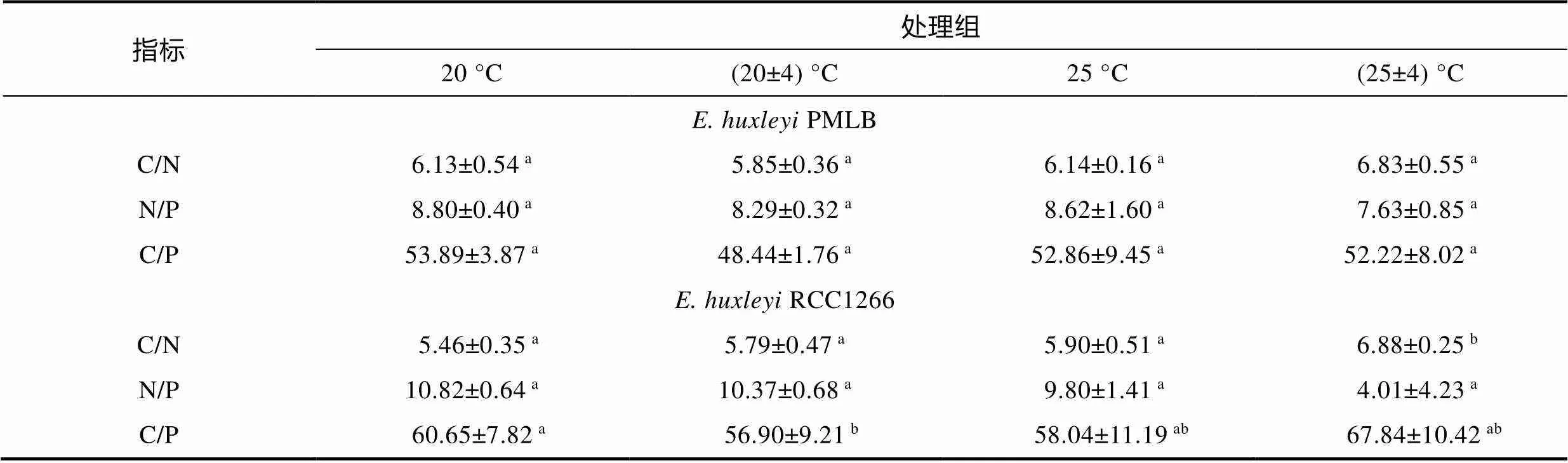
表1 不同温度条件下E. huxleyi PMLB与E. huxleyi RCC1266的元素摩尔比
注: C/N, N/P, C/P分别表示碳氮比值、氮磷比值和碳磷比值; 字母表示处理组间的显著性差异,<0.05
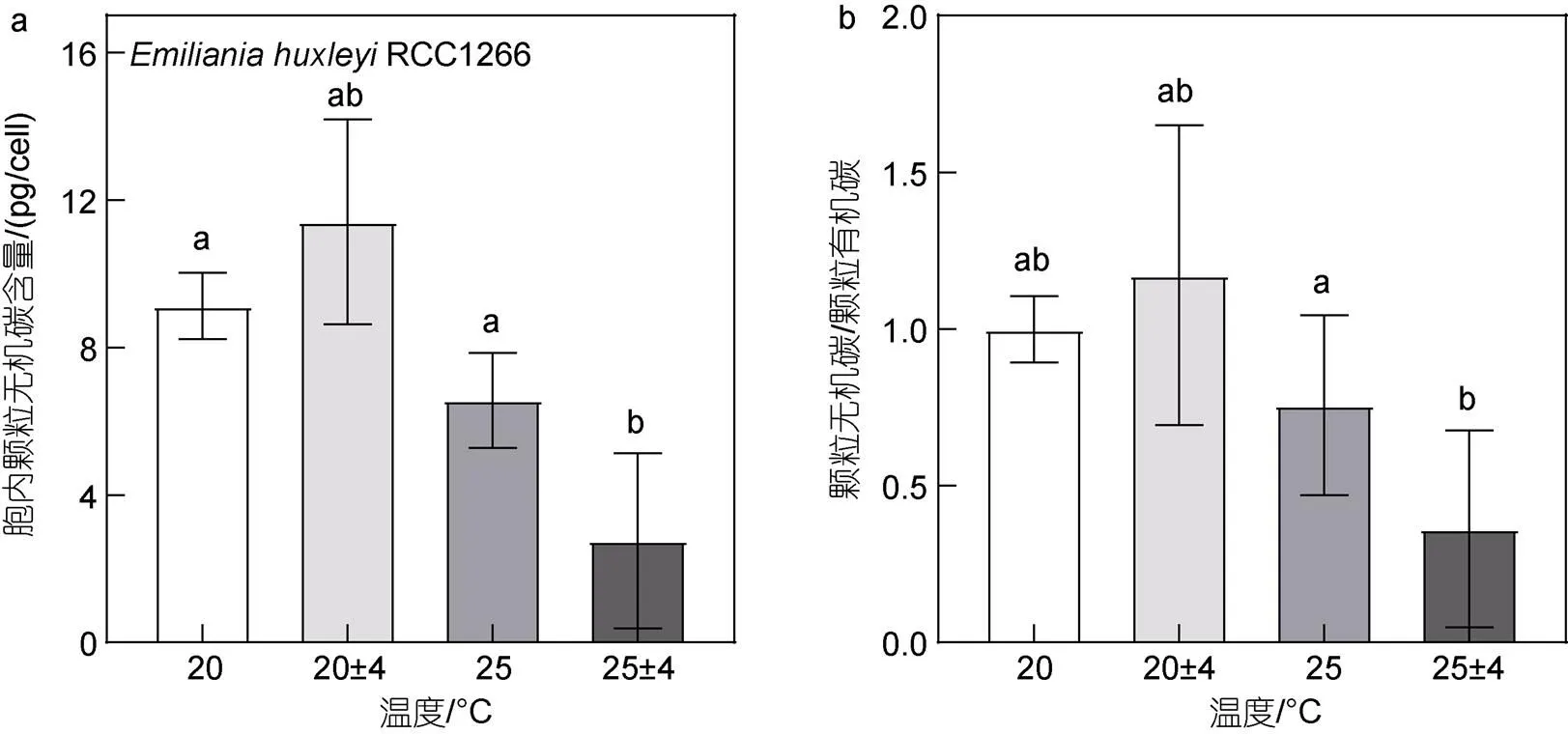
图5 不同温度条件下Emiliania huxleyi RCC1266胞内颗粒无机碳质量浓度(a)与颗粒无机碳/颗粒有机碳质量比(b)
在四个处理组中, 非钙化株系PMLB的POC生产速率在波动组最高、在升温组最低(图6a), 这与前文所述各参数含量的变化趋势一致。在恒温及温度波动条件下, 升温使非钙化株系PMLB的POC生产速率分别显著降低了80.21%和51.86% (<0.05)。在同样的平均温度条件下, 高温波动下的POC生产速率较高温组显著升高了374.58% (<0.05)。而钙化株系RCC1266的POC生产力在对照组最高, 在高温波动组最低。在恒温与温度波动条件下, 升温对POC生产速率无显著影响(图6b,>0.05)。而在同样的平均温度条件下, 温度波动显著降低了钙化株系RCC1266的POC生产速率(<0.05), 波动及升温波动组分别较对照及高温组显著降低了11.49%和41.59%。对钙化株系RCC1266的PIC生产速率而言, 与POC生产速率相似, 其最高值与最低值也分别出现在对照组和高温波动组(图6c)。升温组与对照组的PIC生产速率无显著差异(>0.05),仅在波动条件下, 升温波动组的PIC生产速率显著低于波动组68.23% (<0.05)。而温度波动也仅在高温(25 °C)条件下显著降低了PIC生产速率(<0.05)。双因素方差分析表明, 升温和温度波动对PMLB的POC生产速率无显著交互效应(>0.05), 对RCC1266的POC及PIC生产速率均有显著交互效应(<0.05), 分别较对照组显著降低了46.27%和73.29%。
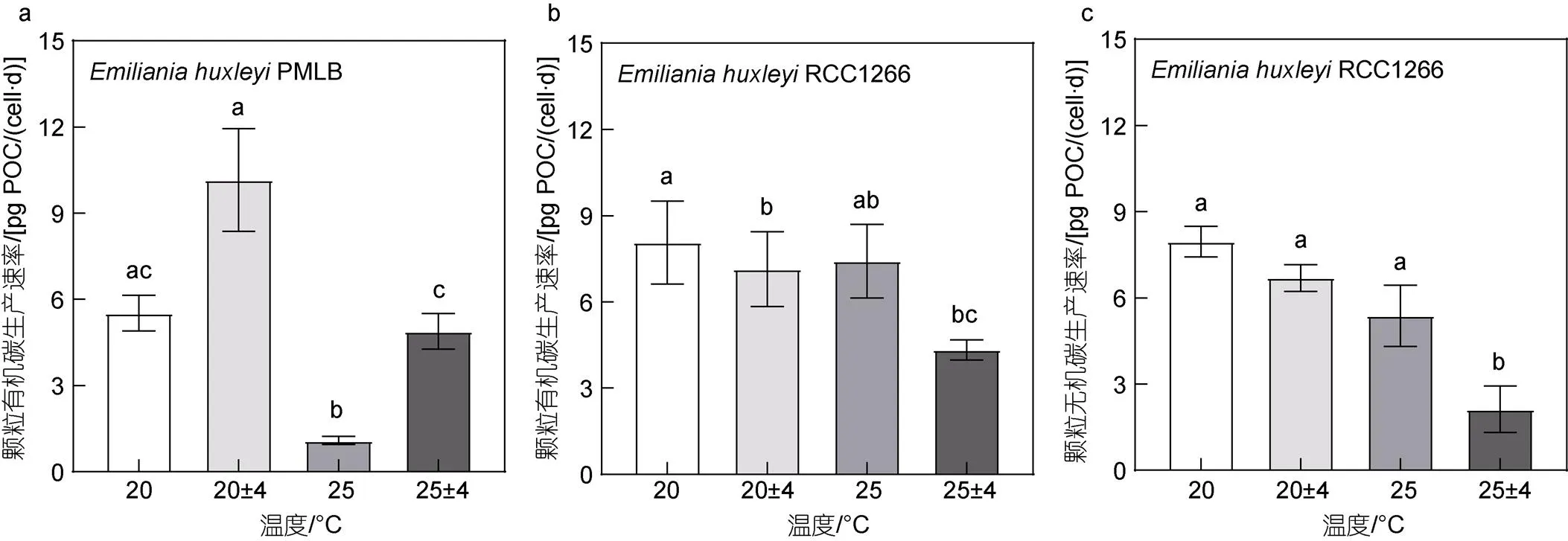
图6 不同温度条件下Emiliania huxleyi PMLB (a)与Emiliania huxleyi RCC1266 (b)的颗粒有机碳生产速率, 以及Emiliania huxleyi RCC1266的颗粒无机碳生产速率(c)
2.4 细胞大小及沉降速率
非钙化株系.PMLB的细胞大小对温度变化均无显著性差异(图7a,>0.05)。钙化株系.RCC1266的细胞大小仅在高温波动下较高温组显著上升了9.47% (图7b,<0.05)。钙化株系.RCC1266经酸化处理后的颗石球大小对温度变化也均无显著性差异(图7c,>0.05)。双因素方差分析表明, 升温和温度波动对两株系的细胞大小无显著交互效应(<0.05)。
在20 °C条件下, 升温与温度波动均显著降低了PMLB的沉降速率(图8a,<0.05)。温度恒定时, 升温使非钙化株系的沉降速率比对照组显著降低了55.40%, 波动使沉降速率比对照组显著降低了53.82%。而对钙化株系RCC1266而言, 升温使沉降速率发生显著下降(图8b,<0.05), 升温及升温波动组分别显著低于对照及波动组69.54%和69.69%, 温度波动则对沉降速率无显著影响(>0.05)。与生长速率相似, 两株系的最高沉降速率也均出现在对照组[非钙化株系: (0.19±0.01) m/d; 钙化株系: (0.05±0.05) m/d], 最低沉降速率出现在升温波动组[非钙化株系: (0.52±0.01) m/d; 钙化株系: (0.12±0.01) m/d]。双因素方差分析表明, 升温和温度波动对RCC1266的沉降速率有显著交互效应(<0.05), 对PMLB无显著交互效应(>0.05)。相关性分析表明钙化颗石藻胞内PIC含量与沉降速率(图8c)呈显著正相关关系(图8c,2=0.601 7,=15.11,<0.05)。

图7 不同温度条件下Emiliania huxleyi PMLB (a)与Emiliania huxleyi RCC1266 (b)的细胞大小, 以及酸化处理后Emiliania huxleyi RCC1266的颗石粒大小(c)
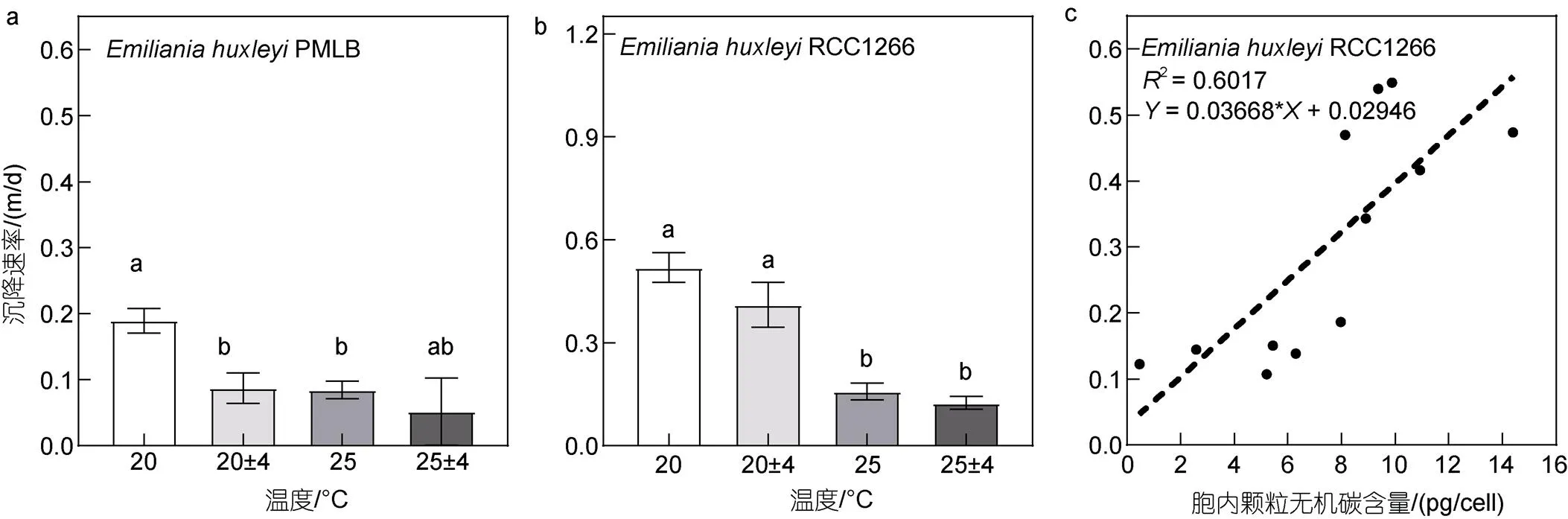
图8 不同温度条件下Emiliania huxleyi PMLB (a)与Emiliania huxleyi RCC1266 (b)的沉降速率及RCC1266株系胞内PIC含量与沉降速率的相关性分析(c)
2.5 交互作用
升温和温度波动对非钙化株系PMLB的生长速率、生物量以及元素计量学指标的交互作用见表2。通过对培养后PMLB各参数的分析发现, 升温和温度波动对PMLB的生长速率、C/N、N/P和C/P产生协同性交互效应, 对胞内chl、蛋白质、碳水化合物、POP、POC和PON含量、POC生产速率以及沉降速率产生拮抗性交互效应。且升温和温度波动对PMLB的生长速率、胞内碳水化合物和POC含量有显著的交互作用(<0.05)。
升温和温度波动对非钙化株系RCC1266的生长速率、生物量以及元素计量学指标的交互作用见表3。通过对培养后RCC1266各参数的分析发现, 升温和温度波动对RCC1266的生长速率、胞内POC、PON和PIC含量、C/N、N/P、C/P、PIC/POC、POC与PIC生产速率产生协同性交互效应, 对胞内chl、蛋白质、碳水化合物、POP含量以及沉降速率产生拮抗性交互效应。且升温和温度波动对RCC1266的生长速率、胞内蛋白质、碳水化合物和PIC含量、C/N、POC与PIC生产速率以及沉降速率有显著的交互作用(<0.05)。
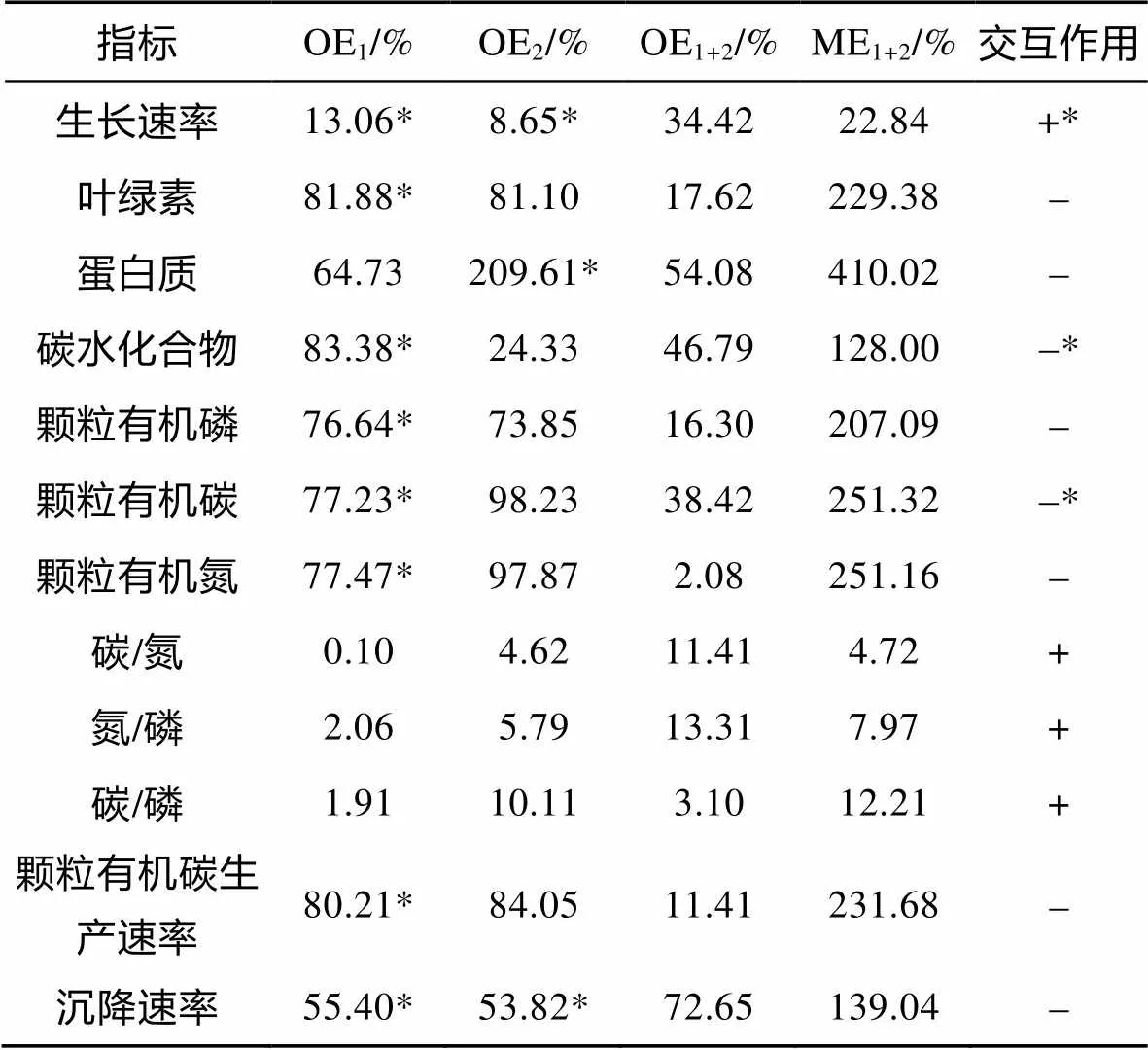
表2 升温和温度波动对E. huxleyi PMLB生长速率、生物量及元素计量学指标的交互作用
注: OE1和OE2分别为升温和温度波动对.PMLB生理参数的表观影响; OE1+2为升温和温度波动交互对.PMLB生理参数的表观影响; ME1+2为升温和波动的交互效应; + 表示协同性交互效应;-表示拮抗性交互效应; *表示Two-way ANOVA的结果为<0.05; 无标记表示Two-way ANOVA的结果为>0.05

表3 升温和温度波动对E. huxleyi RCC1266生长速率、生物量及元素计量学指标的交互作用
注: OE1和OE2分别为升温和温度波动对.PMLB生理参数的表观影响; OE1+2为升温和温度波动交互对.PMLB生理参数的表观影响; ME1+2为升温和波动的交互效应; + 表示协同性交互效应;-表示拮抗性交互效应; *表示Two-way ANOVA的结果为<0.05; 无标记表示Two-way ANOVA的结果为>0.05
3 讨论
升温与温度波动对两株系颗石藻的生长均起到了抑制作用, 导致两株的生长速率均在高温波动组最低。不同的是, 升温对非钙化株系生长速率的影响更明显, 而温度波动对钙化株系生长速率的影响更显著。温度对浮游植物的生长至关重要, 直接影响藻细胞代谢途径中酶的活性。在一定温度范围内, 温度升高通常可以导致浮游植物细胞生长显著升高(Fu, 2014; O’Donnell, 2017)。颗石藻的最佳生长温度范围通常为20~25 °C (Rosas-Navarr, 2016), 而本研究中由20 °C至25 °C的升温使两株的生长速率显著降低, 表明分离自温带海域的两个株系的最优生长温度均低于25 °C。在温度波动条件下, 本研究中两株颗石藻的生长速率则进一步降低。针对分离自马尾藻海域的钙化株系CCMP371的研究也发现, 温度波动生长的削弱作用在平均温度较高的条件下尤为明显(Wang, 2019)。这潜在表明在温度波动条件下的最佳生长温度范围之外的高温条件将对颗石藻生长产生更强的负面影响。藻细胞适应高温可能需要合成新的蛋白质(如热休克蛋白)来加强细胞修复机制对抗恶劣环境, 从而可能对能量和营养重新分配, 降低生长速度(O’Donnell, 2018; Schaum, 2018)。而由于浮游植物对温度的响应是非线性的, 其生理过程对温度波动变化的响应与稳态条件下有显著差异(Jensen, 1906)。
升温显著降低了两种颗石藻胞内叶绿素、碳水化合物、POP、PON含量, 其主要原因可能是高温降低了藻细胞对营养盐的吸收和利用(Reynolds, 2006a, 2006b; O’Donnell, 2018; Qu, 2018)。已有研究表明, 在较高的温度下, 浮游植物会显著提高蛋白质的合成以对抗恶劣环境(Toseland, 2013; Fu, 2022), 而在本研究中尤其是钙化株系的胞内蛋白质含量在升温组显著高于对照组, 有助其对抗升温导致的不利影响, 导致其胞内碳氮元素含量的下降远没有非钙化株系显著, 这也潜在表明了颗石藻的钙化作用可能对其应对高温环境的负面效应起缓冲保护作用。此外, 两株颗石藻的生长速率与元素组成对升温和温度波动的响应存在着不一致的趋势, 这是由于浮游植物可通过改变代谢途径的方式适应环境的变化, 如通过降低生长速率的方式来增加对其他生理功能的能量分配(Toseland, 2013; Halsey, 2015; Yvon-Durocher, 2015)。
升温和温度波动对钙化和非钙化株系的元素组成的影响趋势存在株间差异, 而且两株系对温度波动的生理响应在两种不同的平均温度条件下也有不同的趋势, 这可能与其是否具有钙化功能有关及两株藻的最优生长温度范围有关。在本研究中,尽管升温降低了非钙化株系的胞内叶绿素、蛋白质及碳水化合物含量, 但在温度波动条件下, 这些指标的含量均显著上升; 温度波动使非钙化颗石藻胞内大分子和元素含量与POC生产速率也都显著升高。这表明温度的波动变化可能在一定程度上增强了颗石藻的可塑性, 温度升高导致的负效应在一定程度上被波动状态下短暂出现的良性条件所补偿(Schuam, 2018)。通过对两株系的生理响应结果进行对比分析, 发现非钙化株系各生理参数尤其是元素组成对升温和温度波动变化更为敏感, 而钙化株系的组间差异较小。Flynn等(2016)研究揭示了颗石藻可通过钙化作用保持藻细胞周围微环境(如pH)处于相对稳态, 以抵抗外界环境变化, 而本研究中钙化株系细胞元素组成的不敏感性也可能来自于颗石藻的钙化作用对其应对环境波动下的极端环境条件起缓冲保护作用。近期对同种甲藻不同株系的研究也发现了甲藻应对温度波动变化的生理响应的株间效应与其生活史所处温度范围有关(Fu, 2022)。颗石藻钙化与非钙化株系不同响应的相关机制尚有待后续深入研究。
升温与温度波动均显著削弱了两株颗石藻的向下沉降, 且升温对钙化株系沉降速率的减缓作用尤为显著。颗石藻钙化作用产生的颗石粒的压重效应可大大加速颗石藻的沉降速率(Lecourt, 1996), 导致本研究中钙化株系沉降速率远高于非钙化株系, 并随着升温引起的PIC生产即钙化作用受到显著削弱, 钙化株系的沉降速率也显著降低。且这种削弱作用在高温波动环境中更加显著, 并进一步降
低了钙化株系的沉降速率。这主要是因为温度的波动迫使藻细胞间歇性地应对不利于其生长的极端高温(29 °C) (Rosas-Navarr, 2016), 颗石藻细胞反复经历极端高温环境会大幅削弱其钙化作用降低其颗石粒的生成(Gerecht, 2014; Feng, 2017, 2018), 并随之引起PIC/POC值的显著降低。PIC和POC的比值即雨率(rain ratio)是碳向深海输出的重要参数(Doney, 2009), 而颗石粒的压重效应推动的沉降对在海洋生物碳泵所主导的碳向深海的输运与埋藏起到重要作用。本研究结果表明海水升温可潜在削弱颗石藻相关的碳沉降, 而温度震荡变化将进一步加剧这种效应。
本研究也进一步揭示了升温与温度波动对两株颗石藻的生长及元素组成产生交互作用。升温与温度波动对两株系颗石藻的交互作用表现为对生长速率的协同降低作用以及对碳水化合物含量的拮抗作用。升温与温度波动的交互对非钙化颗石藻生理参数的影响多为拮抗, 这更加说明温度波动可以缓解升温对非钙化颗石藻的不利影响。而钙化株系由于其钙质外壳的存在, 致使升温与温度波动的交互未对其生理参数未出现完全一致的影响, 体现了升温与温度波动的交互对两株系生理参数的影响存在株间差异。升温与温度波动两种环境条件协同抑制了两株系的生长速率, 这表明气候变暖导致的海洋表层温度升高及波动的频率增加不利于颗石藻的生长, 进而加剧降低与颗石藻相关的由表层向深海输出碳的速度。同样的, Cabrerizo等(2021)通过总结分析近年来等相关研究结果, 也发现升温与温度波动对海洋微生物在从个体到种群以及不同时间尺度上均存在不同程度的复杂交互效应。
4 结论与展望
颗石藻的非钙化与钙化株系的生长速率、元素组成及沉降速率等生理指标均受到了升温和温度波动变化的影响, 而升温和温度波动变化对两株的生长速率以及胞内碳水化合物含量均产生了显著的交互效应, 温度的波动变化可能在一定程度上增强了颗石藻的可塑性。通过对两株系的生理响应结果进行对比分析, 结果表明非钙化株系各生理参数对升温和温度波动变化更为敏感, 潜在表明颗石藻的钙化作用可能对其应对环境波动下的极端环境条件起缓冲保护作用。升温和温度波动变化显著削弱了颗石藻的沉降速率, 可对颗石藻相关的海洋碳沉降与输出产生显著的削弱效应。因此, 在全球变化背景下, 叠加在升温基础上的温度波动变化的环境异质性对海洋颗石藻的生理生态学效应不容忽视。
值得注意的是, 尽管本研究初步发现颗石藻非钙化及钙化株系对升温和温度波动变化的响应存在株间差异, 但其分子机制在本研究中并未涉及。因此, 未来的研究还需从分子水平如转录组及基因组层面对其机制进行深入分析。此外, 海洋中环境因子变化的时间尺度可从较短(几秒至几小时)一直到较长(几十年至上百年)甚至到更长的特征时间尺度(Kremer, 2018), 而环境变化作用于浮游植物的长期效应可能不同于短期效应。要更准确地预测颗石藻对未来全球气候变化的响应和相关机制, 也需要从进化学的角度研究颗石藻应对温度波动震荡变化的长期响应趋势。
王鑫威, 2019. 温度波动和CO2浓度升高对典型浮游植物的影响[D]. 厦门: 厦门大学: 69-74.
冯媛媛, 席茂年, 2020. 全球气候变化下的海洋颗石藻生理生态学响应研究进展[J]. 海洋环境科学, 39(6): 945-952.
郭世安, 张海彦, 魏皓, 等, 2022. 2013~2019年渤海夏季高温现象及机制分析[J]. 海洋与湖沼, 53(2): 269-277.
BERNHARDT J R, O’CONNOR M I, SUNDAY J M,, 2020. Life in fluctuating environments [J]. Philosophical Transactions of the Royal Society B, 375(1814): 20190454.
Proceedings of the Royal Society B: Biological Sciences, 285(1886): 20181076.
BIENFANG P K, 1981. SETCOL – a technologically simple and reliable method for measuring phytoplankton sinking rates [J]. Canadian Journal of Fisheries and Aquatic Sciences, 38(10): 1289-1294.
BOYD P W, STRZEPEK R, FU F X,, 2010. Environmental control of open-ocean phytoplankton groups: now and in the future [J]. Limnology and Oceanography, 55(3): 1353-1376.
BRADFORD M M, 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 72(1/2): 248-254.
BROWN C W, 1995. Global distribution of coccolithophore blooms [J]. Oceanography, 8(2): 59-60.
CABRERIZO M J, MARAÑÓN E, 2021. Temperature fluctuations in a warmer environment: impacts on microbial plankton [J]. Faculty Reviews, 10: 9.
CUBILLOS J C, WRIGHT S W, NASH G,, 2007. Calcification morphotypes of the coccolithophoridin the Southern Ocean: changes in 2001 to 2006 compared to historical data [J]. Marine Ecology Progress Series, 348: 47-54.
DOBLIN M A, VAN SEBILLE E, 2016. Drift in ocean currents impacts intergenerational microbial exposure to temperature [J]. Proceedings of the National Academy of Sciences of the United States of America, 113(20): 5700-5705.
DONEY S C, FABRY V J, FEELY R A,, 2009. Ocean acidification: the other CO2problem [J]. Annual Review of Marine Science, 1(1): 169-192.
DUBOIS M, GILLES K A, HAMILTON J K,, 1956. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 28(3): 350-356.
EPPLEY R W, 1972. Temperature and phytoplankton growth in the sea [J]. Fishery Bulletin, 70(4): 1063-1085.
FENG Y Y, ROLEDA M Y, ARMSTRONG E,, 2017. Environmental controls on the growth, photosynthetic and calcification rates of a Southern Hemisphere strain of the coccolithophore[J]. Limnology and Oceanography, 62(2): 519-540.
FENG Y Y, ROLEDA M Y, ARMSTRONG E,, 2018. Environmental controls on the elemental composition of a Southern Hemisphere strain of the coccolithophore[J]. Biogeosciences, 15(2): 581-595.
FENG Y Y, WARNER M E, ZHANG Y H,, 2008. Interactive effects of increased pCO2, temperature and irradiance on the marine coccolithophore(Prymnesiophyceae) [J]. European Journal of Phycology, 43(1): 87-98.
FISCHETTI M, 2013. Deep heat threatens marine life [J]. Scientific American, 308(4): 92.
FLYNN K J, CLARK D R, WHEELER G, 2016. The role of coccolithophore calcification in bioengineering their environment [J]. Proceedings of the Royal Society B: Biological Sciences, 283(1833): 20161099.
FU F X, TSCHITSCHKO B, HUTCHINS D A,, 2022. Temperature variability interacts with mean temperature to influence the predictability of microbial phenotypes [J]. Global Change Biology, 28(19): 5741-5754.
FU F X, YU E, GARCIA N S,, 2014. Differing responses of marine N2fixers to warming and consequences for future diazotroph community structure [J]. Aquatic Microbial Ecology, 72(1): 33-46.
GAO K S, BEARDALL J, HÄDER D P,, 2019. Effects of ocean acidification on marine photosynthetic organisms under the concurrent influences of warming, UV radiation, and deoxygenation [J]. Frontiers in Marine Science, 6: 322.
GERECHT A C, ŠUPRAHA L, EDVARDSEN B,, 2014. High temperature decreases the PIC/POC ratio and increases phosphorus requirements in(Haptophyta) [J]. Biogeosciences, 11(13): 3531-3545.
GUILLARD R R, RYTHER J H, 1962. Studies of marine planktonic diatoms: I.nana Hustedt, and(cleve) Gran [J]. Canadian Journal of Microbiology, 8(2): 229-239.
HAGINO K, OKADA H, MATSUOKA H, 2005. Coccolithophore assemblages and morphotypes ofin the boundary zone between the cold Oyashio and warm Kuroshio currents off the coast of Japan [J]. Marine Micropaleontology, 55(1/2): 19-47.
HALSEY K H, JONES B M, 2015. Phytoplankton strategies for photosynthetic energy allocation [J]. Annual Review of Marine Science, 7(1): 265-297.
HOBDAY A J, ALEXANDER L V, PERKINS S E,, 2016. A hierarchical approach to defining marine heatwaves [J]. Progress in Oceanography, 141: 227-238.
HUTCHINS D A, DITULLIO G R, ZHANG Y,, 1998. An iron limitation mosaic in the California upwelling regime [J]. Limnology and Oceanography, 43(6): 1037-1054.
IPCC, 2022. Climate Change 2022: impacts, adaptation and vulnerability [R/OL]. (2022-02-28) [2022-05-09]. https:// www.ipcc.ch/report/ar6/wg2/.
IUCN, 2016. Explaining ocean warming: causes, scale, effects and consequences [R/OL]. 359-372. (2016-08-19) [2022-05-09]. https://doi.org/10.2305/IUCN.CH.2016.08.en.
JENSEN J L W V, 1906. Sur les fonctions convexes et les inégalités entre les valeurs moyennes [J]. Acta Mathematica, 30(1): 175-193.
KREMER C T, FEY S B, ARELLANO A A,, 2018. Gradual plasticity alters population dynamics in variable environments: thermal acclimation in the green alga[J]. Proceedings of the Royal Society B: Biological Sciences, 285(1870): 20171942.
LECOURT M, MUGGLI D L, HARRISON P J, 1996. Comparison of growth and sinking rates of non-coccolith- and coccolith-forming strains of(Prymnesiophyceae) grown under different irradiances and nitrogen sources [J]. Journal of Phycology, 32(1): 17-21.
LEINWEBER A, GRUBER N, FRENZEL H,, 2009. Diurnal carbon cycling in the surface ocean and lower atmosphere of Santa Monica Bay, California [J]. Geophysical Research Letters, 36(8): L08601.
MCINTYRE A, BÉ A W H, 1967. Modern coccolithophoridae of the Atlantic ocean–I. Placoliths and Cyrtoliths [J]. Deep Sea Research and Oceanographic Abstracts, 14(5): 561-597.
NORBERG J, 2004. Biodiversity and ecosystem functioning: a complex adaptive systems approach [J]. Limnology and Oceanography, 49(4): 1269-1277.
O’DONNELL D R, HAMMAN C R, JOHNSON E C,, 2017. Temperature selection drives evolution of function-valued traits in a marine diatom [J]. bioRxiv, doi: 10.1101/167817.
O’DONNELL D R, HAMMAN C R, JOHNSON E C,, 2018. Rapid thermal adaptation in a marine diatom reveals constraints and trade-offs [J]. Global Change Biology, 24(10): 4554-4565.
PARMESAN C, YOHE G, 2003. A globally coherent fingerprint of climate change impacts across natural systems [J]. Nature, 421(6918): 37-42.
PERKINS-KIRKPATRICK S E, LEWIS S C, 2020. Increasing trends in regional heatwaves [J]. Nature Communications, 11(1): 3357.
PIGGOTT J J, TOWNSEND C R, MATTHAEI C D,, 2015. Reconceptualizing synergism and antagonism among multiple stressors [J]. Ecology and Evolution, 5(7): 1538-1547. https://onlinelibrary.wiley.com/doi/10.1002/ece3.1465.
POULTON A J, ADEY T R, BALCH W M,, 2007. Relating coccolithophore calcification rates to phytoplankton community dynamics: regional differences and implications for carbon export [J]. Deep Sea Research Part II: Topical Studies in Oceanography, 54(5/6/7): 538-557.
QU P P, FU F X, HUTCHINS D A, 2018. Responses of the large centric diatomsp. to interactions between warming, elevated CO2, and nitrate availability [J]. Limnology and Oceanography, 63(3): 1407-1424.
RASCONI S, WINTER K, KAINZ M J, 2017. Temperature increase and fluctuation induce phytoplankton biodiversity loss – Evidence from a multi-seasonal mesocosm experiment [J]. Ecology and Evolution, 7(9): 2936-2946.
RAVEN J A, GEIDER R J, 1988. Temperature and algal growth [J]. New Phytologist, 110(4): 441-461.
REYNOLDS C S, 2006a. Photosynthesis and carbon acquisition in phytoplankton [M] // REYNOLDS C S. The Ecology of Phytoplankton. Cambridge, UK: Cambridge University Press: 93-144.
REYNOLDS C S, 2006b. Nutrient uptake and assimilation in phytoplankton [M] // REYNOLDS C S. The Ecology of Phytoplankton. Cambridge, UK: Cambridge University Press: 145-177.
ROSAS-NAVARRO A, LANGER G, ZIVERI P, 2016. Temperature affects the morphology and calcification ofstrains [J]. Biogeosciences, 13(10): 1-22.
ROST B, RIEBESELL U, 2004. Coccolithophores and the biological pump: responses to environmental changes [M] // THIERSTEIN H R, YOUNG J R. Coccolithophores. Berlin, Germany: Springer: 99-125.
SALINGER M J, 2005. Climate variability and change: past, present and future - An overview [J]. Climatic Change, 70(1/2): 9-29.
SCHAUM C E, BUCKLING A, SMIRNOFF N,, 2018. Environmental fluctuations accelerate molecular evolution of thermal tolerance in a marine diatom [J]. Nature Communications, 9(1): 1719.
SETT S, BACH L T, SCHULZ K G,, 2014. Temperature modulates coccolithophorid sensitivity of growth, photosynthesis and calcification to increasing seawaterCO2[J]. PLoS One, 9(2): e88308.
SHURIN J B, WINDER M, ADRIAN R,, 2010. Environmental stability and lake zooplankton diversity-contrasting effects of chemical and thermal variability [J]. Ecology Letters, 13(4): 453-463.
SOLÓRZANO L, SHARP J H, 1980. Determination of total dissolved phosphorus and particulate phosphorus in natural waters [J]. Limnology and Oceanography, 25(4): 754-758.
TOSELAND A, DAINES S J, CLARK J R,, 2013. The impact of temperature on marine phytoplankton resource allocation and metabolism [J]. Nature Climate Change, 3(11): 979-984.
TYRRELL T, MERICO A, 2004.: bloom observations and the conditions that induce them [M] // THIERSTEIN H R, YOUNG J R. Coccolithophores. Berlin, Germany: Springer: 75-79.
VASSEUR D A, DELONG J P, GILBERT B,, 2014. Increased temperature variation poses a greater risk to species than climate warming [J]. Proceedings of the Royal Society B: Biological Sciences, 281(1779): 20132612.
WANG X W, FU F X, QU P P,, 2019. How will the key marine calcifierrespond to a warmer and more thermally variable ocean? [J]. Biogeosciences, 16(22): 4393-4409.
WELSCHMEYER N A, 1994. Fluorometric analysis of chlorophyll a in the presence of chlorophyllb and pheopigments [J]. Limnology and Oceanography, 39(8): 1985-1992.
WESTBROEK P, BROWN C W, VAN BLEIJSWIJK J,, 1993. A model system approach to biological climate forcing. The example of[J]. Global and Planetary Change, 8(1/2): 27-46.
WILLIAMS I N, TORN M S, RILEY W J,, 2014. Impacts of climate extremes on gross primary production under global warming [J]. Environmental Research Letters, 9(9): 094011.
WINTER A, HENDERIKS J, BEAUFORT L,, 2014. Poleward expansion of the coccolithophore[J]. Journal of Plankton Research, 36(2): 316-325.
YVON-DUROCHER G, DOSSENA M, TRIMMER M,, 2015. Temperature and the biogeography of algal stoichiometry [J]. Global Ecology and Biogeography, 24(5): 562-570.
ZONDERVAN I, ROST B, RIEBESELL U, 2002. Effect of CO2concentration on the PIC/POC ratio in the coccolithophoregrown under light-limiting conditions and different daylengths [J]. Journal of Experimental Marine Biology and Ecology, 272(1): 55-70.
STRAIN SPECIFIC RESPONSES OF COCCOLITHOPHORETO WARMING AND TEMPERATURE FLUCTUATION
WANG Ya-Nan1, 2, FENG Yuan-Yuan2, 3, LI Tong-Tong1, CAI Ting4, BAI You-Cheng4
(1. College of Marine and Environmental Sciences, Tianjin University of Science and Technology, Tianjin 300457, China; 2. School of Oceanography, Shanghai Jiao Tong University, Shanghai 200030, China; 3. Shanghai Polar Frontier Scientific Research Base; Shanghai 200030, China; 4. Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, China)
Under global climate change, with increased frequency of extreme weather, marine organisms are also affected by environmental heterogeneity—the fluctuation of environmental conditions based on average level. Therefore, the strain-specific effects of temperature fluctuation on coccolithophores was studied by conducting a semi-continuous incubation on a non-calcified and a calcified strain of coccolithophore, an important role player in marine carbon cycle. The physiological responses of the two strains to ocean warming and temperature fluctuation at low (20 °C) and high (25 °C) mean temperatures were examined. Results suggest that the temperature increase and fluctuation inhibited the growth of, while significant interactive effects of temperature increase or fluctuation on growth and cellular carbohydrate content of two strains of, PIC content of non-calcified, and protein and PIC contents of calcifiedwere observed. Temperature fluctuation enhanced the adaptability of coccolithphores in response to an elevated temperature. Comparison between the physiological responses of the two strains reveals that the physiology of non-calcified strain was more sensitive to warming and temperature fluctuation, indicating that the calcification of coccolithophores may play a protective role in an extreme environment change. Warming and temperature fluctuation significantly decreased the sinking rate of coccolithophores, suggesting a weakened carbon export by coccolithophores in a warmer and temperature fluctuating environment. Therefore, to precisely predict the response of marine coccolithophores to climate change and the biogeochemical feedbacks, the effects of temperature fluctuation should be considered.
coccolithophores; ocean warming; temperature fluctuations; calcification; strain specific responses
Q948
10.11693/hyhz20220500122
*国家自然科学基金, 41676160号; 天津市自然科学基金项目, 1JCYBJC22900号; 上海市极地前沿科学研究基地资助项目。王雅婻, 硕士研究生, E-mail: 13654956546@163.com
冯媛媛, 研究生导师, 副教授, E-mail: yuanyuan.feng@sjtu.edu.cn, yyfengcocco@126.com
2021-05-09,
2022-08-10
