Ⅱ型糖尿病对小鼠肝脏Cx43蛋白表达及肝纤维化的影响
2023-01-16陆宣兆柴晓明任朝兴朱志铭李佳琪黄鹭铭莫廷美
陆宣兆,柴晓明,任朝兴,朱志铭,李佳琪,黄鹭铭,莫廷美,马 博
(南京工业大学 药学院,江苏 南京 211800)
Ⅱ型糖尿病是由胰岛素抵抗,伴随胰岛β细胞结构和功能性损伤,继而导致胰岛素分泌不足,以血糖升高为主要特征的代谢疾病[1-2]。长期高血糖易诱发多种并发症,包括:糖尿病肾病、视网膜病变、男性生殖系统损伤、心血管及神经病变等[3]。肝脏作为胰岛素主要的靶器官,也是人体内源性和外源性物质主要的代谢场所,糖尿病对肝脏的损害也备受科学界的关注。Tilg等[4]研究表明:胰岛素抵抗和糖尿病已经成为诱发非酒精性脂肪肝的主要因素。长期的高血糖状态可进一步导致不可逆的肝纤维化,并会增加糖尿病患者的死亡风险[5-6]。
肝脏纤维化是纤维结缔组织异常增生的病理表现,是长期的高血糖对肝脏持续性损伤的结果。但目前就糖尿病如何导致肝脏的纤维化的病理机制尚未完全明确。缝隙连接蛋白43(Cx43)作为体内分布最为广泛的连接蛋白家族成员,除了主要在细胞间的通讯中发挥作用外,还参与了基因转录、代谢、自噬和离子转运等生命活动[7]。Cx43参与组织纤维化过程,并在众多疾病模型中产生不同的影响。据Patin等[8]报道:上调Cx43可以激活核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)信号通路,从而发挥自身抗氧化作用,减轻糖尿病肾脏纤维化的发展。给予基因缺陷小鼠Cx43激活剂Gap-163后发现:上调小鼠心脏Cx43和磷酸化Cx43的表达,可以减慢心肌纤维化进程[9]。然而,Li等[10]研究表明:在小鼠疤痕模型中,Cx43的上调可以促进Ⅲ型胶原的积累。Price等[11]研究发现:过表达的Cx43通过增加三磷酸腺苷的外排,可以促进肾小管纤维化的发生。同时,Cx43对维持肝脏功能具有重要作用。与野生型小鼠相比,Cx43基因缺陷型小鼠对CCl4诱导的肝损伤表现更为严重[12]。迄今为止,Cx43在Ⅱ型糖尿病小鼠肝脏中的表达变化及其可能作用机制的研究尚未有所报道。因此,笔者通过构建Ⅱ型糖尿病小鼠模型,观察Cx43在糖尿病小鼠肝脏中的表达变化并探讨其可能的作用机制,以期为Ⅱ型糖尿病诱发的肝纤维化的预防和治疗提供一定的理论基础和依据。
1 材料和方法
1.1 实验材料
1.1.1 药物与试剂
链脲佐菌素(STZ),纯度98%,上海市麦克林生化科技有限公司;高脂饲料,南京市盛民科研动物繁殖场;糖化血清蛋白(GSP)测定试剂盒、葡萄糖测定试剂盒、碱性磷酸酶(AKP)测定试剂盒、谷草转氨酶(AST)测定试剂盒、谷丙转氨酶(ALT)测定试剂盒,南京市建成生物工程研究所有限公司;免疫组化试剂盒,武汉市博士德生物工程有限公司;Cx43抗体及其二抗,美国CST公司;α-SMA、E-cadherin、甘油醛-3-磷酸脱氢酶(GAPDH)抗体及其二抗,武汉市三鹰生物技术有限公司;动物RNA抽提试剂盒、cDNA第一链合成预混液,南通市碧云天生物技术有限公司;实时荧光定量PCR(qPCR)反应专用预混液,南京市诺唯赞生物科技有限公司。
1.1.2 实验动物
SPF级8周龄雄性ICR小鼠,实验动物生产许可证号:SCXK(苏)2017-0007,南京市青龙山动物繁殖场,体质量18~22 g,实验动物自由饮水和进食。
1.2 实验方法
1.2.1 Ⅱ型糖尿病小鼠模型的建立与分组
所有小鼠适应性喂养7 d后,随机选取8只小鼠作为正常组,整个实验过程给予小鼠以普通饲料喂养;另随机选取8只小鼠作为Ⅱ型糖尿病模型组,整个实验周期内给予高脂饲料喂养。并于喂养4周后,模型组小鼠禁食12 h,腹腔注射STZ(溶剂为柠檬酸-柠檬酸钠缓冲液,剂量为30 mg/kg,临用前配制),连续5 d。正常组小鼠则腹腔注射给予同体积的STZ。7 d后,测定模型组小鼠空腹血糖(FBG),发现FBG>11.1 mmol/L,即被视为Ⅱ型糖尿病小鼠模型。模型组小鼠继续高脂饲料喂养8周后,检测肝脏组织和血清生化指标,实验流程见图1。

图1 Ⅱ型糖尿病小鼠模型的建立Fig.1 The establishment of type Ⅱ diabetes model
1.2.2 血糖和糖化血清蛋白的测定
血样以3 500 r/min离心15 min,留取血清,血糖检测采用葡萄糖氧化酶法,糖化血清蛋白采用果糖胺法,分别依照1.1.1项中的试剂盒说明书进行检测。
1.2.3 肝脏形态和肝脏指数
取肝脏置于生理盐水中漂洗,滤纸吸去肝脏表面液体,随后拍摄肝脏图片,同时称取肝脏湿质量,按式(1)计算肝脏指数。
肝脏指数=肝脏质量(g)/体质量(g)
(1)
1.2.4 血清ALT、AST和AKP含量的测定
采用2,4-二硝基苯肼法测定血清AST、ALT浓度,采用磷酸苯二钠底物法测定血清AKP浓度。
1.2.5 组织病理学观察
摘取的肝脏组织置于体积分数4%多聚甲醛溶液中固定48 h后,依次脱水,石蜡包埋,制作4 μm石蜡切片,烤片处理。经二甲苯、梯度乙醇水化,蒸馏水洗 5 min后,参照文献[13]的方法,进行常规苏木素-伊红(HE)和Masson染色,随后进行常规梯度乙醇脱水,二甲苯透片,干燥,中性树胶封片,在光学显微镜下观察肝组织病理学的改变。参照文献[14]的方法,取各组小鼠肝脏制作冰冻切片,进行肝组织油红O染色,甘油明胶封片,在光学显微镜下观察肝脏脂质分布情况。
1.2.6 免疫组化
肝组织石蜡切片经60 ℃烘片,二甲苯脱蜡,梯度乙醇水化;H2O2去除内源性过氧化氢酶;0.01 mol/L枸橼酸钠缓冲溶液微波炉中高火抗原修复3次,每次8 min;体积分数10%山羊血清封闭;滴加一抗α-SMA(按体积比1∶200稀释)和一抗E-cadherin(按体积比1∶400稀释),一抗Cx43(按体积比1∶100稀释)孵育,4 ℃过夜;磷酸缓冲盐溶液(PBS)漂洗3次后,滴加生物素化山羊抗兔IgG,37 ℃孵育1 h;PBS漂洗3次后,滴加链霉亲和素-生物素复合物,37 ℃孵育1 h;随后采用氧化二氨基联苯胺显色并用苏木素复染3 min,经HCl、乙醇快速分化液分化,流动自来水下反蓝;最后采用中性树胶封片后,置于光学显微镜下观察蛋白表达情况。
1.2.7 蛋白免疫印迹测定组织中蛋白的表达
称取一定质量的肝脏组织,预冷PBS清洗3次后,加入含蛋白酶抑制剂的蛋白裂解液匀浆,随后于恒温振荡器上0 ℃振荡裂解30 min,留取上清液。采用BCA法测定蛋白浓度,余下上清液加入上样缓冲液100 ℃水浴6 min;体积分数10%SDS-PAGE凝胶电泳,以湿转法(100 V、120 min)将蛋白转移至聚偏二氟乙烯(PVDF)膜上,质量分数5%脱脂奶粉封闭120 min,孵育一抗Cx43(按体积比1∶1 000稀释)4 ℃过夜,室温120 min孵育对应二抗;采用增强型化学发光法显影,使用凝胶成成像分析系统采集发光信号,曝光后使用Image J软件进行灰度分析。
1.2.8 qPCR
采用离心柱法的动物RNA抽提试剂盒提取肝组织总RNA;依照cDNA第一链合成预混液说明书配制20 μL体系,按照42 ℃、10 min,80 ℃、10 min程序合成cDNA。依照qPCR预混液说明书,配制20 μL qPCR体系。Cx43和GAPDH引物购自上海生工生物工程技术服务公司,引物设计序列为Cx43 primer[正向引物:5-G ̄G ̄T ̄C ̄T ̄G ̄A ̄G ̄A ̄G ̄C ̄C ̄C ̄G ̄A ̄A ̄C ̄T ̄C ̄T ̄C ̄C ̄T-3,反向引物:5-C ̄C ̄C ̄A ̄T ̄G ̄T ̄C ̄T ̄G ̄G ̄G ̄C ̄A ̄C ̄C ̄T ̄C ̄T ̄C ̄T ̄T ̄T-3];GAPDH primer[正向引物:5-AATGGTGAAGGTCGGTGTGAACG-3,反向引物:5-TCGCTCCTGGAAGATGGTGATGG-3]。采用SYBR GreenⅠ嵌合荧光法,按照95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火/延伸30 s,共进行40次循环扩增,监测融解曲线反映扩增产物的特异性。以内参基因GAPDH的表达量作为参照,分析目标基因的表达量。
1.2.9 数据处理
实验数据以平均值±标准差(Mean±SD)表示,采用统计软件GraphPad Prism 8.0比较2组数据差异显著性;t检验法,以P<0.05作为差异显著性,具有统计学意义。
2 结果与讨论
2.1 Ⅱ型糖尿病小鼠动物模型的建立
参照文献[15]的方法,通过高脂饲料喂养结合STZ注射的方法,成功建立了Ⅱ型糖尿病小鼠的模型。高脂饲料喂养诱导外周胰岛素抵抗状态,低剂量的STZ造成了胰岛β细胞轻度损伤,可以较好模拟人类Ⅱ型糖尿病的发病机制和代谢特征,并且参照文献[16]的方法实验后发现:高血糖状态可以在一段时间内保持稳定。
Ⅱ型糖尿病模型建立8周后,分别检测小鼠空腹血糖和糖化血清蛋白指标,以糖化血清蛋白反映小鼠近8周的平均血糖水平,结果见图2。由图2可知:与正常组相比,模型组小鼠空腹血糖、糖化血清蛋白含量均显著增加。说明Ⅱ型糖尿病模型组小鼠在8周的观察期间内,机体均维持在高血糖状态,血糖调节能力下降,糖代谢异常。
2.2 Ⅱ型糖尿病诱导的小鼠肝损伤
取出小鼠肝脏后拍照留存,并观察肝脏形态变化,结果见图3(a)。由图3(a)可知:正常组肝脏质地柔软,呈红褐色,色泽均一。与正常组相比,模型组肝脏体积增大,质地稍硬,色泽呈现黄白色与红褐色相间,提示肝脏可能发生损伤并存在脂肪沉积的现象。同时,称取小鼠体质量和肝脏质量后,计算肝脏指数,结果见图3(b)。由图3(b)可知:模型组肝脏指数相对于正常组显著增加,表明Ⅱ型糖尿病的小鼠肝脏发生了病理性肿大。
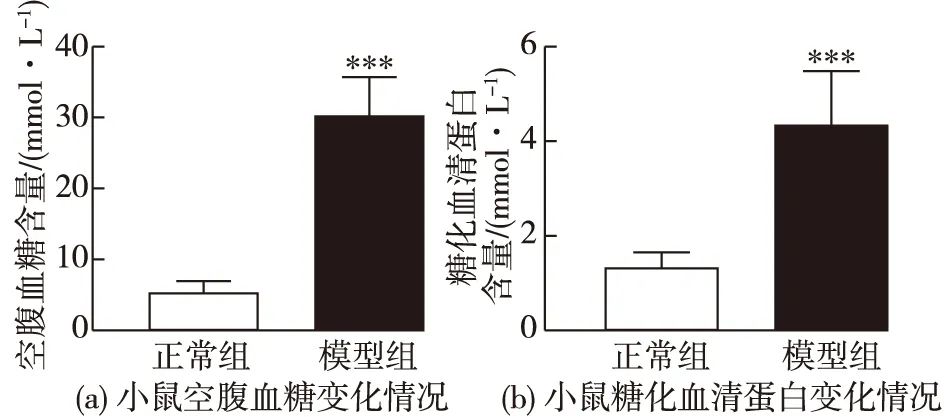
***表示与正常组相比P<0.001图2 小鼠空腹血糖和糖化血清蛋白的变化情况Fig.2 The level of fasting blood glucose and glycated serum proteins in mice

图3 Ⅱ型糖尿病对小鼠肝脏形态和肝脏指数的影响Fig.3 Effects of type Ⅱ diabetes on liver morphology and liver index in mice
肝脏组织中转氨酶AST、ALT和AKP含量丰富,当肝细胞损害发生时,肝细胞中的转氨酶流入血液,血清中AST和ALT含量上升。血清AKP水平的升高提示肝脏疾病的发生。图4为Ⅱ型糖尿病对小鼠血清AST、AKP和ALT含量的影响。由图4可知:相较于正常组,模型组小鼠肝脏指数和血清AST、AKP和ALT均呈显著性增加,提示模型组小鼠的肝功能已受损。
通过对肝组织的HE染色,观察Ⅱ型糖尿病对小鼠肝脏组织形态的影响,结果见图5。由图5可知:正常组小鼠肝小叶结构清晰,肝索呈放射状规则排列,肝血窦大小正常,肝细胞核无空泡变性,形状规则。模型组小鼠肝小叶结构模糊,肝索排列紊乱,肝血窦扩张,肝细胞呈现空泡样改变,细胞核大小不规则,染色质固缩。Saponaro等[17]研究表明:胰岛素抵抗状态会导致脂肪在肝脏的异位沉积。油红O染色观察脂质在肝脏中的沉积情况,红色代表脂质液滴在肝组织中的分布。由图5还可知:相较于正常组,模型组脂质液滴在肝组织的分布明显增加,表明Ⅱ型糖尿病的小鼠肝脏发生了明显的脂肪沉积现象,模型组小鼠肝损伤并伴有脂肪沉积现象。
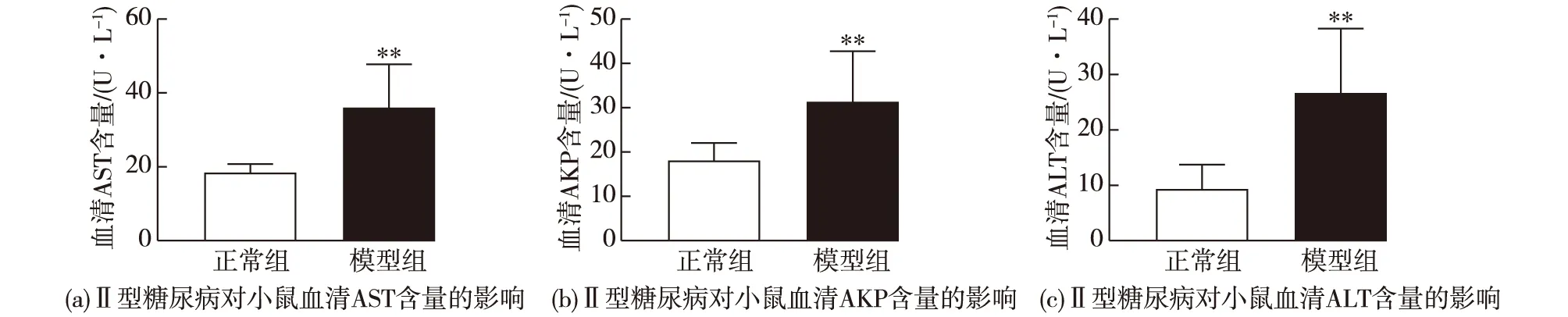
**表示与正常组相比P<0.01图4 Ⅱ型糖尿病对小鼠血清AST、AKP和ALT含量的影响Fig.4 Effects of type Ⅱ diabetes on serum AST,AKP and ALT levels in mice
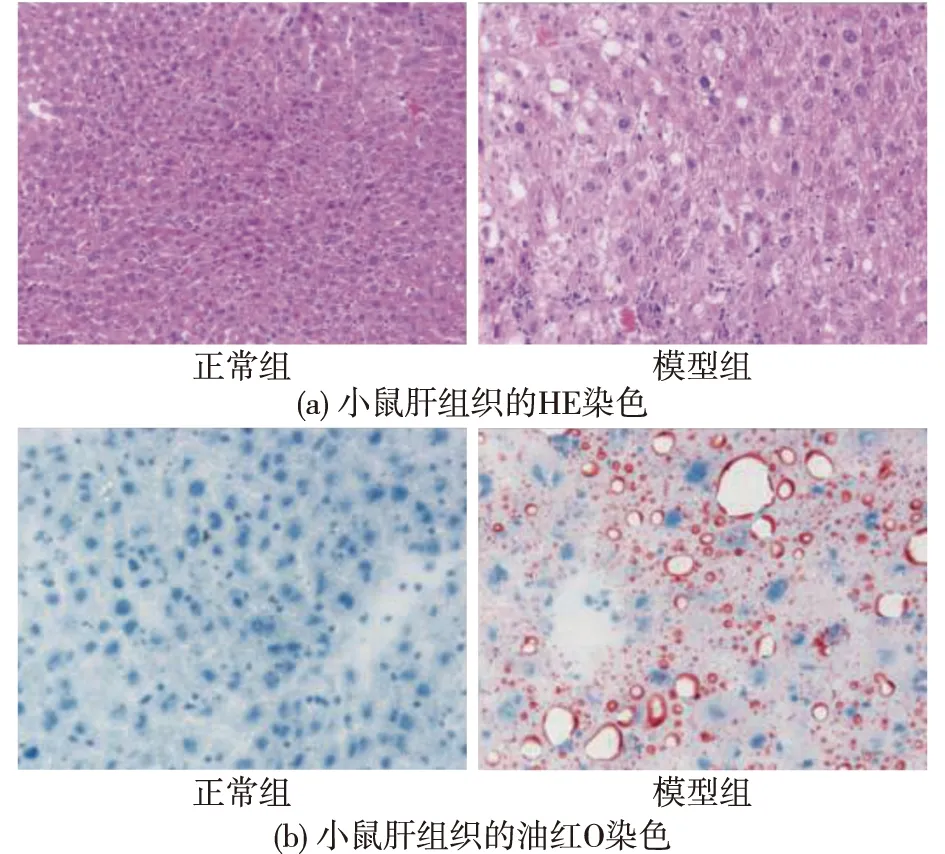
图5 Ⅱ型糖尿病诱发的小鼠肝损伤和脂肪沉积Fig.5 Type Ⅱ diabetes induced liver injury and fat deposition in mice
2.3 Ⅱ型糖尿病诱导的小鼠肝纤维化
Masson染色观察肝组织的纤维化程度,蓝色区域为胶原纤维区域,结果见图6(a)。由图6(a)可知:正常组肝小叶结构完整,中央静脉呈现少量胶原纤维沉积;模型组肝小叶结构紊乱,出现空泡样变化,胶原纤维分布明显增加。α-SMA和E-cadherin的免疫组化结果见图6(b)。由图6(b)可知:模型组相较于正常组肝组织中α-SMA棕黄色的阳性表达明显增加,并且在汇管区域呈现强阳性表达,而模型组E-cadherin的棕黄色阳性表达明显减少。在肝纤维化发展过程中,肝星状细胞激活并向肌成纤维细胞转化,胶原纤维表达增加,并启动α-SMA的表达, E-cadherin表达减少,随后导致细胞外基质过度沉积的发生,这与Nanthakumar等[18]和Hintermann等[19]的研究结果一致。

图6 Ⅱ型糖尿病诱导的小鼠肝纤维化Fig.6 Type Ⅱ diabetes induces liver fibrosis in mice
2.4 Ⅱ型糖尿病对小鼠肝脏Cx43表达的影响
小鼠肝组织Cx43mRNA表达结果见图7(a),由图7(a)可知:模型组Cx43mRNA表达显著高于正常组。小鼠肝组织Cx43的蛋白免疫印迹和免疫组化结果分别见图7(b)和7(c)。由图7(b)和7(c)可知:相较于正常组,模型组小鼠肝组织中Cx43蛋白表达显著上调,这与qPCR的结果相一致。以上结果共同表明:Ⅱ型糖尿病诱导的小鼠肝脏Cx43表达增加。Maes等[20]的研究表明:在对乙酰氨基酚诱导的肝损伤模型中,肝脏Cx43表达上调。同样,Balasubramaniyan等[21]的研究也发现:肝硬化模型中肝组织Cx43的表达增加。Cogliati等[22]的研究也显示:在CCl4诱导的肝纤维化模型中,Cx43基因缺陷小鼠相较于野生型小鼠,肝脏中Cx43表达增加,肝纤维化程度表现更为严重。以上研究均表明:Cx43的过表达可能与肝脏损害有关。

图7 Ⅱ型糖尿病对小鼠肝组织Cx43表达的影响Fig.7 Effects of type Ⅱ diabetes on hepatic Cx43 expression in mice
Cx43家族是主要负责细胞间通讯功能的连接通道。Cooreman等[23]研究也表明:Cx43作为该蛋白家族成员,主要在肝组织的非实质性肝细胞,包括肝星状细胞和巨噬细胞中表达。肝星状细胞的激活在肝纤维化的过程中发挥着重要作用。激活的肝星状细胞表型发生改变,转化为肌成纤维细胞,从而增加胶原纤维的合成[24]。Fischer等[25]研究显示:体内和体外实验中活化的肝星状细胞中都观察到Cx43的表达增加。另有Wu等[26]研究表明:Cx43通过激活TGF-β信号通路,诱导皮肤成纤维细胞向肌成纤维细胞分化,增加皮肤α-SMA和纤连蛋白FN表达,导致纤维化的发生。以上研究均表明了Cx43/TGF-β信号通路的激活可能具有诱导肝星状细胞激活的潜力。除此之外,Li等[10]的研究表明:上调的Cx43通过调节Erk/MMP-1/collagen-Ⅲ通路,促进Ⅲ型胶原积累,提示过表达的Cx43可能与胶原纤维的合成增加有关。由此可见,Cx43的表达上调后,可能通过激活肝星状细胞转化为肌成纤维细胞,并导致肝脏胶原纤维的合成增加。
3 结论
Ⅱ型糖尿病诱导了小鼠肝损伤和肝纤维化的发生。笔者发现了Cx43在Ⅱ型糖尿病小鼠肝组织中表达的增加,并且发现: Cx43的表达上调可能通过参与激活肝星状细胞,增加胶原纤维合成,进而导致肝脏纤维化的发生。
综上所述,本研究为预防和治疗糖尿病诱发的肝损伤和肝纤维化提供了理论基础,下一步可以通过干扰Cx43的表达,观察Cx43对肝星状细胞的影响,并进一步明确在糖尿病诱发的肝损伤和肝纤维化中调控Cx43过表达及其所导致肝纤维化的分子机制。
