优良植物根际促生菌的筛选及其生物学特性
2023-01-15康慎敏武瑞赟穆文强尚庆茂李平兰
康慎敏 武瑞赟 穆文强 尚庆茂 李平兰*
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.中国农业科学院 蔬菜花卉研究所,北京 100081)
农业生产中大量化肥的施用使得环境污染,害虫抗药性以及作物品质下降等问题日趋严重[1-2]。化肥滥用会使土壤中氮磷元素过度累积,造成土壤酸化,地表水富营养化和农产品硝酸盐含量超标等现象,严重威胁着食品安全和公众健康[3-6]。因此,生产高效、安全、环保的新型功能性生物肥料具有重要的现实意义。
植物根际促生菌是指生活在植物根部周围或与植物根部共生的,能通过多种不同机制促进植物生长的一类细菌[7-8]。常见的植物根际促生菌有固氮菌属、芽孢杆菌属、农杆菌属等,其中芽孢杆菌是一类在自然环境中分布极其广泛的革兰氏阳性棒状杆菌,它对人畜无毒无害,且不会对环境带来污染,因其可产生内生孢子,故对复杂环境有较强的适应性,在促进植物生长的领域有较大的应用空间[8]。研究表明芽孢杆菌可产抗生素、细菌素等物质拮抗植物病原真菌,降低植物苗期发病率,也能分泌促生长的物质,进而促进幼苗的生长发育。如Pane等[9]从植物叶面筛选得到能降低番茄链霉病发病率的芽孢杆菌4株,并发现这些菌株均影响番茄早疫病病原真菌的菌丝形态与孢子萌发;Padgham等[10]发现巨大芽孢杆菌能够使水稻根系的线虫侵染和根瘤形成减少40%以上,其代谢产物能够抑制禾谷缢管蚜卵的孵化。但是目前,国内外关于促生抗病芽孢杆菌的研究主要集中在菌株的分离、抑菌活性分析等水平上,没有从基因组层面解析菌株的促生效应,限制了菌株的应用。
本研究旨在筛选出优良的植物根际促生芽孢杆菌,从基因组学的角度上解析菌株促生抗病相关功能及代谢产物合成机制,研究菌株基本特性及促生抗病相关特性,将其促生抗病基因与实际特性进行关联分析,以期为农业生产领域提供新的生物资源与基因资源。
1 材料与方法
1.1 材料及仪器
尖孢镰刀菌(Fusariumoxysporum)、立枯丝核菌(Rhizoctoniasolani),由中国农业微生物菌种保藏管理中心(ACCC)提供,编号分别为36124和37383。青霉菌(Penicilliumglaucum)、灰霉菌(Botrytiscinerea)由中国农业大学食品科学营养与工程学院应用微生物实验室提供。
LB肉汤、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)、蛋白胨、牛肉膏、酵母膏琼脂等购于北京奥博星生物技术有限责任公司;氯化钠、葡萄糖、甘露醇、蔗糖、铬天青、十六烷基三甲基溴化铵、酪蛋白氨基酸等试剂均为分析纯,购于北京蓝弋化工产品有限责任公司;DNA提取及PCR所用试剂均购于北京天根生化科技有限公司;细菌微量生化反应管,购于青岛海博生物技术有限公司。
阿须贝氏(Ashby)无氮培养基:甘露醇10 g/L,K2HPO40.2 g/L,MgSO4·7H2O 0.2 g/L,NaCl 0.2 g/L,CaCO35 g/L,CaSO4·2H2O 0.1 g/L,琼脂15 g/L,pH 7.0;有机磷培养基:蛋白胨10.0 g/L,牛肉膏3.0 g/L,NaCl 5 g/L,琼脂18 g/L,pH 7.0。将配制的培养基分装灭菌,冷却至50 ℃每50 mL加入过滤除菌新鲜蛋黄液3 mL。解钾培养基:蔗糖10 g/L,酵母膏0.5 g/L,(NH4)2SO41 g/L,Na2HPO42 g/L,MgSO4·7H2O 0.5 g/L,CaCO31 g/L,钾长石粉1 g/L,琼脂15 g/L,pH 7.0~7.5;CAS检测液:铬天青(chrome azurol sulphonate,CAS)60.5 mg,十六烷基三甲基溴化铵(hexadecy- ltrimethyl-ammonium bromi,HDTMA)72.9 mg,1 mmol/L FeCl3·6H2O 10 mL,去离子水90 mL,充分混匀后灭菌;酪蛋白氨基酸母液:称取10 g酪蛋白氨基酸溶解于100 mL的去离子水中,0.22 μm的滤膜过滤除菌,4 ℃贮存;MKB培养基:甘油15 mL,K2HPO42.5 g,MgSO4·7H2O 2.5 g,去离子水定容900 mL,pH 7.0~7.5,灭菌后冷却,加入100 mL酪蛋白氨基酸母液。
垂直流洁净工作台(SCL-1300),北京赛伯乐实验仪器有限公司;恒温振荡器(TH2-C),太仓市试验设备厂;电热恒温培养箱(DNP-9162),上海精宏实验设备有限公司;海尔立式冷柜(BCD-539),青岛海尔股份有限公司;微型漩涡混合仪(WH-3),Barloworld Scientific US Ltd;全自动立式电热压力蒸汽灭菌器(YXQ-LS-SⅡ),上海博迅实业有限公司医疗设备厂;台式高速冷冻离心机(TGL20M,长沙平凡仪器仪表有限公司;微量高速离心机(TG16 W),长沙平凡仪器仪表有限公司。
1.2 试验方法
1.2.1植物根际促生菌的初筛
称取10 g土壤,加入含有玻璃珠的90 mL的NaCl溶液(w(NaCl)=0.85%)中,置于37 ℃摇床180 r/min振荡20 min,将悬浮液涂布于无氮固体培养基,37 ℃培养3 d,挑取不同类型的单个典型菌落,经平板多次纯化后,4 ℃保存在LB平板待用。
1.2.2供试细菌菌悬液的制备
将待培养菌株以体积分数为3%的接种量接入LB液体培养基中,摇床培养(180 r/min,37 ℃)20 h,离心(3 000 r/min,5 min),无菌水洗涤2次,调整菌悬液OD600 nm=0.5(菌浓度约为1×108CFU/mL)。
1.2.3植物根际促生菌的复筛
1)溶磷。将1.2.2中的供试菌株菌液接种于有机磷培养基上,37 ℃培养3 d,观察有无透明圈,并根据透明圈直径与菌落直径比值初步确定菌株解有机磷的能力。
2)解钾。将1.2.2中的供试菌株菌液接种于解钾培养基上,37 ℃培养3 d,观察有无透明圈,并根据透明圈直径与菌落直径比值初步确定菌株解钾的能力。
1.2.4优良植物根际促生菌的鉴定
1)全基因组测序。菌株的全基因组测序及分析参考Wu等[11]。按照1.2.2的方法制备菌悬液,离心收集菌体,按照细菌基因组DNA提取试剂盒说明书提取总DNA,检测合格后进行基因组测序、组装和注释菌株的基因组信息。基因组测序采用Illumina Hiseq 2 000平台(GATC Biotech)进行。测序后分别进行组分、通用功能和特殊功能鉴定。利用基因和基因组百科(KEGG)数据库、同源组簇(Clusters of orthologous groups, COG)和Pfam(https:∥pfam.xfam.org/)预测功能基因。
2)生理生化及16S rDNA鉴定。挑取少量的LPL-410.7菌体,于LB平板上划线,37 ℃培养20 h。观察菌株菌落形态,并革兰氏染色记录菌体形态。采用细菌微量生化反应管对糖醇利用、卵磷脂降解、明胶液化、酪素水解等生理生化指标进行测定。
16S rDNA鉴定。采用细菌DNA提取试剂盒提取LPL-410.7菌株基因组DNA,选用细菌的通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACC TTGTTACGACTT-3′),进行 PCR扩增。PCR反应产物纯化后,连接T载体后测序。测序结果在NCBI上使用BLAST比对,利用MEGA软件建立菌株LPL-410.7的系统发育树。
1.2.5优良植物促生菌的特性
1)生长曲线。将活化后的菌株LPL-410.7以体积分数为3%的接种量接入LB液体培养基中,振荡培养(37 ℃,180 r/min),每隔2 h测定菌液的OD600 nm,至OD600 nm无显著变化为止。
2)耐酸碱和耐盐特性。用HCl或NaOH溶液调节LB液体培养基的初始pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0;配置不同质量浓度的NaCl溶液(0、1、3、5、7、10和15 g/L)。将菌株LPL-410.7以体积分数为3%的接种量接入不同pH和NaCl质量浓度的培养基中,37 ℃,180 r/min振荡培养24 h后涂布,测定细菌数量。
3)自凝集性。菌株的表面凝集性测定方法参考李文等[12]。按照1.2.2的方法制备菌悬液,离心(5 000 r/min,10 min,25 ℃),用PBS清洗菌体2次,倒去上清液,用PBS重悬浮菌体,调节菌液OD600 nm=0.5±0.05。吸取5 mL菌悬液于离心管中,置于37 ℃培养箱中静置培养,分别于1、2、4、12和24 h时,轻轻吸取200 mL上层悬浮液,测定OD600 nm。菌体表面凝集性计算公式为:
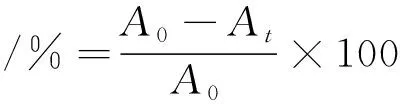
式中:A0为菌悬液初始吸光度;At为菌悬液静置后的吸光度。
4)表面疏水性。参考微生物黏着碳氢化合物法检测菌株的表面疏水性[12]。按照1.2.2的方法制备菌悬液,调节菌液OD600 nm=0.5±0.05,吸取4 mL菌悬液于离心管中,再加入1 mL碳氢化合物(正己烷、乙酸乙酯、二甲苯),不加碳氢化合物的作为对照组。将离心管充分涡旋振荡1 min,混匀后在室温下静置,1 h后使用无菌注射器吸取下层水相,以PBS缓冲液作为空白对照,测定OD600 nm。表面疏水性计算公式为:
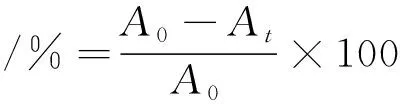
式中:A0为对照组吸光度;At为试验组的吸光度。
5)DPPH清除率。参考Tang等[13]的方法测定菌株的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)清除率。将菌株LPL-410.7摇床培养(180 r/min,37 ℃)20 h后离心(5 000 r/min,10 min,25 ℃),使用0.22 μm的无菌滤膜过滤上清液得到无细胞上清液(Cell-free supernatants,CFS)。PBS清洗2次菌体,调整细菌浓度使得OD600 nm=0.5±0.05,得到完整细胞悬液(Intact cell,IC)。将上述菌悬液在冰浴中使用超声破碎仪(超声3 s,间隔5 s)破碎细菌15 min,离心(5 000 r/min,10 min,4 ℃)后取上清液,得细胞破碎物(Cell-free extracts,CFE)。将待测样品溶液与0.2 mmol/L DPPH乙醇溶液等体积混合均匀,室温下避光反应30 min,离心(5 000 r/min,10 min,25 ℃),测定上清液在517 nm处的吸光度(A1)。DPPH清除率计算公式为:

式中:A0为DPPH乙醇溶液与PBS混合后的吸光度;A2为乙醇溶液与待测样品溶液混合后的吸光度。
6)对植物病原菌的抑制效果。将28 ℃培养3 d的立枯丝核菌菌饼、尖孢镰刀菌菌饼、青霉菌菌饼、灰霉菌菌饼(直径5 mm)置于PDA培养基中央,将LPL-410.7菌悬液5 μL接种于距真菌菌饼相等距离的十字交叉线的四端,以单独接种病原菌为对照,28 ℃恒温培养5 d。
7)分泌水解酶的能力。按照1.2.2的方法制备菌悬液,将5 μL的LPL-410.7菌悬液点接到蛋白酶和纤维素酶鉴定培养基上,37 ℃培养48 h,观察蛋白酶鉴定培养基透明圈有无;在已有菌斑的纤维素酶鉴定培养基中倒入1 mg/mL的刚果红染料,染色10 min后倒出染料,加入1 mol/L的NaCl溶液脱色15 min,重复脱色3次后观察菌落周围有无透明圈。
8)分泌铁载体能力检测。定性检测:向100 mL的1%琼脂中加入5 mL CAS检测液,倒板。待下层琼脂完全凝固后在其上倒入LB固体培养基。按照1.2.2的方法制备菌悬液,将菌液点接于双层平板,30 ℃培养3 d后观察培养基颜色变化。定量检测:按照1.2.2的方法制备菌悬液,将菌液按照体积分数为3%的接种量接入MKB液体培养基,180 r/min 摇床30 ℃培养48 h,离心(3 500 r/min,15 min,25 ℃),将上清液与CAS检测液混合,室温下反应1 h后测定OD630 nm,记为AS;以未接菌的MKB液体培养基上清液同法测定吸光值,记为Ar。细菌铁载体能力强弱的计算公式为:

9)分泌植物激素含量测定。参考张莹等[14]的方法采用双抗夹心酶联免疫吸附法测定菌株分泌植物激素(吲哚乙酸、赤霉素和细胞分裂素)的能力。将待培养菌株以体积分数为1%的接种量接入LB液体培养基中,置于摇床培养(180 r/min,37 ℃)12、24、36、48和60 h,离心(10 000 r/min,20 min,25 ℃),取上清液作为待测样品备用。在酶标包被板上加入不同浓度的标准品50 μL作为标准品孔,而样品孔加入样品溶液。随后加入辣根过氧化物酶(Horseradish peroxidase,HRP)标记的检测抗体100 μL,置于37 ℃培养60 min后将板彻底洗涤。随后,每孔加入底物3,3′,5,5′-四甲基联苯胺显色,反应终止后立即测量各孔OD450 nm的值。
1.3 数据处理及统计分析
所有试验均做3组平行,结果用“平均值±标准差”表示。使用SPSS Statistx version 17.0对数据进行分析,采用Ducan’s ANOVA对结果间的显著性进行比较,P<0.05为显著。
2 结果与分析
2.1 优良植物根际促生菌的筛选
氮、磷、钾是限制植物生长发育的三大营养元素,本试验从不同的样品中分离得到20株具有固氮能力的菌株,并对初筛得到的菌株的溶解磷和溶解钾能力进行测定,结果见表1和表2。仅有6株菌株具有较弱的解钾能力,分别为LPL-410.7、XZ80、KK3、KK4、ZNLK-1。而供试菌株均具有一定的溶有机磷能力,其中菌株LPL-410.7的溶有机磷能力最强,溶磷圈直径为2.683 cm,可溶性指数为3.132,显著高于其他菌株,这与赵龙飞等[15]从地黄中分离出的溶有机磷能力最强的枯草芽孢杆菌DH71能力基本一致,溶磷圈直径为2.52~2.82 cm,祁娟等[16]从紫花苜蓿种子中分离的对溶解有机磷最佳的内生菌根瘤菌菌株SL01,可溶性指数为2.567,可见菌株LPL-410.7在解有机磷方面具有一定的优势。综合上述因素,本试验选取LPL-410.7进行后续的分析研究。

表1 菌株溶解钾能力测试结果Table 1 Determination results of potassium solubilization of strains

表2 菌株溶解有机磷能力测试结果Table 2 Determination results of organophosphorus dissolution of strains
2.2 优良植物根际促生菌的鉴定
2.2.1形态学鉴定
菌株LPL-410.7在LB固体培养基上的菌落形态见图1(a),菌株菌落呈乳白色,较光滑,不透明,边缘较为规则,呈圆形凸起,菌落直径2.0~3.0 mm。革兰氏染色见图1(b),经革兰氏染色后呈紫色,为革兰氏阳性菌,光学显微镜及扫描电镜观察后可发现菌株为短杆状形态。

N为放大倍数。N is the magnification.
2.2.2生理生化鉴定
表3示出菌株的生理生化试验结果。菌株LPL-410.7能够利用海藻糖、七叶苷、甘露醇、木糖进行发酵,但不能利用麦芽糖。能够水解淀粉和酪素,降解卵磷脂,使明胶液化。而甲基红反应呈阴性,表明该菌发酵产酸量少。

表3 LPL-410.7菌株的生理生化试验Table 3 Biophysical and biochemical characteristics of strain LPL-410.7
2.2.316S rDNA序列同源性鉴定
LPL-410.7菌染色体DNA用PCR扩增出单一条带,PCR产物回收纯化后经DNA测序,序列长度为1430 bp。使用NCBI的BLAST功能,将测序获得的DNA序列与GeneBank数据库中进行同源性检索,使用MEGE软件计算序列同源性并构建基础绘制系统发育树(图2),最终确定菌株为芽孢杆菌属的贝莱斯芽孢杆菌,与形态学、生理生化鉴定结果符合。

图2 基于菌株LPL-410.7和相关菌株的16SrDNA序列采用邻接法建立的系统发育树Fig.2 Phylogenetic tree of strain LPL-410.7 based on 16S rDNA gene sequences
2.3 菌株LPL-410.7基因组序列分析
2.3.1基因组的基本特征
菌株LPL-410.7的染色体全长为3 907 842 bp,没有质粒,GC含量46.66%。LPL-410.7的染色体中共发现蛋白编码序列3 743条,RNA中包含27个rRNAs和86个tRNAs(表4)。基因组测序深度、GC分布、GC-skew以及基因组结构注释的整合信息见图3。基因组的系统发育分析表明,菌株LPL-410.7与贝莱斯芽孢杆菌的同源性为82.24%。根据蛋白质指定的聚类同源组,所有被鉴定的基因被划分为23个功能类别(表5)。此外,LPL-410.7(Q类)的2.07%的基因组参与了次级代谢产物的合成、运输、分解。

表4 贝莱斯芽孢杆菌LPL-410.7的基因组特征Table 4 Features of B. velezensis LPL-410.7 genome
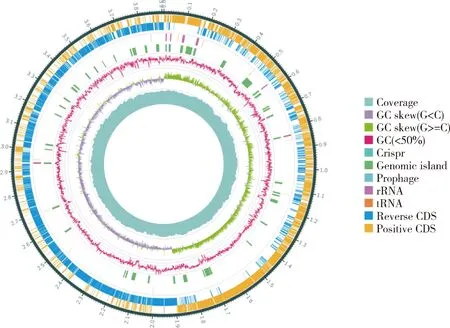
图3 贝莱斯芽孢杆菌LPL-410.7的环形全基因组图Fig.3 Circos genome map of B. velezensis LPL-410.7

表5 贝莱斯芽孢杆菌LPL-410.7的COG类Table 5 COG categories of B. velezensis LPL-410
2.3.2植物促生相关基因分析
碱性磷酸酶、碱性磷酸二酯酶可以将有机磷转化为无机磷酸盐,是用来评价解有机磷能力的常用指标。基因注释结果表明,菌株LPL-410.7能够在phoA、phoB、phoD编码的碱性磷酸酶和glpQ、gdpP编码的磷酸二酯酶的作用下,发挥解有机磷的重要功能,促进植物的对磷元素的吸收。

表6 LPL-410.7解有机磷相关基因Table 6 Genes related to degradation of organophosphorus in LPL-410.7 genome
细菌合成吲哚乙酸主要通过吲哚-3-丙酮酸途径(Indole-3-pyruvicacid,IPA)、吲哚-3-乙酰胺(Indole-3-acetamide,IAM)途径和吲哚-3-乙腈(Indole-3-acetonitrile,IAN)3种途径[17],由LPL-410.7的IAA(Indole-3-acetic acid,IAA)合成相关基因(表7)可知,LPL-410.7菌株含有编码吲哚-3-丙酮酸途径(IPA)关键酶的基因。该菌株具有能够编码吲哚乙酸合成相关的关键基因(trpABC、patB和aldH),推测菌株可以色氨酸为前体物质,在patB编码的氨基转移酶的催化下转化为吲哚3-丙酮酸,吲哚3-丙酮酸脱羧后变为吲哚-3-乙醛,随后在aldH编码的醛脱氢酶(NAD+)作用下,产生吲哚乙酸。类似地,地衣芽孢杆菌LCDD6含有IPA途径相关的patB、aldH,以及IAM途径合成吲哚乙酸必需的酰胺酶的编码基因amiE[18],枯草芽孢杆菌ZJB-603和ATCC21697菌株具有IAN途径中的关键酶[19],可见不同菌种之间产生吲哚乙酸的方式存在差异。

表7 LPL-410.7产IAA相关基因Table 7 Production of IAA related genes in LPL-410.7 genome
细菌可以通过依赖于非核糖体肽(NRPS)途径合成铁载体,通过对LPL-410.7基因组的功能注释发现,菌株具有儿茶酚盐型铁载体合成相关的基因(表8),由基因entB、dhbB、entC、entA编码的产物参与儿茶酚盐型铁载体相关的前体物2,3-二羟基苯甲酸(2,3-dihydroxybenzoic acid,DHB)的合成,dhbF、dhbE参与DHB和氨基酸连接形成单体物后转化为铁载体的过程。

表8 LPL-410.7产铁载体相关基因Table 8 Genes related to siderophore-producing in LPL-410.7 genome
2.3.3植物抗病相关基因分析
基因功能注释结果(表9)显示,贝莱斯芽孢杆菌LPL-410.7基因组中含有属于非核糖体多肽合成酶(Nonribosomal peptide synthetase,NRPS)途径的表面活性素(Surfactin)、丰原素(Fengycin)、溶杆菌素(Bacilysin)和嗜铁素(Bacillibactin)4类抑菌物质合成相关基因,以及由含有聚酮合酶体系的非核糖体肽合成酶体系(Polyketides-nonribosomal peptidesynthetase,PKS-NRPS)途径催化合成伊枯草素(Iturin)和聚酮类化合物(Bacillaene)的相关基因。此外,菌株含有编码纤维素酶合成基因engA、engB、engC,在基因组的水平上预测LPL-410.7能产生内切纤维素酶(Endo-1,4-β-D-glucanohydrolase)。

表9 LPL-410.7抑菌代谢产物合成相关基因Table 9 Genes related to the synthesis of antimicrobial metabolites in LPL-410.7 genome
2.4 菌株LPL-410.7的特性探究
2.4.1生长曲线
菌株LPL-410.7在0~6 h内为生长延滞期,6 h后进入对数生长期,OD600 nm值迅速增加,20 h后进入稳定期(图4)。培养24 h,OD600 nm值为1.56,达到最大菌落数8.9×108CFU/mL。该菌在生长前期会产生少量的酸,使培养基pH降低0.3左右,培养12 h后pH逐渐升高。

图4 菌株LPL-410.7的生长曲线Fig.4 Growth curve of strain LPL-410.7
2.4.2耐酸碱和耐盐特性
生物菌肥的效果易受土壤类型、盐碱等非生物因素的影响,因此优良植物根际促生菌的广泛生态适应性是其在田间发挥效果的前提条件[29]。LPL-410.7具有较好的酸碱耐受性((图5(a)),当pH为5~7时,菌株的生长未受影响。pH为8~9时,菌株的生长情况受的影响较小。当pH继续减小至5以下或上升至10时,LPL-410.7的细菌数量显著降低。图5(b)示出盐耐受试验结果,当ρ(NaCl)为0~5 g/L时,菌株的生长情况未受明显影响,当ρ(NaCl)为7 g/L时,细菌数量下降了约3.5个数量级,当ρ(NaCl)为10和15 g/L时,细菌数量分别降为3.19和3.05 lg(CFU/mL)。说明就菌株的耐受性而言,LPL-410.7菌株对酸碱和盐有很强的耐受性,这与陈腊等[30]从的玉米根际土壤中筛选出3株高效解钾促生芽孢杆菌对酸碱和盐浓度的稳定性基本一致,且LPL-410.7菌株在ρ(NaCl)为7~15 g/L的NaCl仍能存活,可见菌株LPL-410.7在盐耐受方面具有一定的优势。

柱子上方不同字母表示各处理间差异显著(P<0.05),竖线表示标准差,图6和图7同。Different letters above the column show significant difference at P<0.05 level, the vertical bar above the column shows the standard deviation, the same in Figs 6 and 7.
2.4.3表面特性
在菌株静置培养的前1 h内,LPL-410.7的自凝集率为18.23%,随着时间的增加,凝集率也逐渐增加,24 h后达到88.77%((图6(a)),说明该菌株具有较好的定植于植物根际及周围土壤的潜力。菌株LPL-410.7对乙酸乙酯和二甲苯的疏水性中等,分别为33.16%和27.29%,而对正己烷疏水性较弱((图6(b))。

图6 菌株LPL-410.7的表面特性Fig.6 Surface characteristics of strain LPL-410.7
2.4.4DPPH自由基清除率
图7示出菌株LPL-410.7不同组分(无细胞发酵上清液、完整细胞菌悬液和细胞破碎物)对DPPH自由基的清除率。菌株的细胞破碎物对DPPH自由基的清除能力远不如发酵上清液和完整细胞菌悬液,仅为6.63%,而发酵上清液表现出较好的DPPH清除能力(51.51%),比完整细胞菌悬液的DPPH清除率高约13.94%。

图7 菌株LPL-410.7不同组分对DPPH自由基的清除能力Fig.7 The DPPH free radical scavenging capacity of different components of strain LPL-410.7
2.4.5对多种植物病原菌的抑制效果
采用平板对峙法测定菌株LPL-410.7对不同植物病原真菌的抑菌能力,抑菌效果见图8:菌株对4种病原真菌均具有一定的抑制作用,其中对灰孢菌的抑菌带宽为(29.28±0.18) mm,显著高于对其他3种病原菌的抑菌带宽。菌株对立枯丝核菌、青霉菌和尖孢镰刀菌的抑菌带宽分别为(22.86±0.08)、(23.02±0.14)和(22.14±0.12) mm。
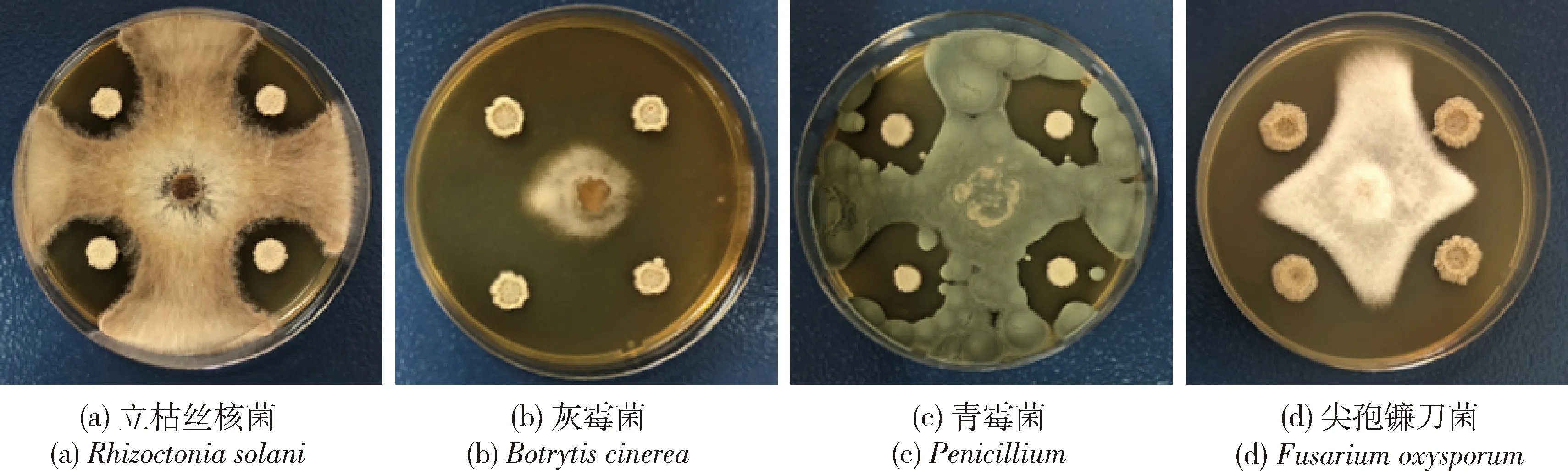
图8 菌株LPL-410.7对不同病原菌的抑制作用Fig.8 Inhibition of strain LPL-410.7 against different pathogens
2.4.6分泌水解酶的能力
蛋白酶和纤维素酶是一类能抑制病原菌的抑菌相关蛋白。LPL-410.7在蛋白酶鉴定培养基、纤维素酶鉴定培养基中均产生了透明水解圈(图9),说明LPL-410.7可以产生蛋白酶和纤维素酶。类似地,王卉等[31]研究发现具有促生抗病功效的芽孢杆菌L-S60能产蛋白酶和淀粉酶,Trinh等[32]从黑胡椒根际中分离的贝莱斯芽孢杆菌RB.DS29产生的蛋白酶能够破坏疫霉菌的细胞壁。因此,我们推测菌株LPL-410.7能够通过产生蛋白酶和纤维素酶,破坏真菌的细胞壁,从而对立枯丝核菌、灰孢菌、尖孢镰刀菌和青霉菌产生抑制作用。

图9 菌株LPL-410.7分泌水解酶的能力Fig.9 Ability of strain LPL-410.7 to secrete hydrolase
2.4.7分泌铁载体的能力
铁载体是微生物分泌的一种小分子铁离子螯合物,具有帮助植物吸收利用土壤中的铁元素的作用[33]。将贝莱斯芽孢杆菌LPL-410.7接种于CAS双层平板上,菌株的菌落周围出现明显黄色晕圈(图10),说明该菌株具有分泌铁载体的能力。采用CAS检测法定量测定菌株分泌铁载体的能力,结果表明贝莱斯芽孢杆菌LPL-410.7铁载体的相对表达量为(51.78±0.82)%,具有较好的分泌铁载体的能力。类似地,李雪艳等[34]从棉株体内及根系土壤中筛选得到的4株产铁载体的细菌,其中产铁载体能力最好的菌株萎缩芽孢杆菌SHZ-24产量可达(31.80±2.06)%,可见LPL-410.7菌株在产铁载体能力方面具有较好的能力。

图10 菌株LPL-410.7分泌铁载体的能力Fig.10 Ability of strain LPL-410.7 to secrete siderophores
2.4.8分泌植物激素的能力
吲哚乙酸IAA能促进植物种子萌发、细胞分化和根系发育[35],赤霉素(Gibberellins,GA)能解除种子休眠、促进种子萌发和茎的伸长[36]。采用ELISA试剂盒测定贝莱斯芽孢杆菌LPL-410.7产生吲哚乙酸、赤霉素和细胞分裂素(Cytokinin,CTK)的能力结果见图11。该菌株能够具备分泌吲哚乙酸的能力,培养12 h后已能产生21.69 μg/L的吲哚乙酸,且随着时间的增长,菌株分泌吲哚乙酸的能力呈先上升后下降的趋势。类似地,菌株分泌细胞分裂素的能力也呈现先上升后下降的趋势,在培养48 h时产细胞分裂素的能力达到最大(30.44 μg/L),60 h后细胞分裂素产量迅速下降至16.05 μg/L。菌株产赤霉素的能力在24 h时达到最大(266.74 ng/L),36 h时赤霉素产量下降至209.13 ng/L,之后赤霉素产量趋于平稳,48和60 h时产量与36 h时相比无显著差异(P>0.05)。目前研究报道的能分泌植物激素的促生菌主要为固氮螺菌属、黄杆菌属、赖氨酸芽胞杆菌、假单胞菌等菌属[37],对于贝莱斯芽孢杆菌的研究甚少。在本试验的结果中,我们发现贝莱斯芽孢杆菌LPL-410.7具有分泌吲哚乙酸、细胞分裂素和赤霉素多种激素的能力,说明其作为根际促生菌具有较大的潜力。

图11 菌株LPL-410.7分泌植物激素的能力Fig.11 Ability of strain LPL-410.7 to secrete plant hormones
3 结 论
本研究从植物根际土壤中筛选获得1株具有很强的促生抗病潜力的微生物菌株LPL-410.7,并将该菌株鉴定为贝莱斯芽孢杆菌(B.velezensis)。全基因组分析结果显示,LPL-410.7中含有与菌株产生铁载体、吲哚乙酸、碱性磷脂酶、纤维素酶和脂肽合成酶等促进植物生长相关的功能基因59个。进一步的试验结果显示,LPL-410.7能够分泌蛋白酶及纤维素酶,能产生相对表达量为51.78%的铁载体,亦能产生植物激素吲哚乙酸、赤霉素和细胞分裂素。这与菌株解有机磷、产生促生抗病相关物质(铁载体、吲哚乙酸、纤维素酶和蛋白酶)的实际功能相符合。此外,菌株特性分析表明LPL-410.7在pH为3~10和ρ(NaCl)为0~15 g/L时均能存活;菌株自凝集性达到88.77%,且具有较强的DPPH自由基的清除能力。本研究还发现LPL-410.7有编码与抑菌相关的脂肽类化合物合成基因,但菌株LPL-410.7是否能分泌有活性的脂肽类代谢产物仍需要进一步验证。
