接合转座子Tn916的水平基因转移
2023-01-14柳天任
柳天任,宋 磊
(上海师范大学生命科学学院,上海 200234)
水平基因转移(HGT)极大地促进了细菌物种的进化[1].通过众多的可移动遗传元件,如质粒、转座子、噬菌体或基因岛(GEIs)横向获得和传播的基因占细菌基因组重要的一部分[2].基因岛是水平基因转移获得的基因片段,能够使细菌迅速得到大量且复杂的,与适应相关的功能基因,从而赋予其进化的优势[2].这些片段有的能够自主移动,有的不能[3].接合转座子(CTns)是一种常见的可移动基因岛,通过接合从供体转移到受体[4].接合转座子及其携带的功能基因的水平传播是细菌基因组的维持和进化,以及抗生素抗性传播的主要驱动力[5-6].其中,Tn916是最早被发现且研究最深入的接合转座子之一[7-8],其结构和功能、转移和扩散,以及危害和应用被研究者们广泛关注.
1 接合转座子
原核生物的遗传多样性很大一部分是通过从其他生物体中获取基因序列而得到的[1].这种在不同生物个体之间,或单个细胞之间所进行的遗传物质的交换被称为水平基因转移[1].水平基因转移常见的机制是转化、转导和接合转移.原核生物的水平基因转移产物通常是基因岛、质粒和噬菌体等[2].可移动的基因岛能够从基因组中自主切除,形成环状中间体,为转移入新的宿主做好准备,又可以重新整合进入原有基因组,使染色体结构达到动态平衡.常见的可移动基因岛包括接合转座子[3]、整合和接合元件(ICEs)、整合质粒[9]和原噬菌体等[10].接合转座子通过其包含的可移动遗传元件[4],如转座酶和切除酶,从供体基因组中切除,产生约6 bp不匹配的双链环状结构[11],再利用其内部的功能性接合模块(通常与Ⅳ型分泌系统相关[12-13])介导自身向其他细胞的转移,随后该环状结构的特定位点与受体基因组中相匹配的位点之间发生重组,使其整合进受体基因组中[3].接合转座子,如Tn916和Tn1545[14-15],在受体基因组中的整合位点常常与其在供体基因组中的整合位点有差异[4],主要用于传播各种抗生素抗性基因(ARGs).
2 Tn916
Tn916是第一个被报道的接合转座子,首先在肺炎链球菌(Streptococcus pneumoniae)的数个菌株中被发现[16],随后又在粪肠球菌菌株DS16中被命名[17].Tn916是一种18 kb碱基大小、宿主范围广泛的接合转座子[18],有些存在于其他更大的可移动基因岛中[19-20],有些则被插入其他基因片段,从而形成新的接合转座子[21-23].它编码四环素抗性,转座和转移都独立完成[17],可以整合到质粒或宿主染色体的不同位点(能够产生多个拷贝)[15,17].后来的研究显示,Tn916家族是最典型的接合转座子家族,大小在16~23 kb[18,24].Tn916家族中都含有相似的接合转移、转录调节和重组模块[25].
2.1 结构与功能
Tn916的DNA序列和遗传分析表明,它由4个功能模块组成,即重组模块、转录调节模块、转录调节的辅助功能模块(四环素抗性基因tet(M))和接合转移模块[5,26-27](图1).
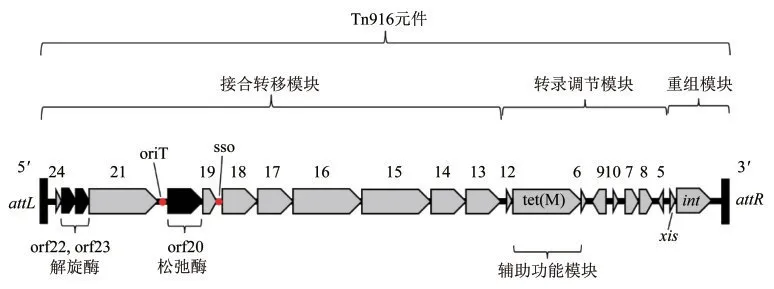
图1 Tn916的功能模块
2.1.1 重组模块
重组模块位于Tn916元件的3'端(图1),这个模块通常包含具有转座酶特点的整合酶基因int(整合和切除所需)和切除酶基因xis(重组反应的方向性所需,通常促进切除)[24,26].整合酶或切除酶单独过表达对Tn916切除频率没有影响,只有当整合酶和删除酶一起过表达时,切除频率才会增加,表明这两种蛋白的表达存在协同效应[28].其中整合酶是切除过程中的决定要素,而切除酶起协助作用[29].整合酶引起Tn916末端的双链断裂及供体DNA的连接[30],整合酶包含3个功能域:臂结合域、核心DNA结合域和催化域[11].整合酶的臂结合域以对称的方式分别与attB和attP中的反向重复序列(IRs)结合,核心DNA结合域插入每个IRs内部的主凹槽中,催化域则主要与外部的主凹槽相互作用[11].这些相互作用有助于整合酶识别IRs及其边界序列[11].偶联序列处的碱基翻转使DNA双螺旋的间距增加,且DNA骨架的几何形状及氢键模式被极大改变,解开了偶联序列的DNA双螺旋[11].由于DNA骨架的柔性,使不同碱基对个数的偶联序列可以容纳在整合酶四聚体的中心[11].Tn916中的切除酶则是重组方向性因子(RDFs)[31].RDFs是小的带正电荷的DNA结合蛋白,通过影响DNA结构或DNA-蛋白质相互作用,辅助整合酶的切除并抑制其整合作用[32-33].
2.1.2 转录调节与辅助功能模块
转录调节模块与辅助功能模块位于重组模块的上游(图1).Tn916的转录调控模块与重组模块密切相关,该模块由orf5~10和orf12组成(orf是开放阅读框,open reading frame),这一模块是高度保守性的[26,34-35].tet(M)(辅助调控模块)则位于转录调控模块中,其转录在Tn916切除和整合的调节中起重要作用[26].RNA聚合酶停留在orf12的转录终止子形成茎环结构后,Tn916中的大部分转录物终止于orf12[26].orf7和orf8可自我激活,从而促进下游重组模块的转录和表达[26],并在Tn916元件环出后增强环状中间体中位于重组模块下游的接合转移模块的转录和表达,为其转移做好准备[31,35].orf9位于orf7和orf8的上游,具有相反的转录方向,正常表达会产生抑制orf7和orf8转录的调节蛋白[26,35].这种调节模块对细菌的进化有重要意义,它提高了细菌在抗生素环境下的生存率.同时,也可能对细胞有不利影响,因为其有利于Tn916的转移并消耗了细胞中大量的RNA[26].该模块确保Tn916只在最佳时间移动(在四环素或其他限制细胞转录因素的应激情况下),而当缺乏选择性压力时,它对宿主的负担最小化,这可能导致Tn916的稳定性增加[26].
2.1.3 接合转移模块
orf13~24是Tn916所必需的接合模块[36].orf20的基因产物是松弛酶(relaxase),结合在orf20和orf21之间,orf20上游的转移起始位点(oriT)上,对一条链进行切割,并与orf22和orf23编码的解旋酶形成复合体,共同完成Tn916环状中间体的滚环复制,并将环状中间体的一条链转移到受体细胞中[5,37-38].整合酶也可以与oriT结合[37],这可能对Tn916的流动性进行控制[26].orf18则编码一种抗限制性蛋白,可能保护Tn916免受宿主限制性系统的攻击,并帮助其他接合转座子在宿主基因组中稳定存在[39-40].接合转移模块还应包含编码供体上用于接合的表面蛋白受体的基因,但至今未被准确鉴定.
2.2 Tn916样的水平转移机制
Tn916从供体中的插入位点上被切除,形成环状中间体,通过滚环复制,利用元件编码的接合机制使一条链转移进入合适的受体中,随后在供体和受体中分别合成互补链,两条双链DNA分别整合到各自的细胞基因组中[7].Tn916的水平转移有3个特征:(1)重组底物(即线状Tn916元件的侧翼、环状中间体和受体基因组中的整合位点)之间的低序列同源性;(2)自然存在的环状中间体中偶联序列的多样性;(3)Tn916中整合酶的绑定位点富含AT碱基的序列[11].
2.2.1 切除
Tn916的整合酶对切除和整合都是必需的,切除酶则刺激切除,但不是必需的,并抑制其整合[29].在切除过程中,整合酶在元件的两端都进行交错切割,在每一端留下约6 bp长的单链突出端,这个片段被称为偶联序列,如图2(a)所示[28].偶联序列并不同源,也不相互碱基配对,它们共价连接产生环状转座中间体,形成凸出的异源双链DNA,如图2(b)所示[28,41].切除了Tn916的宿主DNA也被重新连接.attL和attR(结合位点,attachment site,att)分别位于Tn916左侧和右侧,它们重组产生attP(在环状中间体中)和attB(在宿主染色体中)[28].切除酶对Tn916从革兰氏阳性宿主中的切除是必需的,而在革兰氏阴性宿主中能显著增加切除频率[28,42].切除酶与Tn916左端的结合提高了切除频率,而与Tn916右端的结合则降低了切除频率[42-43],因此,当切除酶在Tn916元件右端的结合比整合酶的结合更紧密时,Tn916能够稳定整合在细菌基因组中[42].在细菌基因组内不存在Tn916的情况下,基因组中的attB可能是未插入Tn916的整合位点,也可能是Tn916切除后形成的新整合位点,具体是哪种情况,目前还没有方法能够辨别[24].
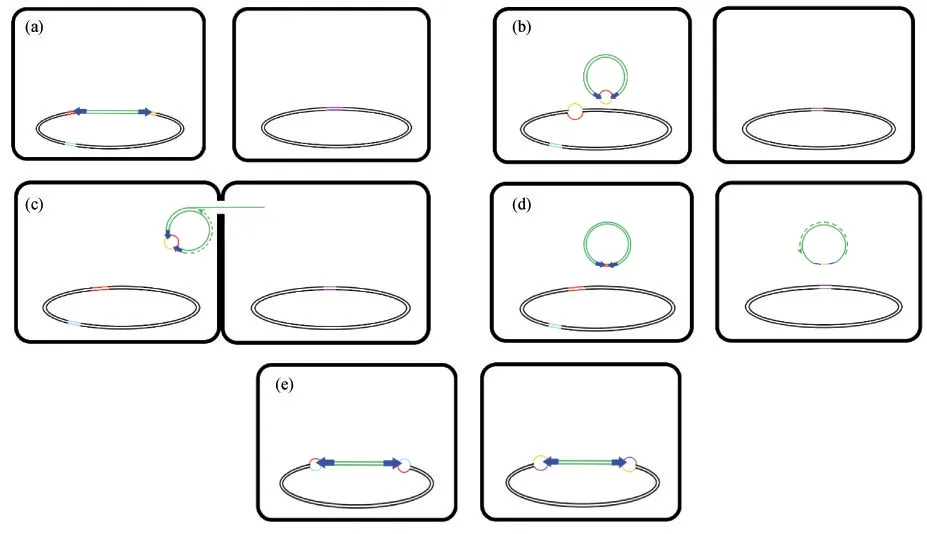
图2 Tn916的水平转移机制.绿色双线代表Tn916元件保守序列;深蓝色箭头代表其反向重复序列;黑色双环代表受体和供体基因组;红色、黄色、浅蓝和紫色双线或单线代表偶联序列.(a)Tn916位于供体基因组中;(b)切除;(c)接合转移;(d)单链环状中间体的复制;(e)整合
2.2.2 转录调控
Tn916的tet(M)对切除和整合的调节起重要作用[26].tet(M)编码的核糖体保护蛋白具有三磷酸鸟苷(GTP)酶活性,当GTP存在时,该蛋白显著降低核糖体对四环素的亲和力,从而解除四环素对蛋白质合成的抑制[44-45].在没有四环素的情况下,由于带电的转运RNA(tRNA)分子缺乏,降低了核糖体的移动速度,使其落后于前方的RNA聚合酶,从而形成orf12转录终止子的tet(M),orf7~10[26].通过tet(M)增强的转录会产生orf9的反向mRNA,从而降低了orf9的表达,使得下游orf7和orf8的转录抑制被解除[26,34].更多的orf7和orf8产物促使转录延伸至整合酶和切除酶之间或之外,导致整合酶活性增加,增加Tn916元件从宿主基因组中的切除频率[26,35].这种调节机制被细胞转录衰减所促进[34].当被切除的Tn916环化时,orf7也可以增强另一端的接合转移基因的转录[31,35].低浓度的四环素能增加Tn916重组和转移所需基因簇的转录,从而提高其切除频率[31].有趣的是,对于不同的插入位点,Tn916切除和接合的量以及四环素的刺激量是不同的[46].当tet(M)蛋白浓度增加到一定程度时,大多数核糖体解除四环素的抑制,细胞整体翻译速率又将恢复到原来的水平,从而带电tRNA分子将变得更少[26].这将导致翻译orf12的核糖体再次落后于RNA聚合酶,形成终止子结构,从而减少tet(M)的转录和Tn916的环出[26].当四环素处于高浓度的时候,Tn916转录和翻译迅速被提高,而后又迅速下降[26,34].
2.2.3 接合转移
当Tn916从染色体上切除后发生环状化时,接合基因就被完全表达[47-48].接合基因编码供体上的表面蛋白复合体[7],使供体与受体紧密接触,随后形成接合通道[49].在接合过程中,供体和受体紧密接触,单链DNA通过交配孔,以滚环复制(RCR)的相似机制转移到受体内,如图2(c)所示[7].接合转移模块编码的解旋酶能解开Tn916元件的双链结构,松弛酶与复制起点oriT共价结合(确保整个Tn916序列在接合转移过程中被严格保护),切割单链DNA[5,37].随后,松弛酶结合到切口链的5’端,游离的3’端被释放,充当DNA聚合酶合成DNA的引物,以启动RCR[50].Tn916松弛酶的N末端含有一个螺旋-转角-螺旋结构域,这个结构域在许多松弛酶同源物中是保守的,且对促进松弛酶对oriT的正确识别和切割是必需的[5].解旋酶促进松弛酶切后环状中间体双链的解旋,使用无切口链作为模板,在环状中间体周围利用DNA聚合酶进行复制,将有切口链释放为单链线状DNA[50].松弛酶与进行转移的单链DNA保持结合,并与Tn916编码的偶联蛋白相互作用,将单链线状DNA靶向移动到供体与受体之间形成的交配孔,介导其与供体的接合分泌系统结合(对革兰氏阳性细菌的接合分泌系统知之甚少,其与IV型分泌系统T4SS没有明显相关),将单链线状DNA转移到受体细胞中[31,49].当DNA聚合酶返回oriT时,松弛酶再次切割oriT以终止无缺口链的合成,在一系列切割与重新连接事件之后,DNA连接酶连接无缺口链形成供体中闭合的无突起的双链环状结构,单链线状DNA则完全转移进入受体,由酶连接其5’端和3’端,形成单链环状中间体[50].
2.2.4 单链环状中间体的复制
单链环状DNA转移到受体细胞后,就成为DNA聚合酶的模板,以重新构建双链环状结构,如图2(d)所示[50].单链环状中间体中的功能性单链复制起点(sso)位于orf19和orf18之间,它能启动DNA的合成[5].通过引物酶的启动和DNA聚合酶的延伸,利用DNA聚合酶去除引物并合成相应的DNA片段,最后DNA连接酶连接,从而以单链DNA为模板合成双链DNA[50].
2.2.5 整合
attP和attB之间的重组事件导致Tn916整合到宿主染色体中,如图2(e)所示[31].关于Tn916的转移,最令人困惑的可能是其整合酶如何在DNA底物之间没有明确序列同源性的情况下对Tn916进行切除和整合,这是Tn916在极其多样的细菌中能够传播的关键[11].Tn916可以整合到宿主基因组的多个位点[15],优先选择富含腺嘌呤和胸腺嘧啶(AT)的区域[51],其整合不会复制目标位点[7],随后对Tn916的研究表明,其attP和attB中偶联序列两端的反向重复序列是AT碱基对丰富区[29].RUBIO-COSIALS等[11]对Tn916同源转座子Tn1549的研究表明,反向重复序列中的第一个和第二个碱基之间(5’-TT-3’)是其整合酶的作用位点.整合酶在attP和attB中交错切割,打开了attP和attB序列,并使其共价连接产生Holliday交叉中间体[11].整合酶再次切割并连接attP和attB中的第二条链,使Holliday交叉中间体解体,使Tn916整合进入受体基因组[11].整合酶与环状中间体所形成的DNA-蛋白质复合体中,整合酶C端与整合相关的结构域处于非活性状态,当整合酶找到合适的整合位点时,该区域被激活,从而使Tn916成功整合进受体基因组中[11].在整合过程中,由于attP和attB中偶联序列的差异,使被插入的Tn916两端分别形成凸起的不配对区域,如图2(e)所示,随后通过受体DNA复制,两端的异源双链DNA分离,消除了不配对区域,于是供体中Tn916一侧的偶联序列来自于受体DNA,另一侧的偶联序列是Tn916引入的[7].切除该Tn916可以恢复整合前的该区域序列,或使受体DNA中的偶联序列被Tn916引入的偶联序列取代[7].
2.2.6 细胞内的非复制型转座
Tn916中整合酶的识别区域由两段AT丰富的反向重复序列夹约6 bp的偶联序列构成,对偶联序列具有非常低的特异性要求[52],所以从基因组中环出的Tn916元件,可以在整合酶的驱动下整合回基因组中,满足其识别要求的各种位点.
2.3 Tn916于细菌门内的扩散
Tn916具有非常广泛的宿主范围,如各种低G+C含量的革兰氏阳性和阴性菌[18].在革兰氏阴性菌,如奈瑟氏球菌(Neisseria)[53]、梭形杆菌(Fusobacterium)、嗜血杆菌(Haemophilus)[54],及在革兰氏阳性菌,如粪肠球菌(Enterococcus)、葡萄球菌(Staphylococcus)[55]、李斯特菌(Listeria)[56]等中,发现了Tn916及其相关元件.Tn916既可以在细胞内转座,也可以在细胞间转移[7].转移机制也可能出现特殊情况,例如,宿主范围广泛的Tn916不能从“死胡同”宿主乳酸乳球菌(Lactococcus lactis)转移到枯草芽孢杆菌(Bacillus subtilis)、粪肠球菌(Enterococcus faecalis)和化脓性链球菌(Streptococcus pyogenes)中[57],其原因可能是Tn916中重组模块的突变或宿主的限制性修饰的作用[58].
2.4 Tn916水平转移的预防及其应用
抗生素在畜禽业中广泛应用于畜禽的疾病控制.据估计,30%~90%的应用抗生素不能被动物消化或代谢,而是以其原始形态随动物粪便和尿液排泄到环境中[59],这使得它们成为抗生素和抗生素抗性基因的重要储存库[60].四环素类抗生素是我国最常用的兽用抗生素之一[61],这促进了携带tet(M)的Tn916的传播,加剧了该类抗生素抗性基因对环境的污染.我国研究人员发现,废水和粪便逐级处理会降低多种抗生素的浓度,使包括tet(M)在内的抗生素抗性基因也随之减少,以阻断Tn916的传播[61].还有研究者认为,复合微生物制剂能够有效减少堆肥中包括tet(M)的抗生素抗性基因的含量,但其使用还可能存在风险[62].宏基因组数据则指出应当规范现今抗生素的使用,以最大限度地减少抗药性传播[63].同时,还需要严格执行传染病控制措施、抗菌药物规范管理和定期One Health流行病学监测研究,以监测和遏制抗生素抗性的增加[55].
通过对Tn916的研究,证明了整合与接合元件能够在细菌之间传播抗生素抗性.其中,Tn916在多种细菌中被用作插入诱变的工具,包括链球菌等革兰氏阳性菌[64],及大肠杆菌、嗜血杆菌等革兰氏阴性菌[65].人们甚至可以将Tn916转移进入支原体Mycoplasma hominis中[66].同时,Tn916还被用于动员其他遗传元件,如将非接合质粒pC194,pUB110导入苏云金杆菌(Bacillus thuringiensis)中[67].到目前为止,人们在Tn916和其家族元件上,发现了多种具有广泛宿主范围的重要临床相关抗性基因,如四环素抗性、红霉素(erm)抗性、万古霉素(van)抗性、氯霉素(cat)抗性、卡那霉素(kan)抗性基因等.这些抗性基因在很大程度上阻碍了抗生素对某些传染病的疗效,如用四环素治疗的感染性心内膜炎和霍乱,用红霉素治疗的淋病和呼吸道感染,用万古霉素治疗的败血症和肺部及皮肤软组织感染,用氯霉素治疗的伤寒和副伤寒,用卡那霉素治疗的肺炎、腹腔感染和猪气喘病等.只有充分了解Tn916结构与功能,才能有效去除耐药菌中的Tn916和其家族元件,以提高抗生素的疗效及治疗某些“超级细菌”导致的强感染病症.
3 Tn916家族
Tn916家族都由4个功能模块组成,即重组模块、转录调节模块、转录调节的辅助功能模块和接合转移模块[26],这4个模块经常会发生变化.Tn916家族元件以重组模块中的整合酶和切除酶协同作用机制是极为相似的[68].由Tn916衍生出的家族元件数量众多,如Tn916S,Tn917,Tn2009,Tn2017,Tn5276,Tn5393,Tn6000,Tn6002,Tn6003,Tn6079,Tn6087,Tn6815,Tn6816和SpnRi3erm等.Tn916家族元件的接合转移模块和转录调节模块中常会插入外来基因,如Tn6002在接合转移模块中插入了erm(B)抗性基因[21];Tn6003插入了包含erm(B)和aphA抗性基因在内的MAS(大环内酯类-氨基糖苷类-链丝菌素)元件[69];Tn6816插入了真核生物逆转录酶基因ltrA[70];Tn6000插入了孤独甲基化酶基因、抗限制性基因、结瘤偶蹄杆菌(Dichelobacter nodosus)的毒力相关基因和某些真核基因[71];Tn2009在转录调节模块中插入了mef(E)抗性基因[72];Tn2017插入了erm(B)和mef(E)抗性基因[73];Tn6815插入了erm(B)抗性基因和转座酶基因,同时它还是在Tn916的转录调节模块中插入了Tn917后形成复合元件[70,74].Tn916家族元件的辅助功能模块常常被其他抗生素抗性基因所取代,如SpnRi3erm中的tet(M)抗性基因被erm(B)抗性基因取代[69];Tn6079中的被erm(T)和tet(L)抗性基因取代[75];Tn916S和Tn6000中的被tet(S)抗性基因取代[71,76].除了抗生素抗性基因外,辅助功能模块还可加入其他功能基因,如具有季铵化合物防腐剂抗性基因qrg的Tn6087[77],具有重金属抗性tmexCD1-toprJ1外排泵基因的Tn5393[78],和具有乳酸链球菌素抗菌基因nisA和sacA的Tn5276[79].除了细胞间的接合转移,Tn916家族元件还可以在细胞内进行转座,或转移到其他可移动的遗传元件内[12].
4 结论与展望
以Tn916为代表的接合转座子由重组模块、转录调节模块、辅助功能模块和接合转移模块组成,其中的重组模块和接合转移模块在Tn916家族中具有高同源性.重组模块中的整合酶和切除酶介导接合转座子在供体基因组中的切除与其环状中间体的形成,和在受体基因组中的整合.转录调节模块和辅助功能模块协同作用,在不同浓度的抗生素环境下调节接合转座子的转录,影响其切除和转移效率.接合转移模块编码的蛋白则开启并延伸供体中环状中间体的滚环复制,介导其单链DNA向受体的接合转移,并在受体中再次形成双链环状中间体.Tn916家族的接合转座子对其整合位点中偶联序列的特异性要求极低,导致其在细菌界分布广泛,这给人们的生活和生物技术的发展带来了极大的影响.随着细菌全序列基因组测序的爆炸式发展,研究Tn916的多样性和分布,及其对细菌适应性的影响会更加顺利.寻找其他影响整合酶和切除酶的调控因子和其作用机制是未来比较重要的工作,因为它们决定了接合转座子整合和切除之间的动态平衡.此外,对Tn916接合转移机制的研究迫在眉睫.
