菠菜AMT基因家族鉴定与表达分析
2023-01-14赵敏华葛晨辉徐晨曦蔡晓锋王小丽
赵敏华,刘 吉,葛晨辉,徐晨曦,蔡晓锋,王小丽
(上海师范大学生命科学学院,上海 200234)
0 引言
菠菜(Spinacia oleraceaL.)属于苋科藜亚科菠菜属植物[1],是世界性重要叶用蔬菜,具有很高的营养价值和经济价值.菠菜的生长需要充足的氮素供应,尤其是硝态氮,但过量硝态氮会导致菠菜硝酸盐积累,影响品质.生产上通常适当配施铵态氮以提高品质和产量,如SCHORTEMEYER等[2]发现,氮肥组合中铵态氮肥比例的增加,可显著降低硝酸盐和亚硝酸盐在菠菜体内的累积,提高菠菜茎叶中的氨基酸总量,同时获取最大的生物量.因此研究菠菜对铵态氮的吸收、转运及利用的机制,对于合理配施铵态氮肥,提高菠菜生产效能和品质有重要指导意义.
植物对铵态氮的吸收及体内转运都依赖铵态氮转运蛋白(AMT).植物铵态氮转运蛋白家族属于AMT/MEP/Rh家族,主要由两个亚家族AMT1和AMT2构成[3].为适应土壤中铵态氮供应浓度的变化,植物进化发展出低亲和转运系统(LATS)和高亲和转运系统(HATS),以充分吸收利用环境中的高、低铵态氮营养[4-6].由于土壤中铵态氮含量较硝态氮低,植物铵态氮的吸收主要是由HATS构成.目前已经从拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、番茄(Solanum lycopersicum)等植物中鉴定到不同数目的AMT蛋白(表1),并对部分AMT功能开展了研究.此外,AMT不仅参与根部铵态氮的吸收运转,还参与地上部分铵态氮的运输和再分配、种子铵态氮的储存,以及铵态氮由共生菌向宿主植物的运输和根部发育等生理过程[7].菠菜AMT研究尚未见系统报道.本文作者通过生物信息学方法筛选鉴定菠菜AMT编码基因,并研究其对不同氮素形态配比的响应模式,初步解析菠菜AMT基因家族在氮素响应中的功能.
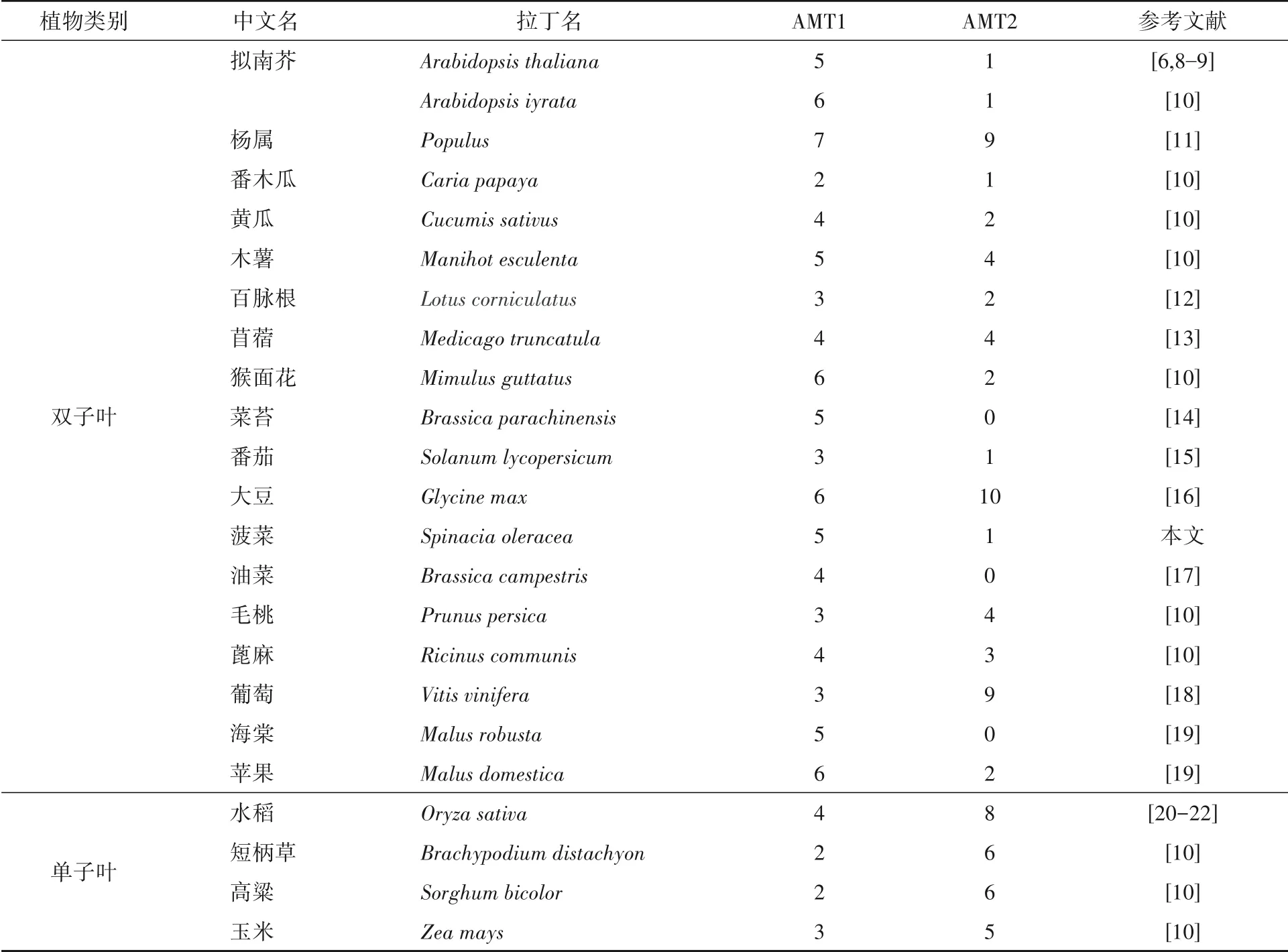
表1 部分植物AMT1和AMT2家族成员数目表
1 材料与方法
1.1 材料处理
选取饱满一致的Sp75菠菜种子,经75%(体积分数)酒精消毒后,播种于吸满蒸馏水的工字孔育苗海绵中,待长出2片子叶后,选取长势一致的幼苗定植于10 L水培箱中.水培营养液采用1/2 Hoagland-Arnon配方.水培至两叶一心期开始氮处理实验.共设置7个氮处理,包括:①缺氮(不含氮);②硝铵比7.0∶0.5(7.0 mmol·L-1NO3--N+0.5 mmol·L-1NH4+-N);③硝铵比7.5∶0(7.5 mmol·L-1NO3--N);④硝铵比0∶0.5(0.5 mmol·L-1NH4+-N);⑤硝铵比0∶7.5(7.5 mmol·L-1NH4+-N);⑥硝铵比0.25∶0(0.25 mmol·L-1NO3--N);⑦正常1/2 Hoagland-Arnon配方处理,硝铵比为7.0∶0.5.处理②~⑦前,均先缺氮预处理2 d.每个处理均设置3次重复.采用CaCl2,K2SO4,KH2PO4调节不同处理中Ca,K,P的浓度,使它们保持一致,其余营养由MgSO4·7H2O,NaFeEDTA,及Amon微量元素配方提供.调节水培营养液pH值为6.0±0.2.处理全程在人工气候室中完成,温度为20℃/18℃(光照/黑暗),光周期为10 h/14 h(光照/黑暗),湿度控制在68%左右.分别于氮素处理0,0.5,2,24,48 h后取样,-80℃保存,用于氮素响应表达谱分析.同时采集正常供氮(1/2 Hoagland-Arnon)培养1周的幼苗叶片、叶柄及根样品,-80℃保存,用于组织表达谱分析.
1.2 菠菜AMT基因家族成员的鉴定
将拟南芥AMT蛋白序列在菠菜基因组数据库(www.spinachbase.org)中进行同源比对搜索,并根据菠菜基因组注释结果,剔除重复序列后获得菠菜AMT候选序列.利用NCBI CDD在线工具(https://www.ncbi.nlm.nih.gov/cdd)预测AMT结构域,存在完整AMT结构域的,则认定为菠菜AMT家族候选蛋白.利用ExPaSy(http://web.expasy.org/protparam)预测候选蛋白各项理化性质,包括氨基酸数量、相对分子质量、等电点、脂溶系数等.利用WoLF PSORT(http://wolfpsort.hgc.jp/)和TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)分别对候选蛋白进行亚细胞定位和跨膜结构的预测.
1.3 基因结构、保守结构域及进化分析
基因结构使用TBtools工具进行分析,并进行可视化操作[23].利用MEME Suite(http://meme.sdsc.edu/meme/memeintro.html/)进行蛋白质保守基序(motif)分析,最大保守序列鉴定数目设置为10,TBtools工具进行基序模式可视化.利用MEGA-X软件,采用邻接(NJ)法构建菠菜AMT基因家族进化树及其与多物种之间的系统进化树,校验参数bootstrap设置为1 000,其余均为默认参数.同时选取基因家族起始密码子上游2 000 bp启动子片段,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件分析,用TBtools工具可视化.
1.4 基因表达谱分析
采用Trizol法提取菠菜总核糖核酸(RNA),通过PrimeScript™RT reagent Kit with gDNA Eraser(Takara)试剂盒将提取的总RNA反转录成cDNA(complementary DNA).使用Primer Premier 5进行实时荧光定量-聚合酶链式反应(qRT-PCR)引物设计(表2),Tm值控制在57~61℃.最后使用TaKaRa TB Green TM Premix Ex Taq TM(Tli RNaseH Plus)试剂盒在Applied Biosystems 7500 Real Time PCR仪器上进行qRT-PCR反应.采用18s rRNA作为内参,以2-ΔΔCT法计算基因的相对表达量,用Sigma Plot 7.0对结果进行作图.采用TBtools工具绘制基因表达量热图,数据作log2转换后以行为单位均一化,采用Euclidean法聚类.

表2 实验所用引物设计
2 结果与分析
2.1 菠菜SoAMT基因家族成员鉴定
在菠菜Sp75基因组数据库(2018),Monoe-Viroflay基因组库(2021)中共获得同源性较高的候选蛋白序列6条,其中5个候选蛋白在两个基因组数据库中完全相同,只有SoAMT1A(Spo21031)仅在Sp75基因组数据库(2018)中被鉴定到(表3).使用在线网站NCBI CCD-search进行逐条验证,结果显示:5个候选蛋白包含amt保守结构域,1个候选蛋白包含AmtB结构域.序列分析表明,6个SoAMT基因分布在4条染色体上(第1,4,5,6条染色体),编码区(CDS)长度在1 443~1 506 bp之间,编码的6个AMT蛋白氨基酸数目为462~501个,其中SoAMT1B、SoAMT1D包含501个氨基酸;而SoAMT2氨基酸数目最少(480个).候选蛋白的分子质量和等电点范围分别为377.829~632.678 ku和5.59~7.64.SoAMT1A预测的等电点最低(5.59),SoAMT1B预测的等电点最高(7.64);6个SoAMT蛋白的平均亲水系数均为正值,表明它们均为疏水性蛋白.SoAMT蛋白的亚细胞定位预测结果均显示定位于质膜上,且含有9~11个跨膜结构域.

表3 菠菜SoAMTs基因家族基因数据库信息
2.2 AMT进化树、保守基序及基因结构分析
对拟南芥(6个)、黄瓜(5个)、大豆(9个)、苜蓿(7个)、水稻(3个)、玉米(8个)、百脉根(5个)及菠菜(6个)共49个AMT蛋白序列进行系统进化树分析,结果如图1所示.49个AMT蛋白聚成两类:AMT1亚家族和AMT2亚家族.菠菜SoAMT2(Spo20483)与拟南芥、苜蓿、百脉根等分组到AMT2亚家族的分支上,其余5个菠菜AMT与其他物种均属于AMT1亚家族分支.

图1 菠菜与其他植物AMT进化树分析.
菠菜AMT家族基因编码蛋白的序列分析表明,除SoAMT2(Spo20483)外,菠菜AMT基因具有类似的编码区和核苷酸长度,如图2(a)所示,但不同基因间,内含子数差异较大,SoAMT1C(Spo24676),SoAMT1B(Spo24677)不含有内含子,SoAMT2(Spo20483)含有2个内含子,其余3个菠菜AMT基因含有1个内含子.SoAMT2与其余5个SoAMT1蛋白保守基序有较大差异,在SoAMT1结构域内鉴定到10个Motif,而SoAMT2只 有4个Motif,如 图2(b)所示.6个SoAMT蛋白均具有共同的Motif 6,如图2(c)所 示,尤其是Motif 6中 的DFAGSGVVHLVGGIAGLWGSIIEGPR(SoAMT1亚家族)和DYSGGYVIHV SSGIAGFTAAYWVGPR(SoAMT2亚家族),与已报道的AMT保守基序D-[FYWS]-[AS]-G-[GSC]-x(2)-[IV]-x(3)-[SAG](2)-x(2)-[SAG]-[LIVMF]-x(3)-[LIVMFYWA](2)-x-[GK]-x-R[24],以及D204FAGSGMVHMVGGIAGLWGAFIESPR229[25]一致.

图2 菠菜SoAMT家族的(a)基因结构、(b)保守基序、(c)Motif
3.3 SoAMT基因家族顺式作用元件分析
SoAMT启动子区顺式调控元件分析发现,除了典型的核心启动子TATA-Box外,这些序列还具有光响应、无氧响应以及胁迫相关的顺式元件,包括缺氧胁迫元件(ARE)、ABA响应元件(ABA,ABRE)、生长素响应元件(Auxin,TGA-element/AuxRE)、干旱诱导元件(Drought,MBS)、茉莉酸甲酯响应元件(MeJA,CGTCA-motif)、水杨酸响应元件(SA,TCA-element)以及赤霉素响应元件(GA,TATC-box)等(图3).不同成员顺式作用元件数目和种类存在差异,SoAMT1A(Spo21031)含有较多ABA响应元件,SoAMT1B(Spo24677)不含有茉莉酸甲酯响应元件,而其余成员均有该元件.SoAMT2(Spo20483)含有的ARE响应元件数量明显多于SoAMT1亚家族成员.

图3 SoAMTs顺式作用元件分析
2.4 AMT基因的组织表达分析
SoAMT基因在菠菜不同组织部位中的表达有差异,如图4所示:SoAMT1A(Spo21031),SoAMT1B(Spo24677),SoAMT1D(Spo05791)在地上部分的表达量明显高于根的,而SoAMT1C(Spo24676)在根中表达量较高,SoAMT1E(Spo16971)在叶柄中表达量明显低于叶片和根.SoAMT2(Spo20483)在根和柄中的表达量明显高于叶片的.供试6个SoAMT基因中,SoAMT1C在叶片、柄及根中的表达量均显著高于其他AMT基因.
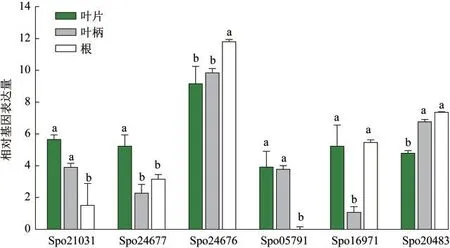
图4 SoAMT基因组织表达量分析.注:柱头不同小写字母表示同一基因组织间差异显著,下同
2.5 SoAMT基因响应氮源供应的表达分析
缺氮处理对不同SoAMT基因表达量影响不同(图5).除SoAMT1D(Spo05791)表达量受缺氮处理影响不显著外,随着处理时间的延长,其余4个SoAMT1表达模式基本呈上调趋势.SoAMT1E(Spo16971),SoAMT1C(Spo24676)及SoAMT1B(Spo24677)表达量变化趋势相似,随处理时间延长,表达量增加,缺氮处理48 h时表达量最大,分别为对照的12.76,8.36,15.04倍,受长期缺氮处理的诱导影响显著.SoAMT1A(Spo21031)表达量在处理0.5 h时无显著变化,处理2,24,48 h时显著上调,平均为对照的4.46倍.

图5 缺氮处理下SoAMT基因表达谱
与SoAMT1表达模式不同,随着处理时间的延长,SoAMT2(Spo20483)表达量先增加后下降,处理24 h 时与对照组(7.5 mmol·L-1NO3--N+0.5 mmol·L-1NH4+-N)差异不大,48 h时甚至低于正常供氮对照组.
以缺氮处理为对照,考察SoAMT基因对不同铵态氮浓度的响应,结果如图6~7所示,单独供应铵态氮时,5个SoAMT1表达量均在处理0.5~24 h后无显著变化,48 h后表达量上调;其中SoAMT1A(Spo21031)和SoAMT1B(Spo24677)表达量在高浓度铵态氮(7.5 mmol·L-1)与低浓度铵态氮(0.5 mmol·L-1)处理下无显著差异.不同的是,SoAMT1D(Spo05791)和SoAMT1C(Spo24676)表达量显著受低铵态氮诱导,而SoAMT1E(Spo16971)表达量显著受高铵态氮诱导.单独铵态氮供应下,SoAMT2表达量变化趋势与SoAMT1正好相反,其表达量受铵态氮抑制,供试时间内表达量均低于缺氮对照组.

图6 不同铵态氮浓度处理下菠菜根SoAMT基因表达谱.
实验同时比较了不同硝态氮浓度及铵硝配比对SoAMT基因表达量的影响(图7~8),结果发现,单独供应硝态氮也能不同程度地诱导SoAMT1基因的表达,SoAMT1A(Spo21031)对高低硝态氮浓度响应差异不显著,处理48 h时表达量达到峰值;SoAMT1D(Spo05791)和SoAMT1B(Spo24677)表达量分别在低硝态氮处理0.5 h和高硝态氮处理48 h时显著上调,其余处理时间下变化不大.SoAMT1C(Spo24676)和SoAMT1E(Spo16971)在低硝态氮处理0.5,2,48 h后的表达量均显著高于缺氮对照,且在48 h时表达量达到最高.硝铵物质的量浓度配比为7.0∶0.5时,不同SoAMT1基因表达模式不同,如SoAMT1B基因在硝铵混合处理48 h时,表达量达到最大值,与其在高硝处理下的表达谱更相似;硝铵混合处理下的SoAMT1D的表达谱与低铵态氮处理相似,48 h达到峰值,而SoAMT1E的硝铵混合氮响应表达谱与其在低硝态氮处理更相似,均在2 h和48 h有明显的上调.SoAMT2氮响应表达模式与SoAMT1不同,除高硝态氮处理48 h后,其表达量显著上调外,其余氮处理均抑制了SoAMT2的表达.硝铵混合处理下,SoAMT2表达同样受到抑制,低于缺氮对照组.

图7 不同氮处理条件下SoAMT基因表达谱比较.
综上,缺氮(除SoAMT1D外)、铵态氮及硝态氮供应均能不同程度地提高5个SoAMT1基因的表达量,大部分基因在48 h时表达量达到峰值;铵态氮或硝态氮供应对SoAMT1A(Spo21031)的表达的作用不受供氮浓度的影响;低氮(铵态氮或硝态氮)显著诱导SoAMT1C(Spo24676)和SoAMT1D(Spo05791)的表达,而SoAMT1E(Spo16971)仅受高铵和低硝显著诱导;高浓度硝态氮诱导SoAMT1B(Spo24677)表达,而铵态氮浓度对其影响差异不大.与SoAMT1相反,SoAMT2基因表达量仅受短期缺氮和长期高浓度硝态氮诱导,在铵态氮存在或低硝态氮浓度处理下,其表达量受抑制.

图8 不同硝铵浓度处理下菠菜根SoAMT基因表达谱.
3 讨论
本文作者在菠菜基因组数据中共鉴定得到6个AMT家族基因,其数量与已报道的作物,如拟南芥(6个)、番茄(4个)、菜苔(5个),黄瓜(6个)等植物AMT数目大致相近,说明菠菜AMT家族基因不存在明显的基因重复和缩减现象,AMT家族数目保守性较高.同源系统进化分析表明,SoAMT分属AMT1和AMT2两个亚家族,且AMT2成员只有1个.与水稻、杨树、大豆等作物具有较多AMT2成员相比,菠菜AMT2成员数量明显少于AMT1,不同植物中AMT1和AMT2成员数目的不同可能与其氮素吸收偏好、真菌共生及生长环境有关,喜铵(水稻、杨树)、固氮(大豆)等作物通常具有更多的AMT2[22,26].
与其他物种(如玉米、拟南芥、水稻等)AMT蛋白相比,SoAMT蛋白在结构上与其高度相似,具有与拟南芥、番茄等类似的编码区和核苷酸长度,含有AMT蛋白典型的保守结构和保守基序,外显子-内含子结构也与其他许多植物物种的分析结果相类似[4],证明了AMT蛋白结构和基因组成的保守性.顺式作用元件分析显示,SoAMT可能参与多个激素及逆境途径的调控,其生物学功能可能不仅局限于铵态氮的吸收与运转,还参与逆境胁迫的响应途径等.
拟南芥AMT1亚家族主要存在于根部,而AMT2亚家族则广泛分布于植物主要器官中[6].菠菜SoAMT基因的组织表达谱具有特异性,除SoAMT1D在根中表达量很低外,其余在根和地上部分中均有较高表达,与其他植物的组织表达谱存在差异,可能与其独特的生物学功能相关.
已有研究表明,AMT转录水平受植物氮浓度及氮素形式的影响,在缺氮条件下大多数AMT基因的表达会受到缺氮诱导而大幅提高[9],这与本实验中SoAMT基因受缺氮胁迫诱导后表达上调结果一致.缺氮一周后恢复供氮,不同浓度的铵态氮、硝态氮处理条件下各基因表达谱有差异.SoAMT1A在根、叶、柄中均有较高表达量,其根部表达量受缺氮诱导,但对铵态氮、硝态氮浓度的变化响应差异不明显,与拟南芥、水稻等模式植物的AMT基因同源性较小,推测SoAMT1A可能是一个组成型铵态氮转运蛋白,或者不参与氮素的转运,具体结论还有待进一步研究证实.
SoAMT1B和SoAMT1C序列同源性较高,均在根、叶、柄中具有较高的表达量,根中表达量均受缺氮和高浓度硝态氮的诱导.不同的是,SoAMT1B对铵态氮浓度不敏感,在长期高浓度和低浓度的铵态氮作用下均被诱导上调;而SoAMT1C受低浓度的铵态氮诱导,在烟草NtAMT1.3中也发现类似氮响应表达谱,氮饥饿和供应NH4+、硝酸盐的条件下,NtAMT1.3表达显著上调,且NtAMT1.3过表达促进了植株根对NH4+的吸收,及叶片氮素的积累,本文作者推测NtAMT1.3在烟草NH4+的获取和利用中发挥着重要作用[27].因此,SoAMT1B和SoAMT1C可能也具有类似的铵态氮吸收运转功能,结合菠菜组织表达谱,SoAMT1B更可能参与菠菜地上部分铵态氮的转运,尤其是在硝态氮供应充足条件下(其表达水平受高硝诱导),负责地上部分硝态氮还原产物的转运和分配;SoAMT1C在根组织中表达水平最高,更可能是一个根部的铵态氮吸收转运蛋白,根据进化树分析结果,SoAMT1C与AtAMT1.2也具有较高的同源性.已知AtAMT1.2转录水平也受缺氮诱导,是一个高亲和转运蛋白,负责根质外体中铵态氮向内皮层细胞的转运过程[9],推测SoAMT1C可能在菠菜根部铵态氮高亲和吸收中发挥重要作用.更重要的是,供应不同浓度的硝态氮以及硝铵比7.0∶0.5混施处理,也能上调SoAMT1C的表达量,但表达水平不如低铵态氮处理下高,进一步说明SoAMT1C可能在高亲和铵态氮转运中发挥功能,并在一定程度上受硝态氮供应的影响.SoAMT1C在硝铵互作中的功能值得进一步深入研究.
与大部分SoAMT表达受缺氮诱导不同,SoAMT1D不受缺氮诱导,且根中表达量为6个SoAMT中最低的.尽管在进化树上看,SoAMT1D与AtAMT1.1,AtAMT1.3具有较高的同源性,但AtAMT1.1和AtAMT1.3均受缺氮诱导,是拟南芥高亲和铵态氮吸收的主要贡献者[9,28].表达谱的差异说明SoAMT1D与AtAMT1.1,AtAMT1.3在功能上差异很大,考虑到SoAMT1D可被低浓度铵态氮诱导,且在地上部分具有较高的表达水平,推测其负责地上部分铵态氮的高亲和转运.
SoAMT1E表达受缺氮和高浓度铵态氮诱导,这与水稻OsAMT1.1相似,OsAMT1.1受缺氮、供氮均诱导,高铵条件下表达量大于缺氮处理.已知OsAMT1.1是一个双亲和铵态氮转运蛋白,负责铵态氮由根向地上部分的转运,过表达OsAMT1.1能提高地上部分铵态氮含量,和籽粒产量的增加[21,29-30].同源进化树结果显示,SoAMT1E与AtAMT1.4也具有较高的同源性.AtAMT1.4是拟南芥花粉中特异表达的转运蛋白[31],在根、叶等组织器官中未见表达,SoAMT1E与AtAMT1.4的组织表达谱差异较大,不太可能具有类似的生物学功能,更可能与OsAMT1.1相似.
SoAMT2是供试6个SoAMT中唯一受高浓度和低浓度铵态氮抑制的AMT成员,其表达谱与棉花GhAMT1.3和AtAMT2.1相似,均受缺氮诱导和较高铵态氮浓度(>1 mmol·L-1NH4+)抑制[8,32].功能实验证明,GhAMT1.3是一个高亲和铵态氮吸收转运蛋白,在棉花铵态氮吸收和利用中起重要作用,而AtAMT2.1受较高铵态氮(1 mmol·L-1或10 mmol·L-1)抑制,却是一个低亲和铵态氮转运蛋白.本研究中,SoAMT2的转录水平受低浓度(0.5 mmol·L-1)和高浓度(7.5 mmol·L-1)铵态氮的抑制,其在铵态氮转运中的功能未知,或许是一个双亲和蛋白,参与调节植物体内铵态氮的动态平衡.
由上可知,SoAMT基因表达水平不仅受外源铵态氮浓度的影响,部分SoAMT表达谱还受硝态氮浓度的影响,如SoAMT1C,SoAMT1D,SoAMT1E显著受单一低硝态氮浓度的诱导,而SoAMT2表达量在长期单一高浓度硝态氮处理下表现上调.有关SoAMT受外源硝态氮浓度的影响,可能的解释有:一方面,硝态氮不仅是植物氮素来源,还作为信号分子,调控植物氮响应途径,从而参与铵态氮转运蛋白的转录调控;另一方面,铵态氮是植物体内硝态氮的还原产物,外源硝态氮的供应必然影响植物体内铵态氮库的大小[17,33],从而影响相关基因的表达.SoAMT的表达谱还与两种氮素形式是否混合供氮有关,如SoAMT1D在低浓度铵态氮下的表达谱与硝铵混合处理相似,说明低浓度铵态氮对SoAMT1D的诱导作用不受高浓度硝态氮的影响,高浓度硝态氮对SoAMT1B(Spo24677)表达量的诱导又与营养液中是否添加铵态氮无关,相反,硝铵混合处理下SoAMT1C的表达谱与单一硝态氮或铵态氮差异很大,说明SoAMT成员间在菠菜硝铵互作中的作用不同,值得更一步深入研究.
4 结论
本文作者从菠菜基因组数据库中共鉴定到6个SoAMT基因家族蛋白,包括5个AMT1亚家族成员和1个AMT2亚家族成员.菠菜SoAMT与其他植物AMT蛋白结构相似,高度保守,但在组织表达谱和氮响应表达谱上与其他物种同源基因差异较大.根据其不同的氮响应模式,初步推测了其在铵态氮吸收转运中的功能,可为后续进一步深入研究奠定基础.
