湖北省某奶牛场乳腺炎主要病原微生物的分离鉴定与药敏分析
2023-01-14许顺鑫张海艳胡长敏金尔光胡秀秀
许顺鑫,张海艳,胡长敏,金尔光,李 东,胡秀秀,4,陈 洁
(1.武汉市农业科学院畜牧兽医研究所,湖北 武汉 430208 ; 2.华中农业大学动物医学院,湖北 武汉 430070 ;3.武汉市动物疫病预防控制中心,湖北 武汉 430016 ; 4.长江大学动物科学学院,湖北 荆州 434025)
奶牛乳腺炎是奶牛养殖业中最常见且对奶牛生产危害最严重的一种复杂的乳腺综合疾病,可由病原微生物入侵、机械性刺激或化学物理性损伤等因素引起,导致奶牛出现妊娠率降低、流产率升高等,影响奶牛的繁殖性能[1]。据统计,1例普通的临床型奶牛乳腺炎的治疗费用平均在150元左右,严重者可能高达几百元,极大地增加了奶牛的养殖成本[2]。
目前已知能够引起奶牛乳腺炎的病原微生物有150种之多[3],其中以金黄色葡萄球菌、链球菌和大肠埃希菌为主,约占所有病原微生物的90%以上[4]。牛无绿藻(Protothecabovis,P.bovis)曾被命名为中型无绿藻基因Ⅱ型(Protothecazopfiigenotype Ⅱ),后根据Jagielski等[5]的研究重新分类命名为P.bovis,其被认为是可导致奶牛隐性乳腺炎的一种条件性致病藻类。近年来,由P.bovis所引起的奶牛乳腺炎在波兰[6]、韩国[7]、日本[8]、德国[9]、意大利[10]等国家被大量报道,在我国北京、天津、山东等地也相继出现牛无绿藻性奶牛乳腺炎的报道[11-12]。
本试验对湖北省某规模化奶牛场引起奶牛乳腺炎的主要病原菌进行分离培养、革兰染色镜检、分子生物学方法鉴定,并对主要病原菌分离株进行体外药敏试验及分析,以期对奶牛乳腺炎的防控提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂 沙氏葡萄糖琼脂培养基(Sabouraud dextrose agar medium,SDA)、沙氏葡萄糖液体培养基(Sabouraud dextrose broth medium,SDB)、无绿藻选择性培养基(Prototheca selective medium,PIM)、胰酪大豆胨琼脂培养基(Tryptose soya agar,TSA)和胰酪大豆胨液体培养基(Tryptose soya broth,TSB),均购自青岛海博生物技术有限公司;革兰染色液,购自珠海贝索生物技术有限公司;乳酸酚棉蓝染色液,购自上海源叶生物科技有限公司;DNA Marker(DL1 000、DL2 000)、ExTaqDNA聚合酶、Buffer缓冲液、dNTP和ddH2O,均购自TaKaRa公司。
1.1.2 主要仪器 超净工作台,北京亚泰科隆仪器技术有限公司产品;Ⅱ级生物安全柜,苏州苏洁生物有限公司产品;GI80DWS型立式自动压力蒸汽灭菌锅,厦门致微仪器有限公司产品;BM2000型台式光学显微镜,南京江南永新光学有限公司产品;HYL-C型全自动振荡培养箱,太仓强乐实验设备有限公司产品;CP-ST100A二氧化碳培养箱,长沙长锦科技有限公司产品;ETC 811型PCR仪,北京东胜创新生物科技有限公司产品。
1.1.3 药敏材料 本试验采用的31种常规抗菌药敏纸片如表1所示,均购自杭州微生物试剂有限公司,包括青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类和抗真菌类等;组合式药敏检测试剂盒,购自天津市金章科技发展有限公司。
1.2 试验方法
1.2.1 乳样采集 乳样采集于湖北省某规模化奶牛场,根据奶牛生产性能测定体系(Dairy herd improvement,DHI)测定结果和临床奶牛乳腺炎症状进行综合判断,选取乳样中体细胞数高于100万个/mL或存在轻微临床型乳腺炎症状的奶牛进行采样,共采集40份样品,采样前对奶牛乳区进行清洗消毒,弃置前3把奶,随后采集15~20 mL多乳区混合生鲜乳样品于无菌离心管中,置冰盒暂存,2 h内进行细菌分离培养。
1.2.2 细菌分离培养 将乳样摇匀后进行梯度稀释,取不同浓度乳样100 μL接种于TSA、SDA和PIM平板上,使用无菌涂布棒涂抹均匀,于37 ℃恒温培养箱中培养24~48 h,肉眼观察菌落的生长状态和菌落形态,挑取典型的菌落进行划线纯化,并进行唯一性编号,接着对典型单个菌落进行革兰染色或乳酸酚棉蓝染色,在油镜下进行镜检,根据菌落形态和染色特征初步判定细菌类属。

表1 药敏纸片名称和含量Table 1 Names and contents of drug senstitive papers
1.2.3 PCR鉴定 对分离出的典型单个菌落使用16S rRNA通用引物进行扩增,引物序列:27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系见表2,其中DNA模板为在液体培养基中培养后的菌液。PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环30次;72 ℃终延伸10 min,同时设置空白对照,PCR反应产物进行1%琼脂糖凝胶电泳(120 V,30 min),电泳结束后进行凝胶成像分析。PCR阳性产物送检测序,在NCBI上进行BLAST同源性分析,确定病原菌的类别。对疑似P.bovis的分离菌株进行cytb特异性引物扩增鉴定[13],引物序列:cytb-F:5′-GyGTwGAACAyATTATGAGAG-3′;cytb-R:5′-wACCCATAArAArTACCATTCwGG-3′。PCR反应体系见表2,其中DNA模板为在液体培养基中培养后的菌液。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,循环30次;72 ℃终延伸5 min,同时设置空白对照,PCR反应产物进行1%琼脂糖凝胶电泳(120 V,30 min),电泳结束后进行凝胶成像分析。
1.2.4 最小抑菌浓度(Minimal inhibitory concentration,MIC)测定 对分离出的P.bovis、葡萄球菌、大肠埃希菌、肺炎克雷伯菌、链球菌和棒状杆菌进行药物敏感性试验,按照美国临床实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的微量肉汤稀释法,利用组合式药敏检测试剂盒(氨苄西林、阿莫西林/克拉维酸、庆大霉素、大观霉素、多西环素、氟苯尼考、磺胺异噁唑、甲氧苄啶/磺胺甲噁唑、头孢噻呋、头孢他啶、恩诺沙星、氧氟沙星、美罗培南、安普霉素、黏杆菌素、乙酰甲喹)进行MIC测定。
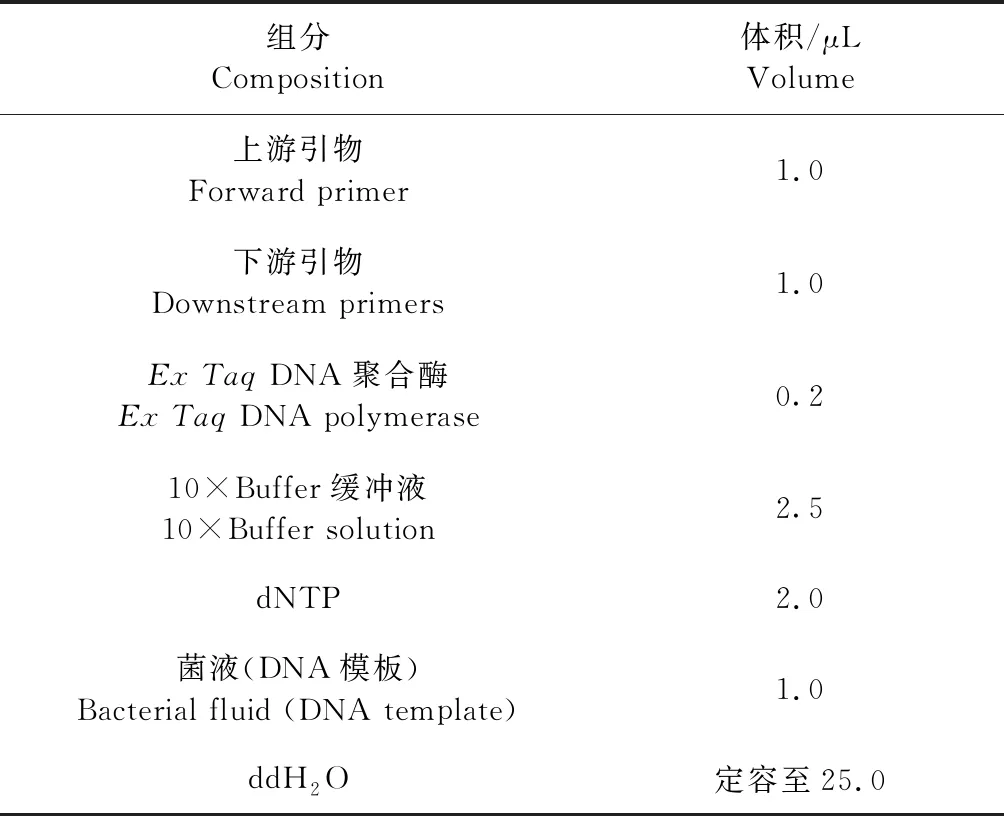
表2 PCR反应体系Table 2 PCR reaction system
1.2.5 药敏试验 采用纸片琼脂扩散法。对分离编号后的P.bovis分别接种至SDB培养基中增殖24~48 h,使用麦氏比浊管法调整P.bovis菌液浓度至1×108CFU/mL,使用移液器分别吸取100 μL转移至SDA培养基上,用无菌涂布棒将菌液均匀涂布于培养基表面;使用灭菌眼科镊夹取药敏纸片置于培养基表面贴紧,记录各药敏纸片名称及位置,置于37 ℃培养箱中培养24~48 h后使用游标卡尺测量各药敏纸片的抑菌圈直径。敏感度判定参照杭州微生物试剂有限公司官网发布的《药敏试验纸片法的抑菌范围解释标准》。
2 结果
2.1 细菌的分离鉴定 本试验对湖北省某规模化奶牛场奶样中体细胞数较高的奶牛进行采样,对病原菌进行分离纯化、肉眼观察(图1)、染色镜检(图2)和16S rRNA通用引物扩增测序比对进行鉴定,对疑似P.bovis菌株进行cytb特异性引物扩增鉴定(图3)。结果显示,40份被检乳样中共分离出83株微生物,其中能引起奶牛乳腺炎的病原微生物共有46株,主要为P.bovis、乳房链球菌和金黄色葡萄球菌(表3),分离率分别为65.0%(26/40)、12.5%(5/40)和10.0%(4/40);其他非病原微生物有37株,主要包括干燥棒状杆菌、芽孢杆菌、库克氏菌、嗜根考克氏菌等。由此可见,引起该规模化奶牛场奶牛乳腺炎的主要病原微生物为P.bovis、乳房链球菌和金黄色葡萄球菌。

图1 肉眼观察P.bovis菌落形态Fig.1 Colony morphology of P.bovis by naked eyes

图2 P.bovis显微镜下形态(1 000×)Fig.2 Microscopic morphology of P.bovis (1 000×)A:革兰染色; B:乳酸酚棉蓝染色A:Gram staining; B:Lactophenol cotton blue staining

图3 乳样分离P.bovis cytb基因的PCR扩增Fig.3 PCR amplification of cytb gene of P.bovis isolated from fresh milk samplesM:DL1 000 Marker; 1~16:P.bovis分离株; 17:阳性对照; 18:阴性对照M:DL1 000 Marker; 1-16:Isolated P.bovis; 17:Positive control; 18:Negative control

表3 湖北省某规模化奶牛场病原微生物分离Table 3 Isolation of pathogenic microorganisms in a dairy farm in Hubei Province
2.2 MIC测定 采用组合式药敏MIC检测试剂盒进行测定,结果如表4所示,本试验分离的P.bovis对甲氧苄啶/磺胺甲噁唑、氧氟沙星、黏杆菌素敏感,对庆大霉素、氟苯尼考、磺胺异噁唑、恩诺沙星、美罗培南、安普霉素、乙酰甲喹中度敏感,对氨苄西林、阿莫西林/克拉维酸、大观霉素、多西环素、头孢噻呋、头孢他啶不敏感。金黄色葡萄球菌对磺胺异噁唑、安普霉素敏感,对阿莫西林/克拉维酸、庆大霉素、大观霉素、多西环素、氟苯尼考、甲氧苄啶/磺胺甲恶唑、恩诺沙星、氧氟沙星、黏杆菌素、乙酰甲喹中度敏感,对氨苄西林、头孢噻呋、头孢他啶、美罗培南不敏感。乳房链球菌对氨苄西林、庆大霉素、氟苯尼考、磺胺异噁唑、甲氧苄啶/磺胺甲噁唑、头孢噻呋,头孢他啶、恩诺沙星、氧氟沙星、美罗培南敏感,对阿莫西林/克拉维酸、大观霉素、安普霉素、黏杆菌素、乙酰甲喹中度敏感,对多西环素不敏感。
2.3 药敏试验 采用药敏纸片测定P.bovis对抗菌药物的敏感性,结果如表5所示,P.bovis对头孢类、喹诺酮类、大环内酯类、四环素类、糖肽类、β-内酰胺类、林可霉素类和磺胺类的大部分抗菌药均不敏感,仅对多黏菌素B、丁胺卡那、庆大霉素、卡那霉素、两性霉素B中度敏感,对抗真菌类抗菌药制霉菌素B敏感。

表4 主要病原微生物MIC测定结果Table 4 MIC determination results of main pathogenic microorganisms (μg/mL)
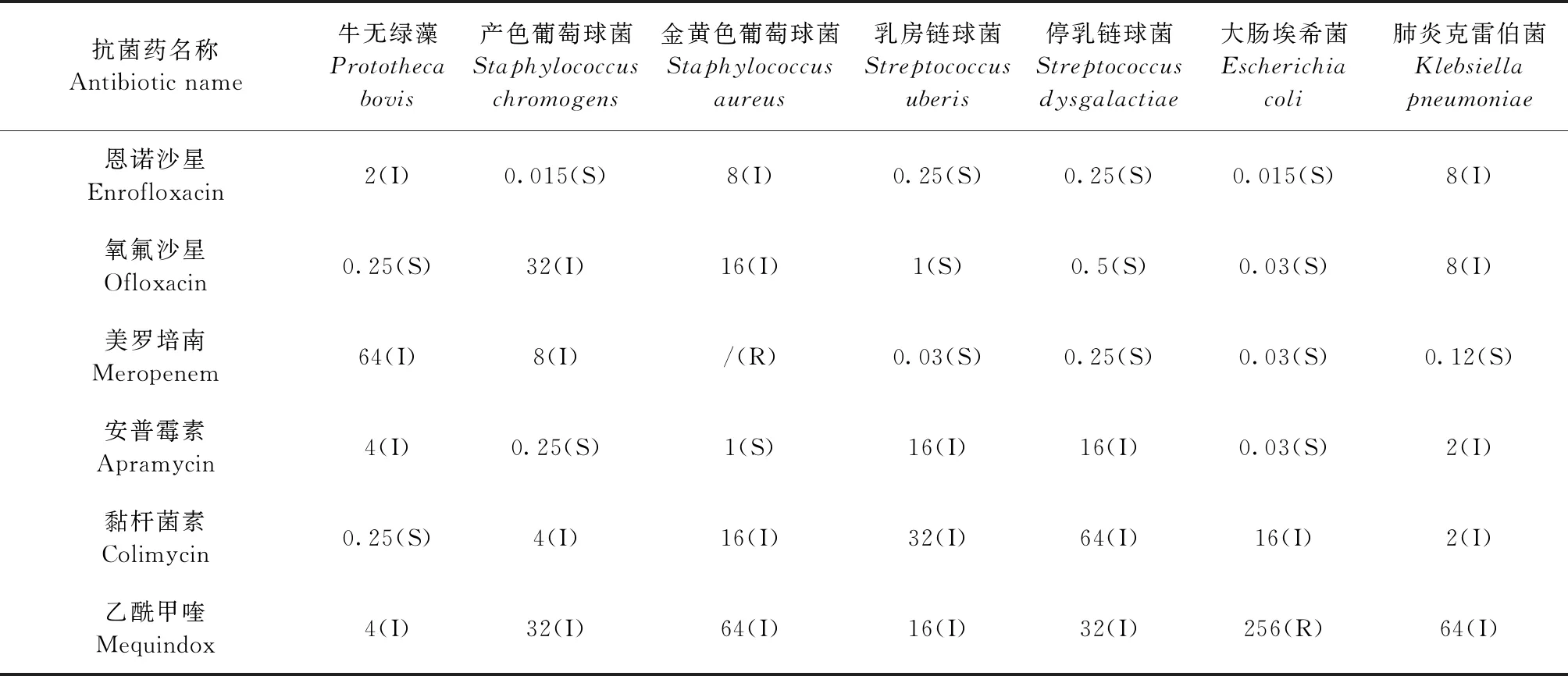
续表
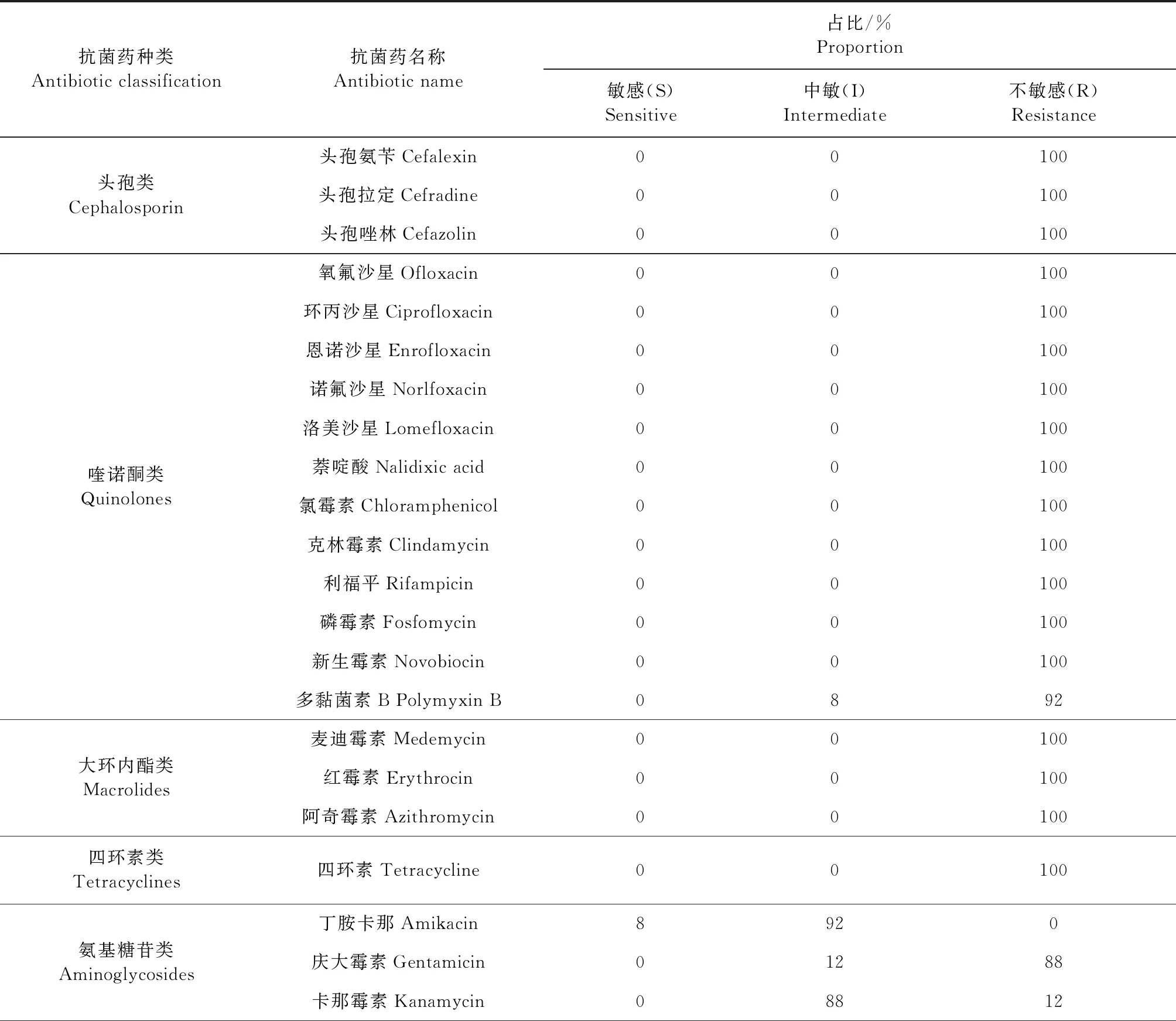
表5 26株P.bovis对主要抗菌药物敏感性Table 5 Sensibility of 26 strains P.bovis to major antibiotic agents
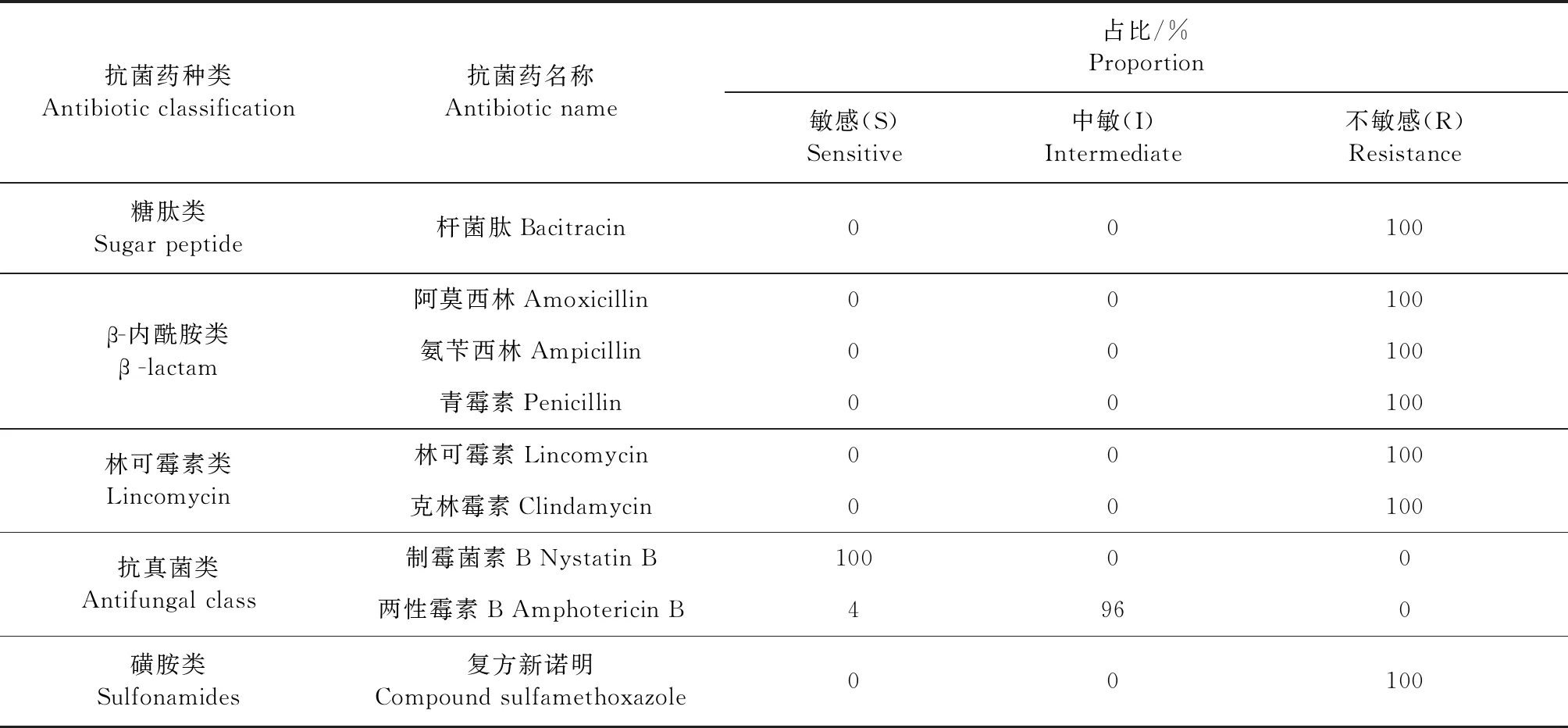
续表
3 讨论
本试验对湖北省某奶牛场的部分乳腺炎患牛乳样进行主要病原微生物的分离和鉴定,分离出主要病原微生物为P.bovis、乳房链球菌和金黄色葡萄球菌,其中P.bovis的分离率为65.0%。同时也分离出大肠埃希菌、肺炎克雷伯菌等奶牛乳腺炎常见病原微生物。Shahid等[11]报道,由北京、天津和山东省所采集到的620份牛奶样品中分离出84株P.bovis,分离率为13.5%,从收集到的410份环境样品中分离出21份P.bovis,分离率为5.1%;张寒琪等[12]报道的北京某规模化奶牛场中采集的11份临床型乳腺炎奶样中分离出8株P.bovis,分离率为72.7%;Alfonso等[14]报道意大利的科莫省、莱科省、米兰省、洛迪省4个地区奶牛乳腺炎流行病学调查情况中,主要病原微生物为金黄色葡萄球菌(42.0%)、无乳链球菌(9.6%)、P.bovis(11.1%)、牛分枝杆菌(1.55%);Jagielski等[15]对波兰16个奶牛场奶牛乳腺炎进行流行病学调查,发现主要病原微生物为链球菌属(19.3%)、葡萄球菌属(7.8%)、P.bovis(8.0%);朱俊平[16]报道的山东省东营市奶牛乳腺炎流行病学调查显示,主要致病菌为无乳链球菌(27.2%)、金黄色葡萄球菌(26.5%)、大肠埃希菌(15.1%)、停乳链球菌(12.1%);沈阳阳等[17]报道的苏中地区部分规模化牧场奶牛乳腺炎流行病学调查情况中,主要致病菌为金黄色葡萄球菌(15.0%)、大肠埃希菌(55.0%)、枸橼酸杆菌(35.0%)、不动杆菌(30.0%)和肺炎克雷伯菌(30.0%);王玲等[18]报道的广西壮族自治区某规模化奶牛场的奶牛乳腺炎流行病学调查发现,假丝酵母菌分离率最高,达73.1%;王军等[19]对青海省部分规模化奶牛场乳腺炎进行调查发现,主要致病菌是大肠埃希菌(14.0%),其次为金黄色葡萄球菌(4.2%)和链球菌(1.4%)。由于地理位置、气候条件和饲养管理水平不同,奶牛乳腺炎主要病原微生物的分离情况存在较大差异。本试验为了重点了解奶牛场隐性乳腺炎主要病原微生物种类,专门挑选了前期调查已经证实了的某P.bovis阳性奶牛场作为调查对象,并采集了体细胞数高于100万个/mL的乳样进行试验,结果显示,P.bovis分离率高达65.0%,明显高于大多数报道以及本团队前期调查数据[20]。这进一步提示,P.bovis与奶牛隐性乳腺炎存在着紧密的联系,其感染机制及相关的防控措施研究值得学者进一步关注和探索。
本试验中使用纸片琼脂扩散法和MIC法对分离出的奶牛乳腺炎主要病原微生物进行药敏分析,通过纸片琼脂扩散法检测了分离出的P.bovis对常见抗菌药的敏感性;通过MIC法检测了P.bovis与其他常见奶牛乳腺炎病原微生物药敏分析的差异。结果显示,该奶牛场所分离出的P.bovis对头孢类、喹诺酮类、大环内酯类、四环素类、糖肽类、β-内酰胺类、林可霉素类和磺胺类的大部分抗菌药均不敏感,对多黏菌素B、丁胺卡那、庆大霉素、卡那霉素、两性霉素B中度敏感,对抗真菌类抗菌药制霉菌素B敏感;MIC检测结果显示,P.bovis对甲氧苄啶/磺胺甲噁唑、氧氟沙星、黏杆菌素敏感,对庆大霉素、氟苯尼考、磺胺异噁唑、恩诺沙星、美罗培南、安普霉素、乙酰甲喹中度敏感,对氨苄西林、阿莫西林/克拉维酸、大观霉素、多西环素、头孢噻呋、头孢他啶不敏感。侯荣光等[21]对P.bovis进行药敏分析表明,P.bovis仅对制霉菌素、庆大霉素、阿米卡星和链霉素敏感。目前国内外对奶牛乳腺炎的治疗主要依赖抗菌药物,使用抗菌药治疗在一定程度上可以治愈奶牛乳腺炎,同时奶牛产前给予抗菌药还能有效防止乳腺炎的发生。结合该奶牛场病原微生物分离情况,P.bovis的感染情况最为严重,故可以考虑选择针对P.bovis有效的抗真菌类或氨基糖苷类药物进行治疗,如制霉菌素B、两性霉素B、庆大霉素等,同时也需考虑针对乳房链球菌、金黄色葡萄球菌、大肠埃希菌等其他奶牛乳腺炎常见病原微生物进行综合防治。鉴于P.bovis是一种条件致病性藻类,能在温暖、潮湿的环境中长期存在,防控无绿藻性奶牛乳腺炎仍需以加强环境卫生消毒、改善挤奶设备和挤奶程序为主要预防控制手段,辅以干奶期科学使用抗菌药进行预防,同时考虑使用生物制剂和中药制剂等新型治疗方法进行治疗,从而有效降低奶牛乳腺炎发生率,保障奶牛正常生产和乳品质量安全。
目前P.bovis所导致的奶牛乳腺炎在世界范围内越来越引起人们的重视,由于P.bovis对大多数抗菌药不敏感,奶牛一旦发生感染很难治愈,且P.bovis一旦感染,在奶牛场环境中可能长期存在,污染奶牛运动场、牛床、饲料、水槽和挤奶机等[22],P.bovis所致奶牛乳腺炎的流行病学调查、致病机制和防治措施研究值得引起国内外研究者和养殖业主们的重点关注,加快针对P.bovis的中草药制剂研究及环境消毒剂研发或许对有效防控无绿藻性奶牛乳腺炎起到重要作用。
