天然腐植酸光热剂
2023-01-13ZhaohuaMiaoKaiLiPeiyingLiuZhenglinLiHuanjieYangQingliangZhaoManliChangQingzhuYangLiangZhenChengyanXu李永健
Zhaohua Miao,Kai Li,Peiying Liu,Zhenglin Li,Huanjie Yang,Qingliang Zhao,Manli Chang,Qingzhu Yang,Liang Zhen,Chengyan Xu 著 李永健 张 敉* 译
1 哈尔滨工业大学材料科学与工程学院 哈尔滨 150001
2 哈尔滨工业大学微系统与微结构制造教育部重点实验室 哈尔滨 150080
3 哈尔滨工业大学生命科学与技术学院 哈尔滨 150080
4 哈尔滨工业大学理学院凝聚态科学与技术研究所 哈尔滨 150080
5 厦门大学公共卫生学院分子影像暨转化医学研究中心分子疫苗学和分子诊断学国家重点实验室 厦门 361102
6 哈尔滨医科大学附属第二医院检验科 哈尔滨 150001
7 昆明理工大学生命科学与技术学院 昆明 650500
天然来源的生物材料具有优异的生物相容性和生物降解性,与化学合成的生物材料相比,往往是临床试验的首选材料,可能也更易获得食品和药品管理局的批准。迄今为止,大量的天然生物材料已用于不同的生物医学应用,如用于外科缝线的胶原蛋白、用作药物载体的海藻酸钠或壳聚糖以及用作止血粉的纤维蛋白。然而,当前大多数天然生物材料通常功能有限,无法满足现代医学从群体转向个体的日益增长的需求,而这个需求也是个体化治疗的基本特征之一。例如,最近,以诊断模式和治疗技术结合为理念的治疗学在可能促进个体化治疗的实施过程中引起了激烈讨论,包括临床医生寻求在治疗前方便地定位病变组织,在治疗过程中监测治疗过程,以及在治疗后评估治疗效果的多功能生物材料(即治疗剂)的设计和开发。在众多的治疗药物中,用于光声(PA)断层成像和光热治疗(PTT)的近红外(NIR)吸光剂因其无创性和副作用较小的优势引起了关注。众所周知,吸光剂包括等离子体金属纳米结构、铜基半导体、碳纳米材料、2 维石墨烯类似物和有机共轭聚合物,它们通常具有良好的光热性能,但生物降解性却相对较差,导致其长期安全性受到了关注。近年来,人们主要关注的几种具有良好生物降解性或快速肾清除能力的吸光生物材料有卟啉纳米囊泡、Fe3+镓酸纳米点、多金属氧酸簇、甲黄素、脱镁素和类黑素。以类黑素为例,通过葡萄糖和氨基酸的美拉德反应制备的类黑素不仅具有较高的光热转换效率,而且具有良好的生物降解性和高效的肾清除率。但即便如此,考虑到进一步临床试验的可行性,直接使用高度生物相容性和可生物降解的天然生物材料仍然是光诱导诊断和治疗的更优选择。
腐植酸和黄腐酸是腐殖物质的两个主要组分,它们是微生物通过生物降解动植物残体而自然形成的,约占地球总碳源的50%。腐植酸是一种复杂的大分子,可溶于碱性介质,部分可溶于水。由于存在丰富的官能团(酚羟基、羧基、烯醇基、醌基等),腐植酸表现出一些令人惊喜的特性,例如易于与金属离子螯合,具有抗氧化、抗炎和可再生电子受体,因此已广泛应用于农业、环境、生物医学和能源领域。令人印象深刻的是,在不同的文化背景下,腐植酸应用于医学领域已历时几个世纪甚至更长的时间。据报道,早在古巴比伦和罗马帝国,含有高腐植酸的沼地泥炭就被用来促进伤口愈合。自中国古代明朝以来,著名的药物“乌金散”就被用于妇科疾病治疗,近期发现其活性成分就是腐植酸物质。迄今为止,尽管具体的成分和结构尚不明确,但腐植酸已被证明在许多疾病的预防和治疗中是有效的,特别是对肌肉骨骼、妇科和皮肤疾病。已开发的市售药物有Salhumin 和Humet-R 糖浆。由此可见,腐植酸在一些特定的生物医学应用中是安全的。然而,据我们所知,腐植酸的治疗应用尚未得到证实,因此,扩大传统腐植酸的生物医学应用范围是非常必要和有价值的。在此,基于从紫外(UV)到近红外区域(图1)内的本征吸收,我们首次证实了腐植酸钠(SH),即腐植酸钠盐,可作为一种有前途的用于光诱导光声成像和PTT的治疗剂。我们采用了先前报道中的腐植酸分子模型进行研究。与大多数先进的光治疗剂相比,SH 具有以下几个突出的优点:(1)SH 具有高光热转换效率,高达76.3%;(2)SH 长期用于生物医学,具有良好的生物相容性;(3)SH 是非常便宜和丰富的。

图1 用于肿瘤光诱导光声成像和光热治疗的腐植酸钠示意图Fig.1 Schematic representation of sodium humate for light-induced photoacoustic imaging and photothermal therapy of tumor
分别采用离心法和渗析法纯化了Aldrich 市售的腐植酸钠,去除了不溶性残留物和小分子。值得注意的是,这里使用腐植酸钠代替腐植酸,是因为腐植酸在水中的溶解度相对较差。冷冻干燥后,纯化的黑色SH 粉末非常蓬松,可以很好地重新分散在水-磷酸盐缓冲盐(PBS)和细胞培养基中(图S1,补充信息),放置超过2 个月后未观察到沉淀(图S2,补充信息)。SH 的这种良好分散性应归因于SH 的高zeta 电位(ζ)。0.5 和2 mg/mL 的SH,ζ 电位分别高达-46.56±1.83 和-45.37±2.92 mV。通过动态光散射(DLS)法测定的浓度为0.02、0.05、0.1、0.2、0.5 和2 mg/mL 的SH 溶液的平均流体动力学直径分别为345.4±50.1、340.3±16.9、224.5±10.3、210.1±9.5、144.5±2.7 和127.7±4.4 nm(图S3,补充信息)。这些结果表明,SH 溶液的流体动力学直径随着SH浓度的增加而减小。如图2(a)所示,激光照射后出现典型的丁达尔现象,表明SH 溶液的胶体特性。由于SH 同时具有亲水性和疏水性结构,使得SH 可以形成胶束。但是,在TEM 图像中无法观察到规则的纳米颗粒(图S4,补充信息)。可能的原因是腐植酸钠分子间弱的或不一致的相互作用随着水分的蒸发而改变,导致形成了不规则形态。能量色散X 射线光谱(EDS)分析结果表明,SH 主要由C、O 和Na 组成(图S5,补充信息)。SH 的傅里叶变换红外光谱(FTIR)证实了许多基团的存在,例如酚羟基、羧基和醌基(图S6,补充信息)。
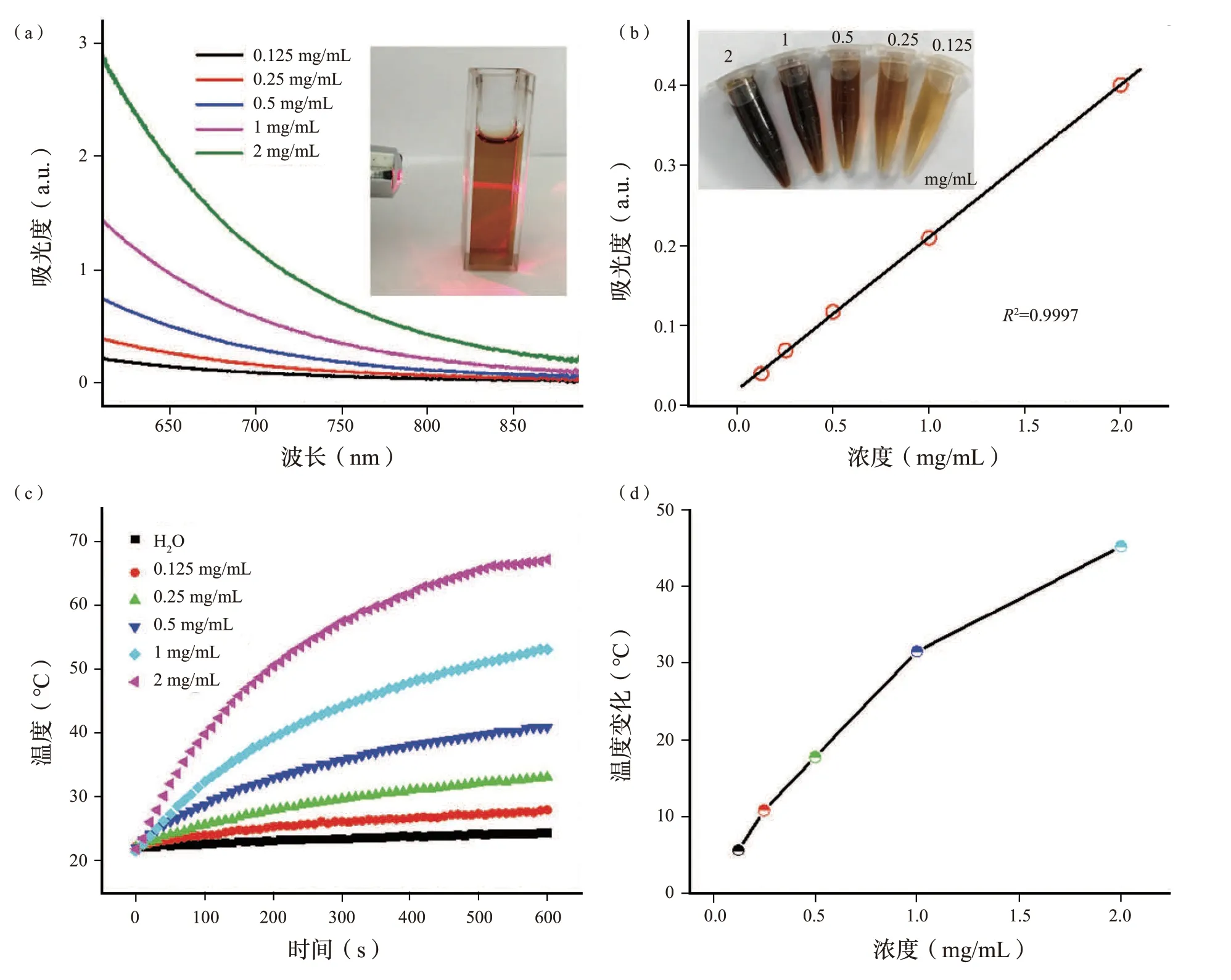
图2 (a)SH 溶液的可见-近红外吸收光谱。(b)SH 溶液在808 nm 处的吸光度随浓度变化的拟合曲线。(c)在808 nm 激光照射下,不同浓度的SH 溶液和去离子水的升温效应。(d)不同浓度的SH 溶液照射10 min 后对应的温度变化。Fig.2 (a) The vis-NIR absorption spectra of SH solutions.(b) The f itting curve of the absorbance of SH solutions at 808 nm as a function of concentrations.(c) Temperature elevation of SH solutions with diff erent concentrations and deionized water under 808 nm laser irradiation.(d) The corresponding temperature changes of diff erent concentrations of SH solutions for 10 min irradiation.
溶解在PBS 溶液(pH=7.4)中的SH 的吸收光谱如图2(a)所示。可见-近红外区域的宽吸收带可能是由于电子供体(如多羟基芳香族和苯酚)和电子受体(如醌)的相互作用非常接近引起的。吸光度随着波长的增大而减少,这与氧化石墨烯、黑磷和类黑素的吸收类似。图2(b)显示,SH 在808 nm 处的吸光度随浓度的增大呈线性增强,进一步证实了SH 在水中的良好分散性。图2(b)是不同浓度(0.125 至2 mg/mL)的SH 溶液的相应照片。如图S7(补充信息)所示,在360、450 和570 nm的激发波长下未观察到荧光,表明腐植酸钠的荧光量子产率极低。进一步对SH 溶液的光热性能进行了评价。在输出功率为2 W 的808 nm 激光照射10 min 后,具有梯度浓度(0、0.125、0.25、0.5、1 和2 mg/mL)的SH 溶液随着温度升高显示出明显的时间和浓度依赖性,而对照组中去离子水显示出较小的温度变化[图2(c),(d)]。例如,浓度为1 mg/mL 的SH 溶液的温度在10 min 内从21.6 ℃升高到53.9 ℃,这足以用于光热消融癌细胞。
为了进一步评估光热能力,根据先前报道的方法计算SH 的光热转换效率(η),确定SH 的η为76.3%[图3(a),(b)],远高于包括金纳米棒(21%)、Cu9S5纳米颗粒(25.7%)、MoS2(24.37%)、锑烯量子点(45.5%)、黑磷量子点(28.4%)的大多数先进的光热剂。腐植酸钠光热转换效率高的可能原因包括羟基芳香供体和醌类受体之间强的分子内电荷转移相互作用、低荧光量子产率和可忽略的光散射。而且,使用溴化十六烷基三甲铵(CTAB)包覆的金纳米棒作为对照,计算出金纳米棒的η为28.2%(图S8,补充信息),略高于先前报道的金纳米棒(21%),这可能是由不同的激光功率和不同的金纳米棒浓度引起的。此外,还评估了SH 的光热稳定性。如图3(c)、(d)所示,经过3 次重复照射循环后,SH 溶液的温度变化几乎保持不变,并且SH 溶液的吸光度在激光照射30 min 前后几乎相同,表明SH 具有优异的光热稳定性。高光热转换效率和优异的光热稳定性说明SH 在作为光诱导PTT 和PAT 的治疗剂上具有很大的潜力。
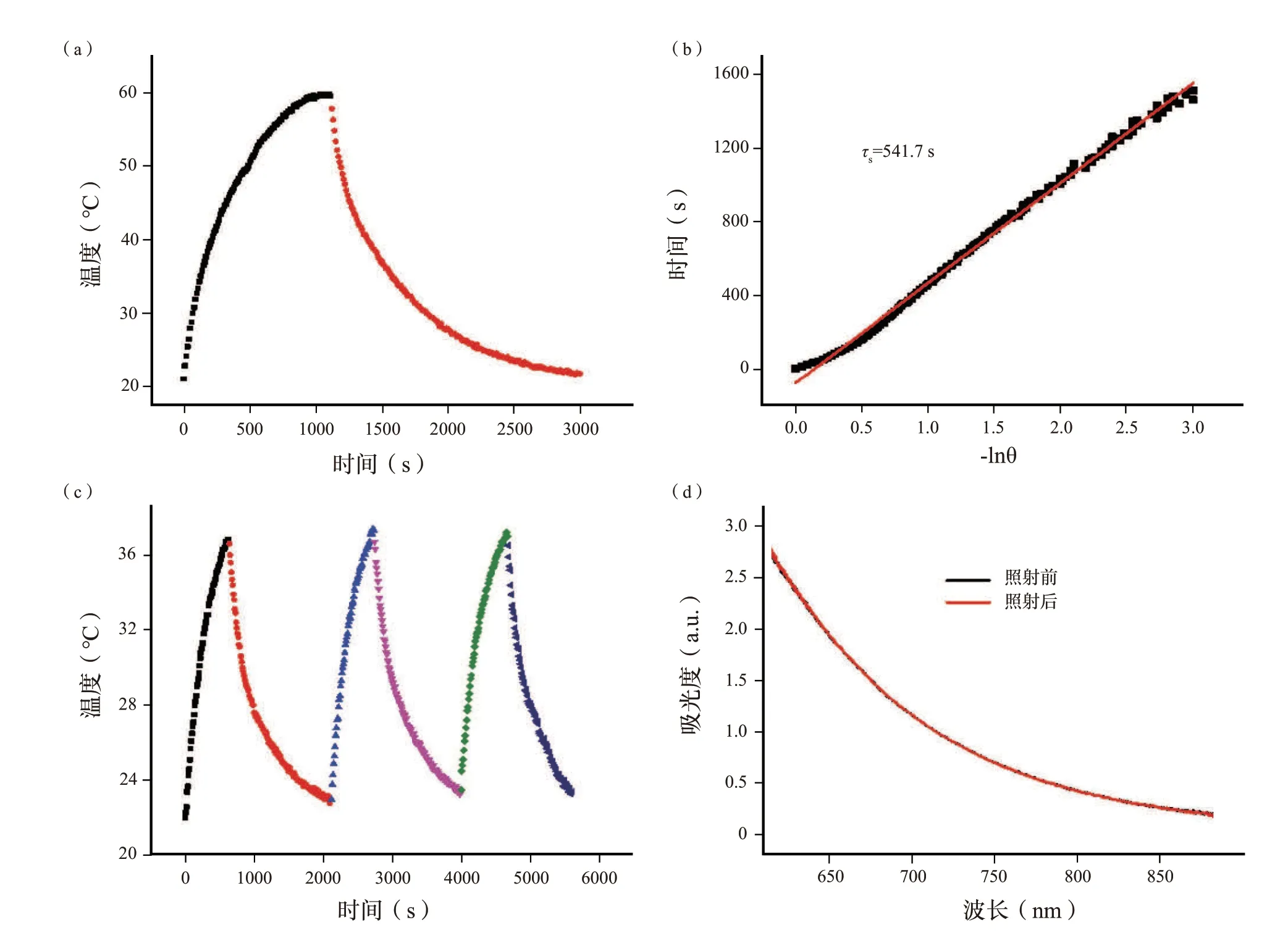
图3 (a)在激光照射(808 nm,2 w)下,SH 溶液(2 mL,1 mg/mL)的加热/冷却曲线。(b)从冷却周期获得的时间数据与-lnθ 的拟合线性曲线,计算出传热的时间常数(τs)为541.7 s。(c)浓度为0.5 mg/mL 的SH 溶液3 次重复照射循环的加热/冷却曲线。(d)SH 溶液照射前后30 min 的可见-近红外吸收光谱。Fig.3 (a) The heating/cooling curves of SH solution (2 mL,1 mg/mL) under laser irradiation (808 nm,2 W).(b) The f itting linear curve of time data versus -lnθ acquired from the cooling period,and the time constant (τs) for heat transfer was calculated to be 541.7 s.(c) Heating/cooling curves of SH solution with a concentration of 0.5 mg/mL for three times repeated irradiation cycles.(d) Vis–NIR absorption spectra of SH solution for 30 min before and after irradiation.
生物材料临床应用的一个普遍关注问题是生物相容性。采用标准MTT[3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑噻唑蓝]法评估天然SH 的细胞毒性。如图4(a)和图S5(补充信息)所示,作用于HeLa、Panc-1 和HUVEC 细胞24 或48 h 后,未观察到SH 的明显细胞毒性[图2(g)、(h);图S9(补充信息)]。例如,即使在2 mg/mL高浓度的SH 下,HeLa 细胞的存活率也可以超过98%。此外,如补充信息中图S10 所示,即使在8 mg/mL 高浓度的SH 下,培养24 h 后HeLa 细胞的存活率仍为85.4%,表明没有明显的细胞毒性。当SH 浓度达到10 mg/mL 时,HeLa 细胞的存活率为55.3%,显示出一定的细胞毒性。而且,我们还进行了体外溶血试验。如图S11(补充信息)所示,在与不同浓度的SH 孵育6 h 后,观察到红细胞(RBC)的溶血可以忽略不计,这表明SH 具有良好的血液相容性。这些结果表明,SH 在生物医学应用中具有超低的细胞毒性。

图4 不同处理的HeLa 细胞荧光显微镜图像及HeLa 细胞在不同浓度的SH 溶液中不同时间后的存活率Fig.4 Fluorescence microscopy images of HeLa cells with diff erent treatments and the viability of HeLa cells exposure to SH solutions with diff erent concentrations for diff erent time
基于SH 的超低细胞毒性和高光热性能,本研究对肿瘤细胞的光热消融进行了评估。HeLa 细胞经含有不同浓度SH 的培养基孵育4 h 后,用NIR 激光(808 nm,4 W/cm2)照射10 min。照射后分别用钙黄绿素乙酰氧基甲酯(AM)和碘化丙啶染色HeLa 细胞,观察活细胞与死细胞。如图4(a)~(f)所示,当HeLa 细胞单独用激光照射或SH 处理时,在整个孔中观察到鲜艳的绿色荧光,表明没有发生明显的细胞死亡。相反,当HeLa 细胞同时接受激光照射和SH 处理时,出现红色荧光,表明SH 具有出色的光热效应,从而导致细胞死亡,并且随着SH 浓度的增加,细胞死亡数增加。通过标准MTT法进一步定量评估光热消融能力。如图4(i)所示,HeLa 细胞的活力随着SH 浓度的增加而降低,与上述荧光染色结果一致。当在浓度为1 mg/mL 的SH溶液中孵育时,只有不到16%的细胞在照射下存活,表明SH 结合近红外光可以通过明显的光热效应有效诱导细胞死亡。
为了进一步证明SH 的光热能力,用携带HeLa 肿瘤的Balb/c 裸鼠作为动物模型进行了体内PTT 试验。将20 只小鼠随机分为4 组,分别为“对照”组、“仅激光”组、“仅SH”组和“SH+激光”组,瘤内注射SH 溶液(25 μL,10 mg/mL)后,使用红外热像仪监测激光照射(808 nm,1.1 W/cm2)期间的温度变化。值得注意的是,尽管注射浓度为10 mg/mL,但在活体组织中的有效腐植酸钠浓度远小于10 mg/mL,因为向小鼠注射腐植酸钠后,可在短时间内扩散到周围组织。如图5(a)所示,“SH+激光”组中,肿瘤区域的温度在10 min 内从36.3 ℃升高到59.7 ℃,高到足以消融肿瘤。相比之下,“激光”组的温度变化仅约为5.2 ℃。治疗后,从不同组中提取肿瘤组织,并通过组织学苏木精和伊红(H&E)染色获得相应的肿瘤切片,如图5(b)所示。“SH+激光”组出现明显的核破裂、核固缩和核溶解,提示严重的肿瘤坏死损伤,而其他3 组均未出现肿瘤损伤现象。黑色箭头表示核破裂,红色箭头表示核固缩,黄色箭头表示核溶解。此外,TUNEL 法检测表明,仅在“SH+激光”组中观察到明显的绿色荧光,表明细胞严重凋亡,这与H&E 染色结果一致(图S12,补充信息)。每隔2 天测量肿瘤体积和小鼠体重。如图5(c)所示,“SH+激光”组的肿瘤在激光照射后被消除,只留下黑色疤痕,在第12 天消失,20 天内没有复发肿瘤。相反,其他3 组的肿瘤体积均达到约700 mm3,表明肿瘤生长迅速。试验还通过数码相机记录了详细的肿瘤变化,不同组小鼠的代表性照片如补充信息中的图S14所示。
此外,在20 天内,4 组的体重几乎相同,表明SH 或激光照射几乎不影响小鼠生存状态。随后处死小鼠,相应的肿瘤照片如图5(e)所示。肿瘤大小和重量的变化与其体积增长一致[图5(e);图S14(补充信息)]。这些结果证明,通过瘤内注射SH,结合近红外激光可有效地在体内消融肿瘤。为了评估SH 是否引起体内毒性,我们提取了“SH+激光”组治疗后小鼠的主要器官(心、肝、脾、肺和肾),进行H&E 染色观察。
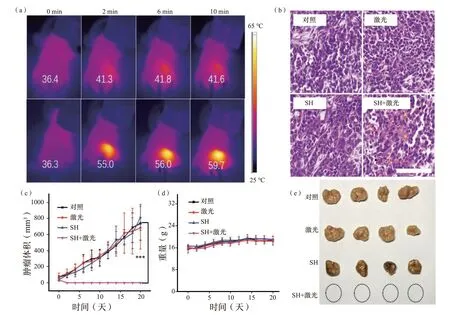
图5 (a)在未注射/注射SH-PBS 溶液(25 μL,10 mg/mL)的激光照射(808 nm,1.1 W/cm2)下肿瘤小鼠的红外图像。(b)不同组肿瘤切片具有代表性的H&E 图像。(c)不同治疗组的肿瘤生长曲线。(d)治疗期间Balb/c 小鼠的体重变化。(e)小鼠处死后从不同组提取的肿瘤照片。Fig.5 (a) Infrared images of tumour-bearing mice under laser irradiation (808 nm,1.1 W/cm2) without/with the injection of SH PBS solution (25 μL,10 mg/mL).(b) Representative H&E images of tumors slice obtained from diff erent groups as indicated.(c) The curves of tumor growth of diff erent treated groups as denoted.(d) Body weight changes of Balb/c mice during treatment.(e) Photograph of extracted tumour from diff erent groups after the mice sacrif ice.
结果如补充信息中图S15 所示,组织未出现明显的病理变化,形态完整。对健康的“对照”组和“SH+激光”组进行血清生化测定。如表S1(补充信息)所示,“SH+激光”组的血清参数与“对照”组无明显差异,包括肝脏指标ALT、AST 和ALP以及肾脏指标UA 和尿素,进一步证实了SH 对小鼠的超低毒性。这些结果是合理的,因为天然腐植酸作为商业制剂已经使用了几个世纪,对于一些特定疾病应该是安全的。因此,良好的生物相容性表明SH 适用于生物医学领域。
各种研究表明,光热剂也可以作为有效的光声造影剂。因此,我们期望具有高光热转换效率的天然SH 也能实现高分辨率的光声成像和深层组织穿透。为了评估SH 的光声性能,本研究制备了一系列浓度为1 至10 mg/mL 的SH 溶液,并对其光声振幅进行了评估。如图6(a)、(c)所示,在低功率1.6 mJ/cm2的808 nm 脉冲激光照射下,可以明显观察到SH 的光声增强,并且强度随SH浓度的增加呈现线性增强。此外,10 mg/mL 的SH溶液的光声信号强度约为去离子水的5.9 倍。受体外良好光声性能的启发,我们在体内进行了光声成像。如补充信息中图S16 所示,由于存在低本征NIR 吸收的血红蛋白分子,肿瘤区域中只有微弱的光声信号。相反,在瘤内注射SH(50 μL,10 mg/mL)30 min 后,光声信号的增强几乎扩展到整个肿瘤区域,表明SH 可以通过扩散效应从注射部位快速穿透整个肿瘤区域。在此基础上,我们评估了SH 静脉注射的潜在肿瘤积聚优势。通过尾静脉注射SHPBS溶液(100 μL,10 mg/mL),在不同时间点(0、1、2 和8 h)收集直径约7 mm 的肿瘤区域的光声成像。如图6(b)、(d)所示,当在肿瘤区域观察到更多细节时,信号强度在注射SH 2 h 后达到最大值。图6(d)中的定量结果表明,注射SH 2 h 后肿瘤区域的光声信号强度约为注射前的2.1 倍。此外,注射SH 8 h 后,肿瘤区域的光声强度与注射前几乎相同,表明SH 最初在肿瘤区域积聚,然后消除或降解。肿瘤的快速清除或生物降解可能与良好的分散性或分子体积小有关,类似于可生物降解的类黑素和Fe3+没食子酸纳米点。PTT 和PA 成像的集成可提高癌症治疗诊断的准确性和治疗效率,促进个体化治疗的实施。基于以上结果,我们认为天然SH 可以作为PA 引导的肿瘤PTT 体内生物相容性光治疗剂。
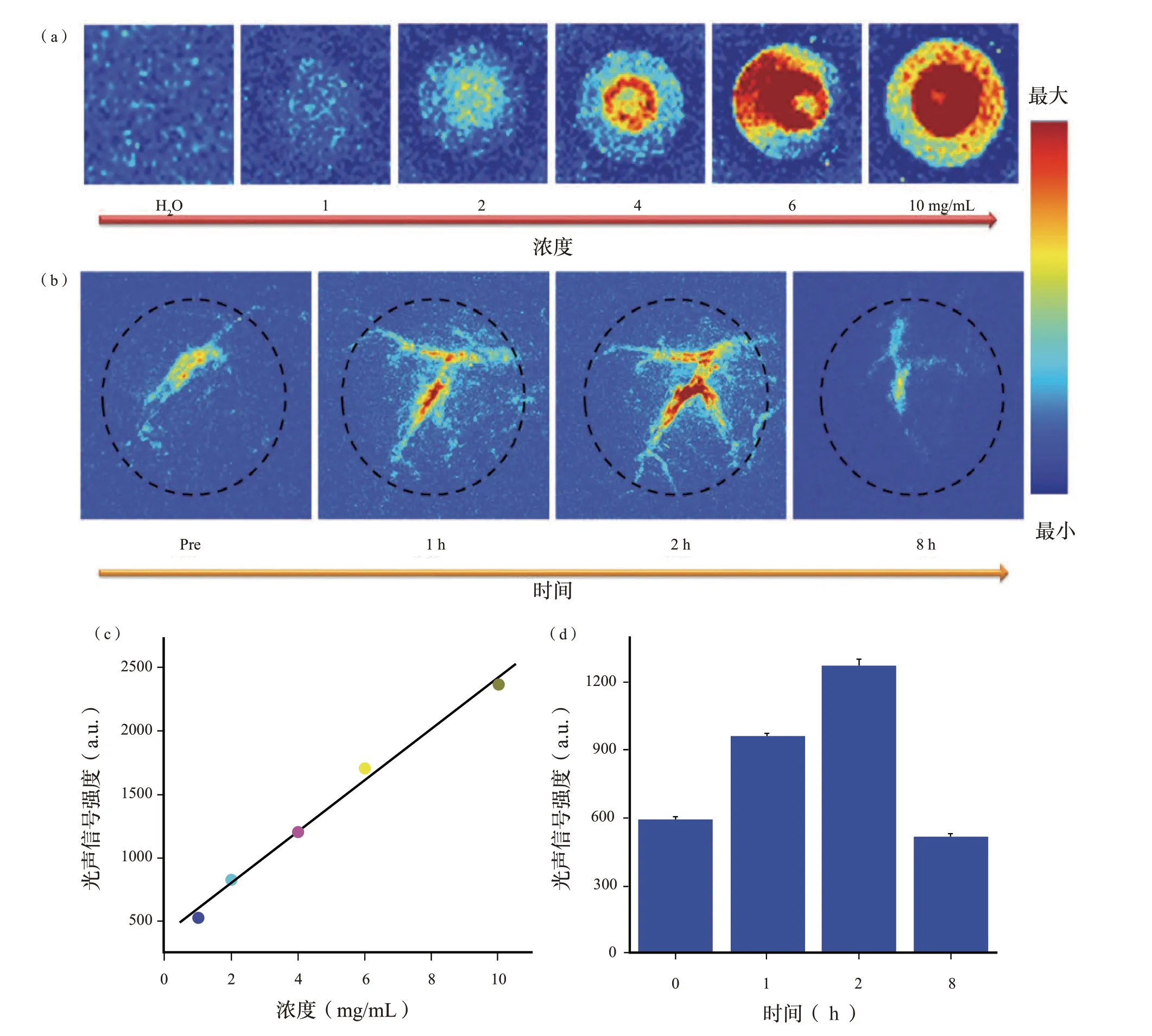
图6 体外和体内SH 的光声成像Fig.6 Photoacoustic imaging of SH in vitro and in vivo
综上所述,天然腐植酸钠可作为光诱导的光声成像和肿瘤PTT 新型治疗剂。SH 的光热转换率高达76.3%,光热稳定性好,在体内表现出明显的光声增强,能在20 天内有效消融肿瘤而不复发。重要的是,SH 在细胞和动物水平上的毒性可以忽略不计。与其他治疗药物相比,SH 具有储量丰富、价格低廉、生物相容性高等优点,具有很高的临床应用前景。需要指出的是,在本研究中,SH 的治疗应用仅通过肿瘤内注射实现。我们希望这项工作能够为传统腐植酸在生物医学领域的应用提供一些参考。
实验部分、补充信息、致谢及参考文献(略)
