唯物辩证法原理在金属性教学中的应用
2023-01-10陈联梅康泰然李红梅漆文胜
陈联梅,康泰然,李红梅,漆文胜
成都大学食品与生物工程学院,成都 610000
唯物辩证法中最核心的法则是矛盾分析法。矛盾具有普遍性,存在于一切事物中,化学学科也不例外;矛盾具有特殊性,在处理问题时要坚持具体情况具体分析的原则,反对一刀切、片面化[1,2]。在分析解决矛盾的过程中,要辩证看待主要因素和次要因素的关系。大多数情况下,主要因素占据支配地位,次要因素处于从属地位,因此往往抓住主要因素来讨论即可;但是,事物是发展变化的,主要因素和次要因素是互相影响、互相制约的,在一定条件下亦互易其位,因此在少数情况下次要因素也会成为影响事物的关键因素。运用唯物辩证法的这些观点和方法来剖析无机化学教学中遇到各种矛盾,不仅可以成功化解这些教学难点,还可培养学生辩证的思维方式和解决复杂问题的能力。
在元素周期表中,金属元素约占4/5。从化学角度来讲,金属元素最突出的性质是容易失去电子,称之为金属性。金属性是一个复杂知识点,是无机化学教学中的一个难点[3,4]。在无机化学教材中讨论金属性强弱时,采用的衡量标准有电极电势(φϴ)、电离能(I)、生成自由能(ΔfGmϴ)、生成焓(ΔfHmϴ)等。如果不厘清这些标准的本质及其适用范围,学生就很容易混淆它们,产生一系列矛盾问题。例如,根据电离能推导出金属性Li < Na < K,根据φϴ推导出金属性Li > K > Na,它们之间为什么不一致呢?在解释金属单质的性质时,应该采用哪个衡量标准?又如,根据φϴ推导出金属性K > Na;然而在800 °C时Na + KCl → NaCl + K,此反应似乎利用不活泼金属Na制取了活泼金属K。再如,根据φϴ推导出金属性Li > K > Na,但是它们与水反应时,Li单质不如Na、K单质反应剧烈。诸如此类的矛盾问题很多,让学生们感到很困惑,甚至让一些年轻教师也感到不解。本文中,我们将运用唯物辩证法原理中的一些观点和方法来剖析金属性这个复杂知识点,那么上述矛盾问题就会迎刃而解。
1 分析矛盾产生的根源
唯物辩证法原理告诉我们,首先要对矛盾进行客观分析,揭示矛盾的内在规律性,然后才能找出解决矛盾的方法。在讨论金属元素的金属性强弱时,学生为什么会得出上面这些矛盾结论?我们深入分析其原因,可以归结为三个方面。第一,金属元素的金属性与其存在形式有关。金属元素有两种存在形式——气态自由原子和聚集态单质。存在形式不同,影响失电子反应的因素不同,所表现出的金属性不同。第二,金属元素的金属性与反应条件有关。当金属元素都以单质形式存在时,反应条件不同,影响失电子反应的因素不同,所表现出的金属性也不同。第三,热力学衡量标准只表明金属元素失电子趋势,不决定实际的反应速率;反应速率属于动力学范畴,还需要研究与动力学相关的一些实际影响因素。可见,影响金属性的因素较多,不可能用一个标准去衡量金属元素在不同情况下的金属性,这就要求我们用辩证观点来剖析金属元素的金属性,坚持具体情况具体分析原则。
2 根据反应实际情况采用相应的金属性衡量标准
金属性是一个复杂知识点。在讨论金属性强弱时,一定要坚持具体情况具体分析原则,根据失电子反应的实际情况采用相应的标准来衡量。金属元素的存在形式不同(气态自由原子和聚集态单质),要采用不同的衡量标准;即使存在形式相同,都以单质形式存在,反应条件不同,采用的衡量标准也不同。
2.1 金属元素处于气态自由原子时的金属性衡量标准
当金属元素处于气态自由原子时,失去电子后生成气态阳离子,这个过程中所吸收的能量为电离能(I)。因此,金属元素处于气态自由原子时,金属性的衡量标准应采用电离能。电离能越小,金属自由原子越容易失电子,其金属性越强。以IA和IIA金属元素为例,它们的第一电离能数据见表1[5]。

表1 IA和IIA金属元素的第一电离能(I1) (M(g) → M+(g) + e-)
从表1可以看出,当金属元素处于气态自由原子时,IA元素的金属性强弱顺序Cs > Rb > K > Na >Li;IIA元素的金属性强弱顺序Ba > Sr > Ca > Mg > Be。
在元素周期律中讨论同周期和同族的金属性递变规律时,衡量标准常采用第一电离能,因此推导出的结论只能表明这些元素均处于气态自由原子时的失电子能力。然而,金属元素绝大多数时候并不处于气态自由原子状态,而是以聚集态单质的形式存在,因此我们更需要找出金属单质的金属性衡量标准。
2.2 金属元素处于单质形式时的金属性衡量标准
金属元素虽然都以单质形式存在,但反应条件不同,分别在干态下(即反应中没有水溶液参与)和水溶液中进行失电子反应,影响反应的因素不同,那么采用的金属性衡量标准也会不同。
2.2.1 金属单质在干态下反应时的金属性衡量标准
在干态下金属单质与非金属单质反应生成金属化合物,因此金属单质在干态下的失电子能力可用产物的ΔfGmϴ来衡量。由于ΔGmϴ= ΔHmϴ-TΔSmϴ,决定ΔGmϴ的因素有ΔHmϴ和ΔSmϴ。很多情况下,考虑ΔSmϴ影响较小和ΔfGmϴ数据不全,也常用产物的标准摩尔生成焓(ΔfHmϴ)来衡量。由于不同产物中所含的化学键数目不同,不能直接比较产物的ΔfHmϴ和ΔfGmϴ,应换算成ΔfHmϴ/化学键数目和ΔfGmϴ/化学键数目来衡量。
1) 金属单质与O2反应时的金属性衡量标准。
以IA、IIA金属单质与O2反应为例,先查出产物(金属氧化物)的ΔfHmϴ和ΔfGmϴ,再计算出ΔfHmϴ/化学键数目和ΔfGmϴ/化学键数目(见表2和表3)[5]。

表2 碱金属氧化物的ΔfHmϴ/化学键数目和ΔfGmϴ/化学键数目
表3 碱土金属氧化物的/化学键数目和/化学键数目

表3 碱土金属氧化物的/化学键数目和/化学键数目
碱金属氧化物 Δ f H m ϴ /2/(k J·m o l-1) Δ f G m ϴ /2/(k J·m o l-1)B e O -3 0 4.7 -2 9 0.0 M g O -3 0 0.8 -2 8 4.6 C a O -3 1 7.4 -3 0 1.6 S r O -2 9 6.0 -2 8 1.0 B a O -2 7 4.0 -2 6 0.2
从表2和表3中可得出以下结论:① 干态下碱金属单质与O2反应时,金属性顺序为Li > Na > K >Cs > Rb;干态下碱土金属单质与O2反应时,金属性顺序为Ca > Be > Mg > Sr > Ba,可见金属单质在干态下反应时的金属性和金属自由原子的金属性不一致;② 根据ΔfHmϴ和ΔfGmϴ得出的结论基本一致;唯物辩证法原理认为,事物的性质常常由主要因素决定,处理问题时往往抓住主要因素来讨论,因此热力学中常常采用ΔHmϴ代替ΔGmϴ处理问题。
2) 金属单质与Cl2反应时的金属性衡量标准。
以IA、IIA金属单质与Cl2反应为例,先查找出产物(金属氯化物)的ΔfHmϴ和ΔfGmϴ,再计算出ΔfHmϴ/化学键数目和ΔfGmϴ/化学键数目(见表4和表5)[5]。

表4 碱金属氯化物的ΔfHmϴ/化学键数目和ΔfGmϴ/化学键数目
表5 碱土金属氯化物的/化学键数目和/化学键数目

表5 碱土金属氯化物的/化学键数目和/化学键数目
碱土金属氯化物 Δ f H m ϴ /2(k J·m o l-1) Δ f G m ϴ /2/(k J·m o l-1)B e C l 2 -2 4 5.2 -2 2 2.8 M g C l 2 -3 2 0.6 -2 9 5.9 C a C l 2 -3 9 7.7 -3 7 4.4 S r C l 2 - -B a C l 2 -4 2 7.5 -4 0 3.4
从表4和表5可得出以下结论:① 干态下碱金属单质与Cl2反应时,金属性顺序K > Rb > Na;干态下碱土金属单质与Cl2反应时,金属性顺序Ba > Ca > Mg > Be;可见,金属单质在干态下的金属性与前面自由原子态的金属性不一致。② 相同的金属单质分别与O2、Cl2反应时,所表现出金属性也不一致;例如,Na、K、Rb单质与O2反应时,金属性Na > K > Rb;它们与Cl2反应时,金属性K >Rb > Na。
我们可利用产物的玻恩-哈勃循环来进一步分析金属单质在干态下的金属性和其自由原子态的金属性不一致的原因。从NaCl的玻恩-哈勃循环图(图1)看出[5],影响反应的因素较多,除了金属原子的电离能之外,还有金属单质的升华能、非金属单质的解离能和非金属气态原子的电子亲合能、产物的晶格能等,这些因素共同决定了金属单质在干态下反应时的金属性。查出这些影响因素的数据,可以计算出NaCl的ΔfHmϴ。

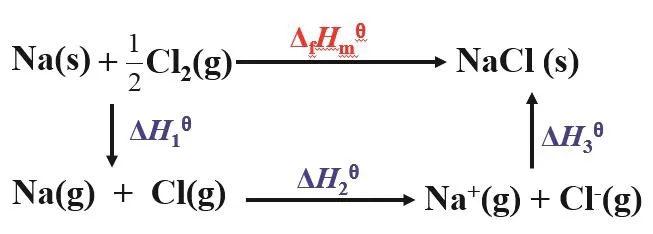
图1 反应(Na + 1/2Cl2 → NaCl)的玻恩-哈勃循环图
从图1可知,金属单质在干态下失电子过程比金属自由原子失电子过程要更复杂,影响因素更多,因此不能用同一标准来衡量金属单质和金属自由原子的失电子能力。这充分体现了矛盾的特殊性,金属元素的存在形式变了,影响失电子反应的因素就变了,金属性衡量标准要随之改变,这样才能得到正确结论。
2.2.2 金属单质在水溶液中的金属性衡量标准
金属单质在水溶液中失去电子之后生成水合金属离子Mn+(aq),M与Mn+之间形成一个双电层,这个双电层的平衡电势(φ)可用来衡量金属单质在水溶液中的金属性。为了使数据具有可比性,可选择标准电极电势(φϴ)来衡量。若电对的φϴ越小,表明金属单质的金属性越强;若电对的φϴ越大,表明金属单质的金属性越弱。查找出金属单质与其低价离子所形成电对的φϴ,按照φϴ从小到大顺序排列(表6)[5],从而可以得到金属单质在水溶液中的金属性强弱顺序。
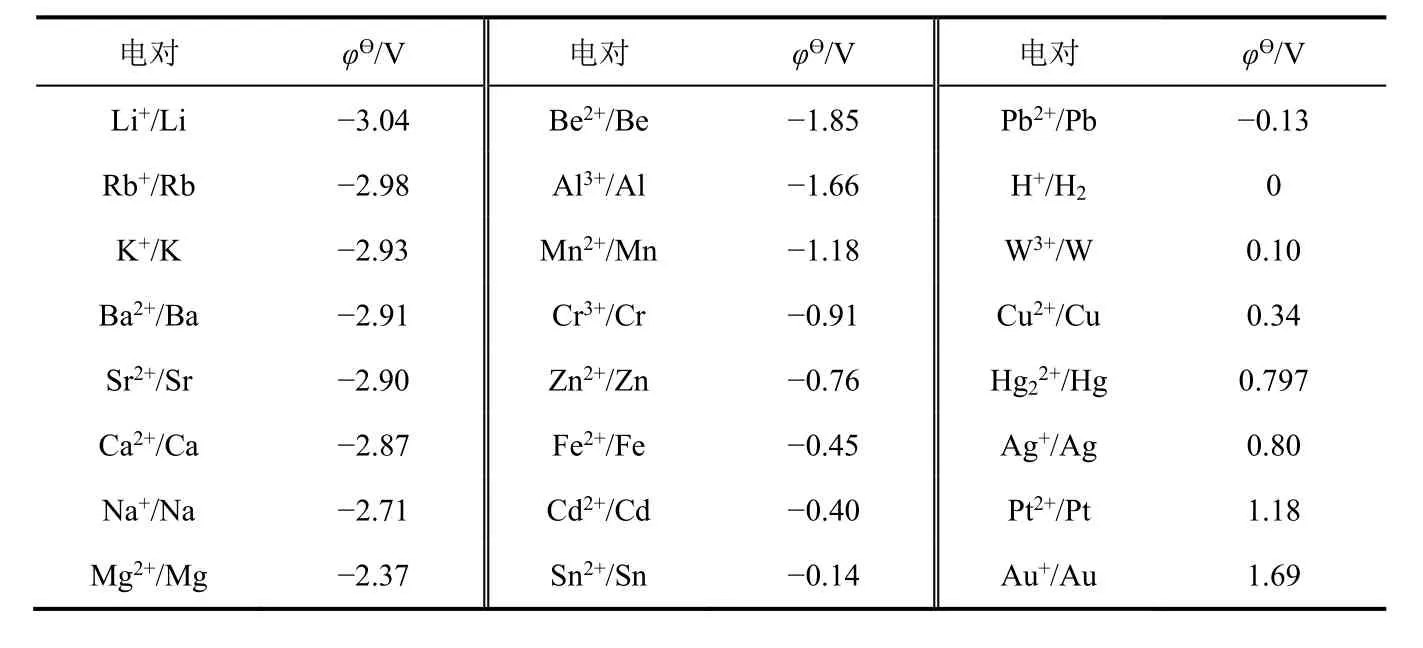
表6 Mn+/M的标准电极电势(φϴ)
从表6可得出以下结论:① 金属单质在水溶液中金属性强弱顺序为Li > Rb > K > Ba > Sr > Ca >Na > Mg > Be > Al > Mn > Cr > Zn > Fe > Cd > Sn > Pb > H2> W > Cu > Hg > Ag > Pt > Au;与中学教材上的金属活动顺序表相比较,这是扩展版的金属活动顺序表;② 金属单质在水溶液中的金属性与干态下的金属性不一致。
我们可利用电极反应的玻恩-哈勃循环来深入分析金属单质在水溶液中与其干态下的金属性不一致的原因。图2是IA金属单质的电极反应的玻恩-哈勃循环图[6],从图中可看出电极反应的影响因素较多,除了金属原子的电离能之外,还有金属单质的升华能、金属离子的水合能。比较图2和图1可得出,金属单质在水溶液中和其在干态下的失电子过程的影响因素不完全相同,因此不可能用同一标准来衡量金属单质在这两种不同反应条件下的失电子能力。这也再次体现了矛盾的特殊性,反应条件变了,影响因素也就变了,金属性衡量标准要随之改变。

图2 IA金属单质的电极反应(M(s) → M+(aq) + e-)的玻恩-哈勃循环图
查出图2中各影响因素的数据[6],计算出IA金属单质的电极反应(M(s) → M+(aq) + e-)的ΔHϴ总,列在表7中。从表7可看出,IA单质在水溶液中反应时,金属性强弱顺序为Li > K > Rb > Na,可见在水溶液中Li单质的金属性最强。究其原因,尽管Li的电离能和升华能最大,但Li+水合过程中放出的能量最大,导致其电极反应的ΔHϴ总小,因此Li单质在水溶液中反应时的金属性最强。
仔细比较发现,根据表7中电极反应的ΔHϴ总推导出金属性顺序为Li > K > Rb > Na,而根据表6中电极反应的φϴ推导出金属性Li > Rb > K > Na,可见,利用ΔHϴ总和φϴ推导出的金属性顺序不完全一致,这就需要进一步分析其原因。
表7 IA金属单质的电极反应(M(s)→M+(aq) + e-)的
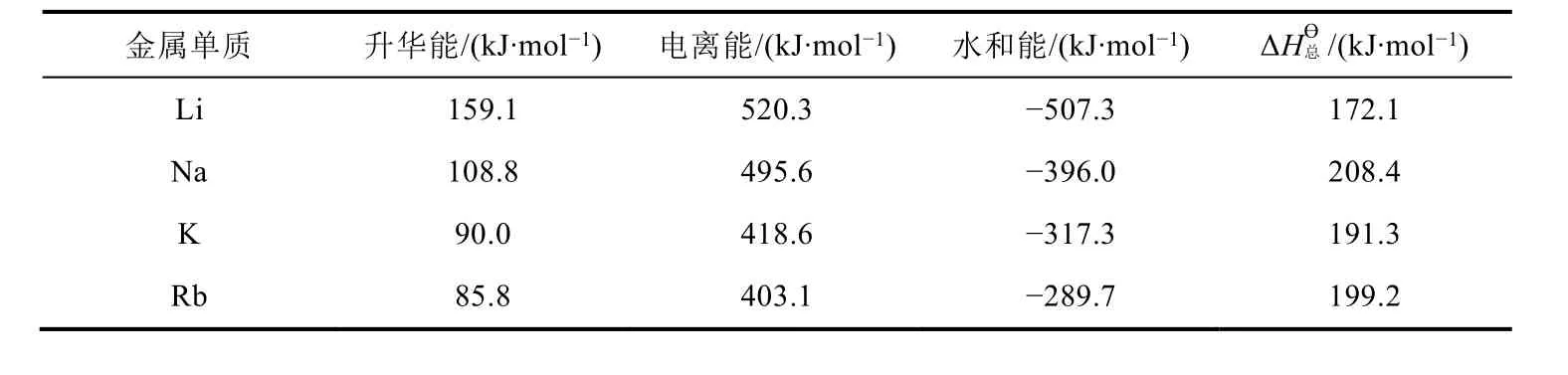
表7 IA金属单质的电极反应(M(s)→M+(aq) + e-)的
金属单质 升华能/(k J·m o l-1) 电离能/(k J·m o l-1) 水和能/(k J·m o l-1) Δ H总ϴ /(k J·m o l-1)L i 1 5 9.1 5 2 0.3 -5 0 7.3 1 7 2.1 N a 1 0 8.8 4 9 5.6 -3 9 6.0 2 0 8.4 K 9 0.0 4 1 8.6 -3 1 7.3 1 9 1.3 R b 8 5.8 4 0 3.1 -2 8 9.7 1 9 9.2
对于氧化还原反应而言,ΔrGmϴ= -nFEϴ= -nF(φ+ϴ-φ-ϴ) = (-nFφ+ϴ) - (-nFφ-ϴ), 而ΔrGmϴ= ΔGmϴ(正极) - ΔGmϴ(负极),推导出电极反应的ΔGmϴ与φϴ之间的计算式(ΔGmϴ= -nFφϴ),因此φϴ可以通过电极反应的ΔGmϴ计算而得。由于ΔGmϴ= ΔHmϴ-TΔSmϴ,绝大多数情况下ΔHmϴ是主要因素,ΔSmϴ是次要因素,因此利用ΔHmϴ和φϴ来推导出的结论基本一致。唯物辩证法原理认为,事物是发展变化的,主要因素和次要因素是互相影响、互相制约的,在一定条件下亦互易其位。对于K和Rb而言,利用ΔHmϴ和φϴ来推导出的结论相反,表明导致φϴ(Rb+/Rb) <φϴ(K+/K)的主要因素是ΔSmϴ,而ΔHmϴ成为次要因素。
根据前面的讨论,就可找出850 °C时反应Na + KCl → NaCl + K能进行的原因。首先分析该反应的条件,此反应属于金属单质在干态下的反应,不能用水溶液中的金属性衡量标准φϴ来判断,只能用ΔGmϴ来判断。其次分析该反应进行的温度是850 °C,显然温度是决定性因素。298 K时,ΔrHmϴ=ΔfHmϴ(NaCl) - ΔfHmϴ(KCl) = -411.2 - (-436.5) = 25.3 kJ·mol-1,属于吸热反应;298 K时反应物和产物都是固体,ΔSmϴ接近于0,因此ΔrGmϴ> 0,该反应298 K时不能进行。当温度升高到850 °C时,Na处于液态(Na的沸点为883 °C),K处于气态(K的沸点为759 °C),该反应ΔSmϴ>> 0;根据ΔrGmϴ= ΔHmϴ-TΔSmϴ,推导出850 °C时ΔrGmϴ< 0,从热力学上角度判断该反应能进行。
3 正确看待热力学结论和反应速率的关系
金属性的各个衡量标准(I,ΔfGmϴ、ΔfHmϴ和φϴ)都属于热力学物理量,反应速率属于动力学范畴。虽然热力学和动力学之间存在一定联系,但它们存在本质的不同,不能用热力学结论去探讨反应速率。热力学结论只表明失电子的趋势,不能决定反应快慢;反应速率需要研究与动力学相关的一些实际影响因素。当然,热力学认为不可能的反应,就无需做动力学研究了。
例如,根据φϴ(Li+/Li) <φϴ(K+/K) <φϴ(Na+/Na),从热力学上推断金属单质在水溶液中的金属性Li > K > Na,单质Li的金属性最强。实际的反应现象,K与水反应剧烈,产生的H2能燃烧;Na与水反应剧烈,反应放出的热使Na融化成小球。然而,Li与水反应比较平稳,不如K、Na剧烈,为什么?进一步研究发现,影响Li与水反应速率的因素有两个,其一是Li单质的熔点较高,产生的热量不足以使Li融化,固体Li与水的接触面积不大,导致反应不剧烈;其二是反应产物LiOH溶解度小,它覆盖在Li的表面,阻碍反应进行。当然,由于φϴ(Li+/Li)很小,从热力学角度表明Li单质的金属性最强,这个性质有着重要用途。我们可用Li做电池的负极,制备出高比能量的锂一次电池。已经商业化的Li/MnO2电池,其工作电压2.9 V,远高于Zn-MnO2电池工作电压(1.5 V);Li/SOCl2、Li/CFx电池的比能量高,可用于心脏起搏器、深空探测飞行器、军事武器等方面[7,8]。
4 结语
我们将唯物辩证法原理的一些观点和方法应用于金属性教学,成功化解了这个教学难点。影响金属性的因素较多,这就要求我们用辩证观点来剖析金属性,反对片面化、一刀切。然后,坚持具体情况具体分析原则,根据金属元素的存在形式和反应条件,采用不同的金属性衡量标准。当金属元素处于气态自由原子时,采用电离能(I)作为金属性的衡量标准。当金属单质在干态下与非金属单质反应时,采用产物的ΔfGmϴ和ΔfHmϴ作为金属性的衡量标准。当金属单质在水溶液中发生反应时,采用φϴ作为金属性的衡量标准。最后,还必须正确看待热力学结论和反应速率之间的关系。热力学物理量(I,ΔfHmϴ、ΔfGmϴ、φϴ)只能表明金属元素失电子趋势,不决定反应快慢;若要解释实际的反应速率,还需要结合动力学影响因素。若将唯物辩证法原理的观点和方法广泛应用于无机化学教学中遇到的各种矛盾问题,有助于厘清矛盾的本质,化解知识难点,提高教与学的效率,还可培养学生辩证的思维方式和解决复杂问题的能力。
