神奇的手性螺环催化剂
——第54届国际化学奥林匹克试题第8题解析
2023-01-10汤平平
汤平平
南开大学化学学院,天津 300071
手性是指物体与其镜像不能重叠的现象,如同人的左右手。构成生命体的基本物质如蛋白质、DNA、糖等都具有手性,所以能够识别客体手性分子的对映异构体,这是手性化合物对映异构体具有不同生理活性的根本原因[1]。
手性直接关系到药物的药理作用,由于药物和其受体之间的这种立体选择性作用,使得药物的一对对映体不论是在作用性质还是作用强度上都会有差别。在20世纪60年代,欧洲曾以消旋体的反应停(Thalidomide)作为抗妊娠反应的镇静剂,一些妊娠妇女服用此药后,出现多例畸变胎儿。后经研究证实(R)-构型才真正起镇静作用,而(S)-构型则有强致畸作用。因此,通过不对称合成的方法高效获得具有手性的化合物,对于医药、农药、精细化工等领域都有重要的意义[2]。
不对称催化方法(asymmetric catalysis),是通过使用手性催化剂来实现不对称合成反应的方法,一般指利用手性金属配合物作为手性模板控制反应物的对映面,将大量前手性底物选择性地转化成特定构型的产物,实现手性放大和手性增殖。简单地说,就是通过使用催化剂量级的手性原始物质来立体选择性地生产大量手性特征的产物。它的反应条件温和,立体选择性好,(R)-异构体或(S)-异构体同样易于生产,且潜手性底物来源广泛,对于生产大量手性化合物来讲是最经济和最实用的技术。2001年、2021年,诺贝尔化学奖两次授予给从事“不对称有机催化发展”相关科学家[3-5]。
1 出题依据
不对称催化是南开大学化学学科的重点研究领域之一,在周其林院士的带领下,该团队经过20年探索,发现了一类全新的手性螺环配体骨架结构[6]。在此基础上,发展了一系列手性螺环催化剂,这些手性螺环催化剂具有广谱性,在许多不对称催化反应中都表现出优于其他手性催化剂的催化活性和对映选择性[7]。比如在酮化合物的不对称氢化中,手性螺环铱催化剂的催化转化数达到了455万[8],是目前“最高效的手性分子催化剂”。周其林教授团队获得2019年度唯一国家自然科学奖一等奖,相关的研究成果发表在Science、Nat. Catal.、JACS、Angew. Chem.、Chem. Sci.、CCS Chem.等顶级期刊上,受到学界的广泛关注。
第54届国际化学奥林匹克试题中第8题中[9],我们以周其林院士发展的手性螺环催化剂Ir-SpiroPAP为主要内容,逐次展开,考查了手性螺环配体SpiroPAP的合成路线,手性螺环催化剂Ir-SpiroPAP的制备以及手性螺环催化剂在合成中的应用。
2 题目及解析
手性化合物对人类健康至关重要,例如,目前临床使用的药物有50%以上是手性分子的单一对映体。然而,合成富含对映体形式的手性分子仍是一个巨大的挑战。南开大学周其林教授团队开发了一系列高活性的手性螺旋催化剂,将不对称合成的效率提高到一个新的高度,在医药行业得到了广泛的应用。这些催化剂催化获得的手性化合物的ee可达99.9%,催化剂用量可降至0.00002 mol% (摩尔百分比)[8]。该系列研究成果获得2019年中国国家自然科学奖一等奖。图1示出一种基于过渡金属铱的手性螺环催化剂及其在酮的不对称催化氢化中的应用。
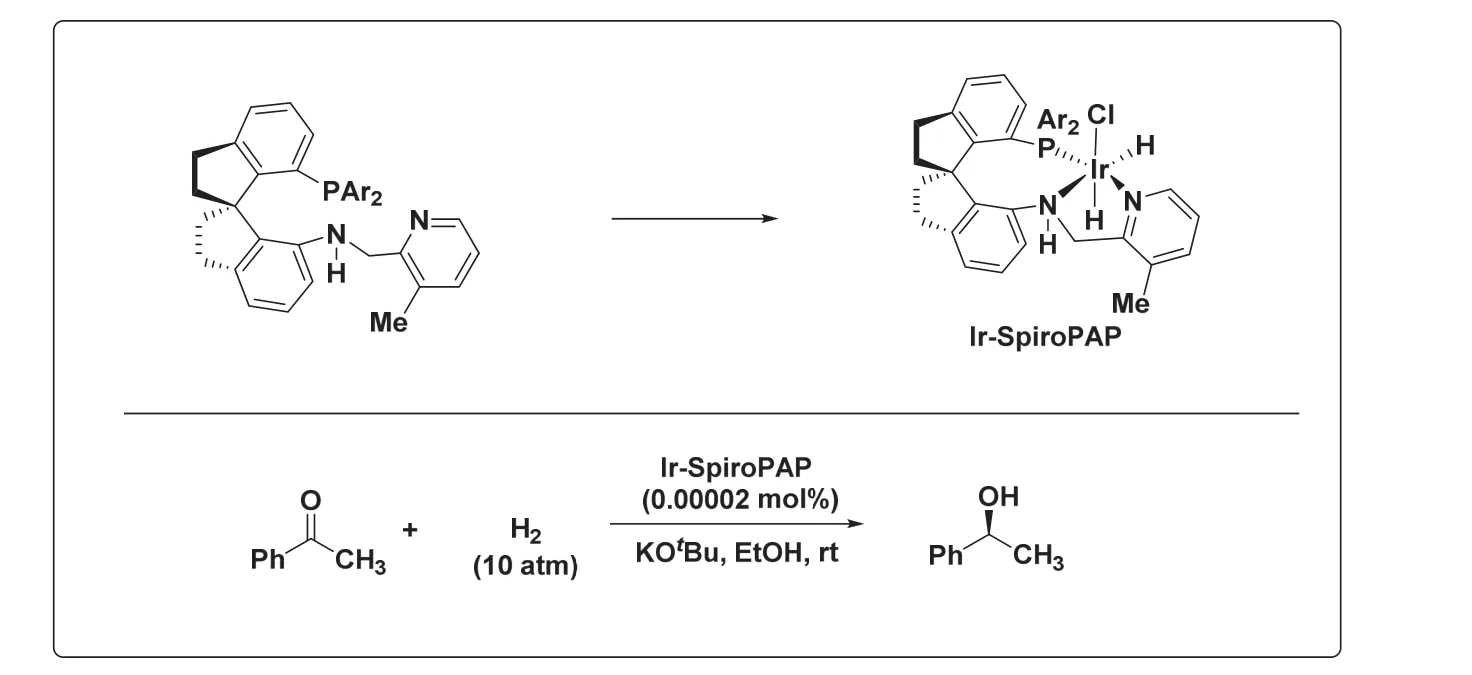
图1 手性螺环金属铱催化剂及其在酮的不对称催化氢化中的应用(Ar = 3,5-(tBu)2C6H3)
2.1 手性配体SpiroPAP的合成
2.1.1 题目
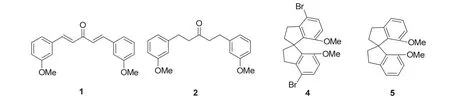
手性配体SpiroPAP的合成路线如图2所示[10]。

图2 手性螺环配体SpiroPAP (+)-9的合成
8-1 (16分) 请画出化合物1,2,4,5的结构式(不考虑立体化学构型)。
8-2 (2分) 在下列试剂中,哪种试剂A不能用于化合物8到9的转化?
(a) NaBH(OAc)3;(b) NaBH3CN;(c) NH2NH2, NaOH;(d) NaBH4
外消旋螺环化合物6与(-)-氯甲酸薄荷酯(10)反应生成柱层析可分离的化合物11a和11b,再经肼解得到光学纯的(+)-6和(-)-6,如图3所示。

图3 外消旋螺环化合物6的动力学拆分
8-3 (2分) 以下说法正确的是。
(a) 化合物11a和11b是一对对映异构体
(b) 化合物11a和11b是一对非对映异构体
(c) 化合物11a和11b是一对顺反异构体
(d) 化合物11a和11b是一对构象异构体
2.1.2 答案与解析
这一部分主要涉及手性螺环配体SpiroPAP的合成路线。本题为经典的有机化学推断题,根据反应条件推测合成过程中缺失结构或者填写所需条件。而该类型的题目我们在有机的预备题第13题中也有体现。本题给出的合成路线中,从间甲氧基苯甲醛出发,在碱性条件NaOH下,与0.5当量的丙酮发生羟醛缩合反应,由于分子式已经给出,因此可以很方便地判断出得到了不饱和酮化合物1,接着在Raney Ni的催化下利用H2将不饱和双键氢化,生成化合物2,再在Br2和吡啶的条件下在芳环上引入两个Br原子,得到化合物3。从3的结构逆推也能验证1和2的结构。化合物3在TiCl4的条件下发生傅氏酰基化反应,生成螺环化合物4,紧接着在nBuLi的条件下发生锂溴交换,随后在EtOH的条件下水解得到化合物5,再在BBr3的条件下脱除甲基得到消旋的螺环配体(±)-6。
8-1小题的答案为:
经过一系列转化得到化合物8,随后考察了一个还原胺化的条件A,得到化合物9,从8-2的选项中我们不难发现a、b、d都可以实现还原胺化反应,因此8-2的答案为c。
其中,光学纯的手性螺环配体6,需要通过对消旋的螺环配体(±)-6进行拆分才能得到。通过与手性化合物10反应,得到一对非对映异构体11a和11b (8-3的答案为b),通过柱层析纯化分离后再肼解得到光学纯的手性螺环配体(+)-6和(-)-6。这里主要考查学生对非对映异构体概念的理解。
2.2 手性配体和Ir-SpiroPAP的制备、性质和应用
2.2.1 题目
用SpiroPAP与[Ir(cod)Cl]2(cod为环己烷-1,5-二烯)在甲醇中与氢气反应制备Ir-SpiroPAP,如图4所示。

图4 催化剂Ir-SpiroPAP的制备(Ar = 3,5-(tBu)2C6H3)
8-4 (2分) 请写出催化剂Ir-SpiroPAP中Ir的氧化态。
8-5 (2分) 请写出催化剂Ir-SpiroPAP中Ir的d轨道价电子数。
在二萜类化合物Mulinane (22)全合成中,采用手性螺旋催化剂Ir-SpiroPAP催化的不对称反应,如图5所示[11]。

图5 手性螺环催化剂Ir-SpiroPAP在二萜类化合物Mulinane (22)全合成中的应用(Ar = 3,5-(tBu)2C6H3)
8-6 (8分) 请画出化合物15和16的结构式,包括其立体构型。
8-7 (2分) 从以下试剂中,选择出最佳条件B。
(a) MeLi/CeCl3;(b) MeLi/CuI;(c) MePh3P+I-,nBuLi;(d) Me3S+I-, NaH
8-8 (2分) 从以下试剂中,选择出最佳条件C。
(a) MeLi/CeCl3;(b) MeLi/CuI;(c) MePh3P+I-,nBuLi;(d) Me3S+I-, NaH
2.2.2 答案与解析
这一部分主要涉及手性螺环催化剂Ir-SpiroPAP的制备、性质与应用。首先考查学生对于络合物中Ir金属的氧化态和外层d轨道价电子的认知。从Ir-SpiroPAP结构中我们不难发现,Ir与六个配位原子结合,其中三个是电中性的,分别是两个N原子和一个P原子,而另外的三个分别是Cl-离子和两个H-离子,因此Ir的氧化态为+3,考虑到基态Ir原子的价层电子组态为5d76s2,失去3个电子后,Ir3+外层d轨道价电子为6。
8-4小题的答案为:+3;8-5小题的答案为:6。
随后是考查手性螺环催化剂Ir-SpiroPAP在Mulinane型二萜天然产物全合成中的应用。本题仍为经典的有机化学推断题,根据反应条件推测合成过程中缺失结构或者填写所需条件。依据所给出的合成路线,从化合物12出发,在手性螺环催化剂Ir-SpiroPAP的不对称催化氢化下,可以以高产率、高ee值一步构建三个连续手性中心,得到化合物13,随后在PCC (氯铬酸吡啶,Pyridinium Chlorochromate)的条件下将羟基氧化成羰基,获得化合物14,紧接着在碱性条件下,化合物14与烷基碘代物发生烷基化反应,得到化合物15。这里需要注意的是新生成的手性中心的判断,因为分子中异丙基是朝面上的,由于面下空间位阻较小,生成的烯醇负离子面下进攻烷基碘代物,因此引入的烷基是朝面下的结构,该手性中心也可以从后面的结构17中得到验证。在MsOH的作用下,化合物15发生分子内傅氏酰基化成环,并消除得到化合物16,随后在Pd/C氢化的条件下将双键还原,得到化合物17。接下来在Na和NH3的条件下将苯环进行还原,生成化合物18,接下来是发生甲基对不饱和酮的1,4-加成,这里考查的是甲基对不饱和酮发生1,4-加成的最佳条件。从8-7的选项中我们不难判断在CuI/MeLi存在下,甲基对不饱和酮发生1,4-加成得到正确的产物19。化合物20发生甲基对不饱和酮的1,2-加成,生成化合物21。这里考查的是甲基对不饱和酮发生1,2-加成的最佳条件。从8-8的选项中我们不难判断在CeCl3/MeLi存在下,甲基对不饱和酮发生1,2-加成得到正确的产物21。最后经过多步反应得到化合物22。
8-6小题的答案为:

8-7小题的答案为b;8-8小题的答案为a。
Mulinane型二萜是1990年Rodriguez等从智利北部一种当地人用于治疗糖尿病、支气管炎、肠胃不适等疾病的传统民间药物伞形灌木Mulinium crassifolium中首次分离得到的。迄今为止,已分离得到的该家族成员达到30多个,生物活性测定表明其具有肠胃保护、抗疟原虫和抗菌等活性。2017年,南开大学周其林团队利用所发展的手性螺环铱催化剂Ir-SpiroPAP催化的不对称催化氢化反应(关键步骤),完成了7个Mulinane型二萜和2个类似物的不对称全合成[11]。
3 结语
周期林院士团队发展的手性螺环催化剂在许多不对称催化反应中都表现出优异的催化效率和对映选择性,成为为数不多的一类“优势手性骨架”。手性螺环催化剂已经被国际同行成功应用于150余种有机合成反应中。国际知名制药公司,如罗氏制药和九州制药等已经将手性螺环催化剂用于Aleglitazar和Rivastigmine等手性药物的生产。国际著名试剂公司Aldrich、Strem、J&K等已将这些手性螺环配体和催化剂进行商品化生产和销售。
本题结合南开大学周其林院士团队在手性螺环催化剂的前沿研究,考查了手性螺环配体SpiroPAP的合成路线,手性螺环催化剂Ir-SpiroPAP的制备及其在合成中的应用。主要涉及的知识点包括羟醛缩合、双键氢化、傅氏酰基化、醚的脱保护、还原胺化反应、烷基化反应、不饱和酮的1,2-加成,1,4-加成反应,以及金属络合物中Ir金属的氧化态和外层d轨道价电子的判断等。该题所涉及到的大部分知识点,都包含在预备题联烯以及天然产物全合成的题目中。
