氮氧化物间的相互转化
——第54届国际化学奥林匹克试题第5题解析
2023-01-10李悦张明涛阮文娟张新星孙宏伟郭东升
李悦,张明涛,阮文娟,张新星,孙宏伟,郭东升
南开大学化学学院,天津 300071
氮氧化物是一大类由氮和氧两种元素组成的化合物。常见的氮氧化物包括一氧化二氮(N2O)、一氧化氮(NO)、二氧化氮(NO2)、三氧化二氮(N2O3)、四氧化二氮(N2O4)以及五氧化二氮(N2O5)等,其中以NO和NO2在大气中的浓度最高。氮氧化物不仅本身具有毒性,可导致支气管炎、肺气肿、组织缺氧以及中枢神经损害等一系列疾病,而且还可以引发包括臭氧层破坏、酸雨、光化学烟雾和温室效应在内的一系列次生环境问题。氮氧化物与空气中的O2、H2O等作用,可以发生复杂的相互转化过程。由于不同氮氧化物的毒性以及环境行为不同,考察氮氧化物间的相互转化对于大气污染的防控与治理具有十分重要的意义。
多相催化反应是指反应物与催化剂在两相界面上进行的反应。考虑到催化剂的回收利用,一般所使用的催化剂为固相,反应原料以气态或液态的形式加入。许多工业化学反应都是在固体催化剂存在下进行的,比如Fe催化剂催化合成氨、SiO2-Al2O3催化裂化石油等。
气-固相催化反应一般包括五个步骤:(1) 反应物分子从体相扩散到固体催化剂表面;(2) 反应物分子在固体催化剂表面发生化学吸附;(3) 被吸附的分子在固体催化剂表面发生化学反应;(4) 产物分子从催化剂表面脱附;(5) 产物分子扩散到体相当中。如果在整个过程当中,第(3)步速率最慢,则总反应是由表面反应控制,或称反应在动力学区进行。对于催化剂表面及催化反应机理的研究一直是这一领域的关键问题。2007年诺贝尔化学奖授予了德国埃特尔(Gerhard Ertl)教授,以表彰他对固体表面化学研究的贡献。
1 出题依据
工业尾气是氮氧化物污染的主要来源之一。根据第二次全国污染源普查结果,2017年我国工业源氮氧化物排放量为645.90万吨,占氮氧化物总排放量的36.2%[1,2]。因此,加强工业废气治理,降低其中氮氧化物的含量,是控制氮氧化物污染的必要途径。由于NO2相对于NO更加活泼,目前普遍采用的一种烟气脱硝工艺就是将初始生成的NO氧化为NO2再用吸附剂吸附生成的NO2。为加速NO氧化为NO2的速率,包括Pt/Al2O3[3]、Au@TiO2[4]、Cr@石墨炔[5]和MnO2@CeO2[6]在内的一系列固体催化剂被开发出来。为了明确反应机理,研究者们也对催化剂表面的动力学模型进行了详细研究,发现不同催化剂表面的具体反应机理有所不同[7,8]。
第54届国际化学奥林匹克试题第5题中,我们以NO氧化生成NO2的反应为主要内容,分别考查该反应在气相和固体催化剂表面进行时的热力学和动力学特征,揭示了物理化学以及表面催化在环境治理中的应用。
2 题目及解析
2.1 题目[9]
氮氧化物(包括N2O、NO、NO2、N2O4等等,通常写做NOx)是空气中主要的污染物之一,可导致诸如臭氧层破坏、酸雨、光化学烟雾和温室效应等一系列问题。因此,为提高空气质量,NOx的排放与转化需要加以控制。在这里,我们研究NO氧化为NO2的反应2NO + O2→ 2NO2。
A部分
一般认为该反应在大气中通过以下机理进行:

反应(1)、(2)都是基元反应。反应(1)是一个预平衡反应,其浓度平衡常数记为Kc1。反应(2)是整个反应的速率决定步骤,其速率常数为k2。
5-1 (4分) 推导总反应2NO + O2→ 2NO2速率方程的表达式,要求表示为关于[NO]、[O2]、Kc1和k2的函数。
Kc1的温度依赖关系式可以近似描述为lnKc1=M- (N/T) (M和N是常数)。k2随温度的关系服从阿仑尼乌斯方程(Arrhenius equation),指前因子为A2,表观活化能为Ea,2。假定Ea,2和A2均与温度无关。
5-2(4分) 推导总反应2NO + O2→ 2NO2的指前因子(A+)和表观活化能(Ea+)的表达式,要求表示为M、N、A2和Ea,2的函数。
总反应的表观速率常数(k+)在600 K时为6.63 × 105L2·mol-2·min-1,其表观活化能为1.20 kJ·mol-1。
5-3 (2分) 计算总反应在700 K时的速率常数(单位:L2·mol-2·min-1)。
一些物质在298.15 K时的标准生成焓(ΔfHϴm)和标准熵(Sϴm)列表如下:

NO(g) O2(g) NO2(g)ΔfHϴm/(kJ·mol-1) 91.3 33.1 Sϴm/(J·K-1·mol-1) 210.8 205.2 240.1
反应2NO + O2→ 2NO2的标准摩尔反应焓和熵变可视为与温度无关。在接下来的问题中,所有气体均可视为理想气体。
5-4 (4分) 计算总反应在600 K时的热力学平衡常数(Kϴp)。
5-5 (3分) 计算总反应在600 K时的标准内能变化ΔrUϴm(单位:kJ·mol-1)。
实验结果表明,反应2NO2→ 2NO + O2的速率与NO和O2的浓度无关。
5-6 (8分) 推导该反应的速率方程式(表观速率常数直接用k-表示),并计算600 K时k-的值。(如果在5-4小题中未能求得Kϴp(600 K),本题中可以使用Kϴp(600 K) = 350.0处理)
600 K,将NO2充入一个体积固定的容器中,并使其达化学平衡,此时有20%的反应物分解为NO和O2。所有气体均可视为理想气体。
5-7 (4分) 计算反应体系达平衡时的总压。(如在5-4小题中未能求得Kϴp(600 K),本题中可以使用Kϴp(600 K) = 350.0)
B部分
工业废气是氮氧化物(NOx)的主要来源。减少NOx排放的方法之一是先将NO氧化为NO2,然后用吸收剂吸收生成的NO2。然而,由于废气中NO的浓度很低,其在大气中自发氧化的速率太慢而无法满足工业需求。通常,固体催化剂被用来加速这一反应。NO的氧化过程在某一类型催化剂(CatX)的表面通过如下机理进行(吸附位点表示为Site):
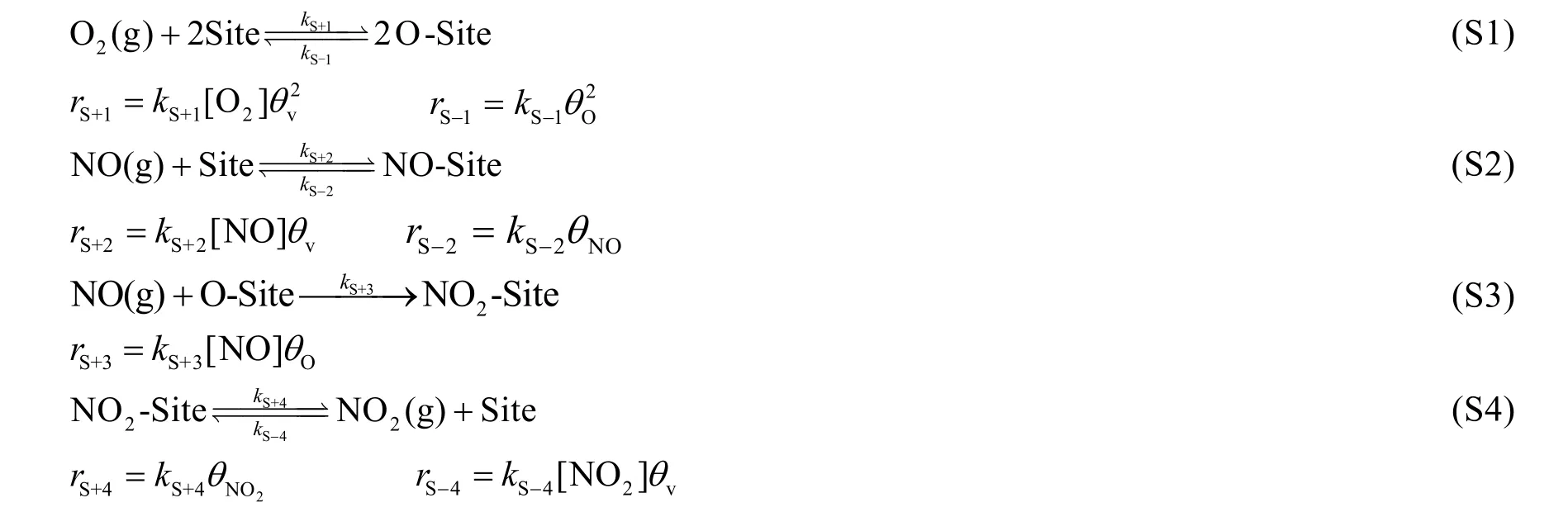
假设NO,NO2和O (来自O2的解离)都是单分子层吸附,并且这些物质被相同类型的表面位点吸附。它们的分数覆盖率(θ,定义为被占据的吸附位点数与总吸附位点数之比)分别表示为θNO,θNO2和θO。所以,对于未被占据的吸附位点的分数(θv),有θv= 1 - θNO- θNO2- θO。假定所有吸附、解吸附过程的速率都远远大于反应(S3)的速率。
5-8 (6分) 推导θv的表达式,要求表示为关于物种浓度[NO],[O2],[NO2]以及反应(S1)-(S4)中速率常数的函数。
5-9 (4分) 选择2NO(g) + O2(g) → 2NO2(g)在反应开始时速率的正确表达式。假定NO2的浓度及吸附均可以忽略。


对于某些催化剂,表面反应过程并不经过步骤(S3),而是通过如下方式而进行:

该步骤也是整个反应的速率决定步骤。
催化剂(CatY)被用来加快反应2NO + O2→ 2NO2的速率。当温度和NO浓度恒定时,初始反应速率与O2浓度的关系如下图所示:
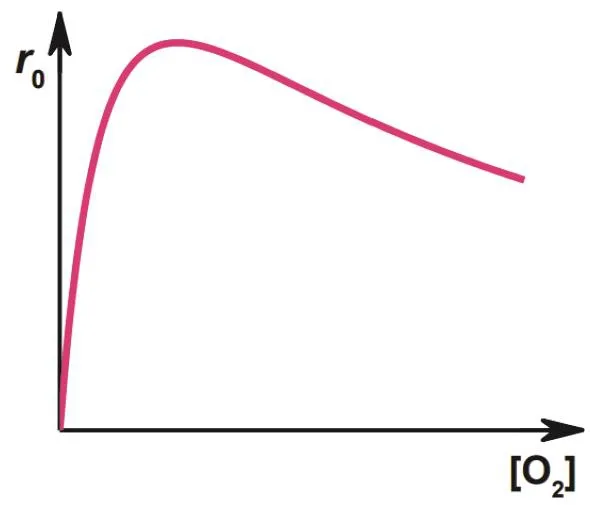
5-10 (6分) 选择符合此曲线变化关系的机理。
(A) S3;(B) S5;(C) 无法确定
2.2 答案与解析
A部分主要涉及气相反应的热力学和动力学。为经典的物理化学计算以及推导题,该类型的题目我们在物理化学的预备题中也有体现。


将其代入反应(2)的速率方程,即可得到总反应2NO + O2→ 2NO2的速率方程:
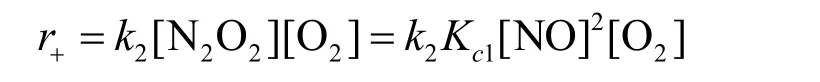
此表达式即5-1的答案。


将该式和阿仑尼乌斯方程进行比较,即可给出5-2的答案:A+= A2exp{M},Ea+= Ea,2+ NR。
该题接着考查阿仑尼乌斯方程的相关计算,该计算与预备题中第26题26-1小题中涉及的知识点相同。根据阿仑尼乌斯方程,可推导反应在两个不同温度下进行的速率常数比值关系为:
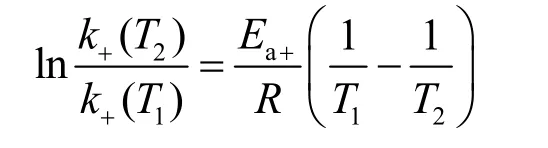
代入题目中给出的总反应在600 K的速率常数k+以及活化能Ea+的数值,即可给出5-3的答案:k+(700 K) = 6.86 × 105L2·mol-2·min-1。
该题随后考查通过热力学方法计算平衡常数。该计算与预备题中第24题24-1小题涉及的知识点相同。根据题目中所给出的各参与反应物质在298 K的ΔfHϴm和Sϴm数据,可计算出该反应在298 K的标准摩尔反应焓变和熵变。因为题目中注明标准摩尔反应焓变和熵变可视为与温度无关,因此所得结果即为题目所考查的600 K的值:



该题接着考查反应的恒容热和恒压热之间的关系,两者相差ΣυRT,其中Συ为气相参与反应物质的化学计量系数之和(对产物取正值,对反应物取负值):

此即5-5的答案。
该题随后考查速率常数和平衡常数间的关系。当反应进行到平衡时,各参与反应物质的浓度满足:

在平衡时,正逆反应速率相等,并进一步代入正反应速率方程以及浓度平衡常数的表达式,可得:

代入数值,解得p0= 53.5 kPa。由此可得5.7的答案为
B部分主要涉及NO的表面催化反应。首先考查有关固体表面吸附的知识点。根据题目所给条件,所有吸附、解吸附过程的速率都远远大于反应(S3)的速率。因此可采用平衡态近似法进行处理。反应过程中,各参与反应物质吸附和解吸速率近似相等。代入各吸附、解吸过程的速率方程,即可得到各物种分数覆盖率与θv之间的比值关系:

结合归一化条件θv+ θO+ θNO+ θNO2= 1,即可得到5-8的答案:
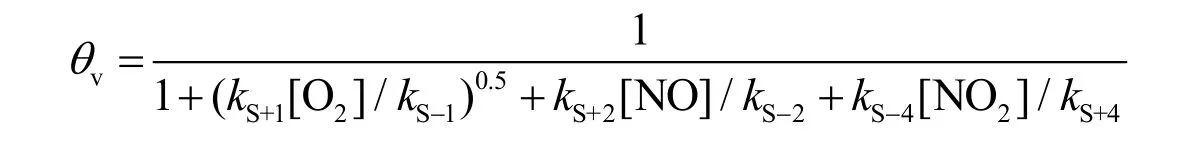
该题随后考查多相催化反应速率方程的推导。因为反应(S3)是速率决定步骤,因此只需要考虑该反应以及之前的步骤反应(S1)和反应(S2)。根据计量方程,反应(S3)生成1当量NO2-Site,而总反应生成2当量NO2,因此:

根据5-8所得出的θv表达式以及θO和θv的比值关系,可得θO的表达式(因为所考查的是初始反应速率,因此[NO2]近似为0):
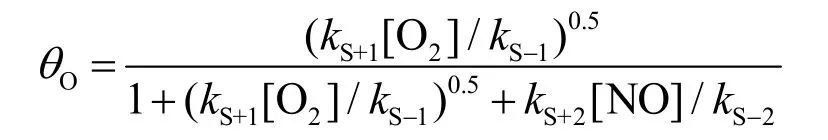
将该式代入rS+的表达式,即可得到:

因此5-9的答案为(B)选项。
该题最后考查不同催化机理的动力学特征。根据题目中所给初始反应速率随[O2]变化曲线,其突出特点为在高O2浓度区间,反应速率随O2浓度的升高反而下降。
如果按照S3机理进行,rS+= 0.5kS+3[NO]θO,反应速率由NO的浓度和O原子在催化剂表面的吸附量共同决定。在题目所给条件下,NO浓度不变,O原子的吸附量随O2浓度单调上升,因此不会出现反应速率随O2浓度的升高而下降的现象。在高O2浓度区间,由于O原子接近饱和吸附,反应速率应趋于平缓,但不会出现下降趋势。
如果按照S5机理进行,rS+= 0.5kS+5θNOθO,反应速率由NO和O原子在催化剂表面的吸附量共同决定。在高O2浓度区间,O原子接近饱和吸附,其吸附量随O2浓度变化并不明显;由于NO和O原子占据相同的吸附位点,两者形成竞争吸附,O2浓度的升高会造成NO吸附量的下降,由此造成反应速率随O2浓度的升高而下降的现象。
因此5-10的答案为(B)选项。
3 结语
本题结合NO氧化催化剂的前沿研究,考查了该反应分别在气相和催化剂表面进行的热力学和动力学特征。主要涉及的知识点包括化学热力学、化学动力学、化学平衡、固体表面吸附、多相催化等,该题所涉及的大部分知识点都包含在预备题物化部分的题目中。本题揭示了物理化学知识在环境监测与治理方面的实际应用。
