硫:古老元素的新征程
——第54届国际化学奥林匹克试题第4题解析
2023-01-10李姝邱晓航王颖霞程方益
李姝,邱晓航,王颖霞,程方益
1南开大学材料科学与工程学院,天津 300350
2南开大学化学学院,天津 300071
3北京大学化学与分子工程学院,北京 100871
便携式二次电池已经对我们的生活产生了深远的影响。然而,由于化石能源引发的环境污染和能源危机等问题,对储能技术提出更高的要求。锂硫电池是以金属锂为负极,单质硫为正极活性物质的一种储能设备。得益于其多电子转移特性,单质硫S8作为正极材料,其理论比容量高达1675 mAh·g-1。同时,硫在地壳中储量丰富,具有明显的成本优势。因此,锂硫电池被认为是未来储能领域中最具应用前景的一类设备[1-3]。
锂硫电池通过反应S8+ 16Li → 8Li2S来实现化学能与电能间的相互转化。在放电过程中,硫并非被直接还原为Li2S,而是经历了一个极为复杂的多步反应过程,涉及S8分子的开环、各种多硫化物的生成,以及难溶化合物Li2S2和Li2S的转化等。放电过程中产生的多硫化物可溶解在电池电解液中,并随电解液扩散到负极。在负极表面,多硫化物与金属锂直接发生氧化还原反应,造成电池的自放电现象,导致电极活性物质的损失和电池容量的衰减。这种现象被称为“穿梭效应”,该效应是锂硫电池商品化过程中最为严重的一个技术难题[4]。
1 出题依据
探究电解液中多硫化物的存在形式,对于有效抑制“穿梭效应”,设计硫宿主材料和电池隔膜具有重要的意义。Li2S6被认为是锂硫电池高电压平台中最具代表性的放电中间产物,而1,2-二甲氧基乙烷(DME)对多硫化物具有良好的稳定性,是锂硫电池研究中常用的醚类电解液。南开大学言天英教授课题组和高学平教授课题组通过从头算方法和UV-Vis光谱研究了Li2S6在DME中的存在状态[5]。研究表明,Li2S6在DME中主要是以分子的形式存在,而以及的浓度非常少,这为设计有合适孔径及结构的电池隔膜提供了理论指导。
此外,锂硫电池的工作电压会随电解液的不同发生变化[6]。由于硫在正极的反应为准固相反应,其电极电势受电解液的影响较小,而金属锂的电极电势与电解液的选取密切相关。南开大学言天英教授课题组和高学平教授课题组使用从头算方法研究了Li+/Li电对在不同有机溶剂中的标准电极电势[7]。通过调节溶剂降低金属锂的电极电势,提升了锂硫电池的工作电压,从而提高电池的能量密度。
第54届国际化学奥林匹克试题第4题[8],从工业生产单质硫开始,首先引导学生了解通过返滴定碘量法对生产条件进行监测,然后引出单质硫在锂硫电池中的应用,以上述两项研究为依据,将硫的前沿应用和化学基础相结合,设计考题。通过电极反应方程式的书写及活性物质质量比的计算,使学生了解锂硫电池的基本化学原理;通过对理想锂硫电池工作时长的计算,向学生展示了锂硫电池迷人的应用前景。针对锂硫电池中的关键技术难题——“穿梭效应”,通过书写多硫化物与金属锂的反应方程式,让学生了解“穿梭效应”的本质,认识具有氧化性的多硫化物与具有还原性的金属锂在电极处直接发生氧化还原反应对电池性能的影响。进一步,根据上述研究的数据,让学生们计算并确定Li2S6在DME中的主要存在形式,通过设计合理的热力学循环求取Li+/Li电对在有机溶剂中的标准电极电势。最后,考查学生根据多硫化物在二甲基亚砜(DMSO)中的浓度比,应用物料及电荷守恒反推初始投料质量的能力。
2 题目及解析
2.1 题目
硫自远古时代就被人们所知晓并使用。如今,硫作为一种廉价的化工原料仍被广泛用于化工和医药生产。
黄铁矿(FeS2)是工业生产单质硫的一种常用原料。在控制空气通量的条件下加热黄铁矿,单质硫的理论产量可达100%,同时生成黑色磁性氧化物(Fe3O4)。
4-1 (2分) 写出上述转化的反应方程式并配平。
在实际生产过程中,除单质硫外,还会有少量SO2副产物产生。通过测量SO2的量,可对生产条件进行监测[9]。具体方案如下:将粉碎后的矿石粉末放入管式控温炉中加热,产生的SO2用2 mol·L-1NaOH溶液吸收。反应结束后,将吸收液转移至500 mL容量瓶中,并用蒸馏水稀释至刻度。准确移取25.00 mL定容后的溶液至碘量瓶中,加入50.00 mL 0.05122 mol·L-1I2标准溶液和5 mL 20% H2SO4溶液。在暗处放置5 min,用0.1012 mol·L-1Na2S2O3标准溶液滴定。当瓶中溶液为浅棕色时,加入3 mL 0.5%淀粉指示剂,然后继续滴定至蓝色消失。
4-2 (4分) 写出上述过程中涉及I2的反应方程式并配平。
4-3 (4分) 若该测试实验所用反应物为黄铁矿,反应后收集到17.6 g单质硫。采用上述过程分析气体副产物,消耗Na2S2O3标准溶液18.47 mL。请计算黄铁矿中硫元素的损失率(假设没有其他含硫物质生成)。
锂硫电池是一类引人注目的储能设备,其理论能量密度高于传统的锂离子电池。锂硫电池的总反应方程式为:16Li + S8→ 8Li2S。在充电过程中,单质硫为正极活性物质,金属锂为负极活性物质。
4-4 (3分) 写出充电过程中正极(a)和负极(b)发生的电极反应方程式并配平。
4-5 (1分) 根据电池总反应,计算正、负极活性物质的质量比。
一个工作电压为3.8 V,可用容量为3110 mAh的锂离子电池在充满电后,可供手机不间断播放视频22小时。
4-6 (5分) 若该锂离子电池被平均工作电压为4.2 V的理想锂硫电池组替代。假设锂硫电池组放电过程完全按电池总反应的化学计量比进行,有23 g正极活性物质硫参与反应。那么,锂硫电池组在充满电后,可为手机不间断播放视频几小时?
单质硫常以S8分子的形式存在。在锂硫电池的实际放电过程中,S8分子并非直接被还原成Li2S,而是经过多步反应,生成多种多硫化锂(Li2Sn,n = 3-8)。这些多硫化锂会扩散到负极,并腐蚀负极,造成电极活性物质的损失,这一现象被称为“穿梭效应”。
4-7 (2分) 写出可溶性多硫化锂腐蚀负极生成Li2S的反应方程式并配平。
为了抑制“穿梭效应”,关于多硫化物在电解液中存在形式的研究备受关注。Li2S6就是其中一种最具代表性的中间产物:
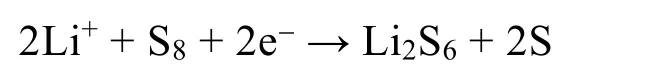
研究显示,在锂硫电池的常用电解液1,2-二甲氧基乙烷(DME)中,存在两种能量相近的异构体,Li2S6(I)和Li2S6(II)。Li2S6在DME中的解离如图4.1所示,所涉反应的Gibbs自由能变见表4.1。

表4.1 298.15 K,1 bar时,DME中不同解离反应的吉布斯自由能(kJ·mol-1)

图4.1 Li2S6、、和在DME中的解离平衡

4-9 (5分) 计算DME (298.15 K,1 bar)中反应的表观平衡常数。
4-11 (6分) 298.15 K,1 bar时,金属锂在水中的标准电极电势为:Eϴ(Li+/Li) = -3.040 V。利用表4.2的数据,请计算金属锂电极在DME中的标准电极电势。

表4.2 气体Li+(g)溶解在不同溶剂中生成Li+(sol)的标准吉布斯自由能变
研究表明,用二甲亚砜(DMSO)代替DME可以提高锂硫电池的电动势。因此,DMSO中多硫化物的形态也引起了研究者的关注。
在一项实验中,将一定量的Li2S和4.81 mg的硫粉加入10.00 mL DMSO中,加热搅拌至完全溶解(忽略体积的变化)。假设DMSO中只存在以下多硫化物:,且它们的平衡浓度之比为:
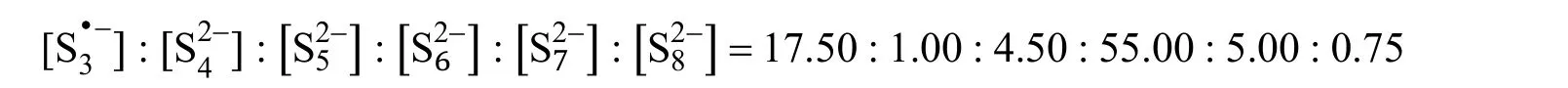
4-12 (5分) 请计算Li2S的初始投料质量m(单位:mg)。
2.2 答案与解析
4-1 介绍了一种由黄铁矿制备单质硫的方法。由题干可知,黄铁矿中所有的硫元素都转化为单质硫,铁元素转化为Fe3O4,故答案为:

4-2 引导学生如何通过返滴定碘量法对反应条件进行监测,考查碘量法的基本原理。碘量法应在近中性介质中进行。若碱性太强,I2会歧化:3I2+ 6OH-→ IO-3+ 5I-+ 3H2O,而酸性太强,Na2S2O3易发生分解:+ 2H+→ SO2↑+ S + H2O。故在书写方程式时,不应该写成HSO-3或H2SO3的形式。答案为:
4-3 I2总的物质的量:0.05122 mol·L-1× 50.00 mL = 2.561 mmol
由4-2的反应方程式可知,被Na2S2O3滴定的I2的物质的量:

与SO2反应的I2的物质的量等于SO2的物质的量。因此,在制备单质硫的过程中,产生的SO2的质量:(2.561 - 0.9346) × 10-3× 20 × 32.06 = 1.043 g。需要注意的是,SO2的吸收液被定容至500.00 mL。在定量分析时,只移取了25.00 mL进行滴定,故计算时需乘以20。

4-4 介绍了锂硫电池的基本化学原理。在电池放电过程中,负极发生氧化反应,正极发生还原反应。单质硫在正极得到电子后,会与电解液中的Li+生成不溶的Li2S,而非以S2-的形式存在,因此正极的最终产物不能写成S2-。
(a) 正极:S8+ 16Li++ 16e-→ 8Li2S 或 S + 2Li++ 2e-→ Li2S
(b) 负极:Li → Li++ e-或 16Li → 16Li++ 16e-

4-6 电池的容量是衡量其性能的重要参数之一。由容量的单位可知,容量即电池储存的总电量,换算成国际单位(库伦)为:
3110 mAh × 10-3× 3600 s·h-1= 11196 C

由于每个硫原子可接受两个电子,因而含23 g单质硫的理想锂硫电池组按电池总反应的化学计量比完全放电时,共转移电量:


4-7 本题旨在引导学生了解“穿梭效应”的本质。过氧链“-O-O-”的氧化性是最基础的元素知识,比如CaO2、BaO2都是常见的氧化剂。同样,过硫链“-S-S-”也具有氧化性,只是氧化能力弱于过氧链。在锂硫电池中,当具有氧化性的多硫化物扩散到金属锂负极后,两者就会在电极处直接发生氧化还原反应,电子不通过外电路做功,造成电极活性物质的损失。这就是“穿梭效应”的化学本质。答案为:

式中:[Li2S6] = c0(Li2S6) - [Li+] = [Li2S6(I)] + [Li2S6(II)]。由4-8题的计算结果可知,[Li2S6(II)] = 0.492[Li2S6(I)],因此,[Li2S6] = 1.492[Li2S6(I)] = 3.03[Li2S6(II)]。代入反应的表观平衡常数表达式,则有:

4-10 本题由表4.1中的自由能数据即可判断出溶液中各离子的平衡浓度大小。ΔGd2最大,因此最小。由均裂反应的自由能变大于一级解离反应的自由能变可知,。再结合4-9中的计算结果,本题答案为:

这说明在DME中,Li2S6主要以分子的形式存在。溶液中存在很少量的,而的含量几乎可以忽略不计。这为抑制“穿梭效应”,设计有合适孔径及结构的隔膜提供了重要的理论依据。
4-11 考查学生合理设计热力学过程的能力。

由金属锂在水中的标准电极电势可求出Li(metal) → Li+(H2O) + e-半反应的Gibbs自由能变,即上图中的。这里需要注意的是,在电极电势表中,电极反应通常表示为还原半反应式,此时对应的ΔGϴ= -nFEϴ。

4-12 考查电荷平衡和物料平衡在溶液化学中的应用。由题目所给比值,可假设的初始浓度为c0,根据电荷平衡:

3 结语
本题结合南开大学言天英教授和高学平教授在锂硫电池领域的研究成果,向学生介绍了锂硫电池的基本工作原理。通过简要的计算,不仅让学生了解了电池常用性能参数(容量)的物理意义,还向学生展现了理想锂硫电池的应用前景,彰显了化学学科对人类生活的重要作用。最后,引出锂硫电池在实际应用中遇见的难题,引导学生学以致用地将化学原理应用到科学研究上,激发学生的科研兴趣。本题综合考查了返滴定法、元素性质、化学平衡、电化学、物料及电荷守恒等知识点。
