啶虫脒分子印迹荧光传感器的构建及检测研究
2023-01-10毛家洛韩奕奕王胜洁魏子奇
毛家洛,韩奕奕,王 震,王胜洁,魏子奇,曹 慧,袁 敏,叶 泰,徐 斐*
(1.上海理工大学健康科学与工程学院,上海 200093;2.上海市农产品质量安全中心,上海 201708;3.上海皓信生物科技有限公司,上海 201100)
啶虫脒(acetamiprid)是一种新烟碱类杀虫剂,由于其具有高效、低毒、杀虫谱广、用量低、内吸传导性好、与常规农药无交互抗性等化学及生物特性,已被用来替代有机磷、有机氯等常规高毒农药用于果蔬等农产品中。啶虫脒通过食物链在体内长期累积,可能对身体造成极大的危害[1],因此我国出台了相关标准对蔬菜中的啶虫脒残留进行限量规定。根据国家食品安全标准(GB2763—2021):啶虫脒在冬瓜、大白菜以及番茄等果蔬中的残留限量为0.2~1.0 mg/kg。因此亟待开发高灵敏度的啶虫脒农药残留检测技术[2]。
分子印迹聚合物具有高度的选择性,不仅可以从复杂食品基质中特异性的富集痕量目标物,还具有耐高温高压、耐酸碱、不易被破坏且能重复使用等优良特性,因而已被广泛应用于待测样品中目标物的选择性富集和检测[3]。Boontongto 等使用磁性双模板印迹聚合物对果蔬中的有机磷农药进行富集,回收率为81.3%~110.6%[4];Immaferrer 等以特丁嗪为模板合成了一系列分子印迹聚合物,这些聚合物对6 种氯三嗪农药的回收率达到80%,进一步结合LC-DAD 技术,能够对环境样品中的农药残留进行高效检测[5];Zhao 等结合分子印迹技术和高效液相色谱串联质谱法测定了黄瓜样品中的20 种三唑类农药,检出限小于0.4 μg/L,可用于农产品中三唑类农药的定量分析[6]。这些方法虽然具有较高的灵敏度,但需要配备气相色谱、高效液相色谱以及气/液相色谱-质谱联用(GC/LC-MS)[4]等大型分析仪器,存在仪器设备昂贵、操作复杂及对样品前处理要求高等不足。
镧系金属有机框架(LMOF)[7]、量子点[8]、发光染料[9]等荧光材料已被作为信号探针包埋于印迹聚合物基质中,以实现对复杂食品样品中痕量目标物的定量速测。在这些标记物中,量子点荧光探针因具有高效的发光性能、可协调的激发光谱、高度的灵敏性以及优秀的抗光漂白特性,已受到广泛关注[10]。程序森等将碳量子点包埋于制备的分子印迹聚合物中,并应用于蜂蜜中甲硝唑的检测,在最优条件下,检出限低至7.2 nmol/L,样品的加标回收率为92.3%~95.1%[11];赵晓磊等使用碳量子点制备的分子印迹材料对多巴胺展现出了高灵敏的响应,该方法的线性范围为0.02~0.30 mg/L,检出限为0.01 mg/L,实际样品的加标回收率为76.7%~118.4%,且可应用于复杂样品中多巴胺的定量分析[12]。基于此,以啶虫脒为模板分子,并结合分子印迹聚合材料的专一性、构效预定性和广泛适用性,以及改性硅碳量子点的高度灵敏性,采用改进的溶胶-凝胶策略制备了啶虫脒分子印迹荧光传感器,同时对该传感器的检测性能及机理进行了研究。
1 材料与方法
1.1 材料与试剂
紫外可见分光光度计:北京普析通用仪器有限责任公司产品;RF-6000 荧光分光光度计:日本岛津仪器公司产品;特氟龙高压反应釜:郑州博科仪器设备有限公司产品;K-Alpha X 射线光电子能谱仪、FEI Inspect F50 扫描电子显微镜、透射电子显微镜:美国赛默飞世尔科技有限公司产品;PerkinElmer 傅里叶红外变换光谱仪:珀金埃尔默仪器有限公司产品;FLS1000 荧光寿命测定仪:英国爱丁堡仪器公司产品。
啶虫脒、吡虫啉、噻虫嗪、噻虫胺(均为标准样品):上海市农药研究所提供;二苯基二乙氧基硅烷(DPDS) 、3-氨丙基三乙氧基硅烷(APTES) 、硅酸四乙酯(TEOS)、环己烷、正己醇、曲拉通、无水乙醇(均为分析纯):阿拉丁化学试剂有限公司产品;氨水、柠檬酸三钠(均为分析纯):国药集团化学试剂有限公司产品。
1.2 啶虫脒分子印迹荧光传感器的制备及表征
1.2.1 硅碳量子点(SiCDs)的合成将0.4 g 柠檬酸三钠置于两颈烧瓶中,加入8 mL 去离子水溶解,脱气15 min;向上述溶液中加入2.0 mL APTES,搅拌10 min 后转移至50 mL 特氟龙高压反应釜中,并在200 ℃下反应2 h;反应完毕后将反应溶液冷却至室温,再用透析袋(截留相对分子质量1 000)透析24 h,得到蓝色的硅碳量子点;收集量子点,并置于4 ℃冰箱下保存。
1.2.2 啶虫脒分子印迹荧光传感器(SiCDs@MIPs)的制备二氧化硅纳米微球的合成[13]:在磁力搅拌下将5 mL Triton X-100、20 mL 环己烷和5 mL 正己醇混合,剧烈搅拌15 min;接下来依次将50 μL TEOS 和135 μL NH3·H2O(体积分数25%~28%)添加到上述混合液中,搅拌8 h;向反应体系加入20 mL 丙酮破乳,用无水乙醇和超纯水洗涤几次后,避光置于60 ℃真空干燥箱内干燥,备用。
SiCDs@MIPs 的制备[14]:将30 mg 二氧化硅纳米微球分散于20 mL 无水乙醇和7.5 mL 水中,再加入13 mg 啶虫脒、27 μL APTES 和31 μL DPDS,搅拌20 min 后,依次加入1 mL 0.2 mol/L CTAB 溶液、50 μL TEOS、100 μL 0.2 mol/L NaOH 溶液和SiCDs,并在室温黑暗下磁力搅拌12 h;反应完毕后采用乙腈和乙醇混合液(体积比2∶8)洗脱模板,直至无啶虫脒紫外吸收峰出现,然后将获得的SiCDs@MIPs在60 ℃下烘干,备用。SiCDs@NIPs 的制备过程与SiCDs@MIPs 一致,只是不加入啶虫脒模板。制备原理见图1。
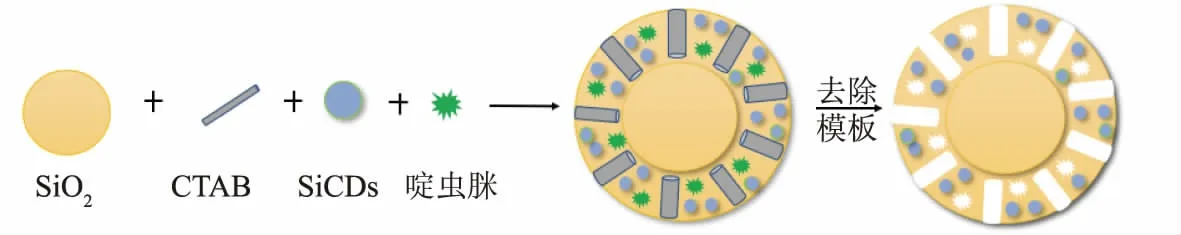
图1 基于SiCDs 的分子印迹荧光传感器制备原理图Fig.1 Schematic diagram of preparation of molecularly imprinted fluorescence sensor based on SiCDs
1.2.3 SiCDs@MIPs 的表征采用TEM 透射电镜、X 射线光电子谱(XPS)、SEM 扫描电子显微镜及傅里叶红外光谱对制备的SiCDs@MIPs 表面形态及结构进行表征。
1.3 SiCDs@MIPs 对啶虫脒的检测过程及检测性能评价
1.3.1 检测过程将10.0 mg SiCDs@MIPs 分散于30 mL 超纯水中,超声处理5 min;取600 μL 超声分散后的SiCDs@MIPs 与300 μL 啶虫脒农药进行混合,漩涡振荡反应20 min;反应完毕后在345 nm激发波长下记录反应溶液在437 nm 处的相对荧光强度。猝灭率(C)的计算公式为C=(F0-F)/F0×100%,其中F和F0分别代表加入和不加入啶虫脒农药时SiCDs@MIPs 的相对荧光强度。
1.3.2 荧光稳定性评价将10 mg SiCDs@MIPs 超声分散于30 mL 超纯水中,并在437 nm 处每隔10 min 测定一次加入与不加入啶虫脒农药(1.0 μg/mL)时SiCDs@MIPs 的相对荧光强度,实验结果以F0/F表示。
1.3.3 选择性与特异性评价将 10 mg SiCDs@MIPs 或SiCDs@NIPs 超声分散于30 mL 超纯水中,分别取600 μL 的1 μg/mL 啶虫脒、吡虫啉、噻虫胺和噻虫嗪进行反应,以考察SiCDs@MIPs的选择性和特异性。
1.4 样品处理
将5.00 g 搅碎后的蔬菜样品置于50 mL 离心管中,加标静置30 min,再加入6 mL 乙腈(含体积分数1%的乙酸)进行振荡提取3 min;在离心管中加入5.00 g MgSO4和0.50 g NaCl 固体,涡旋振荡120 s 后,加入300 mg GCB、300 mg PSA 和300 mg C18,并剧烈振荡3 min;取上清液加入600 μL 氯仿进行液液微萃取,并将下层有机相置于玻璃试管中,于80 ℃水浴中蒸干,再用200 μL 水复溶;在处理好的样液中加入SiCDs@MIPs,并按照1.3 中的步骤进行荧光测定。
2 结果与讨论
2.1 SiCDs@MIPs 的表征
采用X 射线光电子谱对SiCDs@MIPs 进行表征。图2中清晰地显示了N1s(399 eV)、C1s(285 eV)、O1s(532 eV)和Si2p(103 eV)的信号峰,表明模板分子和功能单体APTES 在交联剂TEOS 的作用下发生了溶胶-凝胶反应,并形成了二氧化硅印迹层。在1 080 eV 和165 eV 处出现的Na1s 和S2p 的信号峰则证明了SiCDs 已经被成功包裹到印迹聚合物中。
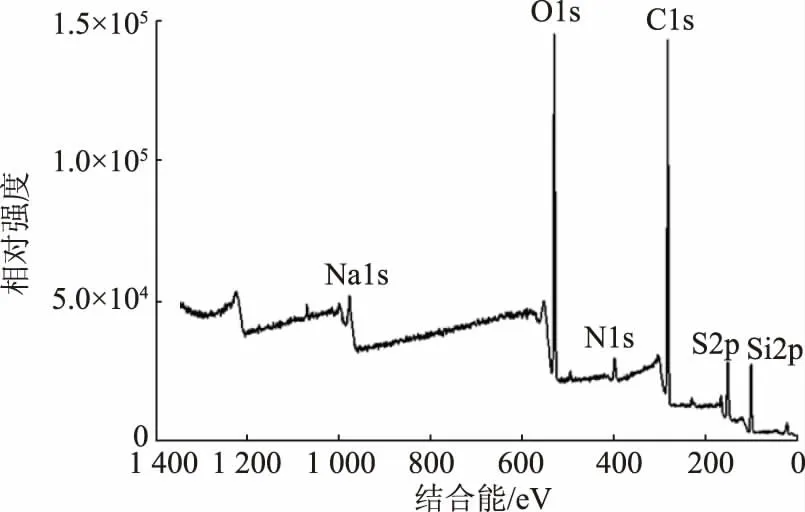
图2 SiCDs@MIPs 的XPS 图Fig.2 XPS spectra of SiCDs@MIPs
采用傅里叶红外光谱对SiCDs@MIPs 的结构进行表征。由图3可见,在794.78、3 186.82 cm-1和1 561.22 cm-1处出现的峰分别归因于Si—O 的伸缩振动、N—H 的伸缩振动和Si—O—Si 的不对称拉伸振动,表明啶虫脒分子印迹荧光探针已被成功合成。
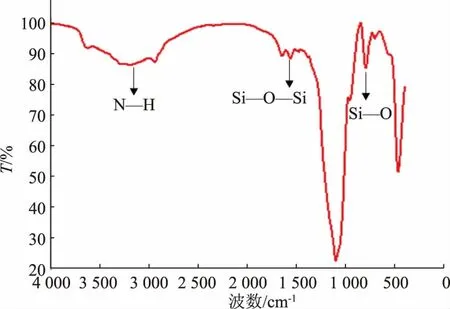
图3 SiCDs@MIPs 的FT-IR 图Fig.3 FT-IR spectra of SiCDs@MIPs
采用扫描电子显微镜和透射电镜对SiCDs@MIPs 的形貌结构进行表征。由图4(a)可见,合成的SiCDs@MIPs 微球大小均一且外表面较粗糙。由图4(b)可见,SiCDs@MIPs 呈现出典型的核壳结构,中间的黑色部分为二氧化硅纳米核,外壳的浅色部分为印迹层。结果均表明,SiCDs@MIPs 微球已经被成功合成。

图4 SiCDs@MIPs 的形貌结构Fig.4 Morphological structure of SiCDs@MIPs
2.2 SiCDs@MIPs 制备条件的优化
2.2.1 模板与功能单体的物质的量比优化为了提高聚合物的识别性能,采用APTES 和DPDS 作为双功能单体,并考察了模板与功能单体物质的量比对SiCDs@MIPs 荧光猝灭的影响。由图5可见,随着功能单体与模板物质的量比的增加,F0/F呈先增加后减小的趋势,这是因为当功能单体的添加量不足时,导致分子印迹聚合物中形成较少的空穴位点,进而降低了检测的灵敏性。当啶虫脒与功能单体的物质的量比为1∶4 时,F0/F达到最高,为1.33。随着功能单体添加量的进一步增加,F0/F反而下降,这可能是因为过量的功能单体导致自身发生交联,使得传质困难[15]。因此,啶虫脒与功能单体的最适物质的量比选择为1∶4。
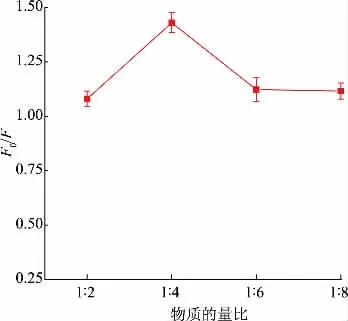
图5 模板与功能单体物质的量比对SiCDs@MIPs 荧光猝灭的影响Fig.5 Effect of the ratio of template to functional monomers on the fluorescence quenching of SiCDs@MIPs
2.2.2 交联剂添加量的优化进一步考察了交联剂TEOS 的添加量(25、50、100、150 μL)对SiCDs@MIPs 荧光猝灭的影响。由图6可知,当TEOS 的添加量为25 μL 时,F0/F达到最大,为1.43。当TEOS 的添加量小于25 μL 时难以形成印迹层,而过量的TEOS 则可能导致过厚的印迹层,使啶虫脒不易接触到包裹在印迹层内部的量子点,进而影响检测的灵敏度[16]。因而,TEOS 的最优加入量确定为25 μL。
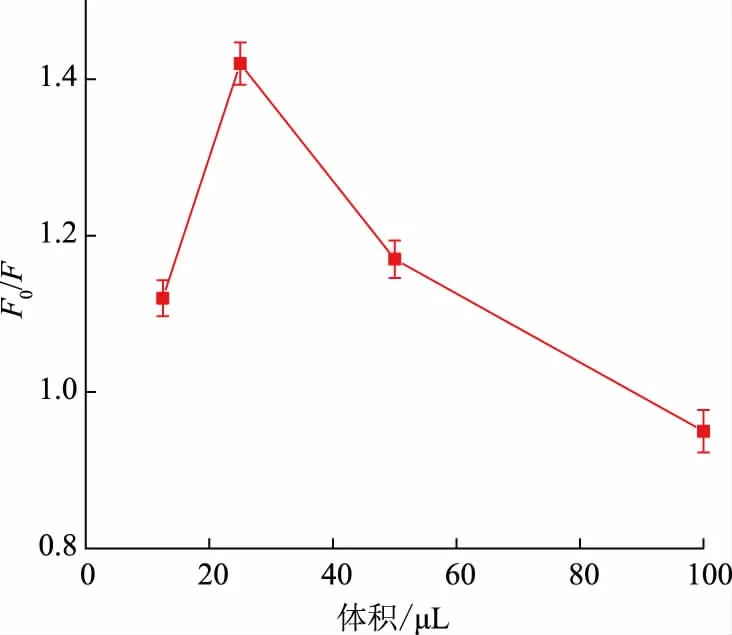
图6 TEOS 添加量对SiCDs@MIPs 荧光猝灭的影响Fig.6 Effect of the amount of TEOS on the fluorescence quenching of SiCDs@MIPs
2.2.3 SiCDs 包埋量的优化SiCDs 在SiCDs@MIPs中的包埋量也会影响检测的灵敏度,因而,考察了SiCDs 的包埋量对SiCDs@MIPs 荧光猝灭的影响。由图7可知,当SiCDs 的包埋量为10 mg/kg 时,F0/F最大。随着SiCDs 包埋量的增加,F0/F显著降低。这是因为当SiCDs 在SiCDs@MIPs 中的包埋量较高时,需要将SiCDs@MIPs 稀释至合适的荧光值才能进行检测,稀释后的SiCDs@MIPs 对啶虫脒的吸附量也降低,因而影响了检测的灵敏度。
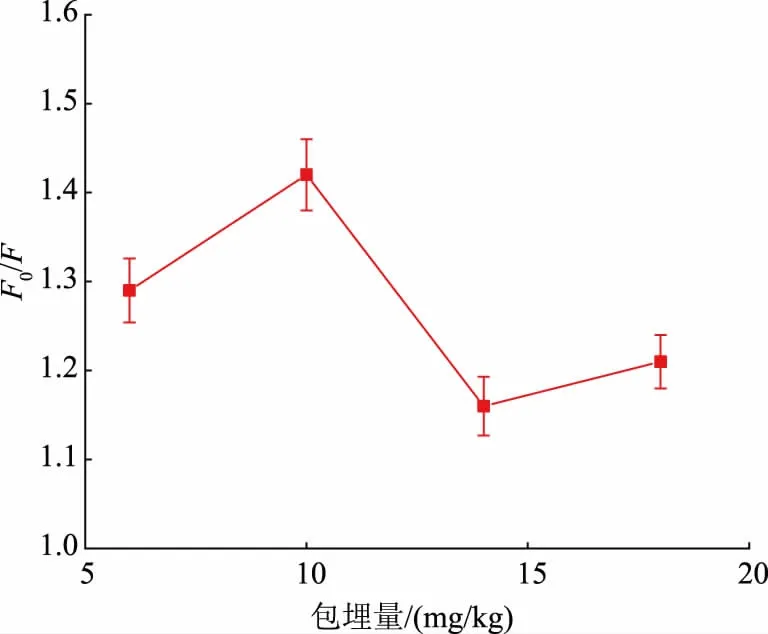
图7 SiCDs 包埋量对SiCDs@MIPs 荧光猝灭的影响Fig.7 Effect of the embedding amount of SiCDs on the fluorescence quenching of SiCDs@MIPs
2.3 SiCDs@MIPs 对啶虫脒农药检测性能的评价
在最优条件下,对SiCDs@MIPs 的检测性能进行了研究。由图8(a)可知,在0~4.5 μmol/L 时,随着啶虫脒农药浓度的逐渐增加,SiCDs@MIPs 的相对荧光强度逐渐降低。进一步以F0/F为纵坐标,啶虫脒浓度为横坐标绘制荧光猝灭曲线图(见图8(b))。如图8(c)所示,范围为0.045~0.450 μmol/L 时,F0/F与啶虫脒浓度呈线性关系y=0.445 6x+1.109 5 (r2=0.989),检出限根据3Sb与K比值(Sb是空白标准偏差,K是校准曲线的斜率)计算为0.086 μmol/L。
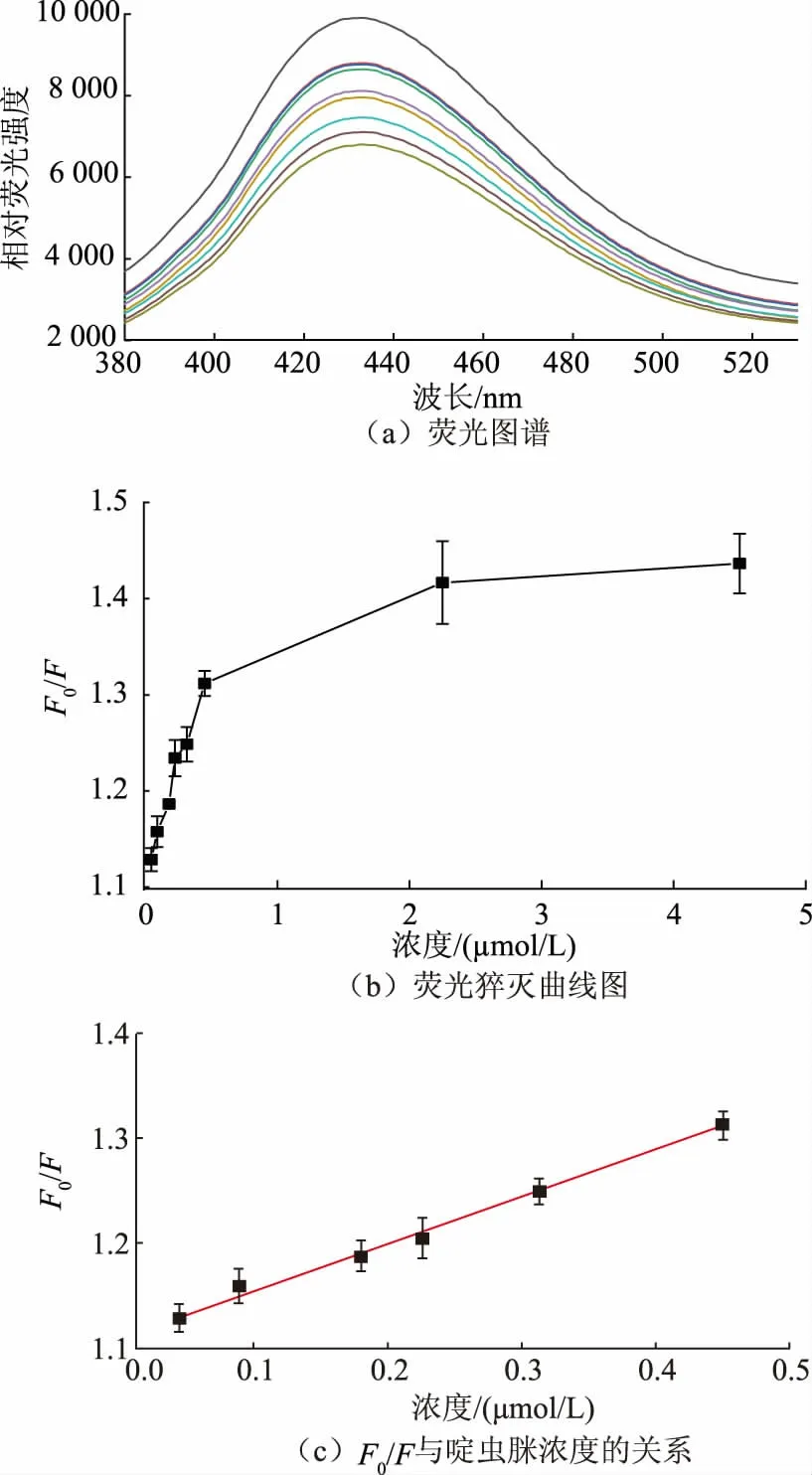
图8 SiCDs@MIPs 对不同浓度啶虫脒响应的荧光图谱和猝灭线性曲线图Fig.8 Fluorescence spectra and fluorescence quenching linear curve of SiCDs@MIPs in response to acetamiprid at different concentrations
进一步将啶虫脒农药加入SiCDs@MIPs 中,每隔10 min 测定一次其在437 nm 处的相对荧光强度,以评价其检测稳定性。由图9(a)所示,在120 min 内F0/F较为稳定,表明SiCDs@MIPs 具有良好的检测稳定性。进一步选取啶虫脒的结构类似物噻虫嗪、吡虫啉和噻虫胺来验证所建立方法的特异性。由图9(b)可知,啶虫脒对SiCDs@MIPs 的猝灭响应最强,这是因为啶虫脒可以通过氢键特异性结合到SiCDs@MIPs 的印迹空腔中,进而通过光致电子转移导致其部分荧光猝灭。噻虫嗪、噻虫胺与啶虫脒具有相似的分子结构,因而也有一小部分通过氢键吸附到SiCDs@MIPs 中,造成其MIPs 和NIPs 之间的响应差异,但这些结构类似物对SiCDs@MIPs 的猝灭响应均较弱。Yu 等研究也发现,由于结构的高度相似,噻虫嗪和噻虫胺对啶虫脒的印迹聚合物会表现出一定的响应效果[17]。
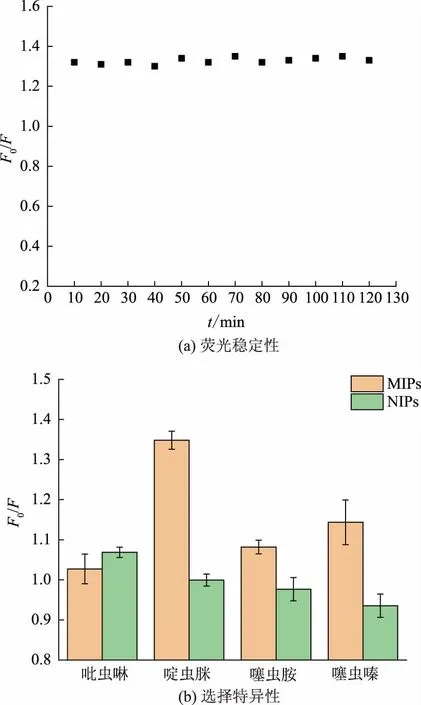
图9 SiCDs@MIPs 的荧光稳定性以及选择特异性Fig.9 Fluorescence stability and selective specificity of SiCDs@MIPs
2.4 啶虫脒农药对SiCDs@MIPs 的猝灭机理研究
为了探究啶虫脒农药对SiCDs@MIPs 的猝灭机理,首先采用紫外分光光度计测定了啶虫脒的紫外吸收峰,结果见图10。其出峰位置在245 nm 左右,这与SiCDs@MIPs 的荧光激发峰和发射峰都不重叠,因此可以排除荧光共振能量转移和内滤作用[18-19]。进一步以时间为横坐标,相对荧光强度为纵坐标绘制SiCDs@MIPs 的荧光衰减曲线图。由图11可知,SiCDs 的荧光寿命为5.335 ns,当加入啶虫脒后,SiCDs 的荧光寿命降至4.972 ns,表明啶虫脒农药使SiCDs 发生了动态电子转移,进而导致其荧光猝灭。
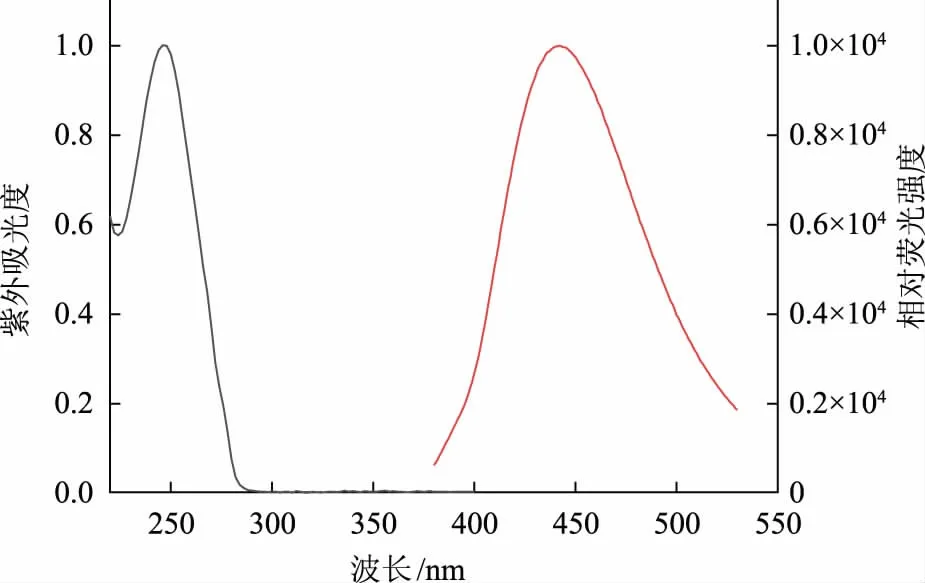
图10 啶虫脒的紫外吸收和SiCDs 的荧光发射图Fig.10 Ultraviolet absorbance spectrum of acetamiprid and fluorescent emission diagram of SiCDs

图11 SiCDs 的荧光衰减曲线Fig.11 Fluorescence decay curve of SiCDs
2.5 实际样品检测
将制备的SiCDs@MIPs 应用于白菜、冬瓜和番茄中啶虫脒的检测,以验证其在实际样品中应用的可行性。由表1可知,SiCDs@MIPs 对不同加标样品中啶虫脒的回收率为73.0%~109.0%,相对标准偏差(n=3)为1.21%~7.49%,表明SiCDs@MIPs 可应用于蔬菜中啶虫脒农药的测定。

表1 SiCDs@MIPs 对蔬菜样品中啶虫脒的加标回收验证(n=3)Table 1 Standard recovery of acetamiprid in the vegetable samples by SiCDs@MIPs(n=3)
3 结 语
结合荧光量子点技术和分子印迹技术,采用改进的溶胶-凝胶策略制备了可应用于实际样品中啶虫脒检测的分子印迹荧光传感器SiCDs@MIPs。SiCDs@MIPs 表现出典型的核壳结构,较薄的印迹层可加速模板分子在其中的传质效率。在最优检测条件下,SiCDs@MIPs 对啶虫脒的检出限为0.086 μmol/L,线性范围为0.045~0.450 μmol/L,相关系数为0.989,检测时间仅需25 min,回收率可达到73.0%~109.0%,能够满足对蔬菜中啶虫脒农药残留检测的要求。
