mTOR 在SD 大鼠TMJOA 髁突软骨中表达变化的实验研究
2023-01-09王子涵叶改映
王子涵,叶改映,赵 涛,张 俊,胡 瑜
(昆明医科大学 口腔医学院,云南 昆明 650500)
颞下颌关节骨关节炎(temporomandibular joint osteoarthritis,TMJOA)是一种常见的口腔颌面部疾病,临床症状包括颞下颌关节(temporomandibular joint,TMJ)区疼痛,肿胀,张口受限,咀嚼效率低下等,严重影响人类的健康和生活质量[1]。TMJOA 是多种致病因素所导致的结果,目前病因尚不完全清楚。TMJOA 典型病理变化包括髁突软骨细胞凋亡,软骨基质降解以及软骨下骨骨质改变等,其中关节软骨的退行性变是OA 病理变化的核心[2]。且在OA 中,自噬在抑制软骨细胞凋亡的启动过程发挥关键的调控作用[3]。自噬转导信号网络及其介导的自噬过程错综复杂,包括P13K/Akt、mTOR、MAPK、和NF—KB 信号通路等[4]。有很多研究证据表明,使用哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂[5]或或 mTOR 基因特异性敲除[6]的动物模型中,OA 的病程明显减轻,这也使得通过调控mTOR 来治疗TMJOA 成为一个重要的研究方向。本实验将构建偏侧咀嚼导致的大鼠TMJOA 动物模型,进一步检测mTOR 在髁突软骨中的表达,探讨自噬对TMJOA 病程的影响,加深理解TMJOA 的发生、发展,对探索相应的治疗方法具有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 实验动物8 周龄清洁级实验动物(sprague dawley,SD)大鼠购于昆明医科大学动物实验中心[合格证编号:SCXK(滇)K2020-0004],饲养于昆明医科大学SPF 动物实验中心,体重(250±25)g,普通清洁环境,自由活动,给予足量食物和水。
1.1.2 主要试剂及实验设备正畸丝(杭州西湖材料有限公司,浙江);苏木素染液(珠海贝索生物技术有限公司,广东);改良番红O-固绿软骨染色液(索莱宝,北京);兔抗SOX9(SRY-related high mobility group-box gene9)抗体(正能生物380995);兔抗mTOR 抗体(ORIGENE TA325696);DAB 显色试剂盒(福州迈新生物技术开发有限公司,福建);石蜡切片机(Leica,德国);光学显微镜(CARL ZEIS,德国)。
1.2 实验动物分组及建模方法
1.2.1 动物选择及分组选用45 只无明显口腔颌面部疾病的8 周龄健康雄性SD 大鼠。将27 只大鼠按偏侧咀嚼2、4、8 周随机分为3 个组,每组9 只;同时设立相应假手术对照组,每组6 只。
1.2.2 建模方法大鼠于手术前夜禁食禁水,提前一天配置好3%戊巴比妥备用。手术时按每只大鼠1.5 mL 麻醉量进行麻醉,麻醉起效后,固定大鼠,并牵拉上下颌切牙及舌头以暴露下颌牙列,固定其开口状态。用持针器持一段长2 cm 的正畸丝从右侧下颌第一磨牙近中舌侧牙间隙穿入,缠绕牙颈部一圈,并在舌面将两头正畸丝缠绕打结固定。实验组将正畸丝结弯曲至牙合面并保留一定长度以造成咬合障碍;对照组将正畸丝弯曲至于邻牙舌面颈部贴合,无咬合障碍,后用探针检查稳定情况。实验组大鼠右侧耳朵减去小三角瓣作为标记,对照组不做标记。建模后,定期检查正畸丝的稳固情况和完整度。
1.2.3 取材、脱钙、脱水及包埋建模后2、4、8周分别取材,用脱颈椎处死法处死大鼠,完整切取大鼠右侧颞下颌关节髁突组织,用生理盐水冲净后以4%多聚甲醛固定液固定于标记好的EP 管中,固定48 h 后将标本放入组织标本盒中,自来水冲洗过夜。冲洗后用快速脱钙液进行脱钙,每四小时检查一次脱钙程度,待完全脱钙后流水冲流过夜。将冲洗好的的髁突组织依照70%酒精、80%酒精、90%酒精、95%酒精、无水乙醇Ⅰ、无水乙醇Ⅱ各浸泡6 min 以脱水,再浸泡入二甲苯Ⅰ30 min、二甲苯Ⅱ15 min 以透明。脱水完毕后将髁突组织取出,依次放入60 ℃恒温烘箱中的熔融石蜡Ⅰ、Ⅱ、Ⅲ中各60 min(浸蜡时间随大鼠周龄增加可适当延长)。将浸好蜡的组织容纳盒放入包埋机蜡池中,用镊子将髁突组织平放于金属包埋盒底,滴满石蜡,盖上塑料包埋框盒,标号序列放于冷冻机上冷冻。待石蜡完全凝固后除去多余部分。
1.2.4 组织化学染色进行病理学检查组织蜡块修整后常规切片、脱蜡、水化后行苏木素-伊红和番红-固绿染色。应用改良Mankind 评分和国际骨关节炎研究协会(OARSI)评分评估大鼠TMJ软骨病损程度。
1.2.5 免疫组织化学染色法测定髁突软骨细胞中SOX9 及mTOR 的表达组织蜡块修整后常规切片、脱蜡、水化后,通过ABC 法进行染色。SOX9 染色一抗为兔抗SOX9(稀释1∶200),mTOR 染色一抗为兔抗mTOR(稀释1∶100),所有切片用兔生物素化的二抗孵育,DAB 显色,苏木素复染。固定封片后用光学显微镜拍摄,应用imageproplus 选取3 个样本计算软骨细胞的平均光密度值(AOD 值),其平均值作为该组的平均光密度值。所有切片放在相同的载玻片上,在相同条件下共同进行处理。
1.3 统计学处理
使用 Graphpad Prism9.0 统计软件对实验结果数据进行作图统计学分析。采用完全随机设计的方差分析(one-way ANOVA)检验,所有数据显示为均数±均数的标准差(mean ± SD)。P< 0.05 为差异有统计学意义。
2 结果
2.1 髁突软骨形态
苏木精-伊红(HE)染色显示,髁突的软骨结构由内向外可依次分为钙化软骨层、肥大层、增殖层和纤维层。番红O-固绿染色显示,对照组大鼠的髁突软骨结构层次清晰,表面平整,蛋白多糖分布均匀。
随着时间推移,实验组(TMD 组)大鼠的髁突软骨结构出现明显的退行性病变。实验2 周组HE 染色显示软骨组织表面略不均匀;番红O-固绿染色显示蛋白多糖非均质性染色。实验4 周组HE 染色显示软骨组织表面不均匀层及水平裂隙,软骨层变薄,肥大层细胞减少,部分标本出现表层纤维化和无细胞区。番红O-固绿染色显示蛋白多糖染色进一步丢失,番红O 淡染。实验8 周组软骨组织表面粗糙,裂隙增大,软骨细胞排列紊乱,可见无细胞区。番红O-固绿染色显示蛋白多糖非均质性染色,表层和中深层失染(图1、2)。改良Mankin 评分[7]和OARSI 评分[8]结果显示,对比对照组,实验组(TMD 组)评分明显升高(P<0.05),且病损评分在4 周时最高,8 周略有回落(图3)。
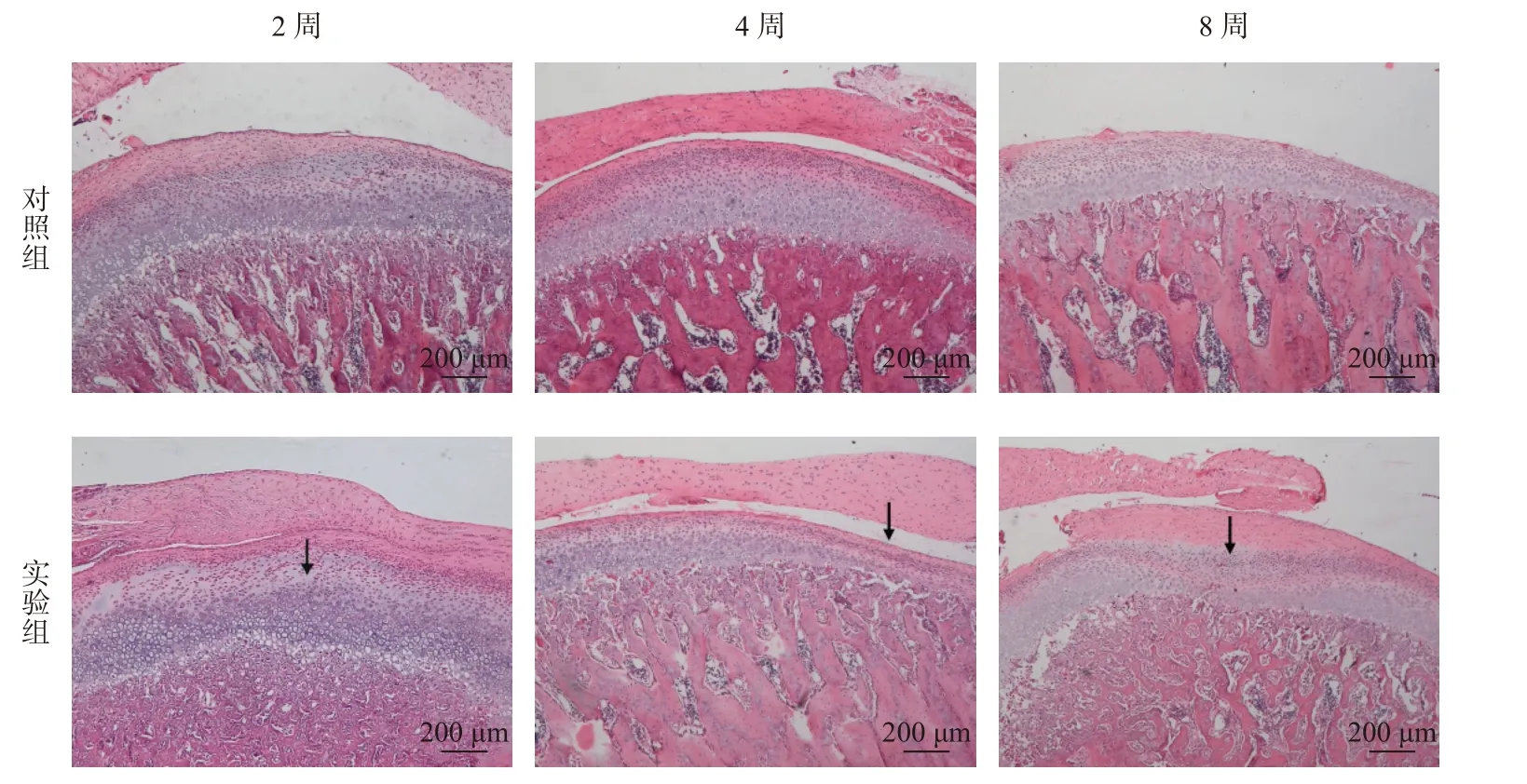
图1 大鼠颞下颌关节 HE 染色(50×)Fig.1 HE staining of TMJ in rats(50×)
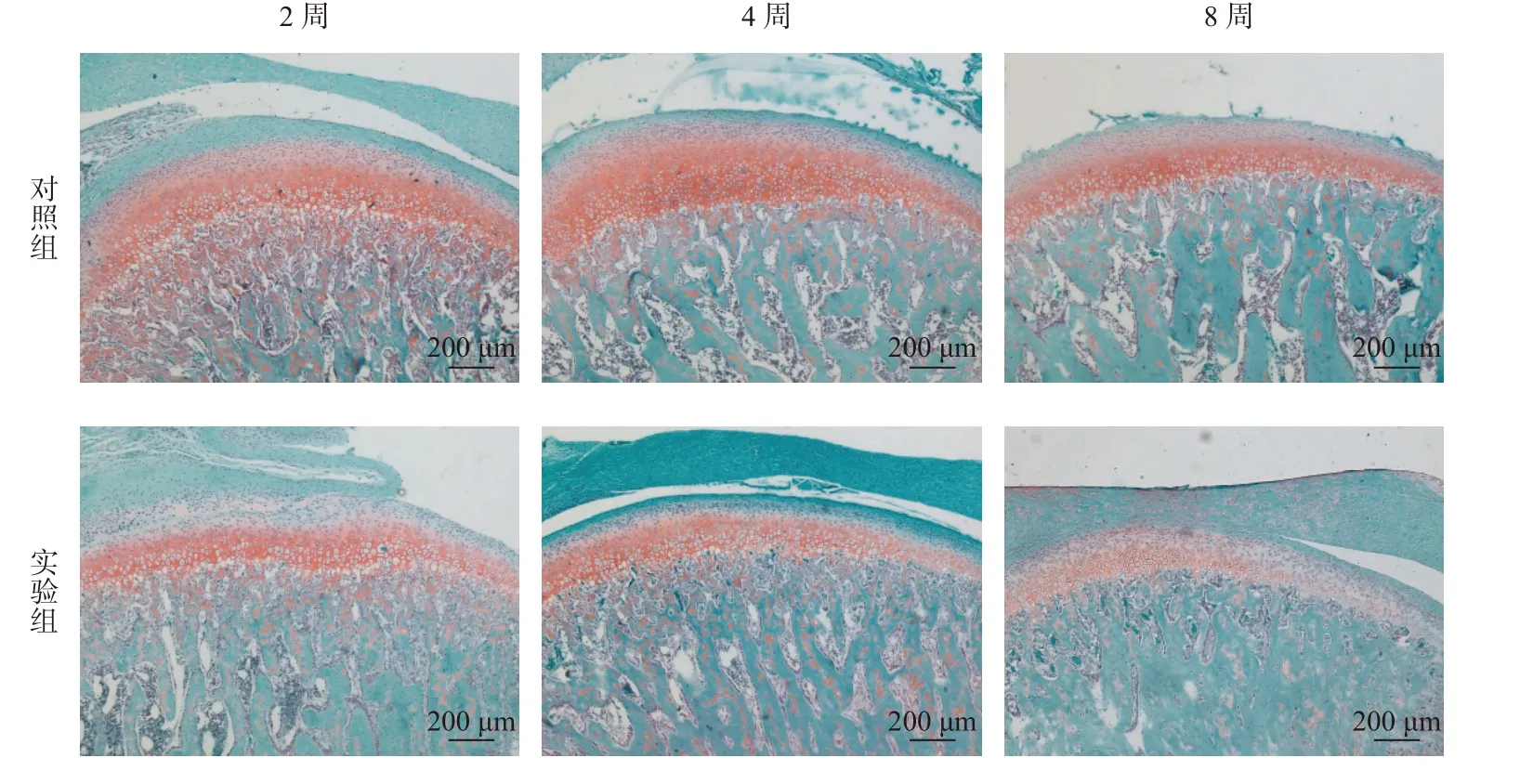
图2 大鼠颞下颌关节番红-固绿染色(50×)Fig.2 HE staining of TMJ in rats(50×)
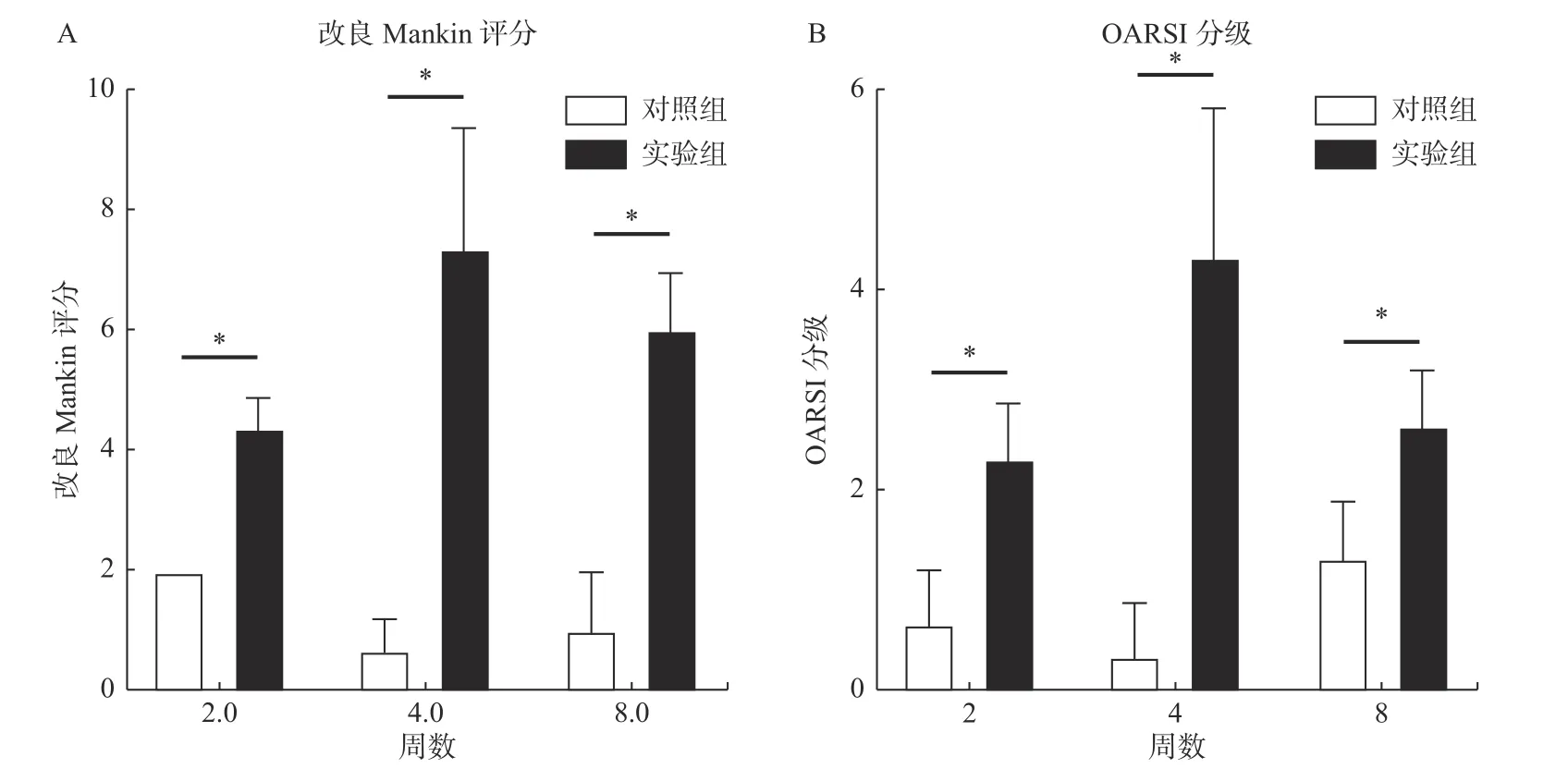
图3 大鼠颞下颌关节组织病理学评分Fig.3 Histopathological scores of TMJ in rats
2.2 髁突软骨中蛋白质SOX9 和mTOR 的表达
SOX9 作为软骨细胞增殖、分化的重要调控因子,其表达水平反映了颞下颌关节的生长改建情况,免疫组织化学染色显示SOX9 阳性细胞主要在细胞核呈棕色染色(图4)。实验过程中随着异常生物力学刺激的增加,实验2 周(P< 0.01)、4 周(P< 0.05)、8 周(P< 0.05)组大鼠髁突软骨中SOX9 表达水平呈依次下降且均低于对照组的趋势(图5)。
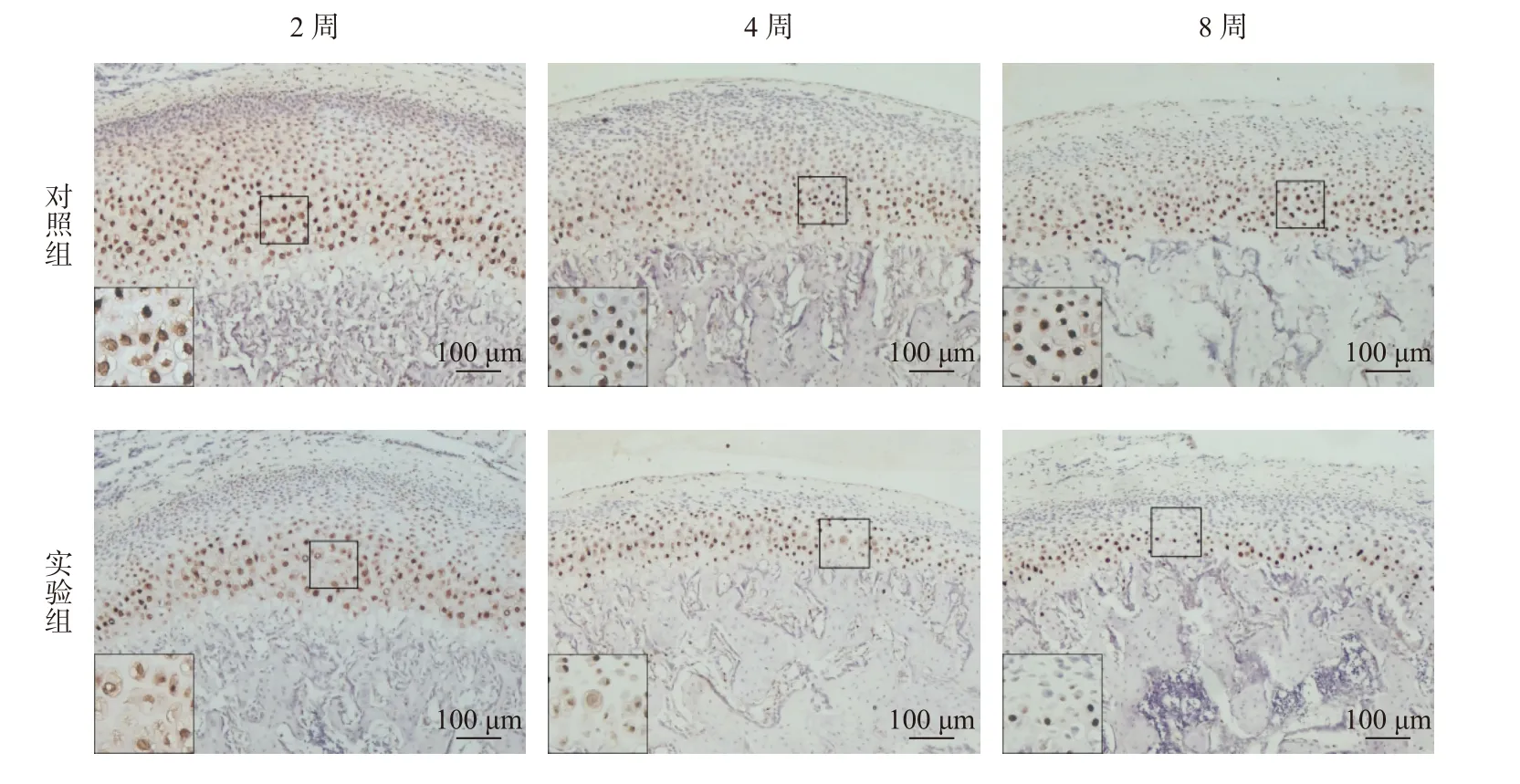
图4 SOX9 免疫组化染色(100×)Fig.4 Immunohistochemical staining of SOX9(100×)
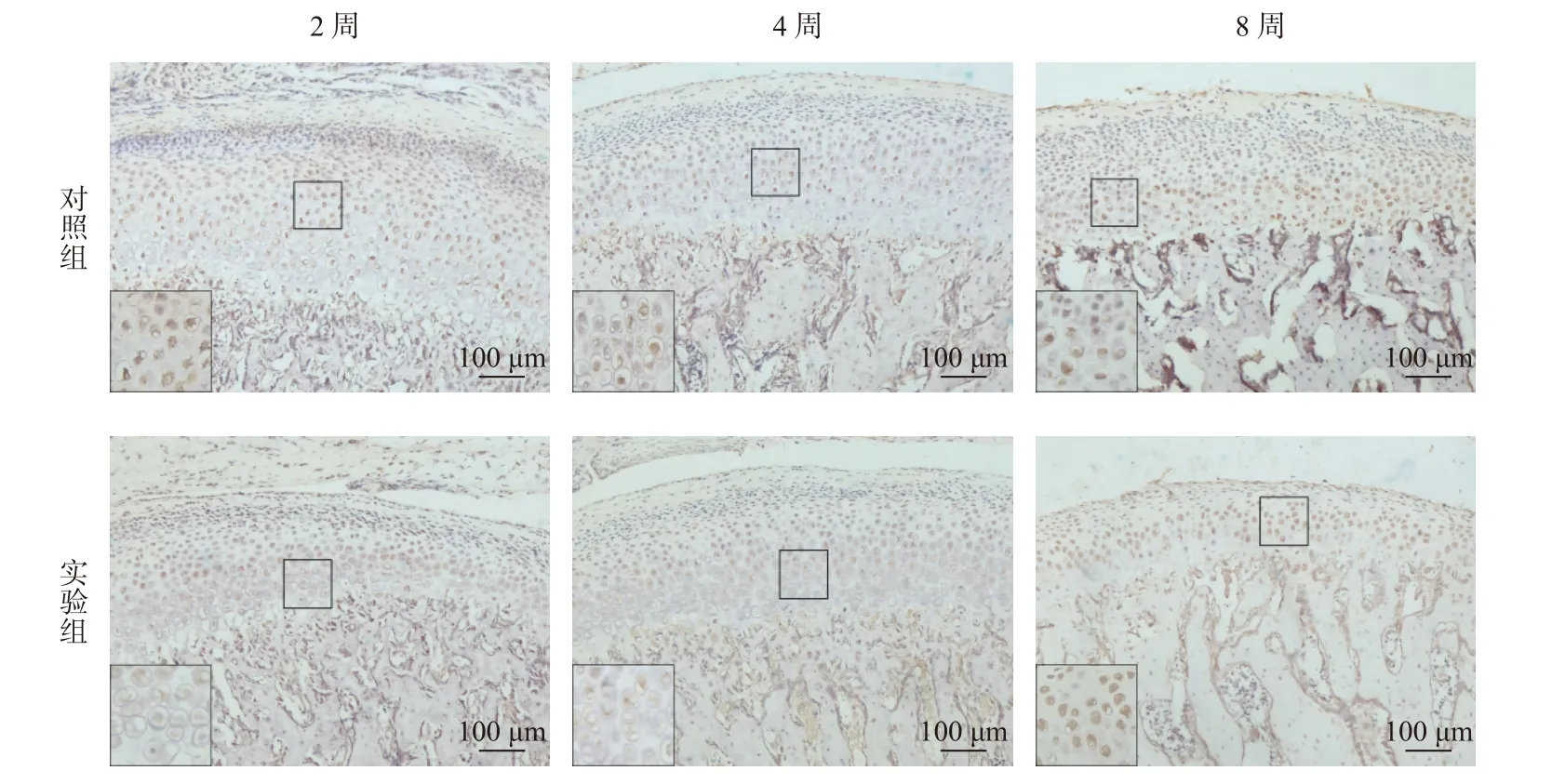
图5 mTOR 免疫组化染色(100×)Fig.5 Immunohistochemical staining of mTOR(100×)
mTOR 作为髁突软骨细胞的自噬抑制因子,在颞下颌骨关节炎中影响细胞的自噬凋亡,免疫组织化学染色显示mTOR 阳性细胞主要在细胞质呈棕色染色。实验过程中随着骨关节炎病情发展,实验组mTOR 表达水平呈2 周(P< 0.01)、4 周(P<0.001)下调,8 周(P< 0.05)上调的趋势(图6)。
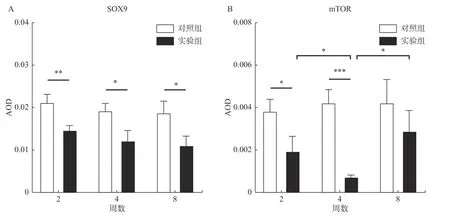
图6 SOX9 和mTOR 免疫组化染色强度分析Fig.6 Immunohistochemical staining intensity of SOX9 and mTOR
3 讨论
虽然TMJOA 具体病因和发病机制尚不清楚,但研究表明过度的机械负荷可能是影响OA 发生发展的重要因素[9],因此偏侧咀嚼常被用于制作一种廉价、高效、贴近于实际病理环境的小鼠颞下颌关节骨关节炎模型[10]。在本研究构建的大鼠TMJOA 模型中,通过对髁突组织进行HE 染色和番红固绿染色可见软骨组织表层不平整,出现裂隙;软骨层变薄,软骨细胞层次紊乱,部分标本出现表层纤维化和无细胞区;蛋白多糖非均质性染色,表层和中深层失染,提示使用偏侧咀嚼构建SD 大鼠TMJOA 模型的方法得以成立。另外,在本研究中,通过对髁突组织进行免疫组织化学染色可以观察到,实验2、4、8 周组大鼠髁突软骨中SOX9 表达水平依次下降且均低于对照组,进一步显示了实验组大鼠骨关节炎的炎症加重情况。
目前的研究认为,骨关节炎中软骨细胞凋亡的增加在骨关节炎的发病机制中居于中心地位和始动环节[11]。自噬在抑制软骨细胞凋亡的启动过程中,发挥关键的调控作用。当细胞器受损时,自噬被激活,从而清除受损细胞器,抑制凋亡、促进修复,延缓OA 的病程[12]。
研究表明,在OA 病程中尤其是发病的早期阶段,软骨细胞的自噬水平(特别是浅层软骨)是明显增高的,并且通过对凋亡及活性氧的调控影响OA 相关基因的表达[13],Bouderlique T 等[14]使用Atg5cKO 鼠研究增龄性和创伤性OA 时,发现抑制软骨细胞的自噬可以使凋亡增加,加速增龄性OA 的进程。Zhang M 等[3]通过改变机械应力诱导颞下颌关节软骨的退变,发现自噬增强,mTOR 和MAP4K3 活性受抑制而降低。表明在OA 中自噬在抑制软骨细胞凋亡的启动过程发挥关键的调控作用。
经研究发现,mTOR 是一种自噬重要的负调节因子,软骨的生长发育以及 OA 的病程均与mTOR 介导的信号通路密切相关。有很多研究证据表明,在使用 mTOR 抑制剂[5]或特异性敲除mTOR 基因[6]的动物模型中,OA 的严重程度显著降低。在笔者构建的大鼠TMJOA 早期模型(2W)中,也可以观察到mTOR 的表达受到了抑制,提示了在TMJOA 早期,自噬程序被激活而凋亡程序受到抑制,减少了早期炎症造成的颞下颌关节软骨损失。
但随着炎症的进展,建模4 周时mTOR 明显下调,而改良Mankin 和OARSI 评分显示,与对照组相比,实验组(TMD 组)评分明显升高,且病损评分在此时达到最高,这可能是由于短暂增加的自噬是对细胞应激的一种补偿反应,但当长期应激超过该机制的能力时,就造成了严重的损伤[15]。
建模8 周后,mTOR 的表达又有回升的趋势,这提示炎症晚期,自噬受到抑制,而细胞的凋亡程序被激活,软骨损失进一步加剧。
综上所述,在笔者构建的TMJOA 大鼠模型中,炎症早期,大鼠的mTOR 表达受到抑制,软骨细胞的自噬被激活而凋亡受到抑制,促进退变软骨修复,从而延缓了OA 的病理进程;但是到了炎症晚期,mTOR 的表达被激活,软骨细胞的自噬受到了抑制而逐渐向凋亡转化,软骨损失加重。mTOR 信号在生物力学诱导的TMJ OA 进展中,在将保护性自噬转变为破坏性的凋亡中发挥了关键作用。
研究表明,仅是通过降解细胞外基质或抑制促炎因子往往不能减缓OA 的进程,但通过调节自噬,则可以改变软骨细胞的基因表达,调控细胞的稳态机制,从而阻止细胞凋亡[16]。抑制mTOR 的表达,则可以激活软骨细胞的自噬,抑制氧化应激和炎症反应,从而达到治疗 OA 的目的[6]。这也使得将 mTOR 作为TMJOA 的治疗靶点成为一种有价值的研究方向。本实验初步探讨了机械应力造成TMJOA 后髁突软骨细胞的病理特征和mTOR 的表达变化,为以后靶向药物的研发提供一定的参考。
